运动性疲劳的线粒体膜分子机制研究 .Ⅱ.运动性氧自由基代谢途径再探讨
作者:时庆德 张勇 文立 陈家琦 李林江 刘树森
单位:时庆德(天津体育学院运动医学研究所 天津 300381);张勇(天津体育学院运动医学研究所 天津 300381);文立(天津体育学院运动医学研究所 天津 300381);陈家琦(天津体育学院运动医学研究所 天津 300381);李林江(中国科学院动物研究所生物膜与膜生物工程国家重点实验室);刘树森(中国科学院动物研究所生物膜与膜生物工程国家重点实验室)
关键词:骨骼肌;心肌;肝脏;线粒体;超氧阴离子;力竭性运动
中国运动医学杂志000115 摘 要:以大鼠中等强度力竭性跑台跑为运动性疲劳模型,采用化学发光法分别直接测定了运动后即刻骨骼肌、心肌和肝脏线粒体超氧阴离子( )生成量;以TBA荧光法测定线粒体丙二醛(MDA)含量。结果表明,骨骼肌和肝脏线粒体
)生成量;以TBA荧光法测定线粒体丙二醛(MDA)含量。结果表明,骨骼肌和肝脏线粒体 生成较运动前安静时显著增加(P<0.05),心肌线粒体
生成较运动前安静时显著增加(P<0.05),心肌线粒体 生成呈增加趋势(P>0.05); 三种组织线粒体脂质过氧化水平均显著增加(P<0.05) 。结果提示,骨骼肌和肝脏线粒体氧自由基代谢以线粒体电子漏机制为主,心肌则可能存在黄嘌呤氧化酶途径的参与。
生成呈增加趋势(P>0.05); 三种组织线粒体脂质过氧化水平均显著增加(P<0.05) 。结果提示,骨骼肌和肝脏线粒体氧自由基代谢以线粒体电子漏机制为主,心肌则可能存在黄嘌呤氧化酶途径的参与。
, http://www.100md.com
Study on Molecular Mechanism of Mitochondrial Membrane for Exercise-induced Fati gue.Ⅱ.Explores to Pathway of Oxygen Free Radicals Metabolism Induced by Exercise
Shi Qingde, Zhang Yong, Wen Li, Chen Jiaqi
(Tianjin Research Institute of Sports Medicine, Tianjin 300381)
Abstract:Using the incremental exercise to exhaustion as an experimental animal model, we determined superoxide anion ( ) production d irectly and the MDA contents in the prepared mitochondria of liver, heart and skeletal muscle from rats immediately after exhaustive exercise. The results showed the following.The mitochondrial
) production d irectly and the MDA contents in the prepared mitochondria of liver, heart and skeletal muscle from rats immediately after exhaustive exercise. The results showed the following.The mitochondrial  of liver and skeletal muscle post-exercise increased significantly than these at rest (P<0 .05).In heart, the production of
of liver and skeletal muscle post-exercise increased significantly than these at rest (P<0 .05).In heart, the production of increased without significance. However, The significant increase of MDA contents were observed among three tissue mitochondria(P<0.05).The present data suggested th at mitochondrial respiratory, eg.electron leak was an importan tmechanism of metabolic pathway of exercise-induced oxygen free radicals in liver and skeletal muscle, but the same situation may be not existed in heart, thus other pathway should be involved in lipid peroxidation.
increased without significance. However, The significant increase of MDA contents were observed among three tissue mitochondria(P<0.05).The present data suggested th at mitochondrial respiratory, eg.electron leak was an importan tmechanism of metabolic pathway of exercise-induced oxygen free radicals in liver and skeletal muscle, but the same situation may be not existed in heart, thus other pathway should be involved in lipid peroxidation.
, 百拇医药
Key words:skeletal muscle;liver;heart;mitochondria;superoxide;exhaustive exercise.▲
1982年Davies等人首次采用电子自旋共振技术 (ESR) 直接观察到大鼠力竭运 动后肝脏和骨骼肌自由基信号增加[1]。此后,大量报道显示机体 运动性内源自由基及其引发的脂质过氧化水平增加,与运动性疲劳及包括线粒体膜在内的细胞膜系统损伤(损害)密切相关。然而,多数实验研究均是以自由基代谢中间产物生成的多 寡来“定量”过氧化损害的程度,少见对脂质过氧化损害源头——运动性自由基生成代谢途 径的关注。某些机制性的问题,如运动代谢中组织氧自由基生成的线粒体呼吸链或黄嘌呤氧 化酶途径孰轻孰重?限于实验手段而鲜见报道。虽有对运动后自由基的ESR研究的组织或组 织匀浆检测,但缺乏对线粒体的直接观察。因此,氧自由基生成的两条途径在运动性内源自 由基及其引发的脂质过氧化水平中的作用及意义尚缺乏有力的实验证据。为此,本实验以化 学发光法直接定量观察并比较大鼠力竭运动后骨骼肌、心肌和肝脏线粒体超氧阴离子( )生成量,并与脂质过氧化水平对照,以期对运动性内源 自由基的生成及代谢途径做再探讨。
)生成量,并与脂质过氧化水平对照,以期对运动性内源 自由基的生成及代谢途径做再探讨。
, 百拇医药
1 材料和方法
1.1 实验动物及运动方式 健康雄性SD大鼠,体重220~260g,由中国科 学院动物研究所实验动物中心提供。实验采用Bedford据鼠体重/摄氧量回归方程所建立的渐 增负荷运动模型[2]。按以下运动程序运动至力竭:第一级负荷: 坡度0°,速度8.2m/min,时间15min;第二级负荷:5°,15m/min,15min;第三级负荷:10° ,19.3m/min(相当于76%最大摄氧量)运动至力竭。力竭标准:第三级负荷运动中,动物未 能坚持本级负荷运动跑速,先后滞于跑道后1/3处达3次以上,刺激驱赶无效。运动至力竭时 间为126±30 min。
1.2 化学试剂 去脂牛血清白蛋白(Defatted BSA),MCLA [2-methyl -6-(p-methoxyl)-3,7-dihy-droimidazol (1,2-a) pyrazin-3-one],超氧化物歧化酶(Sup eroxide dismutase, SOD),鱼藤酮(Rotenone),黄嘌呤(xanthine),1,1,3,3-四乙氧基丙 烷(titraethoxyp-ropane, TEP),ADP(adenosine 5′-diphosphate)为美国Sigma Co. 产 品;黄嘌呤氧化酶(xanthine oxidae)为上海东风试剂厂产品;实验中所用其它试剂均为分 析纯。
, 百拇医药
1. 3 线粒体的提取[3] 实验动物分别于运动 前后断头处死并迅速取后肢骨骼肌、完整心脏肝脏,用介质冲洗两遍,剔除脂肪及结缔组织 、剪碎,电动匀浆器匀浆。0℃~4℃条件下分级分离差速离心法提取线粒体。线粒体蛋白含 量用双缩脲法测定,用280nm下校正的BSA作标准。
1.4 线粒体 生成状况的测定[4] MCLA是一种化学发光剂,可被
生成状况的测定[4] MCLA是一种化学发光剂,可被 ,102等活性氧激发发光,加入过量的
,102等活性氧激发发光,加入过量的 特异性 清除酶SOD后,荧光淬灭的量可反映
特异性 清除酶SOD后,荧光淬灭的量可反映 产生的量。反应介 质为300mmol/L Sucrose, 10mmol/L Tris-HCl(pH 7.5), 10mmol/L KH2PO4, 10mmol/L KCl, 0.05mmol/L MgCl2, 2μmol/L MCLA, 4μmol/L Rotenone。线粒体浓度为0.1mg/ ml。25℃恒温。加入3.3mmol/L琥珀酸启动反应,在LKB-125型发光仪上测试。记录仪记录 反应曲线。用同样反应条件测定黄嘌呤氧化酶体系浓度与对SOD敏感的发光强度之间的量- 效关系,得出发光强度与
产生的量。反应介 质为300mmol/L Sucrose, 10mmol/L Tris-HCl(pH 7.5), 10mmol/L KH2PO4, 10mmol/L KCl, 0.05mmol/L MgCl2, 2μmol/L MCLA, 4μmol/L Rotenone。线粒体浓度为0.1mg/ ml。25℃恒温。加入3.3mmol/L琥珀酸启动反应,在LKB-125型发光仪上测试。记录仪记录 反应曲线。用同样反应条件测定黄嘌呤氧化酶体系浓度与对SOD敏感的发光强度之间的量- 效关系,得出发光强度与 产生之间的标准曲线。
产生之间的标准曲线。
, 百拇医药
1.5 线粒体丙二醛(MDA)含量的测定[5] 依硫 代巴比妥酸(TBA)法,用10%高氯酸配成0.67%的过饱和溶液,再以20%的三氯乙酸稀释(V: V=3:2)。取10μl线粒体蛋白加入TBA溶液,总体积为5ml。95℃加热30分钟,冷水冷却。300 0转/prm离心10分钟,取上清液在532nm测定OD值。相同反应条件下以TEP为标准作标准曲线 。
1. 6 统计学处理 由SPSS统计软件包进行统计处理。以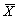 ±SD表 示数据,t检验。
±SD表 示数据,t检验。
2 结果
力竭性运动后肝脏和骨骼肌线粒体超氧阴离子生成和MDA含量均较运动前安静时显著增高,表明线粒体呼吸链机制(电子漏增加)可能是线粒体膜脂质过氧化水平增高的重要原因。心肌线粒体线粒体超氧阴离子生成增加未呈显著性改变,但脂质过氧化水平显著增高。
, 百拇医药
表1 大鼠骨骼肌、心肌和肝脏线粒体超氧阴离子生成 和MDA含量变化
Table 1 Changes of and MDA contents of
and MDA contents of
muscle, heart and liver mi tochondria in rats 线粒体
Mitochondria
指标
Parameters
安静时 Rest
(n=7)
运动后 Post-exercise
, 百拇医药
(n=6)
骨骼肌(Skeletal muscles) (nmol/mg pro.)
(nmol/mg pro.)
2.58±0.63
3.64±1.05*
MDA(nmol/mg pro.)
1.71±0.42
2.40±0.58*
心肌(Myocardium ) (nmol/mg pro.)
(nmol/mg pro.)
, 百拇医药
1.75±0.33
2.16±0.57
MDA(nmol/mg pro.)
1.55±0.27
1.96±0.45*
肝脏( Livers) (nmol/mg pro.)
(nmol/mg pro.)
0.45±0.17
0.70±0.23*
MDA(nmol/mg pro.)
, http://www.100md.com
1.06±0.35
1.57±0.43*
*P<0.05 (compared with rest).
3 讨论
有关运动自由基生物学的研究已得到某些共识,即运动诱导的内源自由基生成增多及其 引发的脂质过氧化反应,与运动性疲劳及包括线粒体膜在内的细胞膜系统损伤(损害)密切 相关。但因实验方法学的不足,以往的研究仅限于间接测定自由基代谢产物及自由基清除酶 系。至今只有Davies(1982)、陈英杰(1991)和丁树哲(1992)等有关ESR技术应用于骨 骼肌、心肌和肝脏组织(匀浆)中运动性内源自由基直接检测的报道,尚缺乏对线粒体的直 接观察。而对自由基生成及代谢的两条重要途径[6]:线粒体呼吸 链机制和组织黄嘌呤氧化酶机制在运动自由基生成及代谢中的作用尚未有直接的实验证据。
, 百拇医药
本实验以化学发光法直接且定量,对同一递增负荷力竭运动模式下不同组织线粒体 生成进行观察。结果表明,力竭运动后骨骼肌、肝脏线粒体
生成进行观察。结果表明,力竭运动后骨骼肌、肝脏线粒体 生成呈显著增加,心肌
生成呈显著增加,心肌 生成有明显增加。对自由基代谢产物测定显示,三种组织线粒体MDA含量均显著增高。 表明线粒体电子传递过程中由电子漏形成的
生成有明显增加。对自由基代谢产物测定显示,三种组织线粒体MDA含量均显著增高。 表明线粒体电子传递过程中由电子漏形成的 是运动性 内源自由基的重要来源[7]。
是运动性 内源自由基的重要来源[7]。
本实验结果还表明,力竭性运动后不同组织线粒体 生 成量并未呈现并行性显著变化。提示不同组织运动内源
生 成量并未呈现并行性显著变化。提示不同组织运动内源 生成及代谢可能存在不同途径。一般认为,应激状态下线粒体耗氧剧增,而超氧自由 基生成与线粒体氧利用率成正比[8]。理论上讲,运动过程中 收缩骨骼肌和心肌以及高代谢器官肝脏中自由基都直接来源于线粒体机制(电子漏途 径)。
生成及代谢可能存在不同途径。一般认为,应激状态下线粒体耗氧剧增,而超氧自由 基生成与线粒体氧利用率成正比[8]。理论上讲,运动过程中 收缩骨骼肌和心肌以及高代谢器官肝脏中自由基都直接来源于线粒体机制(电子漏途 径)。
, 百拇医药
实验中观察到心肌线粒体 生成虽有增高,但未呈现与 骨骼肌和肝脏线粒体并行的显著性改变,但脂质过氧化水平却显著增高。这一结果尚未见文 献报道。心肌线粒体过氧化作用的特点可能与运动中心肌组织能量代谢特点有关。我们早先 的研究曾推测,递增负荷力竭性运动中心肌
生成虽有增高,但未呈现与 骨骼肌和肝脏线粒体并行的显著性改变,但脂质过氧化水平却显著增高。这一结果尚未见文 献报道。心肌线粒体过氧化作用的特点可能与运动中心肌组织能量代谢特点有关。我们早先 的研究曾推测,递增负荷力竭性运动中心肌 的生成可 能主要以经黄嘌呤氧化酶途径为主,而非线粒体呼吸[9]。本文的 结果似乎证实了这一推测。其机制可能与长时间耗竭运动中,由心肌需氧量增加,冠脉供血 不足引起心肌“能量需求过高性”缺氧[10]所介导黄嘌呤氧化酶 途径激活有关。另外,实验所检测到的超氧自由基只反映了线粒体呼吸链生成的
的生成可 能主要以经黄嘌呤氧化酶途径为主,而非线粒体呼吸[9]。本文的 结果似乎证实了这一推测。其机制可能与长时间耗竭运动中,由心肌需氧量增加,冠脉供血 不足引起心肌“能量需求过高性”缺氧[10]所介导黄嘌呤氧化酶 途径激活有关。另外,实验所检测到的超氧自由基只反映了线粒体呼吸链生成的 部分,而组织中经黄嘌呤氧化酶途径生成的
部分,而组织中经黄嘌呤氧化酶途径生成的 并不在其列。所以,其它实验曾观察到的力竭性运动性后心肌组织
并不在其列。所以,其它实验曾观察到的力竭性运动性后心肌组织 信号增强,实际上包括了线粒体呼吸和黄嘌呤氧化酶途径两部 分。由于本实验未对线粒体
信号增强,实际上包括了线粒体呼吸和黄嘌呤氧化酶途径两部 分。由于本实验未对线粒体 生成作运动中和运动后不 同时间段的观察,在线粒体呼吸链(电子漏)与黄嘌呤氧化酶途径对运动性内源自由基形成 的贡献上,仍须进一步深入研究。
生成作运动中和运动后不 同时间段的观察,在线粒体呼吸链(电子漏)与黄嘌呤氧化酶途径对运动性内源自由基形成 的贡献上,仍须进一步深入研究。
, http://www.100md.com
由于至今尚未在骨骼肌发现黄嘌呤氧化酶,因此线粒体电子漏途径可能是其运动性内源自由 基的主要来源。工作骨骼肌中是否存在其它自由基产生途径,尚待进一步研究。另外,实验 观察到的肝脏 含量值明显低于心肌和骨骼肌,可能与 肝脏基础氧耗较低有关[11]。■
含量值明显低于心肌和骨骼肌,可能与 肝脏基础氧耗较低有关[11]。■
基金项目:国家体育总局资助课题(970019)和天津市高校重点学科科研课题.
作者简介:时庆德,男,29岁,现为北京体育大学运动生理学博士研究生
参考文献:
[1]Davies KJA, Quintanilha AT and Brooks GA. Free radicals and tissue damage produced by exercise. Biochem Biophys Res Communi, 1982, 107, 1198-120 5
, http://www.100md.com
[2]Bedford TG. Maximal oxygen consumption of rats and its changes with various experimental produres. J Appl Physiol, 1979, 47, 1278-1283
[3]Sherrat HSA, Watmough NJ, Johnson MA,et al. Methods for study o f normal and abnormal skeletal muscle mitochondria. in Methods of biochemical analysis. Vol.33, David G. eds. Am sterdam: Elsevier, 1982, 264-356
[4]Nakanok,M. Assay of formation or removal of oxygen radicals. in Methods in enzymology. Vol. 186, New York: Academic Press, 1990, 585-590
, 百拇医药
[5]Askawa T and Matsusluta S. Thiobarbituric acid test for detecting lipid peroxides. Lipid. 1979, 14, 401
[6]Sjodin B, Westing YH and Apple FS. Biochemical mechanisms for oxyge n free radical formation during exercise. Sports Med, 1990, 10, 236-254
[7]时庆德,张勇,陈家琦等. 疲劳性运动中线粒体电子漏引起质子漏增加. 生物化学与生物物理学报, 1999,31(1):97-100
[8]Boverris A. Role of ubiquinone in mitochondrial generation of hydroge n peroxide. Biochem J, 1976, 156, 435-444
, 百拇医药
[9]张勇,李静先,陈家琦等. 运动性疲劳状态下线粒体膜生物学特征的研究I:力竭运动后大鼠心肌和骨骼肌线粒体膜脂质过氧化水平变化. 体育科学,1994,14(4):67-70
[10]Bowe WJ. Endurance exercise and injury to heart. Sports Med. 1993,16:73-79
[11]Soboll S. Regulation of energy metabolism in liver. J Biol Chem, 1995,27:571-582
收稿日期:1999-02-05, 百拇医药
单位:时庆德(天津体育学院运动医学研究所 天津 300381);张勇(天津体育学院运动医学研究所 天津 300381);文立(天津体育学院运动医学研究所 天津 300381);陈家琦(天津体育学院运动医学研究所 天津 300381);李林江(中国科学院动物研究所生物膜与膜生物工程国家重点实验室);刘树森(中国科学院动物研究所生物膜与膜生物工程国家重点实验室)
关键词:骨骼肌;心肌;肝脏;线粒体;超氧阴离子;力竭性运动
中国运动医学杂志000115 摘 要:以大鼠中等强度力竭性跑台跑为运动性疲劳模型,采用化学发光法分别直接测定了运动后即刻骨骼肌、心肌和肝脏线粒体超氧阴离子(
 )生成量;以TBA荧光法测定线粒体丙二醛(MDA)含量。结果表明,骨骼肌和肝脏线粒体
)生成量;以TBA荧光法测定线粒体丙二醛(MDA)含量。结果表明,骨骼肌和肝脏线粒体 生成较运动前安静时显著增加(P<0.05),心肌线粒体
生成较运动前安静时显著增加(P<0.05),心肌线粒体 生成呈增加趋势(P>0.05); 三种组织线粒体脂质过氧化水平均显著增加(P<0.05) 。结果提示,骨骼肌和肝脏线粒体氧自由基代谢以线粒体电子漏机制为主,心肌则可能存在黄嘌呤氧化酶途径的参与。
生成呈增加趋势(P>0.05); 三种组织线粒体脂质过氧化水平均显著增加(P<0.05) 。结果提示,骨骼肌和肝脏线粒体氧自由基代谢以线粒体电子漏机制为主,心肌则可能存在黄嘌呤氧化酶途径的参与。, http://www.100md.com
Study on Molecular Mechanism of Mitochondrial Membrane for Exercise-induced Fati gue.Ⅱ.Explores to Pathway of Oxygen Free Radicals Metabolism Induced by Exercise
Shi Qingde, Zhang Yong, Wen Li, Chen Jiaqi
(Tianjin Research Institute of Sports Medicine, Tianjin 300381)
Abstract:Using the incremental exercise to exhaustion as an experimental animal model, we determined superoxide anion (
 ) production d irectly and the MDA contents in the prepared mitochondria of liver, heart and skeletal muscle from rats immediately after exhaustive exercise. The results showed the following.The mitochondrial
) production d irectly and the MDA contents in the prepared mitochondria of liver, heart and skeletal muscle from rats immediately after exhaustive exercise. The results showed the following.The mitochondrial  of liver and skeletal muscle post-exercise increased significantly than these at rest (P<0 .05).In heart, the production of
of liver and skeletal muscle post-exercise increased significantly than these at rest (P<0 .05).In heart, the production of increased without significance. However, The significant increase of MDA contents were observed among three tissue mitochondria(P<0.05).The present data suggested th at mitochondrial respiratory, eg.electron leak was an importan tmechanism of metabolic pathway of exercise-induced oxygen free radicals in liver and skeletal muscle, but the same situation may be not existed in heart, thus other pathway should be involved in lipid peroxidation.
increased without significance. However, The significant increase of MDA contents were observed among three tissue mitochondria(P<0.05).The present data suggested th at mitochondrial respiratory, eg.electron leak was an importan tmechanism of metabolic pathway of exercise-induced oxygen free radicals in liver and skeletal muscle, but the same situation may be not existed in heart, thus other pathway should be involved in lipid peroxidation., 百拇医药
Key words:skeletal muscle;liver;heart;mitochondria;superoxide;exhaustive exercise.▲
1982年Davies等人首次采用电子自旋共振技术 (ESR) 直接观察到大鼠力竭运 动后肝脏和骨骼肌自由基信号增加[1]。此后,大量报道显示机体 运动性内源自由基及其引发的脂质过氧化水平增加,与运动性疲劳及包括线粒体膜在内的细胞膜系统损伤(损害)密切相关。然而,多数实验研究均是以自由基代谢中间产物生成的多 寡来“定量”过氧化损害的程度,少见对脂质过氧化损害源头——运动性自由基生成代谢途 径的关注。某些机制性的问题,如运动代谢中组织氧自由基生成的线粒体呼吸链或黄嘌呤氧 化酶途径孰轻孰重?限于实验手段而鲜见报道。虽有对运动后自由基的ESR研究的组织或组 织匀浆检测,但缺乏对线粒体的直接观察。因此,氧自由基生成的两条途径在运动性内源自 由基及其引发的脂质过氧化水平中的作用及意义尚缺乏有力的实验证据。为此,本实验以化 学发光法直接定量观察并比较大鼠力竭运动后骨骼肌、心肌和肝脏线粒体超氧阴离子(
 )生成量,并与脂质过氧化水平对照,以期对运动性内源 自由基的生成及代谢途径做再探讨。
)生成量,并与脂质过氧化水平对照,以期对运动性内源 自由基的生成及代谢途径做再探讨。, 百拇医药
1 材料和方法
1.1 实验动物及运动方式 健康雄性SD大鼠,体重220~260g,由中国科 学院动物研究所实验动物中心提供。实验采用Bedford据鼠体重/摄氧量回归方程所建立的渐 增负荷运动模型[2]。按以下运动程序运动至力竭:第一级负荷: 坡度0°,速度8.2m/min,时间15min;第二级负荷:5°,15m/min,15min;第三级负荷:10° ,19.3m/min(相当于76%最大摄氧量)运动至力竭。力竭标准:第三级负荷运动中,动物未 能坚持本级负荷运动跑速,先后滞于跑道后1/3处达3次以上,刺激驱赶无效。运动至力竭时 间为126±30 min。
1.2 化学试剂 去脂牛血清白蛋白(Defatted BSA),MCLA [2-methyl -6-(p-methoxyl)-3,7-dihy-droimidazol (1,2-a) pyrazin-3-one],超氧化物歧化酶(Sup eroxide dismutase, SOD),鱼藤酮(Rotenone),黄嘌呤(xanthine),1,1,3,3-四乙氧基丙 烷(titraethoxyp-ropane, TEP),ADP(adenosine 5′-diphosphate)为美国Sigma Co. 产 品;黄嘌呤氧化酶(xanthine oxidae)为上海东风试剂厂产品;实验中所用其它试剂均为分 析纯。
, 百拇医药
1. 3 线粒体的提取[3] 实验动物分别于运动 前后断头处死并迅速取后肢骨骼肌、完整心脏肝脏,用介质冲洗两遍,剔除脂肪及结缔组织 、剪碎,电动匀浆器匀浆。0℃~4℃条件下分级分离差速离心法提取线粒体。线粒体蛋白含 量用双缩脲法测定,用280nm下校正的BSA作标准。
1.4 线粒体
 生成状况的测定[4] MCLA是一种化学发光剂,可被
生成状况的测定[4] MCLA是一种化学发光剂,可被 ,102等活性氧激发发光,加入过量的
,102等活性氧激发发光,加入过量的 特异性 清除酶SOD后,荧光淬灭的量可反映
特异性 清除酶SOD后,荧光淬灭的量可反映 产生的量。反应介 质为300mmol/L Sucrose, 10mmol/L Tris-HCl(pH 7.5), 10mmol/L KH2PO4, 10mmol/L KCl, 0.05mmol/L MgCl2, 2μmol/L MCLA, 4μmol/L Rotenone。线粒体浓度为0.1mg/ ml。25℃恒温。加入3.3mmol/L琥珀酸启动反应,在LKB-125型发光仪上测试。记录仪记录 反应曲线。用同样反应条件测定黄嘌呤氧化酶体系浓度与对SOD敏感的发光强度之间的量- 效关系,得出发光强度与
产生的量。反应介 质为300mmol/L Sucrose, 10mmol/L Tris-HCl(pH 7.5), 10mmol/L KH2PO4, 10mmol/L KCl, 0.05mmol/L MgCl2, 2μmol/L MCLA, 4μmol/L Rotenone。线粒体浓度为0.1mg/ ml。25℃恒温。加入3.3mmol/L琥珀酸启动反应,在LKB-125型发光仪上测试。记录仪记录 反应曲线。用同样反应条件测定黄嘌呤氧化酶体系浓度与对SOD敏感的发光强度之间的量- 效关系,得出发光强度与 产生之间的标准曲线。
产生之间的标准曲线。, 百拇医药
1.5 线粒体丙二醛(MDA)含量的测定[5] 依硫 代巴比妥酸(TBA)法,用10%高氯酸配成0.67%的过饱和溶液,再以20%的三氯乙酸稀释(V: V=3:2)。取10μl线粒体蛋白加入TBA溶液,总体积为5ml。95℃加热30分钟,冷水冷却。300 0转/prm离心10分钟,取上清液在532nm测定OD值。相同反应条件下以TEP为标准作标准曲线 。
1. 6 统计学处理 由SPSS统计软件包进行统计处理。以
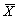 ±SD表 示数据,t检验。
±SD表 示数据,t检验。2 结果
力竭性运动后肝脏和骨骼肌线粒体超氧阴离子生成和MDA含量均较运动前安静时显著增高,表明线粒体呼吸链机制(电子漏增加)可能是线粒体膜脂质过氧化水平增高的重要原因。心肌线粒体线粒体超氧阴离子生成增加未呈显著性改变,但脂质过氧化水平显著增高。
, 百拇医药
表1 大鼠骨骼肌、心肌和肝脏线粒体超氧阴离子生成 和MDA含量变化
Table 1 Changes of
 and MDA contents of
and MDA contents ofmuscle, heart and liver mi tochondria in rats 线粒体
Mitochondria
指标
Parameters
安静时 Rest
(n=7)
运动后 Post-exercise
, 百拇医药
(n=6)
骨骼肌(Skeletal muscles)
 (nmol/mg pro.)
(nmol/mg pro.)2.58±0.63
3.64±1.05*
MDA(nmol/mg pro.)
1.71±0.42
2.40±0.58*
心肌(Myocardium )
 (nmol/mg pro.)
(nmol/mg pro.), 百拇医药
1.75±0.33
2.16±0.57
MDA(nmol/mg pro.)
1.55±0.27
1.96±0.45*
肝脏( Livers)
 (nmol/mg pro.)
(nmol/mg pro.)0.45±0.17
0.70±0.23*
MDA(nmol/mg pro.)
, http://www.100md.com
1.06±0.35
1.57±0.43*
*P<0.05 (compared with rest).
3 讨论
有关运动自由基生物学的研究已得到某些共识,即运动诱导的内源自由基生成增多及其 引发的脂质过氧化反应,与运动性疲劳及包括线粒体膜在内的细胞膜系统损伤(损害)密切 相关。但因实验方法学的不足,以往的研究仅限于间接测定自由基代谢产物及自由基清除酶 系。至今只有Davies(1982)、陈英杰(1991)和丁树哲(1992)等有关ESR技术应用于骨 骼肌、心肌和肝脏组织(匀浆)中运动性内源自由基直接检测的报道,尚缺乏对线粒体的直 接观察。而对自由基生成及代谢的两条重要途径[6]:线粒体呼吸 链机制和组织黄嘌呤氧化酶机制在运动自由基生成及代谢中的作用尚未有直接的实验证据。
, 百拇医药
本实验以化学发光法直接且定量,对同一递增负荷力竭运动模式下不同组织线粒体
 生成进行观察。结果表明,力竭运动后骨骼肌、肝脏线粒体
生成进行观察。结果表明,力竭运动后骨骼肌、肝脏线粒体 生成呈显著增加,心肌
生成呈显著增加,心肌 生成有明显增加。对自由基代谢产物测定显示,三种组织线粒体MDA含量均显著增高。 表明线粒体电子传递过程中由电子漏形成的
生成有明显增加。对自由基代谢产物测定显示,三种组织线粒体MDA含量均显著增高。 表明线粒体电子传递过程中由电子漏形成的 是运动性 内源自由基的重要来源[7]。
是运动性 内源自由基的重要来源[7]。本实验结果还表明,力竭性运动后不同组织线粒体
 生 成量并未呈现并行性显著变化。提示不同组织运动内源
生 成量并未呈现并行性显著变化。提示不同组织运动内源 生成及代谢可能存在不同途径。一般认为,应激状态下线粒体耗氧剧增,而超氧自由 基生成与线粒体氧利用率成正比[8]。理论上讲,运动过程中 收缩骨骼肌和心肌以及高代谢器官肝脏中自由基都直接来源于线粒体机制(电子漏途 径)。
生成及代谢可能存在不同途径。一般认为,应激状态下线粒体耗氧剧增,而超氧自由 基生成与线粒体氧利用率成正比[8]。理论上讲,运动过程中 收缩骨骼肌和心肌以及高代谢器官肝脏中自由基都直接来源于线粒体机制(电子漏途 径)。, 百拇医药
实验中观察到心肌线粒体
 生成虽有增高,但未呈现与 骨骼肌和肝脏线粒体并行的显著性改变,但脂质过氧化水平却显著增高。这一结果尚未见文 献报道。心肌线粒体过氧化作用的特点可能与运动中心肌组织能量代谢特点有关。我们早先 的研究曾推测,递增负荷力竭性运动中心肌
生成虽有增高,但未呈现与 骨骼肌和肝脏线粒体并行的显著性改变,但脂质过氧化水平却显著增高。这一结果尚未见文 献报道。心肌线粒体过氧化作用的特点可能与运动中心肌组织能量代谢特点有关。我们早先 的研究曾推测,递增负荷力竭性运动中心肌 的生成可 能主要以经黄嘌呤氧化酶途径为主,而非线粒体呼吸[9]。本文的 结果似乎证实了这一推测。其机制可能与长时间耗竭运动中,由心肌需氧量增加,冠脉供血 不足引起心肌“能量需求过高性”缺氧[10]所介导黄嘌呤氧化酶 途径激活有关。另外,实验所检测到的超氧自由基只反映了线粒体呼吸链生成的
的生成可 能主要以经黄嘌呤氧化酶途径为主,而非线粒体呼吸[9]。本文的 结果似乎证实了这一推测。其机制可能与长时间耗竭运动中,由心肌需氧量增加,冠脉供血 不足引起心肌“能量需求过高性”缺氧[10]所介导黄嘌呤氧化酶 途径激活有关。另外,实验所检测到的超氧自由基只反映了线粒体呼吸链生成的 部分,而组织中经黄嘌呤氧化酶途径生成的
部分,而组织中经黄嘌呤氧化酶途径生成的 并不在其列。所以,其它实验曾观察到的力竭性运动性后心肌组织
并不在其列。所以,其它实验曾观察到的力竭性运动性后心肌组织 信号增强,实际上包括了线粒体呼吸和黄嘌呤氧化酶途径两部 分。由于本实验未对线粒体
信号增强,实际上包括了线粒体呼吸和黄嘌呤氧化酶途径两部 分。由于本实验未对线粒体 生成作运动中和运动后不 同时间段的观察,在线粒体呼吸链(电子漏)与黄嘌呤氧化酶途径对运动性内源自由基形成 的贡献上,仍须进一步深入研究。
生成作运动中和运动后不 同时间段的观察,在线粒体呼吸链(电子漏)与黄嘌呤氧化酶途径对运动性内源自由基形成 的贡献上,仍须进一步深入研究。, http://www.100md.com
由于至今尚未在骨骼肌发现黄嘌呤氧化酶,因此线粒体电子漏途径可能是其运动性内源自由 基的主要来源。工作骨骼肌中是否存在其它自由基产生途径,尚待进一步研究。另外,实验 观察到的肝脏
 含量值明显低于心肌和骨骼肌,可能与 肝脏基础氧耗较低有关[11]。■
含量值明显低于心肌和骨骼肌,可能与 肝脏基础氧耗较低有关[11]。■基金项目:国家体育总局资助课题(970019)和天津市高校重点学科科研课题.
作者简介:时庆德,男,29岁,现为北京体育大学运动生理学博士研究生
参考文献:
[1]Davies KJA, Quintanilha AT and Brooks GA. Free radicals and tissue damage produced by exercise. Biochem Biophys Res Communi, 1982, 107, 1198-120 5
, http://www.100md.com
[2]Bedford TG. Maximal oxygen consumption of rats and its changes with various experimental produres. J Appl Physiol, 1979, 47, 1278-1283
[3]Sherrat HSA, Watmough NJ, Johnson MA,et al. Methods for study o f normal and abnormal skeletal muscle mitochondria. in Methods of biochemical analysis. Vol.33, David G. eds. Am sterdam: Elsevier, 1982, 264-356
[4]Nakanok,M. Assay of formation or removal of oxygen radicals. in Methods in enzymology. Vol. 186, New York: Academic Press, 1990, 585-590
, 百拇医药
[5]Askawa T and Matsusluta S. Thiobarbituric acid test for detecting lipid peroxides. Lipid. 1979, 14, 401
[6]Sjodin B, Westing YH and Apple FS. Biochemical mechanisms for oxyge n free radical formation during exercise. Sports Med, 1990, 10, 236-254
[7]时庆德,张勇,陈家琦等. 疲劳性运动中线粒体电子漏引起质子漏增加. 生物化学与生物物理学报, 1999,31(1):97-100
[8]Boverris A. Role of ubiquinone in mitochondrial generation of hydroge n peroxide. Biochem J, 1976, 156, 435-444
, 百拇医药
[9]张勇,李静先,陈家琦等. 运动性疲劳状态下线粒体膜生物学特征的研究I:力竭运动后大鼠心肌和骨骼肌线粒体膜脂质过氧化水平变化. 体育科学,1994,14(4):67-70
[10]Bowe WJ. Endurance exercise and injury to heart. Sports Med. 1993,16:73-79
[11]Soboll S. Regulation of energy metabolism in liver. J Biol Chem, 1995,27:571-582
收稿日期:1999-02-05, 百拇医药