GDNF重组腺病毒对损伤运动神经元的保护作用*
作者:唐晓青 万有 徐国恒 王韵 韩济生
单位:北京医科大学神经科学研究所,北京 100083
关键词:运动神经元;药物作用;腺病毒;胶质细胞源性神经营养因子☆
990308 摘 要 目的:观察携带胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)基因的重组腺病毒 (AdCMVgdnf) 对损伤运动神经元的保护作用。方法:采用培养运动神经元的谷氨酸损伤模型,评价GDNF重组腺病毒对损伤运动神经元的影响,指标是运动神经元计数。结果:(1) 建立了运动神经元谷氨酸损伤模型:当培养液中加入0.5 mmol.L-1的谷氨酸,作用24~48 h后,运动神经元数目较对照组显著减少(P<0.01);(2)携带GDNF基因的重组腺病毒可显著减轻谷氨酸导致的运动神经元损伤。结论:腺病毒介导的GDNF表达对损伤的运动神经元具有保护作用。
, 百拇医药
中国图书资料分类法分类号 R338.21-332
Protection of injured motoneurons by adenovirus-mediated
GDNF expression
TANG Xiao-Qing, WAN You, XU Guo-Heng, WANG Yun, HAN Ji-Sheng
(Neuroscience Research Institute, Beijing Medical University, Beijing 100083)
MeSH Motoneuron/drug eff Adenovirus GDNF☆
, 百拇医药 ABSTRACT Objective: To investigate the neuroprotective effect of GDNF, encoded by an adenovirus, on injured motoneurons. Methods: The influence of the recombinant GDNF-adenovirus on injured motoneurons was estimated by using a glutamate-induced lesion model. And the indicator was motoneuron counts. Results: (1) When cultured motoneurons were exposed to glutamate (0.5 mmol.L-1) for 24~48 h, the cell number decreased significantly as compared with the control (P<0.01). (2) Adenovirus encoding GDNF could significantly reduce the excitotoxic damage of motoneurons. Conclusion: Adenovirus encoding GDNF can protect motoneurons from cytotoxic injury.
, 百拇医药
(J Beijing Med Univ, 1999,31:220-222)
许多实验证明,胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)具有使培养的运动神经元存活数目增多,防止发育期运动神经元的程序化死亡以及轴突切断引起的运动神经元死亡或萎缩等作用[1,2],提示它对脊髓损伤、肌萎缩性侧索硬化等疾病的治疗具有潜在的应用价值。但GDNF价格昂贵,且不能通过血脑屏障,限制了它在临床的应用。如果能用合适的载体,将编码GDNF的基因导入中枢神经系统内特定部位,使其稳定、高效地表达GDNF, 以发挥营养、 保护运动神经元的作用,则对上述疾病的治疗具有积极意义。本实验首先建立了体外培养运动神经元的损伤模型,借此模型观察携带GDNF基因的重组腺病毒对运动神经元的保护作用,为in vivo基因治疗的实验研究打下了一定基础。
1 材料与方法
, 百拇医药
1.1 材料
大鼠GDNF蛋白、X-gal为Sigma 公司产品,细胞培养试剂为Gibco BRL公司产品,谷氨酸钠、胆碱酯酶染色试剂等为国产分析纯试剂。
1.2 方法
重组腺病毒的构建[3]:采用体内同源基因重组技术,在人巨细胞病毒(cytomegalovirus, CMV)增强子/启动子序列调控下,将lacZ标记基因或GDNF基因插入到5型复制缺陷型腺病毒基因组E1区,并在人293细胞中扩增、纯化,滴度为108 pfu.ml-1,分别命名为AdCMVlacZ或AdCMVgdnf。
胎鼠脊髓腹侧神经细胞的分离培养[4]:取孕期14 d的胎鼠,在无菌条件下剥离脊髓,在解剖显微镜下切取脊髓腹侧组织块,充分切碎后用1g.L-1的胰蛋白酶消化20 min, 吹打分散后,经200目的钢网过滤,以1000r.min-1离心5 min,弃上清,用含MEM:体积分数为10%的胎牛血清的培养液重悬,调整细胞数为2×105 ml-1, 种在预先经多聚赖氨酸(12.5mg.L-1, 1 h) 包被的24孔板上,每孔接种1ml,37℃,CO2(体积分数为5%)孵箱中培养,2~3 d换一次液。
, 百拇医药
神经细胞染色:X-gal染色以显示lacZ基因的表达产物β-半乳糖苷酶,采用文献[5]的方法;胆碱酯酶( acetylcholinesterase, AChE ) 染色以显示胆碱能神经元,采用Karnovsky-Root法。
细胞计数和统计学处理:用倒置显微镜进行细胞计数,实验数据用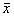 ±
±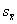 表示。组间比较用ANOVA继之以Newman-Keuls检验进行统计学处理。
表示。组间比较用ANOVA继之以Newman-Keuls检验进行统计学处理。
2 结果
2.1 lacZ重组腺病毒在培养脊髓腹侧细胞的表达
为观察重组腺病毒是否可在培养脊髓腹侧细胞中表达,在培养24 h后,按20 MOI量(即每孔加病毒悬液40 μl,相当于20个病毒颗粒感染每个培养脊髓腹侧细胞)加AdCMVlacZ, 然后在不同时间进行X-gal染色,以检测lacZ标记基因的表达。结果显示,在加入AdCMVlacZ 12 h后,标记基因开始表达,随着时间延长,表达逐渐增多,至48h表达率达100%,几乎所有细胞均蓝染(见图1),表明lacZ重组腺病毒可在培养脊髓腹侧细胞中表达。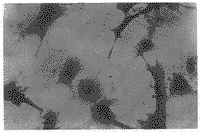
, 百拇医药
图1 培养脊髓腹侧细胞中加入AdCMVlacZ 48 h
后X-gal染色结果 ×200
Figure 1 X-gal staining of ventral spinal cord cultures,48 h after the addition of AdCMVlacZ ×200
2.2 培养运动神经元谷氨酸损伤模型的建立
2.2.1 量效曲线 脊髓腹侧神经细胞培养24 h后,加入谷氨酸钠至终浓度分别为0、0.02、0.1、0.5、2.5、12.5 mmol.L-1,继续培养24h,进行胆碱酯酶染色。胆碱酯酶染色阳性的神经元,同时具有胞体大、至多极神经元特征,可判断为脊髓前角运动神经元[4,6]。计数每孔存活运动神经元的总数,并以不加谷氨酸钠的对照组平均计数为100%进行校正,结果如图2A。运动神经元数目随谷氨酸钠浓度升高而降低,当浓度达到0.5mmolL-1以上时,运动神经元数目较对照组减少40.6%以上(P<0.01)。因此,在以下实验中,采用0.5mmol.L-1为损伤剂量。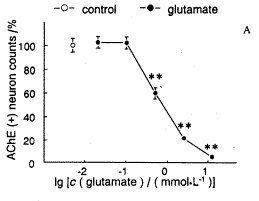

, 百拇医药
*P<0.05, **P<0.01, compared with control group; n=3.
图2 A.谷氨酸作用于培养运动神经元的量效曲线;
B.谷氨酸作用于培养运动神经元的时效曲线
Figure 2 A, The dose-response relationship for glutamate neurotoxicity
on cultured motoneurons; B,The time-response relationship
for glutamate neurotoxicity on cultured motoneurons
2.2.2 时效曲线
, 百拇医药
胎鼠脊髓腹侧细胞培养24 h后,加入谷氨酸钠至终浓度为0.5 mmol.L-1,继续培养不同时间后做胆碱酯酶染色,计数每孔的存活运动神经元总数,并以加药前的平均计数为100%进行校正。每一时间点均平行设立空白对照组,结果如图2B。
谷氨酸盐作用48 h时,运动神经元数目较对照组降低23.1%(P<0.05)。在以下实验中,选择谷氨酸盐作用时间为48h。
2.3 GDNF重组腺病毒对损伤运动神经元的保护作用
胎鼠脊髓腹侧神经细胞培养24 h后,分别加入AdCMVlacZ (20 MOI)、AdCMVgdnf (20 MOI)及GDNF(10μg.L-1), 24 h后加入谷氨酸盐,使终浓度为0.5 mmol.L-1,继续培养48 h后进行胆碱酯酶染色,计数每孔存活运动神经元总数,以不加任何药物的对照组平均值为100%进行校正。结果显示,单纯谷氨酸盐组计数为(66.0±4.2)%, 而(GDNF+谷氨酸盐)组和(AdCMVgdnf+谷氨酸盐)组计数分别为(88.1±4.6)%和(85.1±2.3)%,即加入GDNF蛋白或AdCMVgdnf均可显著减轻谷氨酸盐造成的损伤, 使存活运动神经元数目明显增多(P<0.05),而AdCMVlacZ 则无此作用。
, 百拇医药
3 讨论
谷氨酸可通过NMDA和非NMDA受体引起神经元损伤,不同种类、不同发育阶段、不同培养条件的神经元对这种兴奋性神经毒素的敏感性不同[7]。本实验在胎鼠脊髓腹侧培养细胞上,以运动神经元计数为指标,建立了谷氨酸损伤运动神经元的模型,这对在离体情况下研究某些运动神经元疾病的发病及治疗有一定意义。
腺病毒作为in vivo基因治疗的载体,具有稳定、安全、滴度高、宿主范围广等优点,近年来在中枢神经系统基因转移的研究中用得较多[8,9]。腺病毒的感染量用病毒感染复数(multiplicity of infection, MOI)来表示,它是指病毒颗粒数与细胞数的比值。当MOI在10到50之间时,既可达到较高的转染效率,又不会对细胞的存活、形态及功能造成明显影响[10],因此,我们在实验中,选择MOI=20作为加入腺病毒的剂量。
, http://www.100md.com
本研究中所用的腺病毒是我室利用体内同源重组原理构建的,用形态学、病毒DNA酶切分析、PCR和RT-PCR等方法进行鉴定正确,用免疫沉淀方法从GDNF重组腺病毒感染的293细胞及其培养基上清中均检测到大量GDNF蛋白,说明它能够介导GDNF 基因的高效转移和表达,并能象天然蛋白一样分泌到细胞外,在基因治疗中可能具有重要意义[3]。
本实验观察到,当携带GDNF基因的重组腺病毒加入到培养的运动神经元中,可显著增强后者的抗损伤能力,说明AdCMVgdnf对损伤运动神经元有明显保护作用,迄今国内外未见类似报道。鉴于lacZ重组腺病毒能在本实验的培养体系中表达标记基因,故GDNF重组腺病毒能够介导GDNF基因的表达;且在同样条件下,观察到GDNF蛋白有保护损伤运动神经元的作用,而AdCMVlacZ 无此作用,因此推论AdCMVgdnf的保护作用是通过感染宿主细胞,表达和分泌GDNF实现的。
* 国家自然科学基金(39600150)资助项目;
, 百拇医药
☆ 自由词。
1 Henderson CE, Phillips HS, Pollock RA, et al. GDNF: A potent survival factor for motoneurons present in peripheral nerve and muscle. Science, 1994, 266: 1062-1064
2 Oppenheim RW, Houenou LJ, Johnson JE, et al. Developing motor neurons rescued from programmed and axotomy-induced cell death by GDNF. Nature, 1995, 373: 344-346
3 徐国恒,凌 雁,万 有,等. GDNF重组腺病毒的构建及促进多巴胺能神经元存活的研究. 中国生物化学与分子生物学报,1999,15:42-47
, http://www.100md.com
4 Sean GC, Hong ZY, John HW. Motor neurons are selectively vulnerable to AMPA/kainate receptor-mediated injury in vitro. J Neurosci, 1996, 16: 4069-4079
5 Sanes JR, Rubinstein JLR, Nicolas JF. Use of a recombinant retrovirus to study post implantation cell lineage in mouse embryos. EMBO J, 1986, J5: 3133-3142
6 Satoh K. A comparison of the distribution of central cholinergic neurons as demonstrated by acetylcholinesterase pharmacohistochemistry and choline acetyltransferase immunohistochemistry. Brain Res Bull, 1983, 11: 693-698
, 百拇医药
7 Esteves AG, Stutzmann JM, Barbeito L. Protecive effect of riluzole on excitatory amino acid-mediated neurotoxicity in motoneuton-enriched cultures. Eur J Pharmacol, 1995, 280: 47-53
8 王晓民. 基因治疗. 生理科学进展,1997,28:183-191
9 Davidson BL, Bohn MC. Recombinant adenovirus: a gene transfer vector for study and treatment of CNS diseases. Exp Neurol, 1997, 144: 125-130
10 Slack RS, Bellvean DJ, Rosenberg M, et al. Adenovirus-mediated gene transfer of the tumor suppressor, P53, induces apoptosis in postmitotic neurons. J Cell Biol, 1996, 135: 1085-1096
(1999-03-02收稿), 百拇医药
单位:北京医科大学神经科学研究所,北京 100083
关键词:运动神经元;药物作用;腺病毒;胶质细胞源性神经营养因子☆
990308 摘 要 目的:观察携带胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)基因的重组腺病毒 (AdCMVgdnf) 对损伤运动神经元的保护作用。方法:采用培养运动神经元的谷氨酸损伤模型,评价GDNF重组腺病毒对损伤运动神经元的影响,指标是运动神经元计数。结果:(1) 建立了运动神经元谷氨酸损伤模型:当培养液中加入0.5 mmol.L-1的谷氨酸,作用24~48 h后,运动神经元数目较对照组显著减少(P<0.01);(2)携带GDNF基因的重组腺病毒可显著减轻谷氨酸导致的运动神经元损伤。结论:腺病毒介导的GDNF表达对损伤的运动神经元具有保护作用。
, 百拇医药
中国图书资料分类法分类号 R338.21-332
Protection of injured motoneurons by adenovirus-mediated
GDNF expression
TANG Xiao-Qing, WAN You, XU Guo-Heng, WANG Yun, HAN Ji-Sheng
(Neuroscience Research Institute, Beijing Medical University, Beijing 100083)
MeSH Motoneuron/drug eff Adenovirus GDNF☆
, 百拇医药 ABSTRACT Objective: To investigate the neuroprotective effect of GDNF, encoded by an adenovirus, on injured motoneurons. Methods: The influence of the recombinant GDNF-adenovirus on injured motoneurons was estimated by using a glutamate-induced lesion model. And the indicator was motoneuron counts. Results: (1) When cultured motoneurons were exposed to glutamate (0.5 mmol.L-1) for 24~48 h, the cell number decreased significantly as compared with the control (P<0.01). (2) Adenovirus encoding GDNF could significantly reduce the excitotoxic damage of motoneurons. Conclusion: Adenovirus encoding GDNF can protect motoneurons from cytotoxic injury.
, 百拇医药
(J Beijing Med Univ, 1999,31:220-222)
许多实验证明,胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)具有使培养的运动神经元存活数目增多,防止发育期运动神经元的程序化死亡以及轴突切断引起的运动神经元死亡或萎缩等作用[1,2],提示它对脊髓损伤、肌萎缩性侧索硬化等疾病的治疗具有潜在的应用价值。但GDNF价格昂贵,且不能通过血脑屏障,限制了它在临床的应用。如果能用合适的载体,将编码GDNF的基因导入中枢神经系统内特定部位,使其稳定、高效地表达GDNF, 以发挥营养、 保护运动神经元的作用,则对上述疾病的治疗具有积极意义。本实验首先建立了体外培养运动神经元的损伤模型,借此模型观察携带GDNF基因的重组腺病毒对运动神经元的保护作用,为in vivo基因治疗的实验研究打下了一定基础。
1 材料与方法
, 百拇医药
1.1 材料
大鼠GDNF蛋白、X-gal为Sigma 公司产品,细胞培养试剂为Gibco BRL公司产品,谷氨酸钠、胆碱酯酶染色试剂等为国产分析纯试剂。
1.2 方法
重组腺病毒的构建[3]:采用体内同源基因重组技术,在人巨细胞病毒(cytomegalovirus, CMV)增强子/启动子序列调控下,将lacZ标记基因或GDNF基因插入到5型复制缺陷型腺病毒基因组E1区,并在人293细胞中扩增、纯化,滴度为108 pfu.ml-1,分别命名为AdCMVlacZ或AdCMVgdnf。
胎鼠脊髓腹侧神经细胞的分离培养[4]:取孕期14 d的胎鼠,在无菌条件下剥离脊髓,在解剖显微镜下切取脊髓腹侧组织块,充分切碎后用1g.L-1的胰蛋白酶消化20 min, 吹打分散后,经200目的钢网过滤,以1000r.min-1离心5 min,弃上清,用含MEM:体积分数为10%的胎牛血清的培养液重悬,调整细胞数为2×105 ml-1, 种在预先经多聚赖氨酸(12.5mg.L-1, 1 h) 包被的24孔板上,每孔接种1ml,37℃,CO2(体积分数为5%)孵箱中培养,2~3 d换一次液。
, 百拇医药
神经细胞染色:X-gal染色以显示lacZ基因的表达产物β-半乳糖苷酶,采用文献[5]的方法;胆碱酯酶( acetylcholinesterase, AChE ) 染色以显示胆碱能神经元,采用Karnovsky-Root法。
细胞计数和统计学处理:用倒置显微镜进行细胞计数,实验数据用
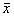 ±
±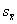 表示。组间比较用ANOVA继之以Newman-Keuls检验进行统计学处理。
表示。组间比较用ANOVA继之以Newman-Keuls检验进行统计学处理。2 结果
2.1 lacZ重组腺病毒在培养脊髓腹侧细胞的表达
为观察重组腺病毒是否可在培养脊髓腹侧细胞中表达,在培养24 h后,按20 MOI量(即每孔加病毒悬液40 μl,相当于20个病毒颗粒感染每个培养脊髓腹侧细胞)加AdCMVlacZ, 然后在不同时间进行X-gal染色,以检测lacZ标记基因的表达。结果显示,在加入AdCMVlacZ 12 h后,标记基因开始表达,随着时间延长,表达逐渐增多,至48h表达率达100%,几乎所有细胞均蓝染(见图1),表明lacZ重组腺病毒可在培养脊髓腹侧细胞中表达。

, 百拇医药
图1 培养脊髓腹侧细胞中加入AdCMVlacZ 48 h
后X-gal染色结果 ×200
Figure 1 X-gal staining of ventral spinal cord cultures,48 h after the addition of AdCMVlacZ ×200
2.2 培养运动神经元谷氨酸损伤模型的建立
2.2.1 量效曲线 脊髓腹侧神经细胞培养24 h后,加入谷氨酸钠至终浓度分别为0、0.02、0.1、0.5、2.5、12.5 mmol.L-1,继续培养24h,进行胆碱酯酶染色。胆碱酯酶染色阳性的神经元,同时具有胞体大、至多极神经元特征,可判断为脊髓前角运动神经元[4,6]。计数每孔存活运动神经元的总数,并以不加谷氨酸钠的对照组平均计数为100%进行校正,结果如图2A。运动神经元数目随谷氨酸钠浓度升高而降低,当浓度达到0.5mmolL-1以上时,运动神经元数目较对照组减少40.6%以上(P<0.01)。因此,在以下实验中,采用0.5mmol.L-1为损伤剂量。


, 百拇医药
*P<0.05, **P<0.01, compared with control group; n=3.
图2 A.谷氨酸作用于培养运动神经元的量效曲线;
B.谷氨酸作用于培养运动神经元的时效曲线
Figure 2 A, The dose-response relationship for glutamate neurotoxicity
on cultured motoneurons; B,The time-response relationship
for glutamate neurotoxicity on cultured motoneurons
2.2.2 时效曲线
, 百拇医药
胎鼠脊髓腹侧细胞培养24 h后,加入谷氨酸钠至终浓度为0.5 mmol.L-1,继续培养不同时间后做胆碱酯酶染色,计数每孔的存活运动神经元总数,并以加药前的平均计数为100%进行校正。每一时间点均平行设立空白对照组,结果如图2B。
谷氨酸盐作用48 h时,运动神经元数目较对照组降低23.1%(P<0.05)。在以下实验中,选择谷氨酸盐作用时间为48h。
2.3 GDNF重组腺病毒对损伤运动神经元的保护作用
胎鼠脊髓腹侧神经细胞培养24 h后,分别加入AdCMVlacZ (20 MOI)、AdCMVgdnf (20 MOI)及GDNF(10μg.L-1), 24 h后加入谷氨酸盐,使终浓度为0.5 mmol.L-1,继续培养48 h后进行胆碱酯酶染色,计数每孔存活运动神经元总数,以不加任何药物的对照组平均值为100%进行校正。结果显示,单纯谷氨酸盐组计数为(66.0±4.2)%, 而(GDNF+谷氨酸盐)组和(AdCMVgdnf+谷氨酸盐)组计数分别为(88.1±4.6)%和(85.1±2.3)%,即加入GDNF蛋白或AdCMVgdnf均可显著减轻谷氨酸盐造成的损伤, 使存活运动神经元数目明显增多(P<0.05),而AdCMVlacZ 则无此作用。
, 百拇医药
3 讨论
谷氨酸可通过NMDA和非NMDA受体引起神经元损伤,不同种类、不同发育阶段、不同培养条件的神经元对这种兴奋性神经毒素的敏感性不同[7]。本实验在胎鼠脊髓腹侧培养细胞上,以运动神经元计数为指标,建立了谷氨酸损伤运动神经元的模型,这对在离体情况下研究某些运动神经元疾病的发病及治疗有一定意义。
腺病毒作为in vivo基因治疗的载体,具有稳定、安全、滴度高、宿主范围广等优点,近年来在中枢神经系统基因转移的研究中用得较多[8,9]。腺病毒的感染量用病毒感染复数(multiplicity of infection, MOI)来表示,它是指病毒颗粒数与细胞数的比值。当MOI在10到50之间时,既可达到较高的转染效率,又不会对细胞的存活、形态及功能造成明显影响[10],因此,我们在实验中,选择MOI=20作为加入腺病毒的剂量。
, http://www.100md.com
本研究中所用的腺病毒是我室利用体内同源重组原理构建的,用形态学、病毒DNA酶切分析、PCR和RT-PCR等方法进行鉴定正确,用免疫沉淀方法从GDNF重组腺病毒感染的293细胞及其培养基上清中均检测到大量GDNF蛋白,说明它能够介导GDNF 基因的高效转移和表达,并能象天然蛋白一样分泌到细胞外,在基因治疗中可能具有重要意义[3]。
本实验观察到,当携带GDNF基因的重组腺病毒加入到培养的运动神经元中,可显著增强后者的抗损伤能力,说明AdCMVgdnf对损伤运动神经元有明显保护作用,迄今国内外未见类似报道。鉴于lacZ重组腺病毒能在本实验的培养体系中表达标记基因,故GDNF重组腺病毒能够介导GDNF基因的表达;且在同样条件下,观察到GDNF蛋白有保护损伤运动神经元的作用,而AdCMVlacZ 无此作用,因此推论AdCMVgdnf的保护作用是通过感染宿主细胞,表达和分泌GDNF实现的。
* 国家自然科学基金(39600150)资助项目;
, 百拇医药
☆ 自由词。
1 Henderson CE, Phillips HS, Pollock RA, et al. GDNF: A potent survival factor for motoneurons present in peripheral nerve and muscle. Science, 1994, 266: 1062-1064
2 Oppenheim RW, Houenou LJ, Johnson JE, et al. Developing motor neurons rescued from programmed and axotomy-induced cell death by GDNF. Nature, 1995, 373: 344-346
3 徐国恒,凌 雁,万 有,等. GDNF重组腺病毒的构建及促进多巴胺能神经元存活的研究. 中国生物化学与分子生物学报,1999,15:42-47
, http://www.100md.com
4 Sean GC, Hong ZY, John HW. Motor neurons are selectively vulnerable to AMPA/kainate receptor-mediated injury in vitro. J Neurosci, 1996, 16: 4069-4079
5 Sanes JR, Rubinstein JLR, Nicolas JF. Use of a recombinant retrovirus to study post implantation cell lineage in mouse embryos. EMBO J, 1986, J5: 3133-3142
6 Satoh K. A comparison of the distribution of central cholinergic neurons as demonstrated by acetylcholinesterase pharmacohistochemistry and choline acetyltransferase immunohistochemistry. Brain Res Bull, 1983, 11: 693-698
, 百拇医药
7 Esteves AG, Stutzmann JM, Barbeito L. Protecive effect of riluzole on excitatory amino acid-mediated neurotoxicity in motoneuton-enriched cultures. Eur J Pharmacol, 1995, 280: 47-53
8 王晓民. 基因治疗. 生理科学进展,1997,28:183-191
9 Davidson BL, Bohn MC. Recombinant adenovirus: a gene transfer vector for study and treatment of CNS diseases. Exp Neurol, 1997, 144: 125-130
10 Slack RS, Bellvean DJ, Rosenberg M, et al. Adenovirus-mediated gene transfer of the tumor suppressor, P53, induces apoptosis in postmitotic neurons. J Cell Biol, 1996, 135: 1085-1096
(1999-03-02收稿), 百拇医药