肠源性脓毒症
http://www.100md.com
《急诊医学》
作者:张 平 杨午鸣
单位:310009 杭州,浙江中医学院病理学教研室(张平);生理学教研室(杨午鸣)
关键词:
急诊医学990632 肠源性脓毒症(gut origin sepsis,GOS)是创伤、急诊医学研究中新认识到的一种临床综合征,它与多器官功能障碍综合征(MODS)的发生密切相关。了解GOS的发生发展,对防治MODS,降低创伤、危重病患者的死亡率具有十分重要的临床意义。本文简介GOS的发生机理包括全身炎症反应综合征(SIRS)的形成及肠道细菌移位的加重,及其防治措施。
1 GOS的概念与MODS
创伤、危重病患者的死亡原因主要是MODS,自70年代以来对MODS的深入研究逐步发现:各种创伤刺激均可引起SIRS,其中轻、中度SIRS对机体是有利的,并随支持疗法而痊愈;重度SIRS经脓毒症发展为单击型MODS,稍重型SIRS患者须遭受第二次攻击后同样经脓毒症发展为双击型MODS。因此,不少危重病患者常经历创伤→SIRS→脓毒症→MODS的变化,而从SIRS发展到MODS的各阶段间并无明确的界限,其中脓毒症是其发展过程中的关键。但在脓毒症的治疗中,约1/3患者体内始终找不到原发感染灶,虽经各种抗菌素治疗,终究未能控制脓毒症而发生MODS;进一步观察到这类患者及动物模型体内常表现明显的肠道细菌移位现象,推测肠道是这类脓毒症患者的细菌感染源,为此Border等早在1987年就提出GOS的概念。目前已有许多研究证明肠道在SIRS、脓毒症、MODS的连续发展过程中起重要作用,支持GOS的观点[1,2]。
, http://www.100md.com
2 GOS的发生机理
脓毒症的发生,Wenzel等[3]认为是机体在SIRS基础上合并感染的过程,Beal等[4]也认为是感染等因素逐步引起的SIRS。不管怎样,它总是包括SIRS及感染两个基本过程,两者相互影响,促进脓毒症的发生。GOS作为一种特殊的脓毒症,其发生也是如此,仅其感染方式为肠道细菌移位。
2.1 SIRS的形成
SIRS的发生先有创伤、出血、烧伤、手术等原始刺激,再有肠缺血/再灌注损伤、输血、禁食等继发刺激,使局部炎症不断扩大;参与SIRS的效应物既有体液中的介质(补体、激肽、细胞因子等),又有不同类型的细胞如巨噬细胞(Mφ)、多形核白细胞(PMN)、内皮细胞(EC)及各脏器如肠、肺、肝;介质、细胞、脏器间的相互作用又使炎症反应向全身扩大。参与SIRS的各种效应物在创伤早期对机体均有一定的保护作用,但过度、持久激活的介质(尤其某些细胞因子)、细胞或脏器则引起组织损伤,促进SIRS的形成[4]。在SIRS形成过程中主要效应物的作用如下。
, 百拇医药
2.1.1 促炎症细胞因子的作用
机体在创伤后的最早反应是由损伤局部Mφ等细胞产生促炎症(proinflammatory)细胞因子包括TNF-α、IL-1、IL-2、IL-6、IFN-γ等。如TNF-α通过趋化PMN、增加毛细血管通透性、诱发细胞因子间相互作用、促进氧自由基的产生,导致SIRS,故多数机体血中TNF-α升高。创伤后由EC产生的IL-6可通过诱导肝合成急性期蛋白、调节免疫反应及限制吞噬细胞产生TNF等影响SIRS的发生。Mφ在SIRS形成过程中主要通过释放TNF、IL-1等30多种细胞因子,在不同脏器的各阶段发挥作用[4,5]。
2.1.2 PMN及EC的作用
PMN在TNF等作用下可增加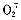 、弹性蛋白酶的释放及粘附分子的表达,既可加强杀菌,又可损伤组织。如PMN表面CD18与伤后血中出现的可溶性细胞间粘附分子-1(sICAM-1)结合后,PMN释放弹性蛋白酶,引起组织损伤;PMN还可通过CD18与心肌细胞、肝细胞及肺泡Ⅰ型上皮等细胞表面的ICAM-1结合,损伤这些实质细胞[6]。
、弹性蛋白酶的释放及粘附分子的表达,既可加强杀菌,又可损伤组织。如PMN表面CD18与伤后血中出现的可溶性细胞间粘附分子-1(sICAM-1)结合后,PMN释放弹性蛋白酶,引起组织损伤;PMN还可通过CD18与心肌细胞、肝细胞及肺泡Ⅰ型上皮等细胞表面的ICAM-1结合,损伤这些实质细胞[6]。
, http://www.100md.com
EC既有调节血管张力、防止凝血,又有维持血管对脂类、高分子蛋白及免疫细胞通透的屏障功能。体外观察到EC在TNF-α、IL-1作用下,其表面ELAM-1表达、EC间紧密连续结构及对蛋白通透性均有损伤性变化,而TNF-α刺激平滑肌产生的NO对EC有直接细胞毒作用[7]。
尤其是PMN及EC上细胞粘附分子(CAM)的异常表达,也是导致SIRS的重要因素。因为PMN的渗出杀菌及EC的屏障功能首先需它们表面各种CAM在表达的时相、数量上相互协调,然后经CAM间特异性结合使PMN与EC间相互作用而完成,如PMN上适量选择素(selectin)-L及EC上适量选择素-E及-P的表达有助于PMN在EC表面滚动(rolling),只有经过滚动,EC上ICAM-1与PMN上CD18相互作用促进PMN粘牢于EC上,并穿过EC间渗出;PMN渗出时表面选择素-L因芽生入血而减少,同时表面CD18/11b增加而被激活,进入炎区发挥吞噬杀菌作用。而临床发现SIRS患者循环PMN上选择素-L减少、EC上无选择素-P表达仅有选择素-E,血中选择素-L升高,很可能PMN及EC上这些CAM的异常表达降低了PMN在EC上的滚动,影响PMN粘附、穿过EC间,使SIRS患者PMN渗出减少,降低杀菌能力;而血中选择素-L升高是PMN激活的标志,说明SIRS患者循环PMN尚未渗出提前在血管内激活,导致血管EC损伤。SIRS患者PMN与EC上CAM的表达异常与损伤后TNF等促炎症细胞因子的作用有关,其机理尚须进一步研究[8]。
, 百拇医药
2.1.3 肠、肺及肝的作用
肠、肺及肝既是促炎症细胞因子的产生器官,又是其效应器官,它们间相互作用促进SIRS的发生。首先,肠在出血性休克、肠系膜动脉栓塞、烧伤、肢体创伤等情况下,均可通过神经、促炎症细胞因子等机理引起肠缺血/再灌注损伤(I/R),I/R肠可预激(priming)PMN,所谓预激是指PMN在激活前接触某些预激剂(如血小板活化因子)作用后处于静止与激活状态之间,预激过的PMN再经激活后释放的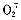 等产物大幅度增加,具有更强的杀菌及组织损伤作用。I/R肠还可引起肺、肝及心等器官的功能变化,如肠I/R后肺内预激PMN大量积聚,并在TNF、白细胞三烯等作用下损伤肺血管平滑肌松弛机理,引起肺漏及血管收缩;还可增加肺内诱导型NO合成酶的含量及活性,与肺水肿的形成密切相关[9,10]。
等产物大幅度增加,具有更强的杀菌及组织损伤作用。I/R肠还可引起肺、肝及心等器官的功能变化,如肠I/R后肺内预激PMN大量积聚,并在TNF、白细胞三烯等作用下损伤肺血管平滑肌松弛机理,引起肺漏及血管收缩;还可增加肺内诱导型NO合成酶的含量及活性,与肺水肿的形成密切相关[9,10]。
2.2 肠道细菌移位的加重
, 百拇医药
肠道细菌移位是指肠腔内细菌穿过肠粘膜进入固有膜,出现于肠系膜淋巴结,并扩散到肝、脾等全身肠外组织。肠道细菌移位在常人可以是肠上皮摄取抗原的自然现象,但在SIRS机体内因以下机理使其加重,可导致脓毒症[2]。
2.2.1 肠防御功能障碍
肠免疫生理研究表明,肠不仅有营养吸收功能,还有抗感染及调低过敏反应等防御功能,其基础是肠相关淋巴组织及肠壁结构的完整性,在创伤出血等原始病因作用下,肠I/R使上皮坏死脱落、淋巴组织细胞凋亡,降低粘膜屏障功能,加重肠道细菌移位。如肠缺血使正常肠壁粘膜面氧分压低于浆膜面更明显,尤其粘膜面氧分压降低5~10mmHg,妨碍ATP合成,上皮细胞坏死脱落,以利细菌入侵;有报告休克时肠壁浆膜侧杀菌力降低25%而粘膜侧降低近100%[1];创伤出血大鼠中发现,集合淋巴小结内Fas表达增加、出现细胞凋亡,引起IgA分泌减少,降低粘膜免疫功能,促进肠道细菌移位[11]。此外,长期禁食、胃肠外营养,因肠缺乏食物刺激,使肠内蛙皮素等神经肽生成减少,引起肠淋巴组织萎缩,T、B细胞减少,IgA分泌不足,而固有膜中CD+8细胞增多,均促进肠道细菌移位[12]。
, http://www.100md.com
2.2.2 机体细胞免疫功能障碍
T细胞介导的免疫功能对防止肠菌转位起重要作用。如无胸腺裸鼠或新生时切除胸腺小鼠肠道细菌可自发移位至肠系膜淋巴结、肝、脾及肾;T细胞(包括CD+4、CD+8、CD+4/CD+8、CD+4/CD-8、CD-8细胞)缺失小鼠大肠杆菌的移位明显增加。临床与实验动物中均观察到,各种创伤因素都可抑制T细胞免疫功能,如在创伤刺激后无论外科病人或动物体内,均可抑制Th1类细胞的细胞免疫功能,促进Th2类细胞的体液免疫功能,因而也加重了这些机体内的肠道细菌移位[13]。
2.2.3 肠道细菌的过度生长
, http://www.100md.com
肠内依靠专性厌氧菌对其它肠菌拮抗维持肠菌的生态平衡。如全胃肠外营养后使厌氧菌与需氧菌比例失调或胰腺炎时肠内胰液、乳酸杆菌的减少,使肠内厌氧菌减少,因拮抗失衡均使大肠杆菌过度生长,促进肠道细菌移位[2]。
3 GOS的防治
为及早诊断GOS,对创伤或大手术等患者可监测胃肠粘膜微循环灌流;肠pH及碱性磷酸酶同功酶;肠脂肪酸结合蛋白,其正常人血尿含量为1.87ng/ml,SIRS患者血中为5.3ng/ml,肠缺血时血中为50ng/ml;用PCR检测肠道细菌移位[14,15]。
为保护肠粘膜的屏障功能,可用EGF促进肠上皮创伤后的恢复,减少禁食后肠上皮的萎缩,诱发肠隐窝细胞的增生;蛙皮素可引起缩胆素、胃泌素的释放,刺激肠分泌IgA,维持肠淋巴组织的密度。为提高免疫功能,须补充富含ω-3脂肪酸、精氨酸等免疫营养食物,前者尚可降低血或组织中白三烯、血栓素、前列腺素等促炎介质;后者在基础型NO合成酶作用下生成的NO可扩张血管、促进PMN的吞噬及呼吸爆发。新生兔喂以乳汁内提取的IgA可增强肠粘膜屏障功能,防止肠道细菌移位[16];免疫调节剂胸腺潘丁(Thymopentin)可调整创伤后Th1/Th2细胞因子间的失衡,增加对移位肠菌的杀灭[17]。此外还用缓激肽拮抗剂Deltibunt、TNF拮抗剂、抗PMN单克隆抗体Urge-8等治疗防止SIRS的发生。
, http://www.100md.com
参考文献
1 Gennari R,Alexander JW.Effects of hyperoxia on bacterial translocation and mortality during gut-derived-sepsis.Arch Surg,1996,131:57.
2 Wang X,Andersson R,Soltesz V,et al.Gut origin spsis,macrophage function and oxygen extraction associated with acute pancreatitis in the rats.World J Surg,1996,20:299.
3 Wenzel RP,Pinsky MR,Ulevitch RJ,et al.Current understanding of sepsis.Clinic Infect Dis,1996,22:407.
, http://www.100md.com
4 Beal AL,Cerra FB.Multiple organ failure in the 1990s:systemic inflammatory response and organ dysfunction.JAMA,1994,271:226.
5 Kusske AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice.Surgery,1996,120:284.
6 Barnett CC,Moore EF,Moore FA,et al.Soluble intercellular adhesion molecule-1 provokes polymorphonuclear leukocyte elastase release by CD18.Surgery,1996,120:395.
, http://www.100md.com
7 Marcus BC,Wyble CW,Hynes KL,et al.Cytokine-induced increases in endothelial permeability occur after adhesion molecule expression.Surgery,1996,120:411.
8 Mcgill SN,Ahmed NA,Hu F,et al.Shedding of L-selectin as a mechanism for reduced polymorphonuclear neutrophil exudation in patients with the systemic inflammatory response syndrome.Arch Surg,1996,131:1141.
9 Koike K,Moore EE,Moore FA,et al.Gut phospholipase A2 mediates neutrophil priming and lung injury after mesenteric ischemia-reperfusion.Am J Physiol,1995,268:G397.
, 百拇医药
10 Turnage RH,Wright JK,Iglesias J,et al.Intestinal reperfusion-induced pulmonary edema is related to increased pulmonary inducible nitric oxide synthase activity.Surggery,1998,124:457.
11 Xu YX,Ayala A,Monfils B,et al.Mechanism of intestinal mucosal immune dysfunction following trauma-hemorrhage:increased apoptosis associated with elevated Fas expression in peyers patches.J Surg Res,1997,70:55.
12 Li J,Kudsk KA,Harbara H,et al.Bombesin affects mucosal immunity and gut associated lymphoid tissue in intravenously fed mice.Arch Surg,1995,130:1164.
, 百拇医药
13 Decker D,Schondorf M,Bidlingmaier F,et al.Surgical stress induces a shift in the type-1/type-2 T-helper cell balance,suggesting down-regulation of cell-mediated and up-regulation of antibody-mediated immunity commensurate to the trauma.Surgery,1996,119:316.
14 Liebermen JM,Sacchettini J,Marks C,et al.Human intestinal fatty acid binding protein:report of an assay with studies in normal volunteers and intestinal ischemia.Surgery,1997,121:335.
, http://www.100md.com
15 Kane TD,Johnson SR,Alexander JW,et al.Detection of intestinal bacterial translocation using PCR.J Surg Res,1996,63:59.
16 Dickinson EC,Gorga JC,Garrett M,et al.Immunoglobulin a supplementation abrogates bacterial translocation and preserves the architecture of the intestinal epithelium.Surgery,1998,124:284.
17 Brage M,Gianotti L,Gentilini O,et al.Thymopentin modulates Th1 and Th2 cytokine response and host survival in experimental injury.J Surg Res,1996,62:197.
收稿:1999-06-17,修回:1999-08-02, 百拇医药
单位:310009 杭州,浙江中医学院病理学教研室(张平);生理学教研室(杨午鸣)
关键词:
急诊医学990632 肠源性脓毒症(gut origin sepsis,GOS)是创伤、急诊医学研究中新认识到的一种临床综合征,它与多器官功能障碍综合征(MODS)的发生密切相关。了解GOS的发生发展,对防治MODS,降低创伤、危重病患者的死亡率具有十分重要的临床意义。本文简介GOS的发生机理包括全身炎症反应综合征(SIRS)的形成及肠道细菌移位的加重,及其防治措施。
1 GOS的概念与MODS
创伤、危重病患者的死亡原因主要是MODS,自70年代以来对MODS的深入研究逐步发现:各种创伤刺激均可引起SIRS,其中轻、中度SIRS对机体是有利的,并随支持疗法而痊愈;重度SIRS经脓毒症发展为单击型MODS,稍重型SIRS患者须遭受第二次攻击后同样经脓毒症发展为双击型MODS。因此,不少危重病患者常经历创伤→SIRS→脓毒症→MODS的变化,而从SIRS发展到MODS的各阶段间并无明确的界限,其中脓毒症是其发展过程中的关键。但在脓毒症的治疗中,约1/3患者体内始终找不到原发感染灶,虽经各种抗菌素治疗,终究未能控制脓毒症而发生MODS;进一步观察到这类患者及动物模型体内常表现明显的肠道细菌移位现象,推测肠道是这类脓毒症患者的细菌感染源,为此Border等早在1987年就提出GOS的概念。目前已有许多研究证明肠道在SIRS、脓毒症、MODS的连续发展过程中起重要作用,支持GOS的观点[1,2]。
, http://www.100md.com
2 GOS的发生机理
脓毒症的发生,Wenzel等[3]认为是机体在SIRS基础上合并感染的过程,Beal等[4]也认为是感染等因素逐步引起的SIRS。不管怎样,它总是包括SIRS及感染两个基本过程,两者相互影响,促进脓毒症的发生。GOS作为一种特殊的脓毒症,其发生也是如此,仅其感染方式为肠道细菌移位。
2.1 SIRS的形成
SIRS的发生先有创伤、出血、烧伤、手术等原始刺激,再有肠缺血/再灌注损伤、输血、禁食等继发刺激,使局部炎症不断扩大;参与SIRS的效应物既有体液中的介质(补体、激肽、细胞因子等),又有不同类型的细胞如巨噬细胞(Mφ)、多形核白细胞(PMN)、内皮细胞(EC)及各脏器如肠、肺、肝;介质、细胞、脏器间的相互作用又使炎症反应向全身扩大。参与SIRS的各种效应物在创伤早期对机体均有一定的保护作用,但过度、持久激活的介质(尤其某些细胞因子)、细胞或脏器则引起组织损伤,促进SIRS的形成[4]。在SIRS形成过程中主要效应物的作用如下。
, 百拇医药
2.1.1 促炎症细胞因子的作用
机体在创伤后的最早反应是由损伤局部Mφ等细胞产生促炎症(proinflammatory)细胞因子包括TNF-α、IL-1、IL-2、IL-6、IFN-γ等。如TNF-α通过趋化PMN、增加毛细血管通透性、诱发细胞因子间相互作用、促进氧自由基的产生,导致SIRS,故多数机体血中TNF-α升高。创伤后由EC产生的IL-6可通过诱导肝合成急性期蛋白、调节免疫反应及限制吞噬细胞产生TNF等影响SIRS的发生。Mφ在SIRS形成过程中主要通过释放TNF、IL-1等30多种细胞因子,在不同脏器的各阶段发挥作用[4,5]。
2.1.2 PMN及EC的作用
PMN在TNF等作用下可增加
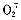 、弹性蛋白酶的释放及粘附分子的表达,既可加强杀菌,又可损伤组织。如PMN表面CD18与伤后血中出现的可溶性细胞间粘附分子-1(sICAM-1)结合后,PMN释放弹性蛋白酶,引起组织损伤;PMN还可通过CD18与心肌细胞、肝细胞及肺泡Ⅰ型上皮等细胞表面的ICAM-1结合,损伤这些实质细胞[6]。
、弹性蛋白酶的释放及粘附分子的表达,既可加强杀菌,又可损伤组织。如PMN表面CD18与伤后血中出现的可溶性细胞间粘附分子-1(sICAM-1)结合后,PMN释放弹性蛋白酶,引起组织损伤;PMN还可通过CD18与心肌细胞、肝细胞及肺泡Ⅰ型上皮等细胞表面的ICAM-1结合,损伤这些实质细胞[6]。, http://www.100md.com
EC既有调节血管张力、防止凝血,又有维持血管对脂类、高分子蛋白及免疫细胞通透的屏障功能。体外观察到EC在TNF-α、IL-1作用下,其表面ELAM-1表达、EC间紧密连续结构及对蛋白通透性均有损伤性变化,而TNF-α刺激平滑肌产生的NO对EC有直接细胞毒作用[7]。
尤其是PMN及EC上细胞粘附分子(CAM)的异常表达,也是导致SIRS的重要因素。因为PMN的渗出杀菌及EC的屏障功能首先需它们表面各种CAM在表达的时相、数量上相互协调,然后经CAM间特异性结合使PMN与EC间相互作用而完成,如PMN上适量选择素(selectin)-L及EC上适量选择素-E及-P的表达有助于PMN在EC表面滚动(rolling),只有经过滚动,EC上ICAM-1与PMN上CD18相互作用促进PMN粘牢于EC上,并穿过EC间渗出;PMN渗出时表面选择素-L因芽生入血而减少,同时表面CD18/11b增加而被激活,进入炎区发挥吞噬杀菌作用。而临床发现SIRS患者循环PMN上选择素-L减少、EC上无选择素-P表达仅有选择素-E,血中选择素-L升高,很可能PMN及EC上这些CAM的异常表达降低了PMN在EC上的滚动,影响PMN粘附、穿过EC间,使SIRS患者PMN渗出减少,降低杀菌能力;而血中选择素-L升高是PMN激活的标志,说明SIRS患者循环PMN尚未渗出提前在血管内激活,导致血管EC损伤。SIRS患者PMN与EC上CAM的表达异常与损伤后TNF等促炎症细胞因子的作用有关,其机理尚须进一步研究[8]。
, 百拇医药
2.1.3 肠、肺及肝的作用
肠、肺及肝既是促炎症细胞因子的产生器官,又是其效应器官,它们间相互作用促进SIRS的发生。首先,肠在出血性休克、肠系膜动脉栓塞、烧伤、肢体创伤等情况下,均可通过神经、促炎症细胞因子等机理引起肠缺血/再灌注损伤(I/R),I/R肠可预激(priming)PMN,所谓预激是指PMN在激活前接触某些预激剂(如血小板活化因子)作用后处于静止与激活状态之间,预激过的PMN再经激活后释放的
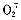 等产物大幅度增加,具有更强的杀菌及组织损伤作用。I/R肠还可引起肺、肝及心等器官的功能变化,如肠I/R后肺内预激PMN大量积聚,并在TNF、白细胞三烯等作用下损伤肺血管平滑肌松弛机理,引起肺漏及血管收缩;还可增加肺内诱导型NO合成酶的含量及活性,与肺水肿的形成密切相关[9,10]。
等产物大幅度增加,具有更强的杀菌及组织损伤作用。I/R肠还可引起肺、肝及心等器官的功能变化,如肠I/R后肺内预激PMN大量积聚,并在TNF、白细胞三烯等作用下损伤肺血管平滑肌松弛机理,引起肺漏及血管收缩;还可增加肺内诱导型NO合成酶的含量及活性,与肺水肿的形成密切相关[9,10]。2.2 肠道细菌移位的加重
, 百拇医药
肠道细菌移位是指肠腔内细菌穿过肠粘膜进入固有膜,出现于肠系膜淋巴结,并扩散到肝、脾等全身肠外组织。肠道细菌移位在常人可以是肠上皮摄取抗原的自然现象,但在SIRS机体内因以下机理使其加重,可导致脓毒症[2]。
2.2.1 肠防御功能障碍
肠免疫生理研究表明,肠不仅有营养吸收功能,还有抗感染及调低过敏反应等防御功能,其基础是肠相关淋巴组织及肠壁结构的完整性,在创伤出血等原始病因作用下,肠I/R使上皮坏死脱落、淋巴组织细胞凋亡,降低粘膜屏障功能,加重肠道细菌移位。如肠缺血使正常肠壁粘膜面氧分压低于浆膜面更明显,尤其粘膜面氧分压降低5~10mmHg,妨碍ATP合成,上皮细胞坏死脱落,以利细菌入侵;有报告休克时肠壁浆膜侧杀菌力降低25%而粘膜侧降低近100%[1];创伤出血大鼠中发现,集合淋巴小结内Fas表达增加、出现细胞凋亡,引起IgA分泌减少,降低粘膜免疫功能,促进肠道细菌移位[11]。此外,长期禁食、胃肠外营养,因肠缺乏食物刺激,使肠内蛙皮素等神经肽生成减少,引起肠淋巴组织萎缩,T、B细胞减少,IgA分泌不足,而固有膜中CD+8细胞增多,均促进肠道细菌移位[12]。
, http://www.100md.com
2.2.2 机体细胞免疫功能障碍
T细胞介导的免疫功能对防止肠菌转位起重要作用。如无胸腺裸鼠或新生时切除胸腺小鼠肠道细菌可自发移位至肠系膜淋巴结、肝、脾及肾;T细胞(包括CD+4、CD+8、CD+4/CD+8、CD+4/CD-8、CD-8细胞)缺失小鼠大肠杆菌的移位明显增加。临床与实验动物中均观察到,各种创伤因素都可抑制T细胞免疫功能,如在创伤刺激后无论外科病人或动物体内,均可抑制Th1类细胞的细胞免疫功能,促进Th2类细胞的体液免疫功能,因而也加重了这些机体内的肠道细菌移位[13]。
2.2.3 肠道细菌的过度生长
, http://www.100md.com
肠内依靠专性厌氧菌对其它肠菌拮抗维持肠菌的生态平衡。如全胃肠外营养后使厌氧菌与需氧菌比例失调或胰腺炎时肠内胰液、乳酸杆菌的减少,使肠内厌氧菌减少,因拮抗失衡均使大肠杆菌过度生长,促进肠道细菌移位[2]。
3 GOS的防治
为及早诊断GOS,对创伤或大手术等患者可监测胃肠粘膜微循环灌流;肠pH及碱性磷酸酶同功酶;肠脂肪酸结合蛋白,其正常人血尿含量为1.87ng/ml,SIRS患者血中为5.3ng/ml,肠缺血时血中为50ng/ml;用PCR检测肠道细菌移位[14,15]。
为保护肠粘膜的屏障功能,可用EGF促进肠上皮创伤后的恢复,减少禁食后肠上皮的萎缩,诱发肠隐窝细胞的增生;蛙皮素可引起缩胆素、胃泌素的释放,刺激肠分泌IgA,维持肠淋巴组织的密度。为提高免疫功能,须补充富含ω-3脂肪酸、精氨酸等免疫营养食物,前者尚可降低血或组织中白三烯、血栓素、前列腺素等促炎介质;后者在基础型NO合成酶作用下生成的NO可扩张血管、促进PMN的吞噬及呼吸爆发。新生兔喂以乳汁内提取的IgA可增强肠粘膜屏障功能,防止肠道细菌移位[16];免疫调节剂胸腺潘丁(Thymopentin)可调整创伤后Th1/Th2细胞因子间的失衡,增加对移位肠菌的杀灭[17]。此外还用缓激肽拮抗剂Deltibunt、TNF拮抗剂、抗PMN单克隆抗体Urge-8等治疗防止SIRS的发生。
, http://www.100md.com
参考文献
1 Gennari R,Alexander JW.Effects of hyperoxia on bacterial translocation and mortality during gut-derived-sepsis.Arch Surg,1996,131:57.
2 Wang X,Andersson R,Soltesz V,et al.Gut origin spsis,macrophage function and oxygen extraction associated with acute pancreatitis in the rats.World J Surg,1996,20:299.
3 Wenzel RP,Pinsky MR,Ulevitch RJ,et al.Current understanding of sepsis.Clinic Infect Dis,1996,22:407.
, http://www.100md.com
4 Beal AL,Cerra FB.Multiple organ failure in the 1990s:systemic inflammatory response and organ dysfunction.JAMA,1994,271:226.
5 Kusske AM,Rongione AJ,Ashley SW,et al.Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice.Surgery,1996,120:284.
6 Barnett CC,Moore EF,Moore FA,et al.Soluble intercellular adhesion molecule-1 provokes polymorphonuclear leukocyte elastase release by CD18.Surgery,1996,120:395.
, http://www.100md.com
7 Marcus BC,Wyble CW,Hynes KL,et al.Cytokine-induced increases in endothelial permeability occur after adhesion molecule expression.Surgery,1996,120:411.
8 Mcgill SN,Ahmed NA,Hu F,et al.Shedding of L-selectin as a mechanism for reduced polymorphonuclear neutrophil exudation in patients with the systemic inflammatory response syndrome.Arch Surg,1996,131:1141.
9 Koike K,Moore EE,Moore FA,et al.Gut phospholipase A2 mediates neutrophil priming and lung injury after mesenteric ischemia-reperfusion.Am J Physiol,1995,268:G397.
, 百拇医药
10 Turnage RH,Wright JK,Iglesias J,et al.Intestinal reperfusion-induced pulmonary edema is related to increased pulmonary inducible nitric oxide synthase activity.Surggery,1998,124:457.
11 Xu YX,Ayala A,Monfils B,et al.Mechanism of intestinal mucosal immune dysfunction following trauma-hemorrhage:increased apoptosis associated with elevated Fas expression in peyers patches.J Surg Res,1997,70:55.
12 Li J,Kudsk KA,Harbara H,et al.Bombesin affects mucosal immunity and gut associated lymphoid tissue in intravenously fed mice.Arch Surg,1995,130:1164.
, 百拇医药
13 Decker D,Schondorf M,Bidlingmaier F,et al.Surgical stress induces a shift in the type-1/type-2 T-helper cell balance,suggesting down-regulation of cell-mediated and up-regulation of antibody-mediated immunity commensurate to the trauma.Surgery,1996,119:316.
14 Liebermen JM,Sacchettini J,Marks C,et al.Human intestinal fatty acid binding protein:report of an assay with studies in normal volunteers and intestinal ischemia.Surgery,1997,121:335.
, http://www.100md.com
15 Kane TD,Johnson SR,Alexander JW,et al.Detection of intestinal bacterial translocation using PCR.J Surg Res,1996,63:59.
16 Dickinson EC,Gorga JC,Garrett M,et al.Immunoglobulin a supplementation abrogates bacterial translocation and preserves the architecture of the intestinal epithelium.Surgery,1998,124:284.
17 Brage M,Gianotti L,Gentilini O,et al.Thymopentin modulates Th1 and Th2 cytokine response and host survival in experimental injury.J Surg Res,1996,62:197.
收稿:1999-06-17,修回:1999-08-02, 百拇医药