不同DNA疫苗联合接种可有效增强免疫效果
作者:孟昕 阮力 魏博 刘文军 朱既明
单位:中国预防医学医学院科学院 病毒学研究所 100052
关键词:DNA疫苗;免疫增强;多价疫苗:HBcAg; HBeAg;HSV-1-gD
病毒学报000305 摘要:选择乙型肝炎(乙肝)病毒核心抗原(HBcAg)、e抗原(HBeAg)及单纯疱疹病毒gD抗原(HSV-1-gD)基因为目的基因,进行DNA疫苗联合免疫的研究。通过对不同基因片段的表达研究,选择了能在哺乳动物细胞中高效表达乙肝病毒核心抗原、e抗原和单纯疱疹病毒gD抗原的质粒DNA免疫Balb/c小鼠。结果显示:表达乙肝病毒核心抗原和单纯疱疹病毒gD抗原的DNA疫苗单独免疫,能有效刺激机体产生体液免疫和细胞免疫,二者的联合免疫明显加强了这种免疫效果,并可以使乙肝核心抗体提前出现。但表达乙肝病毒e抗原和单纯疱疹病毒gD抗原的DNA疫苗联合免疫则加强作用不明显。这些结果表明:不同DNA疫苗的适当组合有可能在获得多价疫苗的同时,提高DNA疫苗的免疫效果。
, 百拇医药
中图分类号:Q789,R373.2+1 文献标识码:A
文章编号:1000-8721(2000)03-0212-07
Immune Response Can Be Enhanced by Inoculation of Combined(Different)DNA Vaccines
MENG Xin,RUAN Li,WEI Bo,LIU Wen-jun,ZHU Ji-ming
(Institute of Virology, Chinese Academy of Preventive Medicine, Beijing 100052, China)
Abstract: In this experiment, a series of plasmids which harboring the HBcAg, HBeAg and HSV-1-gD genes respectively have been constructed as DNA vaccines. Some of them could highly express their target genes in tissue cultures. The single inoculation of the plasmids expressing HBcAg, and HSV-1-gD showed inducement of both humoral and cellular immune responses efficiently. The combined DNA immunization with these two plasmids could not only enhance the immune response obviously, but also the early appearance of HBcAb. The combined immunization of plasmids expressing HBeAg and HSV-1 gD showed no obvious enhancement of immune response. Our work offers a new approach to improve the immune response by multivalent DNA vaccine, if the vaccine DNAs are properly combined.
, 百拇医药
Key words: DNA vaccine; immune enhancement; multivalent vaccine; HBcAg; HBeAg; HSV-1-gD
DNA疫苗是近十年以来随着分子生物学、分子免疫学等学科的发展而出现的一种新型疫苗,它与常规疫苗相比有诸多优点:可以激发全面和持久的细胞免疫和体液免疫,易于构建和改造,易于构成多价疫苗,成本低廉,热稳定性好等等[1];在预防某些多型善变的病原体如流感、HIV感染方面表现尤为突出。迄今为止,已有大量报道DNA疫苗被用于艾滋病、流感、肝炎病毒、巨细胞病毒感染等病毒性疾病,结核等细菌性疾病,疟疾等寄生虫病的防治研究,以及抗肿瘤、抗自身免疫病的实验性治疗中。其中一些DNA疫苗已经美国FDA批准进行了小量人体试验[2]。
DNA疫苗尽管有诸多优点,但也有明显不足,其安全性目前尚无定论,质粒导入细胞效率低,诱发的免疫效果也相对较弱,等等。因此,各种增强DNA疫苗免疫效果的方法一直在研究和改进中。如在质粒构建时导入非甲基化的CpG序列,以使某些细胞因子的活性增强;与某些表达细胞因子如GM-CSF、IL-12等真核表达质粒共同免疫,也被证明有很好的加强免疫的作用。从理论上讲,表达不同抗原的DNA疫苗联合免疫除了可能起到多价疫苗的作用之外,还有可能在体液免疫和细胞免疫水平上产生相互影响,出现免疫增强或免疫抑制的情况。因此对这类问题的研究将不但有利于提高DNA疫苗的免疫效果,而且将为DNA多价疫苗的研究提供有意义的资料。
, http://www.100md.com
乙型肝炎(乙肝)病毒核心抗原和单纯疱疹病毒gD糖蛋白都是相应病原体引起细胞免疫和体液免疫的主要抗原,在疾病的预防和转归中具有重要意义。因此本文选择上述两种抗原基因,构建可在真核细胞中表达的DNA疫苗,分别单独和联合免疫Balb/c小鼠,对其诱导的免疫反应的特点、效果及相互影响进行了研究。
材料与方法
1 质粒、病毒与细胞株、菌株 pHBV-2质粒由本实验室提供,含有全长的HBV(ayw亚型)序列。pSK/HSV-1-gD质粒由病毒基因工程国家重点实验室提供,含有1.2kb HSV-1 gD糖蛋白基因。pcDNAI、pCMVβ均为商品化真核细胞表达质粒。pcDNAI-β质粒由本室构建,表达β-半乳糖苷酶。表达HSV-1 gD糖蛋白的重组痘苗病毒vRHSV1175D由病毒基因工程国家重点实验室提供。HSV-1病毒标准株由本所毒种室提供。293细胞购于美国ATCC,P815细胞由本所肿瘤病毒研究室和毒种室提供。
, 百拇医药
2 酶和试剂及免疫检测试剂 实验用酶类购于美国New England Biolabs公司、Promega公司、华美生物技术公司。脂质体转化试剂盒购于美国GIBCO公司。Na251CrO4购于美国杜邦公司。乙肝病毒核心抗原特异性CTL表位短肽SYMNTNMGL[3]由赛百盛公司合成。其余试剂均为常规分析纯试剂。乙肝病毒核心抗原及e抗原由军事医学科学院凌世淦教授惠赠。乙肝核心抗体A3H6、乙肝e抗体C4B8及共同抗体1G8由本所肝炎室詹美云教授惠赠。HSV-1gD糖蛋白纯品、兔抗gD血清RT及抗gD单克隆抗体ID3均由美国Philadelphia大学Dr.Willis惠赠。
3 质粒的构建、鉴定、提取和纯化 按文献进行[4]。
4 质粒的体外短暂表达 取已经纯化的等摩尔数的质粒,加入等量的表达β-半乳糖苷酶的质粒作为内对照,脂质体法转染70%~80%成片的293细胞。48h~72h后,取上清放入透析袋中,10倍风干浓缩,检测HBeAg。同时刮下细胞,重悬于0.5ml PBS中,超声破碎细胞,提取细胞内容物作HBcAg检测和β-半乳糖苷酶测定[5]。
, http://www.100md.com
5 ELISA检测抗原抗体 采用夹心法检测HBcAg和HBeAg,乙肝核心抗体(HBcAb)和乙肝e抗体(HBeAb),HSV-1 gD糖蛋白。包被抗体用包被液1∶1?000稀释,20%小牛血清封闭1h后加待检样品,37℃ 1h。洗板3遍后,加入第二抗体或酶标第二抗体,37℃ 1h。而加入酶标二抗的则直接检测;加入第2抗体的在洗板3遍后,加入HRP标记的羊抗鼠IgG,37℃ 1h;加入OPD显色液100μl/孔,室温10min,50μl 2mol/L硫酸终止反应。490nm测OD值。
6 免疫小鼠 将Balb/c小鼠随机分组,每组6只。注射质粒前24h乙醚麻醉小鼠,每只小鼠均在左胫骨前肌部位用4号针头肌肉注射25%蔗糖溶液100μl,分3点注射。24h后,每只小鼠在上次注射相同部位按同样方法注射100μl质粒液(包括两种质粒同时注射),两周后加强免疫1次。每只小鼠在免疫后不同时间用眼底取血法采集血清,检测抗体水平。
7 CTL的检测[6]
, http://www.100md.com
刺激细胞制备:常规制备小鼠脾细胞悬液,未免疫鼠脾细胞加入配好的ConA和乙肝病毒核心抗原特异性CTL表位九肽SYMNTNMGL,终浓度分别为2μg/ml和50μg/ml。在37℃ 5% CO2孵箱中孵育4h后,加入丝裂霉素C,终浓度80μg/ml。在37℃ 5%CO2孵箱中继续孵育2h。无血清RPMI 1640洗3次,然后调细胞浓度为2.5×106/ml作为刺激细胞。
效应细胞制备:每只免疫鼠脾细胞经无血清RPMI 1640洗后计数,用含10%小牛血清的完全培养基调细胞数为1×107/ml。取1ml加入24孔细胞培养板,每孔再加入1ml刺激细胞。培养液中加入rIL-2,终浓度为20μ/ml,然后放入37℃ 5% CO2孵箱中共培养4~6天。调节反应细胞数为1×107/ml。按3个梯度接种于96孔板,每个梯度接种3孔。
, 百拇医药 靶细胞制备及杀伤实验:每1×106P815细胞(H-2d)用100μl含2mg/ml九肽SYMNTNMGL的完全培养基重悬该细胞。加入100μl Na251CrO4,在37℃ 5% CO2条件下共培养1.5h。无血清RPMI 1640培养基洗3次,调节细胞浓度为1×105/ml。按100μl/孔加入预先已接种反应细胞的96孔板,形成不同的效∶靶比(E∶T)。同时做自然释放和最大释放对照,在37℃ 5% CO2条件下共培养6h。水平离心机1?500r/min离心96孔板5min,小心吸取100μl上清,γ-计数仪读取cpm值。按公式计算杀伤率: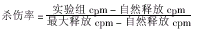
HSV-1gD抗原的CTL检测方法与HBV核心抗原的检测方法基本相同,但在制备刺激细胞时采用10MOI的重组痘苗病毒VRHB1175D(表达HSV-1 gD糖蛋白的重组痘苗病毒疫苗)感染过夜,同样加入丝裂霉素C后孵育2h,无血清RPMI 1640洗3次后,调细胞浓度为2.5×106/ml。靶细胞的处理是用10MOI HSV-1病毒感染P815细胞过夜,无血清RPMI 1640洗3次后加入100μl Na251CrO4标记,37℃ 5% CO2条件下培养1.5h,再用无血清RPMI 1640洗3次后,调节细胞浓度为1×105/ml,其余各步骤及杀伤率的计算与检测乙肝病毒核心抗原的方法完全一致。
, 百拇医药
结 果
1 目的基因的选择与重组质粒构建
考虑到乙肝病毒核心抗原与e抗原分别为非分泌型和分泌型抗原,且一级结构上e抗原包含核心抗原,而乙肝病毒本身的调控序列又可能会对目的基因的表达有一定的影响,故本实验选择不同长度的基因片段作为目的基因。首先从带有HBV(ayw亚型)全基因的pHBV-2质粒中酶切、电泳分离出3.2kb的HBV基因,再用不同的限制性内切酶组合酶切,分离出不同长度的4个片段,用于构建表达乙肝病毒核心抗原和e抗原的DNA疫苗(图1)。HSV-1gD基因来自pSK/HSV-1-gD质粒经BamHI+EcoRI酶切后分离的1.2kb片段序列,含有HSV-1-gD糖蛋白全基因,用于构建表达HSV-1-gD的DNA疫苗。各DNA疫苗的主要结构特点见表1(构建过程及酶切鉴定资料略)。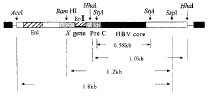
, http://www.100md.com 图1 乙肝核心抗原及周围基因图谱
Figure 1 The map of HBV core and surrounding genes
2 质粒的短暂表达
采用脂质体技术在293细胞上进行短暂表达研究,各质粒均使用等摩尔数的量进行转化。用表达β-半乳糖苷酶基因的质粒作为内对照,标化转染效率。结果见表2、表3。
从实验结果可以看出,pcDNAI-HBc 0.58kb质粒主要表达乙肝核心抗原,pcDNAI-HBc 1.0kb质粒主要表达乙肝e抗原。pcDNAI-HBc1.2kb质粒仅在标化后呈HBcAg和HBeAg弱阳性,pcDNAI-HBc1.8kb质粒无基因表达,故不再用这两种乙肝基因构建免疫用质粒。表1 实验用质粒
Table 1 The plasmids used in the experiments Name of plasmid
, 百拇医药
Shortened form
Vector
Product of gene
kb of the
plasmid
Dose for
transient expression
Note
pcDNAI-HBc0.58
pI-0.58
pcDNAI
, 百拇医药
HBcAg
5.38
10.8μg
pcDNAI-HBc1.0
pI-1.0
pcDNAI
HBeAg
5.80
11.6μg
pcDNAI-HBc1.2
pI-1.2
pcDNAI
, 百拇医药
HBeAg
6.00
12.0μg
pcDNAI-HBc1.8
pI-1.8
pcDNAI
HBeAg
6.60
13.2μg
pcDNAI-gD
pI-gD
pcDNAI
, 百拇医药
HSV-1 gD
6.00
pCMV-HBc0.58
pC-0.58
pCMVβ(no β-gal)
HBcAg
4.36
2.2μg
for immunization
pCMV-HBc1.0
pC-1.0
pCMVβ(no β-gal)
, 百拇医药
HBeAg
4.78
2.4μg
for immunization
pCMV-gD-HBc0.58
pDC-0.58
pCMVβ(no β-gal)
HBcAg
6.68
3.3μg
HSV-1 gD
2.8μg
, http://www.100md.com
PCMV-gD-HBc1.0
pDC-1.0
pCMVβ(no β-gal)
HBeAg
7.11
3.5μg
for immunization
HSV-1 gD
3.0μg
PCMV-gD
pC-gD
pCMVβ(no β-gal)
, http://www.100md.com
HSV-1 gD
4.90
2.5μg
for immunization
表2 各质粒在293细胞中短暂表达乙肝抗原结果
Table 2 The transient expression of the plasmids expressing HBV core gene in 293 cells Antigen
pcDNAI-HBc
pCMV-HBc
pCMV-gD-HBc
, http://www.100md.com 0.58kb
1.0kb
1.2kb
1.8kb
0.58kb
1.0kb
0.58kb
1.0kb
HBeAg(P/N)
4.58
22.12
2.44
1.08
, 百拇医药
1.79
24.32
2.09
2.79
HBcAg(P/N)
10.83
5.02
2.18
1.08
10.98
3.89
5.58
2.19
, http://www.100md.com
表3 含HSV-1-gD基因各质粒在293细胞中短暂表达结果
Table 3 The transient expression of the plasmids expressing HSV-1-gD gene in 293 cell Antigen
pCMV-gD
gD-HBc 0.58
gD-HBc1.0
pCMVβ
HSV-1-gD(P/N)
14.53
6.49
, 百拇医药 2.15
-
P/N value was standardized, P/N>2.1 was positive.
pCMV-HBc 0.58kb质粒仅表达乙肝核心抗原,pCMV-HBc 1.0kb质粒主要表达乙肝e抗原,且这两种质粒分别在几种能表达它们所表达的基因的质粒中表达水平最高。由于它们的表达水平分别高于pcDNAI-HBc 0.58kb和pcDNAI-HBc1.0kb质粒,而它们转化细胞时的质粒用量则仅为后者的1/5。表明pCMV结构在表达上要好于pcDNAI结构,故选择以pCMV为载体的各质粒作为免疫用质粒。pCMV-gD质粒可以很好地表达HSV-1gD糖蛋白。结合pCMV为载体的质粒体外转化结果可见:pCMV-gD-HBc 0.58kb质粒转化细胞后可检测出gD和HBcAg的表达,但水平大大低于pCMV-gD和pCMV-HBc 0.58kb质粒。而pCMV-gD-HBc 1.0kb质粒仅在标化后呈HBeAg、HSV-1-gD弱阳性。
, http://www.100md.com
3 免疫反应的测定
根据质粒体外细胞转化的结果,挑选pCMV-HBc 0.58kb、pCMV-HBc 1.0kb、pCMV-gD、pCMV-gD-HBc 0.58kb、pCMV-gD-HBc 1.0kb共五种质粒免疫Balb/c小鼠(4~6周,雌性),每种质粒分别单独免疫一组小鼠(6~10只)。另外,pCMV-HBc 0.58kb、pCMV-HBc 1.0kb质粒分别与pCMV-gD质粒各联合一组免疫小鼠。每只小鼠注射100μg质粒,联合免疫则各100μg质粒。
3.1 抗体产生时间上的差异
两批不同时间免疫的Balb/c小鼠,分别在免疫后3周和4周取眼底血,分离血清,进行抗体检测,结果见表4和表5。ELISA法检测HBcAb和HBeAb(OD值),结果除第二批6只小鼠中有1只弱阳性外,所有其他单独免疫组均未检测出阳性血清(1∶4或1∶10稀释),pCMV-HBc 1.0 kb与pCMV-gD联合免疫组也未测出阳性血清,只有pCMV-HBc 0.58 kb与pCMV-gD同部位联合免疫组检测出较高滴度抗体。
, 百拇医药
表4 首批免疫鼠1∶10稀释度下的平均抗体水平(第3周)
Table 4 The average antibody level of the first group of plasmid immunized mice in 1:10 dilution(3rd week) Antibody
pC-0.58
pC-1.0
pC-0.58
+pc-gD
*pC-0.58
+pc-gD
pC-1.0
, http://www.100md.com
+pc-gD
*pC-1.0
+pc-gD
pDC-0.58
pDC-1.0
HBcAb
0.96
-
3.75(6/10)
1.06
-
-
1.23
, 百拇医药
-
HBeAb
-
1.13
-
-
1.09
1.13
-
0.78
Note: *: Means both the left and right posterior limbs of mice were injected with one kind of plasmid, other mice were injected only in the left posteroir limb.
, 百拇医药
The values in Table 4 were P/N, the ratio in bracket was positive sera/total sera, the same as below.表5 第二批质粒免疫鼠1∶4稀释度下平均抗体水平(第4周)
Table 5 The average antibody level of the second group of plasmid immunized mice in 1:4 dilution(4th week) Antibody
pC-0.58
pC-1.0
pC-0.58
+pc-gD
pC-1.0
, 百拇医药
+pc-gD
pCD-0.58
pDC-1.0
pC-0.58+
pCMVβ
HBcAb
1.78(1/6)
-
7.17(6/6)
-
1.20
-
6.86(6/6)
, http://www.100md.com
HBeAb
-
1.24
-
1.45
-
1.02
-
由此可见,上述两质粒联合免疫可以使免疫应答的出现时间大大提前。pCMVβ质粒与pCMV-HBc 0.58kb质粒的联合免疫也可使免疫应答提前出现(表5)。同时第一批免疫小鼠还设置了两种质粒分别自不同部位(左右腿)单独注射的联合免疫组,在同部位注射的联合免疫组产生抗体时,不同部位的联合免疫组未能产生可检测到的抗体反应,表明不同部位的联合免疫并不能互相加强。
, http://www.100md.com
3.2 抗体反应的强度
第二批免疫小鼠用ELISA法检测HBcAb、HBeAb、抗HSV-1-gD抗体,滴度见表6。表6 各质粒免疫鼠血清中HBeAb、HBeAb、抗HSV-1-gD抗体检测结果
Table 6 Detection of HBeAb, HBcAb, anti-HSV-1-gD level in the sera of the mice immunized by the plasmids
expressing HBeAg, HBcAg and HSV-1-gD Antibody
Plasmid
Serum dilution
1∶4
, 百拇医药
1∶16
1∶64
1∶256
1∶1024
HBeAb, 6th week
pCMV-HBc1.0
4.33
2.75
-
-
pCMV-HBc1.0+PCMV-gD
4.38
, http://www.100md.com
2.90
-
-
HBcAb, 4th week
pCMV-HBc 0.58
4.90
3.84
2.57
-
-
pCMV-HBc 0.58+pCMV-gD
6.51
, 百拇医药
5.22
3.56
2.16
-
pCMV-gD-HBc 0.58
4.38
2.90
-
-
-
pCMV-HBc 0.58+pCMVβ
5.66
4.54
, 百拇医药
3.11
-
-
Anti-HSV-1 gD,pCMV-gD
8.47
7.15
5.13
2.93
-
4th week
pCMV-HBc 0.58+pCMV-gD
10.12
, 百拇医药
8.12
6.23
3.71
2.31
pCMV-HBc 1.0+pCMV-gD
8.20
7.07
4.34
2.43
-
pCMV-gD-HBc0.58
5.56
, 百拇医药 439
2.78
-
-
可见pCMV-HBc0.58kb+pCMV-gD和pCMV-HBc 0.58kb+pCMVβ联合免疫可以明显增强抗体滴度,而pCMV-HBc 1.0kb+pCMV-gD联合免疫的效果则不明显;pCMV-gD-HBc 0.58kb虽可表达两种抗原,但免疫后起不到增强免疫的作用;pCMV-gD-HBc 1.0kb单独免疫则没有抗体产生。表达gD糖蛋白的质粒免疫后在第4周左右可以检测出伉体,且水平较高。
4 CTL反应的检测
免疫后6~12周中,根据抗体产生情况,同日取不同组中抗体阳性鼠,取免疫鼠脾细胞检测CTL水平,结果见图2、图3和图4。自图2中可见,pCMV-HBc 0.58kb分别与pCMV-gD和pCMVβ联合免疫鼠,其针对乙肝核心抗原的CTL水平明显高于pCMV-HBc 0.58kb单独免疫鼠(P<0.01),pCMV-HBc 0.58kb与pcDNAI联合免疫鼠对乙肝核心抗原的CTL水平与pCMV-HBc 0.58kb单独免疫无明显差异(P>0.05)。而图3中pCMV-HBc 1.0kb+pCMV-gD联合免疫组对乙肝e抗原的CTL虽略有提高,但无显著性差异(P>0.05)。pCMV-gD-HBc 0.58kb组对乙肝核心抗原和HSV-1-gD抗原的免疫水平也不比单独免疫高(图2、4),可能与其表达水平不高有关。而图4显示pCMV-gD质粒表达产物本身就能刺激产生较高水平的针对HSV-1-gD的CTL,HBcAg、HBeAg与HSV-1-gD联合作用仅能轻度提高针对后者的CTL的水平(P<0.01)。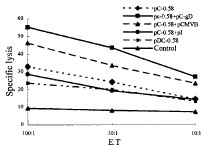
, 百拇医药
图2 HBcAg的CTL检测
Figure 2 The detection of the CTL against HBcAg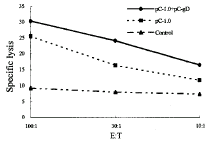
图3 HBeAg的CTL检测
Figure 3 The detection of the CTL against HBeAg
图4 HSV-1-gD抗原的CTL检测
Figure 4 The detection of the CTL against HSV-1-gD antigen
, 百拇医药
讨 论
本文构建了以乙肝病毒核心抗原、e抗原和单纯疱疹病毒gD糖蛋白的DNA疫苗,单纯疱疹病毒gD抗原和乙肝核心抗原主要表达在细胞膜上和细胞浆内,主要通过诱发机体产生细胞免疫以清除感染细胞。所以在质粒构建方面选择了几种不同长度的乙肝病毒核心抗原序列:仅含核心蛋白基因的0.58kb序列,包括PreC在内的1.0kb序列,分别含有乙肝增强子EnⅡ、EnⅠ的1.2kb和1.8kb序列。分别以pcDNAI和pCMVβ(去除β-gal基因)为载体构建DNA疫苗。经比较发现,包括乙肝EnⅠ、EnⅡ的pcDNAI-HBc 1.2kb和pcDNA1-HBc1.8kb质粒并不能在体外转染中很好表达抗原,可能与CMV启动子与真正的抗原基因相隔较远所致。故认为乙肝病毒的增强子尽管它们在病毒本身的繁殖及蛋白表达中有较强作用,但在使用本文的载体构建的DNA疫苗中并不能发挥作用。以pcDNAI为载体和以pCMVβ为载体的质粒,在转染效率上也不尽相同,以pCMVβ为载体的质粒仅用1/5的量即可取得比pcDNAI为载体的质粒还好的转染效果,故而选用以pCMVβ为载体的质粒用于免疫小鼠。
, 百拇医药
以pCMVβ为载体的质粒分别单独和联合免疫Balb/c小鼠,除pCMV-gD-HBc 1.0kb质粒外均有抗体产生,但各质粒单独免疫鼠中,pCMV-gD的抗体在第4周时即全部阳性;pCMV-HBc 0.58kb质粒的免疫抗体在第4周时仅1只弱阳性,第6周时全部阳性;pCMV-HBc 1.0kb组则第4周时未测出抗体,第6周时全部阳性;pCMV-gD-HBc 0.58kb组则仅在第6周时有一半小鼠抗体阳性,且滴度分别比pCMV-HBc 0.58kb和pCMV-gD单独免疫为低。CTL检测表明,除pCMV-gD-HBc1.0kb质粒外,其余四种质粒均可诱发一定程度的细胞免疫,表明这几种质粒可以诱发全面的细胞免疫和体液免疫反应。
在质粒免疫过程中,还发现单独免疫一种质粒DNA,尽管可以诱发抗体及CTL反应,但pCMV-HBc 0.58kb和pCMV-gD两种质粒同时免疫小鼠时,免疫效果明显加强,表现为:(1)两种质粒同时免疫,乙肝病毒核心抗原抗体的出现时间明显提前,抗体滴度提高;(2)两种质粒同时免疫时的CTL水平均有提高,以乙肝病毒核心抗原较明显,幅度为20%以上。但表达乙肝e抗原与gD糖蛋白的质粒联合免疫时却并不明显。抗体产生时间未发现提前,抗体滴度及CTL水平只有轻微提高,无显著性差异,似表现为各质粒的分别单独作用而非协同,这主要可能是HBeAg主要是一种分泌性抗原,合成后即分泌到细胞外,主要激活体液免疫;而gD糖蛋白以激活细胞免疫为主,二者抗原性质不同。据认为非分泌性抗原主要在细胞破裂后释放出来与免疫系统接触而产生抗体,一般出现较晚。而在两种质粒同时免疫的情况下,部分细胞内有两种质粒同时表达,在受到其中一种抗原的CTL攻击而破裂时,另一种抗原相应释放,从而使机体较早和较多接触抗原,且此时免疫系统已在活跃增生,因而对其产生较早且强烈的免疫反应。而在不同部位免疫情况下,尽管gD糖蛋白诱发对其自身的免疫反应,但其杀伤性T细胞却不能攻击表达HBV核心抗原的细胞,并不能使其抗原提前释放,也就不能使抗体较早产生。乙肝e抗原作为分泌性抗原,合成后即分泌到细胞外,在联合免疫后,细胞受攻击时,尽管也有抗原释放,但由于其原已有的部分抗原释放出来,因而细胞内无抗原蓄积,增加的抗原有限,并不足以使其产生抗体的过程得以明显强化。
, 百拇医药
细胞免疫方面,由于gD糖蛋白有较强的抗原性使得免疫系统活跃增生,细胞因子的分泌增加。由于两种抗原在转染细胞上的共同表达,受攻击时同时释放,因而使得相对较弱的乙肝病毒核心抗原的CTL反应也相应增强。同时刺激机体免疫进一步增强,也使机体对gD糖蛋白的反应有所提高。pCMV-HBc 1.0kb与pCMV-gD联合免疫,尽管在抗体水平上增强不明显,在CTL水平上却有一定程度的相应增强。这可能与乙肝e抗原与乙肝核心有共同的CTL表位有关。
此外,一组本应作为对照的β-半乳糖苷酶表达质粒pCMVβ与pCMV-HBc 0.58kb质粒联合免疫时,取得了和pCMV-gD质粒与pCMV-HBc 0.58kb质粒联合免疫相类似的结果。考虑到β-半乳糖苷酶也是主要表达在细胞内的蛋白,所以联合免疫的作用与上述的pCMV-gD与pCMV-HBc 0.58kb质粒联合免疫是相同的,而不表达任何基因的pcDNAI质粒与pCMV-HBc 0.58kb质粒的联合免疫则并不产生加强作用,说明联合免疫的效果与表达外源基因是相关的。
, 百拇医药
总之,本实验表明,两种抗原联合免疫动物可以使免疫反应得到一定程度的加强,这对免疫效果一直未令人满意的DNA疫苗而言提供了一条加强免疫的新途径。也说明适当组合DNA疫苗,不但可能提高免疫效果,而且可以有效地组合成DNA多价疫苗。
作者简介:孟昕(1966-),男,辽宁鞍山人,博士。主要从事DNA疫苗和非复制型痘苗病毒载体的研究。
参考文献:
[1] Ertl H C, Xiang Z Q. Genetic Immunization[J]. Viral Immunology, 1996, 9: 1-9.
[2] Donnelly J J, Ulmer J B, Liu M A. DNA vaccines[J]. Life Sci, 1997, 60: 163-172.
, 百拇医药
[3] Kuhorber A, Wild J, Pudollek H P. DNA vaccination with plasmids encoding the intracellular(HBcAg)or secreted(HBeAg)form of the core protein of hepatitis B virus primes T cell responses to two overlapping Kb-and Kd-restricted epitopes[J]. Int Immunol, 1997, 9(8): 1203-1212.
[4] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].第二版,北京:科学出版社,1992,16-57.
[5] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].第二版,北京:科学出版社,1992,808-809.
[6] Schirmbeck R, Bohm W, Ando K, et al. Nucleic acid vaccination primes hepatitis B virus surface antigen-specific cytotoxic T lymphocytes in nonresponder mice[J]. J Virol, 1995, 69(10): 5929-5934.
收稿日期:1999-09-24;修回日期:1999-12-28, 百拇医药
单位:中国预防医学医学院科学院 病毒学研究所 100052
关键词:DNA疫苗;免疫增强;多价疫苗:HBcAg; HBeAg;HSV-1-gD
病毒学报000305 摘要:选择乙型肝炎(乙肝)病毒核心抗原(HBcAg)、e抗原(HBeAg)及单纯疱疹病毒gD抗原(HSV-1-gD)基因为目的基因,进行DNA疫苗联合免疫的研究。通过对不同基因片段的表达研究,选择了能在哺乳动物细胞中高效表达乙肝病毒核心抗原、e抗原和单纯疱疹病毒gD抗原的质粒DNA免疫Balb/c小鼠。结果显示:表达乙肝病毒核心抗原和单纯疱疹病毒gD抗原的DNA疫苗单独免疫,能有效刺激机体产生体液免疫和细胞免疫,二者的联合免疫明显加强了这种免疫效果,并可以使乙肝核心抗体提前出现。但表达乙肝病毒e抗原和单纯疱疹病毒gD抗原的DNA疫苗联合免疫则加强作用不明显。这些结果表明:不同DNA疫苗的适当组合有可能在获得多价疫苗的同时,提高DNA疫苗的免疫效果。
, 百拇医药
中图分类号:Q789,R373.2+1 文献标识码:A
文章编号:1000-8721(2000)03-0212-07
Immune Response Can Be Enhanced by Inoculation of Combined(Different)DNA Vaccines
MENG Xin,RUAN Li,WEI Bo,LIU Wen-jun,ZHU Ji-ming
(Institute of Virology, Chinese Academy of Preventive Medicine, Beijing 100052, China)
Abstract: In this experiment, a series of plasmids which harboring the HBcAg, HBeAg and HSV-1-gD genes respectively have been constructed as DNA vaccines. Some of them could highly express their target genes in tissue cultures. The single inoculation of the plasmids expressing HBcAg, and HSV-1-gD showed inducement of both humoral and cellular immune responses efficiently. The combined DNA immunization with these two plasmids could not only enhance the immune response obviously, but also the early appearance of HBcAb. The combined immunization of plasmids expressing HBeAg and HSV-1 gD showed no obvious enhancement of immune response. Our work offers a new approach to improve the immune response by multivalent DNA vaccine, if the vaccine DNAs are properly combined.
, 百拇医药
Key words: DNA vaccine; immune enhancement; multivalent vaccine; HBcAg; HBeAg; HSV-1-gD
DNA疫苗是近十年以来随着分子生物学、分子免疫学等学科的发展而出现的一种新型疫苗,它与常规疫苗相比有诸多优点:可以激发全面和持久的细胞免疫和体液免疫,易于构建和改造,易于构成多价疫苗,成本低廉,热稳定性好等等[1];在预防某些多型善变的病原体如流感、HIV感染方面表现尤为突出。迄今为止,已有大量报道DNA疫苗被用于艾滋病、流感、肝炎病毒、巨细胞病毒感染等病毒性疾病,结核等细菌性疾病,疟疾等寄生虫病的防治研究,以及抗肿瘤、抗自身免疫病的实验性治疗中。其中一些DNA疫苗已经美国FDA批准进行了小量人体试验[2]。
DNA疫苗尽管有诸多优点,但也有明显不足,其安全性目前尚无定论,质粒导入细胞效率低,诱发的免疫效果也相对较弱,等等。因此,各种增强DNA疫苗免疫效果的方法一直在研究和改进中。如在质粒构建时导入非甲基化的CpG序列,以使某些细胞因子的活性增强;与某些表达细胞因子如GM-CSF、IL-12等真核表达质粒共同免疫,也被证明有很好的加强免疫的作用。从理论上讲,表达不同抗原的DNA疫苗联合免疫除了可能起到多价疫苗的作用之外,还有可能在体液免疫和细胞免疫水平上产生相互影响,出现免疫增强或免疫抑制的情况。因此对这类问题的研究将不但有利于提高DNA疫苗的免疫效果,而且将为DNA多价疫苗的研究提供有意义的资料。
, http://www.100md.com
乙型肝炎(乙肝)病毒核心抗原和单纯疱疹病毒gD糖蛋白都是相应病原体引起细胞免疫和体液免疫的主要抗原,在疾病的预防和转归中具有重要意义。因此本文选择上述两种抗原基因,构建可在真核细胞中表达的DNA疫苗,分别单独和联合免疫Balb/c小鼠,对其诱导的免疫反应的特点、效果及相互影响进行了研究。
材料与方法
1 质粒、病毒与细胞株、菌株 pHBV-2质粒由本实验室提供,含有全长的HBV(ayw亚型)序列。pSK/HSV-1-gD质粒由病毒基因工程国家重点实验室提供,含有1.2kb HSV-1 gD糖蛋白基因。pcDNAI、pCMVβ均为商品化真核细胞表达质粒。pcDNAI-β质粒由本室构建,表达β-半乳糖苷酶。表达HSV-1 gD糖蛋白的重组痘苗病毒vRHSV1175D由病毒基因工程国家重点实验室提供。HSV-1病毒标准株由本所毒种室提供。293细胞购于美国ATCC,P815细胞由本所肿瘤病毒研究室和毒种室提供。
, 百拇医药
2 酶和试剂及免疫检测试剂 实验用酶类购于美国New England Biolabs公司、Promega公司、华美生物技术公司。脂质体转化试剂盒购于美国GIBCO公司。Na251CrO4购于美国杜邦公司。乙肝病毒核心抗原特异性CTL表位短肽SYMNTNMGL[3]由赛百盛公司合成。其余试剂均为常规分析纯试剂。乙肝病毒核心抗原及e抗原由军事医学科学院凌世淦教授惠赠。乙肝核心抗体A3H6、乙肝e抗体C4B8及共同抗体1G8由本所肝炎室詹美云教授惠赠。HSV-1gD糖蛋白纯品、兔抗gD血清RT及抗gD单克隆抗体ID3均由美国Philadelphia大学Dr.Willis惠赠。
3 质粒的构建、鉴定、提取和纯化 按文献进行[4]。
4 质粒的体外短暂表达 取已经纯化的等摩尔数的质粒,加入等量的表达β-半乳糖苷酶的质粒作为内对照,脂质体法转染70%~80%成片的293细胞。48h~72h后,取上清放入透析袋中,10倍风干浓缩,检测HBeAg。同时刮下细胞,重悬于0.5ml PBS中,超声破碎细胞,提取细胞内容物作HBcAg检测和β-半乳糖苷酶测定[5]。
, http://www.100md.com
5 ELISA检测抗原抗体 采用夹心法检测HBcAg和HBeAg,乙肝核心抗体(HBcAb)和乙肝e抗体(HBeAb),HSV-1 gD糖蛋白。包被抗体用包被液1∶1?000稀释,20%小牛血清封闭1h后加待检样品,37℃ 1h。洗板3遍后,加入第二抗体或酶标第二抗体,37℃ 1h。而加入酶标二抗的则直接检测;加入第2抗体的在洗板3遍后,加入HRP标记的羊抗鼠IgG,37℃ 1h;加入OPD显色液100μl/孔,室温10min,50μl 2mol/L硫酸终止反应。490nm测OD值。
6 免疫小鼠 将Balb/c小鼠随机分组,每组6只。注射质粒前24h乙醚麻醉小鼠,每只小鼠均在左胫骨前肌部位用4号针头肌肉注射25%蔗糖溶液100μl,分3点注射。24h后,每只小鼠在上次注射相同部位按同样方法注射100μl质粒液(包括两种质粒同时注射),两周后加强免疫1次。每只小鼠在免疫后不同时间用眼底取血法采集血清,检测抗体水平。
7 CTL的检测[6]
, http://www.100md.com
刺激细胞制备:常规制备小鼠脾细胞悬液,未免疫鼠脾细胞加入配好的ConA和乙肝病毒核心抗原特异性CTL表位九肽SYMNTNMGL,终浓度分别为2μg/ml和50μg/ml。在37℃ 5% CO2孵箱中孵育4h后,加入丝裂霉素C,终浓度80μg/ml。在37℃ 5%CO2孵箱中继续孵育2h。无血清RPMI 1640洗3次,然后调细胞浓度为2.5×106/ml作为刺激细胞。
效应细胞制备:每只免疫鼠脾细胞经无血清RPMI 1640洗后计数,用含10%小牛血清的完全培养基调细胞数为1×107/ml。取1ml加入24孔细胞培养板,每孔再加入1ml刺激细胞。培养液中加入rIL-2,终浓度为20μ/ml,然后放入37℃ 5% CO2孵箱中共培养4~6天。调节反应细胞数为1×107/ml。按3个梯度接种于96孔板,每个梯度接种3孔。
, 百拇医药 靶细胞制备及杀伤实验:每1×106P815细胞(H-2d)用100μl含2mg/ml九肽SYMNTNMGL的完全培养基重悬该细胞。加入100μl Na251CrO4,在37℃ 5% CO2条件下共培养1.5h。无血清RPMI 1640培养基洗3次,调节细胞浓度为1×105/ml。按100μl/孔加入预先已接种反应细胞的96孔板,形成不同的效∶靶比(E∶T)。同时做自然释放和最大释放对照,在37℃ 5% CO2条件下共培养6h。水平离心机1?500r/min离心96孔板5min,小心吸取100μl上清,γ-计数仪读取cpm值。按公式计算杀伤率:
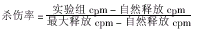
HSV-1gD抗原的CTL检测方法与HBV核心抗原的检测方法基本相同,但在制备刺激细胞时采用10MOI的重组痘苗病毒VRHB1175D(表达HSV-1 gD糖蛋白的重组痘苗病毒疫苗)感染过夜,同样加入丝裂霉素C后孵育2h,无血清RPMI 1640洗3次后,调细胞浓度为2.5×106/ml。靶细胞的处理是用10MOI HSV-1病毒感染P815细胞过夜,无血清RPMI 1640洗3次后加入100μl Na251CrO4标记,37℃ 5% CO2条件下培养1.5h,再用无血清RPMI 1640洗3次后,调节细胞浓度为1×105/ml,其余各步骤及杀伤率的计算与检测乙肝病毒核心抗原的方法完全一致。
, 百拇医药
结 果
1 目的基因的选择与重组质粒构建
考虑到乙肝病毒核心抗原与e抗原分别为非分泌型和分泌型抗原,且一级结构上e抗原包含核心抗原,而乙肝病毒本身的调控序列又可能会对目的基因的表达有一定的影响,故本实验选择不同长度的基因片段作为目的基因。首先从带有HBV(ayw亚型)全基因的pHBV-2质粒中酶切、电泳分离出3.2kb的HBV基因,再用不同的限制性内切酶组合酶切,分离出不同长度的4个片段,用于构建表达乙肝病毒核心抗原和e抗原的DNA疫苗(图1)。HSV-1gD基因来自pSK/HSV-1-gD质粒经BamHI+EcoRI酶切后分离的1.2kb片段序列,含有HSV-1-gD糖蛋白全基因,用于构建表达HSV-1-gD的DNA疫苗。各DNA疫苗的主要结构特点见表1(构建过程及酶切鉴定资料略)。

, http://www.100md.com 图1 乙肝核心抗原及周围基因图谱
Figure 1 The map of HBV core and surrounding genes
2 质粒的短暂表达
采用脂质体技术在293细胞上进行短暂表达研究,各质粒均使用等摩尔数的量进行转化。用表达β-半乳糖苷酶基因的质粒作为内对照,标化转染效率。结果见表2、表3。
从实验结果可以看出,pcDNAI-HBc 0.58kb质粒主要表达乙肝核心抗原,pcDNAI-HBc 1.0kb质粒主要表达乙肝e抗原。pcDNAI-HBc1.2kb质粒仅在标化后呈HBcAg和HBeAg弱阳性,pcDNAI-HBc1.8kb质粒无基因表达,故不再用这两种乙肝基因构建免疫用质粒。表1 实验用质粒
Table 1 The plasmids used in the experiments Name of plasmid
, 百拇医药
Shortened form
Vector
Product of gene
kb of the
plasmid
Dose for
transient expression
Note
pcDNAI-HBc0.58
pI-0.58
pcDNAI
, 百拇医药
HBcAg
5.38
10.8μg
pcDNAI-HBc1.0
pI-1.0
pcDNAI
HBeAg
5.80
11.6μg
pcDNAI-HBc1.2
pI-1.2
pcDNAI
, 百拇医药
HBeAg
6.00
12.0μg
pcDNAI-HBc1.8
pI-1.8
pcDNAI
HBeAg
6.60
13.2μg
pcDNAI-gD
pI-gD
pcDNAI
, 百拇医药
HSV-1 gD
6.00
pCMV-HBc0.58
pC-0.58
pCMVβ(no β-gal)
HBcAg
4.36
2.2μg
for immunization
pCMV-HBc1.0
pC-1.0
pCMVβ(no β-gal)
, 百拇医药
HBeAg
4.78
2.4μg
for immunization
pCMV-gD-HBc0.58
pDC-0.58
pCMVβ(no β-gal)
HBcAg
6.68
3.3μg
HSV-1 gD
2.8μg
, http://www.100md.com
PCMV-gD-HBc1.0
pDC-1.0
pCMVβ(no β-gal)
HBeAg
7.11
3.5μg
for immunization
HSV-1 gD
3.0μg
PCMV-gD
pC-gD
pCMVβ(no β-gal)
, http://www.100md.com
HSV-1 gD
4.90
2.5μg
for immunization
表2 各质粒在293细胞中短暂表达乙肝抗原结果
Table 2 The transient expression of the plasmids expressing HBV core gene in 293 cells Antigen
pcDNAI-HBc
pCMV-HBc
pCMV-gD-HBc
, http://www.100md.com 0.58kb
1.0kb
1.2kb
1.8kb
0.58kb
1.0kb
0.58kb
1.0kb
HBeAg(P/N)
4.58
22.12
2.44
1.08
, 百拇医药
1.79
24.32
2.09
2.79
HBcAg(P/N)
10.83
5.02
2.18
1.08
10.98
3.89
5.58
2.19
, http://www.100md.com
表3 含HSV-1-gD基因各质粒在293细胞中短暂表达结果
Table 3 The transient expression of the plasmids expressing HSV-1-gD gene in 293 cell Antigen
pCMV-gD
gD-HBc 0.58
gD-HBc1.0
pCMVβ
HSV-1-gD(P/N)
14.53
6.49
, 百拇医药 2.15
-
P/N value was standardized, P/N>2.1 was positive.
pCMV-HBc 0.58kb质粒仅表达乙肝核心抗原,pCMV-HBc 1.0kb质粒主要表达乙肝e抗原,且这两种质粒分别在几种能表达它们所表达的基因的质粒中表达水平最高。由于它们的表达水平分别高于pcDNAI-HBc 0.58kb和pcDNAI-HBc1.0kb质粒,而它们转化细胞时的质粒用量则仅为后者的1/5。表明pCMV结构在表达上要好于pcDNAI结构,故选择以pCMV为载体的各质粒作为免疫用质粒。pCMV-gD质粒可以很好地表达HSV-1gD糖蛋白。结合pCMV为载体的质粒体外转化结果可见:pCMV-gD-HBc 0.58kb质粒转化细胞后可检测出gD和HBcAg的表达,但水平大大低于pCMV-gD和pCMV-HBc 0.58kb质粒。而pCMV-gD-HBc 1.0kb质粒仅在标化后呈HBeAg、HSV-1-gD弱阳性。
, http://www.100md.com
3 免疫反应的测定
根据质粒体外细胞转化的结果,挑选pCMV-HBc 0.58kb、pCMV-HBc 1.0kb、pCMV-gD、pCMV-gD-HBc 0.58kb、pCMV-gD-HBc 1.0kb共五种质粒免疫Balb/c小鼠(4~6周,雌性),每种质粒分别单独免疫一组小鼠(6~10只)。另外,pCMV-HBc 0.58kb、pCMV-HBc 1.0kb质粒分别与pCMV-gD质粒各联合一组免疫小鼠。每只小鼠注射100μg质粒,联合免疫则各100μg质粒。
3.1 抗体产生时间上的差异
两批不同时间免疫的Balb/c小鼠,分别在免疫后3周和4周取眼底血,分离血清,进行抗体检测,结果见表4和表5。ELISA法检测HBcAb和HBeAb(OD值),结果除第二批6只小鼠中有1只弱阳性外,所有其他单独免疫组均未检测出阳性血清(1∶4或1∶10稀释),pCMV-HBc 1.0 kb与pCMV-gD联合免疫组也未测出阳性血清,只有pCMV-HBc 0.58 kb与pCMV-gD同部位联合免疫组检测出较高滴度抗体。
, 百拇医药
表4 首批免疫鼠1∶10稀释度下的平均抗体水平(第3周)
Table 4 The average antibody level of the first group of plasmid immunized mice in 1:10 dilution(3rd week) Antibody
pC-0.58
pC-1.0
pC-0.58
+pc-gD
*pC-0.58
+pc-gD
pC-1.0
, http://www.100md.com
+pc-gD
*pC-1.0
+pc-gD
pDC-0.58
pDC-1.0
HBcAb
0.96
-
3.75(6/10)
1.06
-
-
1.23
, 百拇医药
-
HBeAb
-
1.13
-
-
1.09
1.13
-
0.78
Note: *: Means both the left and right posterior limbs of mice were injected with one kind of plasmid, other mice were injected only in the left posteroir limb.
, 百拇医药
The values in Table 4 were P/N, the ratio in bracket was positive sera/total sera, the same as below.表5 第二批质粒免疫鼠1∶4稀释度下平均抗体水平(第4周)
Table 5 The average antibody level of the second group of plasmid immunized mice in 1:4 dilution(4th week) Antibody
pC-0.58
pC-1.0
pC-0.58
+pc-gD
pC-1.0
, 百拇医药
+pc-gD
pCD-0.58
pDC-1.0
pC-0.58+
pCMVβ
HBcAb
1.78(1/6)
-
7.17(6/6)
-
1.20
-
6.86(6/6)
, http://www.100md.com
HBeAb
-
1.24
-
1.45
-
1.02
-
由此可见,上述两质粒联合免疫可以使免疫应答的出现时间大大提前。pCMVβ质粒与pCMV-HBc 0.58kb质粒的联合免疫也可使免疫应答提前出现(表5)。同时第一批免疫小鼠还设置了两种质粒分别自不同部位(左右腿)单独注射的联合免疫组,在同部位注射的联合免疫组产生抗体时,不同部位的联合免疫组未能产生可检测到的抗体反应,表明不同部位的联合免疫并不能互相加强。
, http://www.100md.com
3.2 抗体反应的强度
第二批免疫小鼠用ELISA法检测HBcAb、HBeAb、抗HSV-1-gD抗体,滴度见表6。表6 各质粒免疫鼠血清中HBeAb、HBeAb、抗HSV-1-gD抗体检测结果
Table 6 Detection of HBeAb, HBcAb, anti-HSV-1-gD level in the sera of the mice immunized by the plasmids
expressing HBeAg, HBcAg and HSV-1-gD Antibody
Plasmid
Serum dilution
1∶4
, 百拇医药
1∶16
1∶64
1∶256
1∶1024
HBeAb, 6th week
pCMV-HBc1.0
4.33
2.75
-
-
pCMV-HBc1.0+PCMV-gD
4.38
, http://www.100md.com
2.90
-
-
HBcAb, 4th week
pCMV-HBc 0.58
4.90
3.84
2.57
-
-
pCMV-HBc 0.58+pCMV-gD
6.51
, 百拇医药
5.22
3.56
2.16
-
pCMV-gD-HBc 0.58
4.38
2.90
-
-
-
pCMV-HBc 0.58+pCMVβ
5.66
4.54
, 百拇医药
3.11
-
-
Anti-HSV-1 gD,pCMV-gD
8.47
7.15
5.13
2.93
-
4th week
pCMV-HBc 0.58+pCMV-gD
10.12
, 百拇医药
8.12
6.23
3.71
2.31
pCMV-HBc 1.0+pCMV-gD
8.20
7.07
4.34
2.43
-
pCMV-gD-HBc0.58
5.56
, 百拇医药 439
2.78
-
-
可见pCMV-HBc0.58kb+pCMV-gD和pCMV-HBc 0.58kb+pCMVβ联合免疫可以明显增强抗体滴度,而pCMV-HBc 1.0kb+pCMV-gD联合免疫的效果则不明显;pCMV-gD-HBc 0.58kb虽可表达两种抗原,但免疫后起不到增强免疫的作用;pCMV-gD-HBc 1.0kb单独免疫则没有抗体产生。表达gD糖蛋白的质粒免疫后在第4周左右可以检测出伉体,且水平较高。
4 CTL反应的检测
免疫后6~12周中,根据抗体产生情况,同日取不同组中抗体阳性鼠,取免疫鼠脾细胞检测CTL水平,结果见图2、图3和图4。自图2中可见,pCMV-HBc 0.58kb分别与pCMV-gD和pCMVβ联合免疫鼠,其针对乙肝核心抗原的CTL水平明显高于pCMV-HBc 0.58kb单独免疫鼠(P<0.01),pCMV-HBc 0.58kb与pcDNAI联合免疫鼠对乙肝核心抗原的CTL水平与pCMV-HBc 0.58kb单独免疫无明显差异(P>0.05)。而图3中pCMV-HBc 1.0kb+pCMV-gD联合免疫组对乙肝e抗原的CTL虽略有提高,但无显著性差异(P>0.05)。pCMV-gD-HBc 0.58kb组对乙肝核心抗原和HSV-1-gD抗原的免疫水平也不比单独免疫高(图2、4),可能与其表达水平不高有关。而图4显示pCMV-gD质粒表达产物本身就能刺激产生较高水平的针对HSV-1-gD的CTL,HBcAg、HBeAg与HSV-1-gD联合作用仅能轻度提高针对后者的CTL的水平(P<0.01)。

, 百拇医药
图2 HBcAg的CTL检测
Figure 2 The detection of the CTL against HBcAg

图3 HBeAg的CTL检测
Figure 3 The detection of the CTL against HBeAg

图4 HSV-1-gD抗原的CTL检测
Figure 4 The detection of the CTL against HSV-1-gD antigen
, 百拇医药
讨 论
本文构建了以乙肝病毒核心抗原、e抗原和单纯疱疹病毒gD糖蛋白的DNA疫苗,单纯疱疹病毒gD抗原和乙肝核心抗原主要表达在细胞膜上和细胞浆内,主要通过诱发机体产生细胞免疫以清除感染细胞。所以在质粒构建方面选择了几种不同长度的乙肝病毒核心抗原序列:仅含核心蛋白基因的0.58kb序列,包括PreC在内的1.0kb序列,分别含有乙肝增强子EnⅡ、EnⅠ的1.2kb和1.8kb序列。分别以pcDNAI和pCMVβ(去除β-gal基因)为载体构建DNA疫苗。经比较发现,包括乙肝EnⅠ、EnⅡ的pcDNAI-HBc 1.2kb和pcDNA1-HBc1.8kb质粒并不能在体外转染中很好表达抗原,可能与CMV启动子与真正的抗原基因相隔较远所致。故认为乙肝病毒的增强子尽管它们在病毒本身的繁殖及蛋白表达中有较强作用,但在使用本文的载体构建的DNA疫苗中并不能发挥作用。以pcDNAI为载体和以pCMVβ为载体的质粒,在转染效率上也不尽相同,以pCMVβ为载体的质粒仅用1/5的量即可取得比pcDNAI为载体的质粒还好的转染效果,故而选用以pCMVβ为载体的质粒用于免疫小鼠。
, 百拇医药
以pCMVβ为载体的质粒分别单独和联合免疫Balb/c小鼠,除pCMV-gD-HBc 1.0kb质粒外均有抗体产生,但各质粒单独免疫鼠中,pCMV-gD的抗体在第4周时即全部阳性;pCMV-HBc 0.58kb质粒的免疫抗体在第4周时仅1只弱阳性,第6周时全部阳性;pCMV-HBc 1.0kb组则第4周时未测出抗体,第6周时全部阳性;pCMV-gD-HBc 0.58kb组则仅在第6周时有一半小鼠抗体阳性,且滴度分别比pCMV-HBc 0.58kb和pCMV-gD单独免疫为低。CTL检测表明,除pCMV-gD-HBc1.0kb质粒外,其余四种质粒均可诱发一定程度的细胞免疫,表明这几种质粒可以诱发全面的细胞免疫和体液免疫反应。
在质粒免疫过程中,还发现单独免疫一种质粒DNA,尽管可以诱发抗体及CTL反应,但pCMV-HBc 0.58kb和pCMV-gD两种质粒同时免疫小鼠时,免疫效果明显加强,表现为:(1)两种质粒同时免疫,乙肝病毒核心抗原抗体的出现时间明显提前,抗体滴度提高;(2)两种质粒同时免疫时的CTL水平均有提高,以乙肝病毒核心抗原较明显,幅度为20%以上。但表达乙肝e抗原与gD糖蛋白的质粒联合免疫时却并不明显。抗体产生时间未发现提前,抗体滴度及CTL水平只有轻微提高,无显著性差异,似表现为各质粒的分别单独作用而非协同,这主要可能是HBeAg主要是一种分泌性抗原,合成后即分泌到细胞外,主要激活体液免疫;而gD糖蛋白以激活细胞免疫为主,二者抗原性质不同。据认为非分泌性抗原主要在细胞破裂后释放出来与免疫系统接触而产生抗体,一般出现较晚。而在两种质粒同时免疫的情况下,部分细胞内有两种质粒同时表达,在受到其中一种抗原的CTL攻击而破裂时,另一种抗原相应释放,从而使机体较早和较多接触抗原,且此时免疫系统已在活跃增生,因而对其产生较早且强烈的免疫反应。而在不同部位免疫情况下,尽管gD糖蛋白诱发对其自身的免疫反应,但其杀伤性T细胞却不能攻击表达HBV核心抗原的细胞,并不能使其抗原提前释放,也就不能使抗体较早产生。乙肝e抗原作为分泌性抗原,合成后即分泌到细胞外,在联合免疫后,细胞受攻击时,尽管也有抗原释放,但由于其原已有的部分抗原释放出来,因而细胞内无抗原蓄积,增加的抗原有限,并不足以使其产生抗体的过程得以明显强化。
, 百拇医药
细胞免疫方面,由于gD糖蛋白有较强的抗原性使得免疫系统活跃增生,细胞因子的分泌增加。由于两种抗原在转染细胞上的共同表达,受攻击时同时释放,因而使得相对较弱的乙肝病毒核心抗原的CTL反应也相应增强。同时刺激机体免疫进一步增强,也使机体对gD糖蛋白的反应有所提高。pCMV-HBc 1.0kb与pCMV-gD联合免疫,尽管在抗体水平上增强不明显,在CTL水平上却有一定程度的相应增强。这可能与乙肝e抗原与乙肝核心有共同的CTL表位有关。
此外,一组本应作为对照的β-半乳糖苷酶表达质粒pCMVβ与pCMV-HBc 0.58kb质粒联合免疫时,取得了和pCMV-gD质粒与pCMV-HBc 0.58kb质粒联合免疫相类似的结果。考虑到β-半乳糖苷酶也是主要表达在细胞内的蛋白,所以联合免疫的作用与上述的pCMV-gD与pCMV-HBc 0.58kb质粒联合免疫是相同的,而不表达任何基因的pcDNAI质粒与pCMV-HBc 0.58kb质粒的联合免疫则并不产生加强作用,说明联合免疫的效果与表达外源基因是相关的。
, 百拇医药
总之,本实验表明,两种抗原联合免疫动物可以使免疫反应得到一定程度的加强,这对免疫效果一直未令人满意的DNA疫苗而言提供了一条加强免疫的新途径。也说明适当组合DNA疫苗,不但可能提高免疫效果,而且可以有效地组合成DNA多价疫苗。
作者简介:孟昕(1966-),男,辽宁鞍山人,博士。主要从事DNA疫苗和非复制型痘苗病毒载体的研究。
参考文献:
[1] Ertl H C, Xiang Z Q. Genetic Immunization[J]. Viral Immunology, 1996, 9: 1-9.
[2] Donnelly J J, Ulmer J B, Liu M A. DNA vaccines[J]. Life Sci, 1997, 60: 163-172.
, 百拇医药
[3] Kuhorber A, Wild J, Pudollek H P. DNA vaccination with plasmids encoding the intracellular(HBcAg)or secreted(HBeAg)form of the core protein of hepatitis B virus primes T cell responses to two overlapping Kb-and Kd-restricted epitopes[J]. Int Immunol, 1997, 9(8): 1203-1212.
[4] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].第二版,北京:科学出版社,1992,16-57.
[5] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].第二版,北京:科学出版社,1992,808-809.
[6] Schirmbeck R, Bohm W, Ando K, et al. Nucleic acid vaccination primes hepatitis B virus surface antigen-specific cytotoxic T lymphocytes in nonresponder mice[J]. J Virol, 1995, 69(10): 5929-5934.
收稿日期:1999-09-24;修回日期:1999-12-28, 百拇医药