脉冲式微透析法葡萄糖传感器系统——部分体外实验
作者:梁 华1 赵 阳2 宋作珪1
单位:1(浙江医科大学 附属第二医院内科,杭州 310009);2(浙江大学 科仪系)
关键词:脉冲式微泵;微透析;葡萄糖传感器;葡萄糖恢复;温度实验
生物医学工程学杂志980321 内容摘要 为构建一小型的皮下组织葡萄糖传感器系统,简化其葡萄糖监测前后的校正过程,改进其温度特性,本研究采用了脉冲式微泵和微透析技术,在5.5 mM及10 mM G.S中对这个葡萄传感器系统进行了葡萄糖恢复的实验。在20~40℃的范围,每5℃为一阶梯进行渐增渐减温度实验。结果显示葡萄糖恢复达(97±2)%;传感器输出电流虽随温度的增高而增加,但温度系数仅3.4%。本系统具有体积小,校正简便的特点,能克服温度的干扰而适用于发热的糖尿病患者血糖的监测。
, http://www.100md.com
Pulsatile Microdialysis Method with Glucose Sensor System
Liang Hua1 Zhao Yang2 Song Zuogui1
(Department of Internal Medicine, 2nd Affiliated Hospital Zhejiang Medical University, Hangzhou 310009)
Abstract To develop a miniature subcutaneous glucose sensor system, to simplify calibration procedure before or after glucose monitor, and to improve its temperature characteristic, a pulsatile micropump and the microdialysis technique were used. The experiments of glucose recovery in 5.5mM and 10mM G.S. and the temperature experiment from 20℃ to 40℃ were conducted. The results showed that glucose recovery was (97±2)%, the current values of glucose sensor varied with temperature, but the temperature parameter was only 3.4%. These indicate that the glucose sensor system is miniature and the calibration procedure is simple. Because of its modified temperature characterisic, it is useful to monitor the blood glucose of feverish diabetics.
, 百拇医药
Key words Pulsatile micropump Microdialysis Glucose sensor Glucose recovery Temperature experiment
1 引 言
自60年代Clark发明葡萄糖氧化酶—过氧化氢产物的酶电极以来[1],这类葡萄糖传感器经过不断发展,至今已公认为是最理想、临床应用最普遍的葡萄糖传感器[2,3]。从80年代实验证实皮下组织液的葡萄糖浓度与血糖浓度一致后[4],持续或按需从皮下组织采样以动态监测血糖的研究正在走向实用阶段,葡萄糖传感器系统小型化或微型化用于不卧床的病人已成为一个新的研究方向。本研究构建了一个新的脉冲式微透析法葡萄糖传感器系统,采用了脉冲式微泵和微透析技术。本文将重点探讨此系统微透析探针内葡萄糖的恢复、传感器使用前后校正过程的简化和整个传感器系统的小型化等问题,以及此传感器系统应用于高热病人时抗体温干扰的实用价值。
, 百拇医药
2 检测原理和实验方法
2.1 检测原理
脉冲式微透析法葡萄糖传感器系统的检测原理参见图1。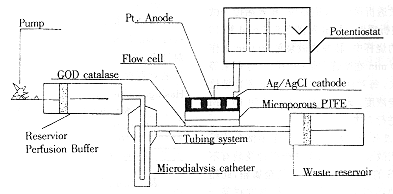
图1 脉冲式微透析法萄糖传感器系统的检测原理
Fig 1 Schematic diagram of pulsatile microdialysis sensor system
图1中的泵为脉冲式微泵,其内装有微型CPU,可按需定时定量泵出液体。本研究中每20 min泵磷酸缓冲液(pH7.4)20 μl。泵工作时将缓冲液泵至微透析探针的导管内。导管外层为微透析膜。缓冲液在此停留20 min,导管内、外液体中的各物质依据各自的浓度梯度从高浓度向低浓度进行扩散。在体内,微透析探针置于皮下组织,因而皮下组织液中的葡萄糖将向缓冲液中扩散。在本研究中,此探针置于不同浓度的葡萄糖液中(G.S)。20 min后,在泵的推动下,葡萄糖的缓冲液经管道系统进入流动室。流动室以白金为阳极,Ag/Agcl为阴极,电压+700 mV。流动室的外层是一层酶膜,其上固植着葡萄糖氧化酶(GOD)和过氧化氢酶。在酶膜和电极之间有一层Teflon膜,用以滤过大分子干扰物。葡萄糖在流动室产生下列反应[5]: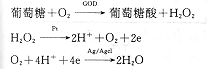
, 百拇医药
与流动室相连的电流计将此反应产生的电流放大、输出。电流的大小与葡萄糖浓度成正比,其值由曲线记录仪记录如图2。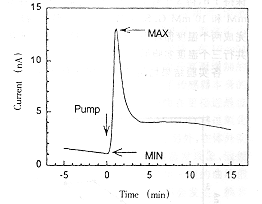
图2 脉冲式微透析法葡萄糖传感器输出信号
Fig 2 The signal of glucose sensor
实验用的脉冲式微泵、流动室、微透析探针、残液回收器由德国Eppendorf公司协同研制、提供;Biometra Ep 30电流计、BD 101双笔式曲线记录仪、循环加热器、温度监测仪均由德国吕贝克医科大学Kerner教授实验室提供;酶膜由Yellow Spring器械公司提供;Teflon膜由Universal Sensor ZNC提供;各种实验用化学品由Sigma化学公司提供。
2.2 实验方法
, http://www.100md.com
2.2.1 检测葡萄糖的恢复 按图1连接脉冲式微泵和微透析探针、管道系统,其末端接一微管。将微透析探针分别放入盛有5.5 mM和10 mM G.S的烧杯中。脉冲式微泵每20 min工作一次,每20 min在微管和烧杯中同时分别采等量样本一次。每对样本均在Beckman葡萄糖检测机上测定浓度。此实验在5.5 mM和10 mM G.S中各进行5次。
2.2.2 温度性能实验 按图1连接整个传感器系统。把微泵、流动室、微透析探针及装有不同浓度G.S的烧杯放入一密闭的金属箱,此箱与循环加热器相连,可调节和保持温度在某一设定点上。用温度监测仪监测金属箱内的温度。温度从20℃逐步上升至40℃,再渐降至20℃,形成一温度循环,每5℃为一阶梯,每一温度值保持1 h,得3个峰值。同一系统实验分别在0 mM和10 mM G.S.中各进行一个温度循环。完成两个温度循环为一温度实验循环。本研究共行三个温度实验循环。
各实验结果均用Sigma Plot软件进行统计。
, http://www.100md.com
3 结 果
将5.5 mM和10 mM G.S.的各5份标本及经微透析探针扩散后的配对标本各5份在Beckman葡萄糖检测机上测定浓度并进行配对计算、统计分析,其结果显示本系统微透析探针的葡萄糖恢复为(97±2.2)%,远远高于Y.Hashigrouchi(35.6±0.2)%的报道[6]。
表1 10mM G.S时的温度系数值
Talbe 1 Temperature parameter in 10 mM G.S No
1
2
3
Parameter(%)
, 百拇医药
3.63
2.96
3.63
表1显示三次10 mM G.S温度实验中所得的三个温度系数,计算公式如下: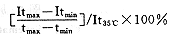
式中:Itmax=最高温度时电极的输出电流值;
Itmin=最低温度时电极的输出电流值;
It35℃=35℃时电极的输出电流值;
tmax和tmin分别为最高和最低温度。
, http://www.100md.com
从表1可见本研究的温度系数与已报道的3%~10%值相比也是较理想的[2]。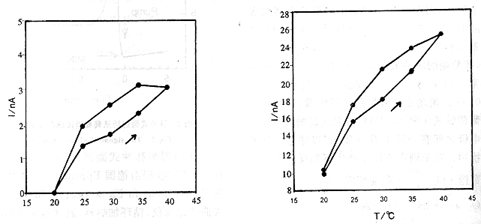
图3 OmM G.S时温度实验
图4 10 mM G.S时温度实验
Fig 3 OmM G.S temperature test
Fig 4 10mM G.S temperature test
图3、图4显示一个温度实验循环的结果。从图中可以看出,在不含葡萄糖的液体中,传感器输出电流随温度的升高而增加。此种趋势在10 mM G.S温度实验中更为明显,但同一温度值时传感器的输出电流值比较接近。
, http://www.100md.com
4 讨 论
动态了解糖尿病患者的血糖波动是正确指导治疗的先决条件。20多年来许多专家致力于连续监测血糖的研究。然而,连续监测血糖就需持续泵入缓冲液,这引起了以下问题:(1)微透析膜两侧物质扩散不充分,具体而言,微透析导管中葡萄糖的恢复不完全。众所周知,半透膜的物质扩散不仅与两侧的物质浓度梯度有关,也和扩散持续的时间有关。(2)由于扩散的不完全,影响了测量的准确性,因此主张用体内两点法来校正之[7]。这种校正法需在病人身上人为地造成高血糖和低血糖状态,不仅在监测血糖前要花费较长的时间进行校正,影响监测的及时性,而且对危重病人来讲,经历高、低血糖状态是十分危险的。(3)连续泵入缓冲液致使血糖浓度信号连续发生变化,而一个信号的充分表达是需要一定时间的,这就难免造成前后信号互相干扰,进而影响电极输出电流与葡萄糖浓度的相关关系。(4)连续泵入缓冲液致使缓冲液储存池及残液回收器体积较大,不利于整个系统的小型化。我们的研究着眼于临床应用的实际需要,一改普遍采用的连续监测血糖的思路为间歇监测血糖。实验结果显示本研究有以下优点:①采用脉冲式微泵,使前后电信号的发出时间相隔20 min。图2显示传感器电流达峰值后,在20 min内已稳定于基线,因此脉冲式微泵减少了前后电信号互相干扰的机会,提高了电极输出电流与葡萄糖浓度的一致性。②采用脉冲式微泵和微透析技术,使葡萄糖有足够的扩散时间,葡萄糖恢复几乎达到完全,因此使体外校正替代体内校正成为可能。部分体内实验也证实本系统仅用体外校正即能获得理想的监测效果。因而本系统更具及时和安全的实用价值。③脉冲式微泵24 h泵出缓冲液为1.44 ml,回收的残液更少,使整个传感器系统更趋小型化。从临床角度来讲也没必要每分每秒监测血糖,因为血糖的波动要达到一定幅度、药物要发挥明显的作用都需要一定的时间。
, 百拇医药
葡萄糖传感器输出电流随温度的升高而变大是酶电极传感器的一个特性[8]。这种特性干扰了葡萄糖传感器对发热病人血糖监测的准确性,限制了它的临床应用。为了探讨本传感器系统应用于发热病人的可能性进行了温度实验。结果显示此系统在不含葡萄糖的溶液中,其输出电流也随温度的升高而变大,具有此类传感器共有的特性。但其在20~40℃的温度范围内输出电流最大变化也小于4 nA,与10 mM G.S、40℃时电极输出电流值26 nA相比是很小的。从临床实用来讲,皮下组织的温度波动范围不可能达到20℃,因为正常人的皮下组织温度一般不会低达20℃,所以在实际应用时,传感器本身特性所产生的温度干扰更小,而这么小的干扰误差不会影响对治疗的指导。在10 mM G.S实验中,输出电流随温度的升高而增加的趋势更为明显。分析其原因,除了传感器本身的特性引起小的干扰外,主要与酶在更接近最佳功能温度时活性明显增加有关(GOD与过氧化氢酶的最佳活性温度为37℃)。另外,在体外实验中,温度增高时G.S液存在蒸发现象,致使葡萄糖浓度较实验前增高,产生一定的曲线值升高的假象,这种现象在体内不会发生。换言之,体内应用时温度对电极输出电流的影响只会小于体外实验值。为了解温度对电极输出电流影响范围的程度,我们以温度-输出电流呈直线关系为假设,以35℃为基本条件(因为正常人的皮下组织温度一般在35℃左右),计算了温度系数。结果显示在10 mM G.S中其均值为3.4%,即温度每升高1℃,输出电流增加3.4%。尽管从图3、图4中可知实际上温度-输出电流间并非呈直线关系,但知道温度系数的大致范围后可采用各种方法(如采用曲线补偿法、计算机程序补偿法等)补偿温度-输出电流间的大部分偏差,剩余的偏差就很小。因为即使在体温高于40℃时,皮下组织的温度也很少超过40℃,因而温度变化范围是有限的,另外,高热时糖尿病患者往往会因并发感染、酮症酸中毒、高渗性昏迷等而使血糖大幅度增加,相比之下,经大部分校正后的温度所引起的输出电流的增加就显得不重要了。综上所述,脉冲式微透析法葡萄糖传感器系统在发热患者中确有应用价值。
, 百拇医药
5 结 论
我们在这里所介绍的葡萄糖传感器系统,具有体积小、校正安全、简便的特点,同时也有较理想的温度特性。此葡萄糖传感器系统携带方便、应用范围广、操作简便、安全,更符合临床实际需求。
参 考 文 献
1 Clark LC. Membrane polarograpic electrode system and method with electrochemical compensation. 1970;U.S.Patent No.3539455
2 Pelleschi G, Fariolnia HM, Lubrano JG et al.Ideal hydrogen peroxide-based glucose sensor. Applied Biochemistry and Biotechnology, 1993;31∶21
, 百拇医药
3 Fischer U. Fundametals of glucose sensor. Diabetic Med. 1991;8∶309
4 Bruckel J, Kemer W, Zier H et al. In vivo measurement of subcutaneous glucose concentrations with an enzymatic glucose sensor and a wick method. Klin. Wochenschr, 1989;67∶491
5 John C, Pickup, Biosensors for diabetes mellitus. In:Wise DL, ed. Applied Biosensor. Butterworth publisher, 1989;227
6 Hashiguchi Y, Uemura T, Sakakida M et al. Development of a miniaturized glucose monitoring system by combinig a need-type glucose sensor with microdialysis sampling method. Diabetes Care,1994;17∶387
7 Velho G, Froguel PH, Thevenot DR et al. Strategies for calibrating a subcutaneous glucose sensor. Biomed. Biochim. Acta 1989;48∶957
8 Gough DA, Arderson FL, Giner J et al. Effect of coreactants on electrochemical glucose oxidation. Anal. Chem, 1978;50∶941
(收稿:1996-12-25 修回:1997-09-28), http://www.100md.com(梁 华1 赵 阳2 宋作珪1)
单位:1(浙江医科大学 附属第二医院内科,杭州 310009);2(浙江大学 科仪系)
关键词:脉冲式微泵;微透析;葡萄糖传感器;葡萄糖恢复;温度实验
生物医学工程学杂志980321 内容摘要 为构建一小型的皮下组织葡萄糖传感器系统,简化其葡萄糖监测前后的校正过程,改进其温度特性,本研究采用了脉冲式微泵和微透析技术,在5.5 mM及10 mM G.S中对这个葡萄传感器系统进行了葡萄糖恢复的实验。在20~40℃的范围,每5℃为一阶梯进行渐增渐减温度实验。结果显示葡萄糖恢复达(97±2)%;传感器输出电流虽随温度的增高而增加,但温度系数仅3.4%。本系统具有体积小,校正简便的特点,能克服温度的干扰而适用于发热的糖尿病患者血糖的监测。
, http://www.100md.com
Pulsatile Microdialysis Method with Glucose Sensor System
Liang Hua1 Zhao Yang2 Song Zuogui1
(Department of Internal Medicine, 2nd Affiliated Hospital Zhejiang Medical University, Hangzhou 310009)
Abstract To develop a miniature subcutaneous glucose sensor system, to simplify calibration procedure before or after glucose monitor, and to improve its temperature characteristic, a pulsatile micropump and the microdialysis technique were used. The experiments of glucose recovery in 5.5mM and 10mM G.S. and the temperature experiment from 20℃ to 40℃ were conducted. The results showed that glucose recovery was (97±2)%, the current values of glucose sensor varied with temperature, but the temperature parameter was only 3.4%. These indicate that the glucose sensor system is miniature and the calibration procedure is simple. Because of its modified temperature characterisic, it is useful to monitor the blood glucose of feverish diabetics.
, 百拇医药
Key words Pulsatile micropump Microdialysis Glucose sensor Glucose recovery Temperature experiment
1 引 言
自60年代Clark发明葡萄糖氧化酶—过氧化氢产物的酶电极以来[1],这类葡萄糖传感器经过不断发展,至今已公认为是最理想、临床应用最普遍的葡萄糖传感器[2,3]。从80年代实验证实皮下组织液的葡萄糖浓度与血糖浓度一致后[4],持续或按需从皮下组织采样以动态监测血糖的研究正在走向实用阶段,葡萄糖传感器系统小型化或微型化用于不卧床的病人已成为一个新的研究方向。本研究构建了一个新的脉冲式微透析法葡萄糖传感器系统,采用了脉冲式微泵和微透析技术。本文将重点探讨此系统微透析探针内葡萄糖的恢复、传感器使用前后校正过程的简化和整个传感器系统的小型化等问题,以及此传感器系统应用于高热病人时抗体温干扰的实用价值。
, 百拇医药
2 检测原理和实验方法
2.1 检测原理
脉冲式微透析法葡萄糖传感器系统的检测原理参见图1。

图1 脉冲式微透析法萄糖传感器系统的检测原理
Fig 1 Schematic diagram of pulsatile microdialysis sensor system
图1中的泵为脉冲式微泵,其内装有微型CPU,可按需定时定量泵出液体。本研究中每20 min泵磷酸缓冲液(pH7.4)20 μl。泵工作时将缓冲液泵至微透析探针的导管内。导管外层为微透析膜。缓冲液在此停留20 min,导管内、外液体中的各物质依据各自的浓度梯度从高浓度向低浓度进行扩散。在体内,微透析探针置于皮下组织,因而皮下组织液中的葡萄糖将向缓冲液中扩散。在本研究中,此探针置于不同浓度的葡萄糖液中(G.S)。20 min后,在泵的推动下,葡萄糖的缓冲液经管道系统进入流动室。流动室以白金为阳极,Ag/Agcl为阴极,电压+700 mV。流动室的外层是一层酶膜,其上固植着葡萄糖氧化酶(GOD)和过氧化氢酶。在酶膜和电极之间有一层Teflon膜,用以滤过大分子干扰物。葡萄糖在流动室产生下列反应[5]:
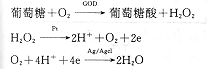
, 百拇医药
与流动室相连的电流计将此反应产生的电流放大、输出。电流的大小与葡萄糖浓度成正比,其值由曲线记录仪记录如图2。

图2 脉冲式微透析法葡萄糖传感器输出信号
Fig 2 The signal of glucose sensor
实验用的脉冲式微泵、流动室、微透析探针、残液回收器由德国Eppendorf公司协同研制、提供;Biometra Ep 30电流计、BD 101双笔式曲线记录仪、循环加热器、温度监测仪均由德国吕贝克医科大学Kerner教授实验室提供;酶膜由Yellow Spring器械公司提供;Teflon膜由Universal Sensor ZNC提供;各种实验用化学品由Sigma化学公司提供。
2.2 实验方法
, http://www.100md.com
2.2.1 检测葡萄糖的恢复 按图1连接脉冲式微泵和微透析探针、管道系统,其末端接一微管。将微透析探针分别放入盛有5.5 mM和10 mM G.S的烧杯中。脉冲式微泵每20 min工作一次,每20 min在微管和烧杯中同时分别采等量样本一次。每对样本均在Beckman葡萄糖检测机上测定浓度。此实验在5.5 mM和10 mM G.S中各进行5次。
2.2.2 温度性能实验 按图1连接整个传感器系统。把微泵、流动室、微透析探针及装有不同浓度G.S的烧杯放入一密闭的金属箱,此箱与循环加热器相连,可调节和保持温度在某一设定点上。用温度监测仪监测金属箱内的温度。温度从20℃逐步上升至40℃,再渐降至20℃,形成一温度循环,每5℃为一阶梯,每一温度值保持1 h,得3个峰值。同一系统实验分别在0 mM和10 mM G.S.中各进行一个温度循环。完成两个温度循环为一温度实验循环。本研究共行三个温度实验循环。
各实验结果均用Sigma Plot软件进行统计。
, http://www.100md.com
3 结 果
将5.5 mM和10 mM G.S.的各5份标本及经微透析探针扩散后的配对标本各5份在Beckman葡萄糖检测机上测定浓度并进行配对计算、统计分析,其结果显示本系统微透析探针的葡萄糖恢复为(97±2.2)%,远远高于Y.Hashigrouchi(35.6±0.2)%的报道[6]。
表1 10mM G.S时的温度系数值
Talbe 1 Temperature parameter in 10 mM G.S No
1
2
3
Parameter(%)
, 百拇医药
3.63
2.96
3.63
表1显示三次10 mM G.S温度实验中所得的三个温度系数,计算公式如下:
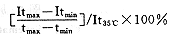
式中:Itmax=最高温度时电极的输出电流值;
Itmin=最低温度时电极的输出电流值;
It35℃=35℃时电极的输出电流值;
tmax和tmin分别为最高和最低温度。
, http://www.100md.com
从表1可见本研究的温度系数与已报道的3%~10%值相比也是较理想的[2]。

图3 OmM G.S时温度实验
图4 10 mM G.S时温度实验
Fig 3 OmM G.S temperature test
Fig 4 10mM G.S temperature test
图3、图4显示一个温度实验循环的结果。从图中可以看出,在不含葡萄糖的液体中,传感器输出电流随温度的升高而增加。此种趋势在10 mM G.S温度实验中更为明显,但同一温度值时传感器的输出电流值比较接近。
, http://www.100md.com
4 讨 论
动态了解糖尿病患者的血糖波动是正确指导治疗的先决条件。20多年来许多专家致力于连续监测血糖的研究。然而,连续监测血糖就需持续泵入缓冲液,这引起了以下问题:(1)微透析膜两侧物质扩散不充分,具体而言,微透析导管中葡萄糖的恢复不完全。众所周知,半透膜的物质扩散不仅与两侧的物质浓度梯度有关,也和扩散持续的时间有关。(2)由于扩散的不完全,影响了测量的准确性,因此主张用体内两点法来校正之[7]。这种校正法需在病人身上人为地造成高血糖和低血糖状态,不仅在监测血糖前要花费较长的时间进行校正,影响监测的及时性,而且对危重病人来讲,经历高、低血糖状态是十分危险的。(3)连续泵入缓冲液致使血糖浓度信号连续发生变化,而一个信号的充分表达是需要一定时间的,这就难免造成前后信号互相干扰,进而影响电极输出电流与葡萄糖浓度的相关关系。(4)连续泵入缓冲液致使缓冲液储存池及残液回收器体积较大,不利于整个系统的小型化。我们的研究着眼于临床应用的实际需要,一改普遍采用的连续监测血糖的思路为间歇监测血糖。实验结果显示本研究有以下优点:①采用脉冲式微泵,使前后电信号的发出时间相隔20 min。图2显示传感器电流达峰值后,在20 min内已稳定于基线,因此脉冲式微泵减少了前后电信号互相干扰的机会,提高了电极输出电流与葡萄糖浓度的一致性。②采用脉冲式微泵和微透析技术,使葡萄糖有足够的扩散时间,葡萄糖恢复几乎达到完全,因此使体外校正替代体内校正成为可能。部分体内实验也证实本系统仅用体外校正即能获得理想的监测效果。因而本系统更具及时和安全的实用价值。③脉冲式微泵24 h泵出缓冲液为1.44 ml,回收的残液更少,使整个传感器系统更趋小型化。从临床角度来讲也没必要每分每秒监测血糖,因为血糖的波动要达到一定幅度、药物要发挥明显的作用都需要一定的时间。
, 百拇医药
葡萄糖传感器输出电流随温度的升高而变大是酶电极传感器的一个特性[8]。这种特性干扰了葡萄糖传感器对发热病人血糖监测的准确性,限制了它的临床应用。为了探讨本传感器系统应用于发热病人的可能性进行了温度实验。结果显示此系统在不含葡萄糖的溶液中,其输出电流也随温度的升高而变大,具有此类传感器共有的特性。但其在20~40℃的温度范围内输出电流最大变化也小于4 nA,与10 mM G.S、40℃时电极输出电流值26 nA相比是很小的。从临床实用来讲,皮下组织的温度波动范围不可能达到20℃,因为正常人的皮下组织温度一般不会低达20℃,所以在实际应用时,传感器本身特性所产生的温度干扰更小,而这么小的干扰误差不会影响对治疗的指导。在10 mM G.S实验中,输出电流随温度的升高而增加的趋势更为明显。分析其原因,除了传感器本身的特性引起小的干扰外,主要与酶在更接近最佳功能温度时活性明显增加有关(GOD与过氧化氢酶的最佳活性温度为37℃)。另外,在体外实验中,温度增高时G.S液存在蒸发现象,致使葡萄糖浓度较实验前增高,产生一定的曲线值升高的假象,这种现象在体内不会发生。换言之,体内应用时温度对电极输出电流的影响只会小于体外实验值。为了解温度对电极输出电流影响范围的程度,我们以温度-输出电流呈直线关系为假设,以35℃为基本条件(因为正常人的皮下组织温度一般在35℃左右),计算了温度系数。结果显示在10 mM G.S中其均值为3.4%,即温度每升高1℃,输出电流增加3.4%。尽管从图3、图4中可知实际上温度-输出电流间并非呈直线关系,但知道温度系数的大致范围后可采用各种方法(如采用曲线补偿法、计算机程序补偿法等)补偿温度-输出电流间的大部分偏差,剩余的偏差就很小。因为即使在体温高于40℃时,皮下组织的温度也很少超过40℃,因而温度变化范围是有限的,另外,高热时糖尿病患者往往会因并发感染、酮症酸中毒、高渗性昏迷等而使血糖大幅度增加,相比之下,经大部分校正后的温度所引起的输出电流的增加就显得不重要了。综上所述,脉冲式微透析法葡萄糖传感器系统在发热患者中确有应用价值。
, 百拇医药
5 结 论
我们在这里所介绍的葡萄糖传感器系统,具有体积小、校正安全、简便的特点,同时也有较理想的温度特性。此葡萄糖传感器系统携带方便、应用范围广、操作简便、安全,更符合临床实际需求。
参 考 文 献
1 Clark LC. Membrane polarograpic electrode system and method with electrochemical compensation. 1970;U.S.Patent No.3539455
2 Pelleschi G, Fariolnia HM, Lubrano JG et al.Ideal hydrogen peroxide-based glucose sensor. Applied Biochemistry and Biotechnology, 1993;31∶21
, 百拇医药
3 Fischer U. Fundametals of glucose sensor. Diabetic Med. 1991;8∶309
4 Bruckel J, Kemer W, Zier H et al. In vivo measurement of subcutaneous glucose concentrations with an enzymatic glucose sensor and a wick method. Klin. Wochenschr, 1989;67∶491
5 John C, Pickup, Biosensors for diabetes mellitus. In:Wise DL, ed. Applied Biosensor. Butterworth publisher, 1989;227
6 Hashiguchi Y, Uemura T, Sakakida M et al. Development of a miniaturized glucose monitoring system by combinig a need-type glucose sensor with microdialysis sampling method. Diabetes Care,1994;17∶387
7 Velho G, Froguel PH, Thevenot DR et al. Strategies for calibrating a subcutaneous glucose sensor. Biomed. Biochim. Acta 1989;48∶957
8 Gough DA, Arderson FL, Giner J et al. Effect of coreactants on electrochemical glucose oxidation. Anal. Chem, 1978;50∶941
(收稿:1996-12-25 修回:1997-09-28), http://www.100md.com(梁 华1 赵 阳2 宋作珪1)