人工生物胰治疗糖尿病的实验研究
作者:杨华 张平 章丛杰
单位:(华西医科大学 附属第一医院内分泌科,成都 610041)
关键词:人工生物胰;糖尿病;排斥反应
生物医学工程学杂志000209 摘要 为防止胰岛移植后的排斥反应,本实验以大鼠胰岛、琼脂糖和胶原为原料制成人工生物胰(Bioartificial pancreas, BAP),并在体内外条件下,研究其胰岛素的分泌功能、免疫保护性以及在异种动物糖尿病治疗中的作用。结果表明,此人工生物胰能维持胰岛的分泌功能、降低胰岛移植物的免疫原性、移植后能纠正糖尿病小鼠的糖代谢紊乱、维持正常血糖水平。提示以胰岛、琼脂糖和胶原制成的人工生物胰不失为治疗糖尿病,减缓异种胰岛移植排斥反应的一种有效手段。
An Investigation of Bioartificial Pancreas
, http://www.100md.com
for Treatment of Diabetes Mellitus
Yang Hua
(Department of Endocrinology, First University Hospital, West China University of Medical Sciences, Chengdu 610041)
Zhang Ping Zhang Congjie
(Department of Immunology, School of Basic Medical Sciences, West China University of Medical Sciences,Chengdu 610041)
Abstract Bioartificial pancreas(BAP) made up of rat islet, agarose and collagen was developed in this experiment to cure the diabetes mellitus and prevent immune rejection of the islet xenograft.The insulin secretion function, immunoprotection and effect of BAP on the treatment of diabetes mellitus in mice were investigated. The results showed that the BAP maintained the insulin secretion function of islet, decreased the immunogenicity of islet xenograft and normalized the metabolic disturbances of carbohydrate in diabetic mice. These indicate that the BAP composed of the islet, agarose and collagen is an alternate approach to therapy for diabetes mellitus and to remission of immune rejecction of the islet xenograft.
, http://www.100md.com
Key words Bioartificial pancrease Diabetes mellitus Rejection
1 引 言
人工生物胰(BAP)由合成材料和胰岛构成,即半透膜包被的胰岛移植物[1],该半透膜可使植入的胰岛与宿主的免疫系统隔离而防止排斥反应,故在移植后无需使用免疫抑制剂。本实验采用Wistar Furth大鼠胰岛、琼脂糖和胶原为原料制成人工生物胰,并研究其分泌功能,免疫保护机理及对糖尿病的治疗作用,现报道如下。
2 材料与方法
2.1 实验动物
成年雄性Wistar Furth(WF)大鼠,体重250~300 g,用作胰岛供体。
, http://www.100md.com 成年C57BL/6、B6AF1及BALB/c小鼠,体重20~25 g,移植前2~3周腹腔注入链脲佐菌素(Streptozotocin, Sigma)170~200 mg/kg,造成糖尿病模型。注射后48 h取非空腹血测定血糖,连续两次以上血糖≥22.2 mmol/L,且糖尿病病程长达一周以上者用作移植物受者。
2.2 实验设计
2.2.1 胰岛素分泌功能测定 实验分为BAP组(每个BAP内含50个WF大鼠胰岛)和WF大鼠胰岛组(胰岛含量同BAP组)。每组各6个样本,收集培养上清,用大鼠胰岛素放射免疫试剂盒(美国Incstar公司)测定胰岛素含量。
2.2.2 淋巴细胞刺激指数(Stimulating index, SI)与白介素水平测定 实验分为BAP组(每个BAP内含100个Wistar大鼠胰岛)、Wistar大鼠胰岛组及C57小鼠胰岛组(胰岛含量同BAP组)。每组各5个样本。采用BAP(胰岛)C57小鼠淋巴细胞混合培养,测定及计算淋巴细胞刺激指数及培养上清中IL-2活性。
, 百拇医药
2.2.3 BAP对糖尿病小鼠血糖及耐糖曲线的影响 实验分为BAP组(n=39,每个BAP含1 000个WF大鼠胰岛)及WF大鼠胰岛组(n=5,植入的胰岛量与BAP组相同)。腹腔移植BAP(或WF大鼠胰岛)后观察糖尿病小鼠非空腹血糖。
移植后80天行葡萄糖耐量实验,以正常小鼠及糖尿病小鼠作为对照。
2.3 方法
2.3.1 胰腺消化及胰岛分离纯化 采用胶原酶(Sigma Ⅴ型)消化供体胰腺,不连续Euro-collins Ficoll密度梯度离心分离胰岛。
2.3.2 BAP制备 简言之,用1%的琼脂糖(Sigma Ⅹ Ⅱ型)及1%胶原包被胰岛后转入矿物油中,形成直径约0.4 cm、表面光滑的小球,洗涤后置RPMI-1640于5%CO2、37 ℃孵箱过夜,次日用5%琼脂糖再次包被,形成直径约0.8 cm大小的BPA,供移植用[2,3]。
, 百拇医药
用于胰岛素分泌功能测定及胰岛淋巴细胞混合培养(MLIC)的BPA制作方法基本同上,仅胰岛含量较少(见前),直径0.3~0.4 cm,用于MLIC的BPA不含胶原。
2.4 统计分析
数据以均数加减标准差表示。检测结果采用《中国医学百科全书。医学统计学》软件进行方差分析或t检验。
3 结 果
3.1 BAP的胰岛素分泌功能
BAP组胰岛素水平为57.5±20.1Mu。24h-1。50 islets,未包被大鼠胰岛组胰岛素水平为68.0±15.4Mu。24h-1。50 islets,两者比较无统计学差异(P=0.33,见图1)。
, 百拇医药
3.2 BAP与淋巴细胞混合培养中淋巴细胞刺激指数及白介素2(IL-2)水平
(1)BAP组淋巴细胞刺激指数为3.25±1.12,小鼠胰岛组淋巴细胞刺激指数为5.07±1.24,两组比较无显著性差异(P>0.05)。大鼠胰岛组淋巴细胞刺激指数为14.22±3.38,显著高于BAP组及小鼠胰岛组的水平(P<0.01,见图2)。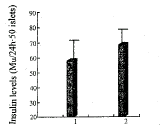
图1 BAP组及WF大鼠胰岛组岛素水平的比较
Fig 1 Comparison of inslin levels
(1) Bioartificial panrease group; (2) WF rat islets group
, 百拇医药
图2 各组淋巴细胞刺激指数比较
Fig 2 Comparison of lyphocyte stiumlating index
(1)Bioartificial panrease group; (2)C57 mouse group; (3)WF rat islets group
(2)BAP组IL-2活性为8.02±1.64 IU/ml,小鼠胰岛组为10.6±1.81 IU/ml,两组比较无显著性差异(P>0.05)。大鼠胰岛组IL-2活性为17.8±2.171 IU/ml,明显高于BAP组及小鼠胰岛组的水平(P<0.01,见图3)。
3.3 BAP对糖尿病小鼠血糖及耐糖曲线的影响
由表1可见,接受BAP移植后,92.3%(36/39)的糖尿病小鼠血糖恢复正常。平均非空腹血糖从移植前的24.3 mmol/L降至7.8±0.54 mmol/L。受者正常血糖持续时间125.8±57.9 d。对照组正常血糖持续时间仅6.75±2.99 d。
, 百拇医药
表1 接受BAP移植的糖尿病小鼠正常血糖持续时间
Table 1 Normoglycemic period of diabetic mice with BAP Group
Recipient
n
Normoglycemic period
individual period(D) ±s
±s
Percentage of mice with
normoglycemic state(%)
, 百拇医药
C57BL/6
19
240(2)#,230(1),200(6),140(2),130(1),120(1),103(1)*,90(1),80(2),70(1),60(1)
153.8±61.9
100(19/19)
Ⅰ
B6AF1
15
114(4)*,100(2),90(1),80(4)*,70(2)
, http://www.100md.com
92.8±17.3
86.6(13/15)
BALB/c
5
190(1),90(2),30(1)
100 ±66.0
80(4/5)
Ⅱ
C57BL/6
5
11(1),6(2),4(1)
6.75±2.99
, 百拇医药
80(4/5)
# Number of mice *Retrieving BAP;Group Ⅰ: Mice received BAP;Group Ⅱ:Mice received nonencapsulated WF rat islets
图3 各组IL-2水平比较
Fig 3 Comparison of IL-2 levels
(1)Bioartificial panrease group; (2)C57 mouse group; (3)WF rat islets group
BAP组与正常对照组的耐糖曲线相似,高峰出现在刺激后30 min,峰值小于11.1 mmol/L,然后逐渐下降,至刺激后120 min恢复到刺激前水平。未接受BAP移植的糖尿病对照组耐糖曲线明显高于BAP组及正常对照组(见图4)。BAP移植后80~114 d分别从9只小鼠腹腔内取出植入的BAP表面光滑、无粘连,移植局部未见组织反应。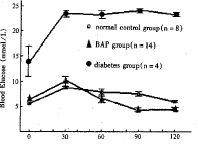
, http://www.100md.com
图4 耐糖曲线比较
Fig 4 Glucsoe tolerance curves
4 讨 论
排斥反应是胰岛移植失败的主要原因之一,人工生物胰的研制及应用为胰岛移植后排斥反应的防治开辟了新的途径。理想的BAP应具备以下条件:(1)能接受葡萄糖的刺激而调节自身胰岛素的分泌;(2)BAP的膜能为胰岛提供充分的免疫保护作用,同时还具有良好的生物相容性(Biocompatibility);(3)BAP中的胰岛能存活并维持胰岛素分泌功能[4]。现常用的BAP如扩散盒(Diffusion chambers)、微囊(Microcapsules)、中空纤维(Hollow fibers)以及血管内装置(Intravascular devices)并非十分理想,扩散盒和微囊移植后常引起膜周纤维化,而血管内装置可致装置内血液凝固及血栓形成[5]。
, 百拇医药
我们以大鼠胰岛、琼脂糖和胶原制成的BAP能保持其分泌胰岛的素功能,降低胰岛移植物的免疫原性,植入糖尿病小鼠腹腔后能使小鼠血糖恢复正常。在未使用任何免疫抑制剂的情况下,受者正常血糖持续时间为125.8±57.9 d,耐糖曲线与正常对照组相似。移植术后取出的BAP未见组织反应及纤维化。
琼脂糖是制备BAP的理想基质,通过胶凝技术能将胰岛包被于琼脂糖中而无损于胰岛的功能[6]。琼脂糖形成的人工膜不引起组织反应及纤维化,具有较好的生物相容性,它能允许葡萄糖、胰岛素等小分子物质的自由通过,从而维持正常血糖水平及耐糖曲线,又能将植入的异种胰岛移植物与宿主免疫系统隔离,使其逃避宿主免疫系统的识别,并阻止宿主免疫细胞及大分子免疫活性物质对胰岛的攻击,从而防止排斥反应。胶原是生物体的组成成分,能为细胞生长提供较理想的生理环境,有利于维持胰岛的活性和功能[7]。采用大鼠胰岛、琼脂糖和胶原为原料制备的人工生物胰符合理想BAP应具备的条件,为糖尿病的治疗提供了一条有效途径,在其它组织细胞的移植中亦将有广泛的应用前景。
, 百拇医药
致谢:本研究课题在美国纽约医院-康乃尔医学中心Kanti Jain博士的指导和大力支持下完成,在此致以衷心的感谢!
参考文献
1,Iwata H,Takagi T, Ameniya H et al. Agarose for a bioartificial pancrease. J Biomed Material Res 1992; 26∶967
2,JainK,Yang H,Cai BR et al. Retrievable, replaceable, macroencapsulated pancreatic islet xenografts:long-term engraftment without immunosuppression. Transplantation 1995; 59∶319
3,杨 华,赵克胜,叶燕熙等.大囊包被胰岛异种移植治疗糖尿病小鼠的实验研究.华西医科大学学报,1998;29(2)∶132
, 百拇医药
4,Reach G. Bioartificial pancreas. Diabetic Medicine 1993; 10∶105
5,Colton CK, Avgoustiniatos ES. Bioengineering in development of the hybrid artificial pancreas. Journal of Biomechanical Engineering 1991; 113∶152
6,Iwata H, Amemiya H, Matsude T et al. Microencapsulation of Langerhans islets in agarose microbeads and their application for a bioartificial pancreas. Journal of Bioactive and Compatible Polymers 1988; 3(10)∶356
7,Lucas-Clerc C, Massart C, Campion JP et al. Long-term culture of human pancreatic islets in an extracellular matrix: morphological and metabolic effects. Molecular and Cellular Endocrinology 1993; 94∶9
(收稿:1999-01-25), http://www.100md.com
单位:(华西医科大学 附属第一医院内分泌科,成都 610041)
关键词:人工生物胰;糖尿病;排斥反应
生物医学工程学杂志000209 摘要 为防止胰岛移植后的排斥反应,本实验以大鼠胰岛、琼脂糖和胶原为原料制成人工生物胰(Bioartificial pancreas, BAP),并在体内外条件下,研究其胰岛素的分泌功能、免疫保护性以及在异种动物糖尿病治疗中的作用。结果表明,此人工生物胰能维持胰岛的分泌功能、降低胰岛移植物的免疫原性、移植后能纠正糖尿病小鼠的糖代谢紊乱、维持正常血糖水平。提示以胰岛、琼脂糖和胶原制成的人工生物胰不失为治疗糖尿病,减缓异种胰岛移植排斥反应的一种有效手段。
An Investigation of Bioartificial Pancreas
, http://www.100md.com
for Treatment of Diabetes Mellitus
Yang Hua
(Department of Endocrinology, First University Hospital, West China University of Medical Sciences, Chengdu 610041)
Zhang Ping Zhang Congjie
(Department of Immunology, School of Basic Medical Sciences, West China University of Medical Sciences,Chengdu 610041)
Abstract Bioartificial pancreas(BAP) made up of rat islet, agarose and collagen was developed in this experiment to cure the diabetes mellitus and prevent immune rejection of the islet xenograft.The insulin secretion function, immunoprotection and effect of BAP on the treatment of diabetes mellitus in mice were investigated. The results showed that the BAP maintained the insulin secretion function of islet, decreased the immunogenicity of islet xenograft and normalized the metabolic disturbances of carbohydrate in diabetic mice. These indicate that the BAP composed of the islet, agarose and collagen is an alternate approach to therapy for diabetes mellitus and to remission of immune rejecction of the islet xenograft.
, http://www.100md.com
Key words Bioartificial pancrease Diabetes mellitus Rejection
1 引 言
人工生物胰(BAP)由合成材料和胰岛构成,即半透膜包被的胰岛移植物[1],该半透膜可使植入的胰岛与宿主的免疫系统隔离而防止排斥反应,故在移植后无需使用免疫抑制剂。本实验采用Wistar Furth大鼠胰岛、琼脂糖和胶原为原料制成人工生物胰,并研究其分泌功能,免疫保护机理及对糖尿病的治疗作用,现报道如下。
2 材料与方法
2.1 实验动物
成年雄性Wistar Furth(WF)大鼠,体重250~300 g,用作胰岛供体。
, http://www.100md.com 成年C57BL/6、B6AF1及BALB/c小鼠,体重20~25 g,移植前2~3周腹腔注入链脲佐菌素(Streptozotocin, Sigma)170~200 mg/kg,造成糖尿病模型。注射后48 h取非空腹血测定血糖,连续两次以上血糖≥22.2 mmol/L,且糖尿病病程长达一周以上者用作移植物受者。
2.2 实验设计
2.2.1 胰岛素分泌功能测定 实验分为BAP组(每个BAP内含50个WF大鼠胰岛)和WF大鼠胰岛组(胰岛含量同BAP组)。每组各6个样本,收集培养上清,用大鼠胰岛素放射免疫试剂盒(美国Incstar公司)测定胰岛素含量。
2.2.2 淋巴细胞刺激指数(Stimulating index, SI)与白介素水平测定 实验分为BAP组(每个BAP内含100个Wistar大鼠胰岛)、Wistar大鼠胰岛组及C57小鼠胰岛组(胰岛含量同BAP组)。每组各5个样本。采用BAP(胰岛)C57小鼠淋巴细胞混合培养,测定及计算淋巴细胞刺激指数及培养上清中IL-2活性。
, 百拇医药
2.2.3 BAP对糖尿病小鼠血糖及耐糖曲线的影响 实验分为BAP组(n=39,每个BAP含1 000个WF大鼠胰岛)及WF大鼠胰岛组(n=5,植入的胰岛量与BAP组相同)。腹腔移植BAP(或WF大鼠胰岛)后观察糖尿病小鼠非空腹血糖。
移植后80天行葡萄糖耐量实验,以正常小鼠及糖尿病小鼠作为对照。
2.3 方法
2.3.1 胰腺消化及胰岛分离纯化 采用胶原酶(Sigma Ⅴ型)消化供体胰腺,不连续Euro-collins Ficoll密度梯度离心分离胰岛。
2.3.2 BAP制备 简言之,用1%的琼脂糖(Sigma Ⅹ Ⅱ型)及1%胶原包被胰岛后转入矿物油中,形成直径约0.4 cm、表面光滑的小球,洗涤后置RPMI-1640于5%CO2、37 ℃孵箱过夜,次日用5%琼脂糖再次包被,形成直径约0.8 cm大小的BPA,供移植用[2,3]。
, 百拇医药
用于胰岛素分泌功能测定及胰岛淋巴细胞混合培养(MLIC)的BPA制作方法基本同上,仅胰岛含量较少(见前),直径0.3~0.4 cm,用于MLIC的BPA不含胶原。
2.4 统计分析
数据以均数加减标准差表示。检测结果采用《中国医学百科全书。医学统计学》软件进行方差分析或t检验。
3 结 果
3.1 BAP的胰岛素分泌功能
BAP组胰岛素水平为57.5±20.1Mu。24h-1。50 islets,未包被大鼠胰岛组胰岛素水平为68.0±15.4Mu。24h-1。50 islets,两者比较无统计学差异(P=0.33,见图1)。
, 百拇医药
3.2 BAP与淋巴细胞混合培养中淋巴细胞刺激指数及白介素2(IL-2)水平
(1)BAP组淋巴细胞刺激指数为3.25±1.12,小鼠胰岛组淋巴细胞刺激指数为5.07±1.24,两组比较无显著性差异(P>0.05)。大鼠胰岛组淋巴细胞刺激指数为14.22±3.38,显著高于BAP组及小鼠胰岛组的水平(P<0.01,见图2)。

图1 BAP组及WF大鼠胰岛组岛素水平的比较
Fig 1 Comparison of inslin levels
(1) Bioartificial panrease group; (2) WF rat islets group

, 百拇医药
图2 各组淋巴细胞刺激指数比较
Fig 2 Comparison of lyphocyte stiumlating index
(1)Bioartificial panrease group; (2)C57 mouse group; (3)WF rat islets group
(2)BAP组IL-2活性为8.02±1.64 IU/ml,小鼠胰岛组为10.6±1.81 IU/ml,两组比较无显著性差异(P>0.05)。大鼠胰岛组IL-2活性为17.8±2.171 IU/ml,明显高于BAP组及小鼠胰岛组的水平(P<0.01,见图3)。
3.3 BAP对糖尿病小鼠血糖及耐糖曲线的影响
由表1可见,接受BAP移植后,92.3%(36/39)的糖尿病小鼠血糖恢复正常。平均非空腹血糖从移植前的24.3 mmol/L降至7.8±0.54 mmol/L。受者正常血糖持续时间125.8±57.9 d。对照组正常血糖持续时间仅6.75±2.99 d。
, 百拇医药
表1 接受BAP移植的糖尿病小鼠正常血糖持续时间
Table 1 Normoglycemic period of diabetic mice with BAP Group
Recipient
n
Normoglycemic period
individual period(D)
 ±s
±sPercentage of mice with
normoglycemic state(%)
, 百拇医药
C57BL/6
19
240(2)#,230(1),200(6),140(2),130(1),120(1),103(1)*,90(1),80(2),70(1),60(1)
153.8±61.9
100(19/19)
Ⅰ
B6AF1
15
114(4)*,100(2),90(1),80(4)*,70(2)
, http://www.100md.com
92.8±17.3
86.6(13/15)
BALB/c
5
190(1),90(2),30(1)
100 ±66.0
80(4/5)
Ⅱ
C57BL/6
5
11(1),6(2),4(1)
6.75±2.99
, 百拇医药
80(4/5)
# Number of mice *Retrieving BAP;Group Ⅰ: Mice received BAP;Group Ⅱ:Mice received nonencapsulated WF rat islets

图3 各组IL-2水平比较
Fig 3 Comparison of IL-2 levels
(1)Bioartificial panrease group; (2)C57 mouse group; (3)WF rat islets group
BAP组与正常对照组的耐糖曲线相似,高峰出现在刺激后30 min,峰值小于11.1 mmol/L,然后逐渐下降,至刺激后120 min恢复到刺激前水平。未接受BAP移植的糖尿病对照组耐糖曲线明显高于BAP组及正常对照组(见图4)。BAP移植后80~114 d分别从9只小鼠腹腔内取出植入的BAP表面光滑、无粘连,移植局部未见组织反应。

, http://www.100md.com
图4 耐糖曲线比较
Fig 4 Glucsoe tolerance curves
4 讨 论
排斥反应是胰岛移植失败的主要原因之一,人工生物胰的研制及应用为胰岛移植后排斥反应的防治开辟了新的途径。理想的BAP应具备以下条件:(1)能接受葡萄糖的刺激而调节自身胰岛素的分泌;(2)BAP的膜能为胰岛提供充分的免疫保护作用,同时还具有良好的生物相容性(Biocompatibility);(3)BAP中的胰岛能存活并维持胰岛素分泌功能[4]。现常用的BAP如扩散盒(Diffusion chambers)、微囊(Microcapsules)、中空纤维(Hollow fibers)以及血管内装置(Intravascular devices)并非十分理想,扩散盒和微囊移植后常引起膜周纤维化,而血管内装置可致装置内血液凝固及血栓形成[5]。
, 百拇医药
我们以大鼠胰岛、琼脂糖和胶原制成的BAP能保持其分泌胰岛的素功能,降低胰岛移植物的免疫原性,植入糖尿病小鼠腹腔后能使小鼠血糖恢复正常。在未使用任何免疫抑制剂的情况下,受者正常血糖持续时间为125.8±57.9 d,耐糖曲线与正常对照组相似。移植术后取出的BAP未见组织反应及纤维化。
琼脂糖是制备BAP的理想基质,通过胶凝技术能将胰岛包被于琼脂糖中而无损于胰岛的功能[6]。琼脂糖形成的人工膜不引起组织反应及纤维化,具有较好的生物相容性,它能允许葡萄糖、胰岛素等小分子物质的自由通过,从而维持正常血糖水平及耐糖曲线,又能将植入的异种胰岛移植物与宿主免疫系统隔离,使其逃避宿主免疫系统的识别,并阻止宿主免疫细胞及大分子免疫活性物质对胰岛的攻击,从而防止排斥反应。胶原是生物体的组成成分,能为细胞生长提供较理想的生理环境,有利于维持胰岛的活性和功能[7]。采用大鼠胰岛、琼脂糖和胶原为原料制备的人工生物胰符合理想BAP应具备的条件,为糖尿病的治疗提供了一条有效途径,在其它组织细胞的移植中亦将有广泛的应用前景。
, 百拇医药
致谢:本研究课题在美国纽约医院-康乃尔医学中心Kanti Jain博士的指导和大力支持下完成,在此致以衷心的感谢!
参考文献
1,Iwata H,Takagi T, Ameniya H et al. Agarose for a bioartificial pancrease. J Biomed Material Res 1992; 26∶967
2,JainK,Yang H,Cai BR et al. Retrievable, replaceable, macroencapsulated pancreatic islet xenografts:long-term engraftment without immunosuppression. Transplantation 1995; 59∶319
3,杨 华,赵克胜,叶燕熙等.大囊包被胰岛异种移植治疗糖尿病小鼠的实验研究.华西医科大学学报,1998;29(2)∶132
, 百拇医药
4,Reach G. Bioartificial pancreas. Diabetic Medicine 1993; 10∶105
5,Colton CK, Avgoustiniatos ES. Bioengineering in development of the hybrid artificial pancreas. Journal of Biomechanical Engineering 1991; 113∶152
6,Iwata H, Amemiya H, Matsude T et al. Microencapsulation of Langerhans islets in agarose microbeads and their application for a bioartificial pancreas. Journal of Bioactive and Compatible Polymers 1988; 3(10)∶356
7,Lucas-Clerc C, Massart C, Campion JP et al. Long-term culture of human pancreatic islets in an extracellular matrix: morphological and metabolic effects. Molecular and Cellular Endocrinology 1993; 94∶9
(收稿:1999-01-25), http://www.100md.com