纤溶酶原激活物抑制物-1基因转导对肾小球系膜细胞外基质积聚的影响
作者:于志恒 陈香美 廖洪军 叶一舟 傅博
单位:100853 北京,解放军总医院肾科、解放军肾病中心、解放军重点实验室
关键词:纤溶酶原激活物抑制物1;基因表达;肾小球膜
中华内科杂志990811 【摘 要】 目的 利用体外基因转染技术使纤溶酶原激活物抑制物-1(PAI-1)基因过表达,直接观察局部PAI-1对大鼠系膜细胞外基质(ECM)积聚的影响,解析ECM积聚的分子机制。方法 以绿色荧光蛋白(GFP)为报告基因,构建PAI-1/GFP融合基因真核表达载体,利用脂质体将外源PAI-1 cDNA导入体外培养的大鼠系膜细胞。在活细胞状态下,动态观察外源基因的表达。用Northern 杂交、ELISA方法检测大鼠系膜细胞纤维连接蛋白(FN)、层连蛋白(LN)及IV型胶原表达。结果 PAI-1基因转染后,转染组大鼠系膜细胞中的培养上清PAI活性明显增高,到24小时达最高值(8.16±0.62) IU/ml,与对照组(2.27±0.19) IU/ml相比,差异有显著性(P<0.05)。同时基因转染组FN(0.51±0.03)、LN(1.26±0.07)及Ⅳ型胶原(0.98±0.08)水平均较对照组明显增高(P<0.05)。结论 首次建立了系膜细胞PAI-1的过度表达体系,证实细胞过度表达PAI-1可以直接导致ECM的积聚。局部PA/PAI活性的变化可能是调节系膜细胞ECM积聚与降解的重要因素。
, http://www.100md.com
Effect of plasminogen activator inhibitor 1 gene transfer into mesangial cells
on Extracellular matrix accumulation
YU Zhiheng, CHEN Xiangmei, LIAO Hongjun, et al.
Department of Nephrology, General Hospital of PLA, Kidney Center of PLA, Beijing 100853
【Abstract】 Objective To observe the influence of plasminogen activator inhibitor 1 (PAI-1) overexpression on extracellular matrix (ECM) accumulation of rat mesangial cells. Methods PAI-1/GFP green fluorescent protein fusion gene eukaryotic expression vector pCMX-PAI-1-GFP was constructed and delivered into cultured rat mesangial cells by liposome. PAI-1/GFP expression was observed by fluorescent microscope. FN, LN and Type IV collagen levels were measured by Northern blot analysis and ELISA method. Results Northern blot analysis, SDS-PAGE analysis and Western blot analysis demonstrated that PAI-1/GFP gene can be transcripted and translated in rat mesangial cells. PAI-1/GFP gene can express a specific protein. The recombinant PAI-1/GFP had significant inhibition activity on urokinase-type plasminogen activator and displayed autonomous fluorescence. The PA activity of cell supernatants decreased markedly in gene transfer group. FN, LN and Type Ⅳ collagen levels were higher than in a control group. Conclusion Over-expression of PAI-1 gene leads to mesangial ECM accumulation. The changes of PA/PAI-1 activity in supernatants of cultured rat mesangial cells might be the key factor in ECM accumulation regulation.
, 百拇医药
【Key words】 Plasminogen activator inhibitor 1 Gene expression Glomerular mesangial
纤溶酶原激活物(PA)/纤溶酶系统不仅是纤维蛋白(原)降解的调控系统,而且在细胞外基质(ECM)降解过程中起重要作用[1,2]。纤溶酶原激活物抑制物1(PAI-1)是PA/纤溶酶系统的主要抑制物。由于ECM合成与降解失衡是导致肾小球硬化的重要原因,我们认为PAI-1有可能通过抑制ECM的降解参与肾小球硬化的发生机制。但到目前为止,尚未见到PAI-1引起ECM积聚的直接实验证据。因此,有必要深入研究PA/PAI/纤溶酶系统在肾小球系膜细胞基质代谢过程中的作用。我们从培养的人肾脏系膜细胞中克隆了PAI-1的编码区cDNA序列,构建了原核表达质粒pBV220-PAI-1,并得到了高效表达[3]。在此工作的基础上,本研究拟构建以绿色荧光蛋白(GFP)为报告基因的PAI-1/GFP融合基因真核表达载体,用脂质体(liposome)将外源PAI-1 cDNA导入体外培养的大鼠系膜细胞,在活细胞状态下动态观察PAI-1/GFP的表达。检测PAI-1过度表达对大鼠系膜细胞外基质积聚的影响,从而在体外直接证实PAI-1的作用,并为进一步解析PAI-1在体内的功能奠定基础。
, 百拇医药
材料与方法
1.菌株、质粒和细胞株:大肠杆菌DH5由本室保存,质粒pUC19-PAI-1为本室构建,质粒pCMX-GFP由日本九州大学的Ogawa教授惠赠,大鼠系膜细胞为本室培养。
2.试剂:各种限制性内切酶、工具酶及DNA测序试剂盒为美国Promega公司产品,总RNA提取试剂盒、pGEM-T Easy载体购自GIBCO公司,Lipofectin转染试剂盒,随机引物标记试剂盒为宝灵曼公司产品,DNA纯化试剂盒购自QIAGEN公司。纤维蛋白平法测PAI-1活性的试剂均购自中国药品生物制品检定所。纤维连接蛋白(FN)、层连蛋白(LN)、IV 型胶原检测试剂盒购自北京医科大学。
3.细胞的培养及转染:大鼠肾小球系膜细胞的培养和鉴定参照文献[4]。第3代大鼠肾小球系膜细胞在37℃,5% CO2饱和湿度下用10% FCS-1640培养,转染前24小时细胞传代,换2% FCS-1640培养液。细胞密度为5×105/25 cm×25 cm细胞培养瓶。取5 μg质粒pCMX-PAI-1-GFP与30 μg脂质体混合,室温静止15分钟,加入25 cm×25 cm细胞培养瓶。转染10小时后换RPMI 1640培养液。
, 百拇医药
4.PAI-1/GFP融合基因真核表达载体的构建:以含有人类pai-1(hpai-1)全长cDNA序列的质粒pUC19-PAI-1为模板聚合酶链反应(PCR)扩增hpai-1编码区cDNA序列。hpai-1的5′端引物为:CAAGCTTATGCAGATGTCTCCAGCCCTC,3′端引物为:CGGTACCACCACCGGGTTCCATCACTTGGCCCAT。所扩增产物预计大小为1 227 bp,在其5′端加入Hind Ⅲ酶切位点及起始密码ATG,3′端去掉终止密码TGA并加入Asp 718酶切位点及编码3个氨基酸的铰链序列。PCR反应体积为50 μl,扩增参数为94 ℃ 45秒,60℃ 45秒,72℃ 45秒。35个循环后行1%琼脂糖电泳分析。PCR产物克隆至pGEM-T Easy载体测序。将测序证实的hpai-1 cDNA用Asp718及Hind Ⅲ双酶从pGEM-T Easy载体中切下,定向克隆至表达载体pCMX-GFP的Asp718、Hind Ⅲ位点,hpai-1插入点位于gfp之前,并与gfp共用一套转录单元。pai-1与gfp之间由编码3个甘氨酸及2个苏氨酸的碱基链连接。
, 百拇医药
5.DNA测序:按Promega测序试剂盒说明书进行。
6.Northern杂交:转染后4、12、24和48小时分别提取细胞总RNA,细胞总RNA用异硫酸胍一步法提取。用随机引物法制备32P标记的人PAI-1及FN的cDNA探针。20 μg总RNA用1%甲醛变性凝胶电泳分离后,转移到尼龙膜上,65℃预杂交2小时后加入探针,杂交过夜。常规洗膜、压片、放射性自显影。
7.十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE):采用不连续缓冲系统检测细胞培养上清蛋白质浓缩液。积层胶浓度为5%,分离胶浓度为12%,20 μg蛋白质上样,50 mA电泳5小时后考马斯亮蓝染色。
8.Western 印迹:转染后24小时提取细胞总蛋白质。细胞总蛋白的提取方法及Western印迹操作参照文献[5]。
9.PAI-1/GFP活性测定:转染后4、8、12、24小时、2、3、5天在荧光倒置显微镜下用492 nm蓝光激发,观察PAI-1/GFP表达。取上述时间点无血清RPMI 1640培养的细胞上清与等量的u-PA混合,25℃放置30 min后,取30 μl加在纤维蛋白平板上,37℃温育12小时。比较各组溶环面积,溶环面积缩小表示待测样品具有PAI活性。利用u-PA标准品绘制标准曲线,计算各点PAI活性。
, 百拇医药
10.FN、LN、IV型胶原测定:按试剂盒说明书进行。
11.统计学处理:用Statistica统计软件进行统计学处理,结果以均数±标准差(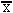 ±s)表示,对实验结果进行方差分析及配对t检验,P<0.05即认为有统计学差异。
±s)表示,对实验结果进行方差分析及配对t检验,P<0.05即认为有统计学差异。
结果
1.pCMX-PAI-1-GFP表达载体的构建:构建流程(图1)。以含有hpai-1全长cDNA序列的质粒pUC19-PAI-1为模板PCR扩增hpai-1编码区cDNA。PCR产物克隆至pGEM-T Easy载体测序。将测序证实的hpai-1 cDNA用Asp718及Hind Ⅲ双酶从pGEM-T Easy载体中切下,定向克隆至表达载体pCMX-GFP的Asp718、Hind Ⅲ位点,hpai-1 cDNA插入点位于gfp之前,并与gfp共用一套转录单元。pai-1与gfp之间由编码3个甘氨酸及2个苏氨酸的碱基链连接。选用上述酶切位点保持了pai-1与gfp的阅读框架。重组载体pCMX-PAI-1-GFP含有CMV启动子、hpai-1 cDNA、gfp cDNA和完整的SV40polyA序列。经Asp718、Hind Ⅲ双酶切证实有约1.2 kd的插入片段,并经酶切图谱证实。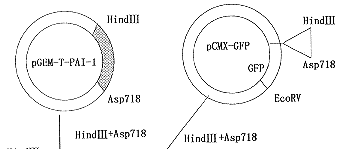


, http://www.100md.com
图1 pCMX-GFP-PAI-1表达载体构建图
2.PAI-1/GFP融合蛋白在大鼠系膜细胞中的表达:转染后4、12、24和48小时分别收集细胞, 提取总RNA进行Northern 杂交。转染4小时后大鼠系膜细胞PAI-1 mRNA表达开始增强,并于24小时达到最高值(图2a,b)。
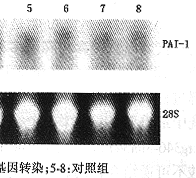
图2a Northern杂交检测纤溶酶原激活物抑制物-1(PAI-1) mRNA表达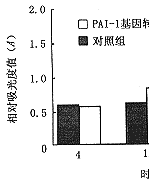
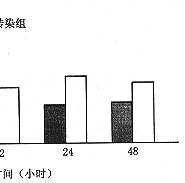
图2b 相对吸光度扫描PAI-1 mRNA表达
, http://www.100md.com
3.FN mRNA表达:转染后4、12、24和48小时Northern 杂交检测FN mRNA表达。结果显示在转染组与对照组FN表达无明显变化(图3a,b)。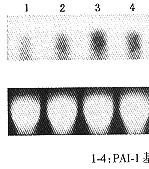
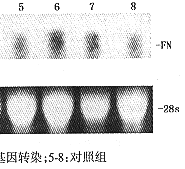
图3a Northern杂交检测FN mRNA表达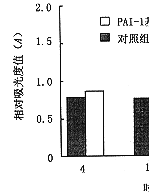
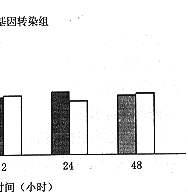
图3b 相对吸光度扫描FN mRNA表达
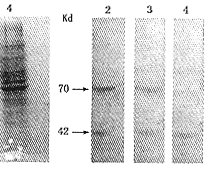
4.SDS-PAGE及Western 印迹分析:转染后4、12、24和48小时分别收集细胞提取总蛋白,进行SDS-PAGE及Western印迹分析。结果显示大鼠系膜细胞表达的PAI-1/GFP融合蛋白特异性条带位于70 kd左右处(图4a,b)。
, 百拇医药
1:标准分子量;2,3:PAI-1基因转染组;4:对照组
图4a、b SDS-PAGE及Western blot检测PAI-1/GFP融合蛋白表达
5.PAI-1/GFP活性检测:倒置荧光显微镜下,用492 nm蓝光激发,转染阳性细胞可见自发绿色荧光。纤维蛋白平板法测大鼠系膜细胞培养上清PA/PAI活性,检测重复6次取平均值。转染组细胞培养上清PAI-1活性从转染8小时后开始上升,24~48小时达到最高值,并在一周内维持较高水平,与空质粒对照组相比差异有显著性,P<0.05(图5)。

图5 PAI-1活性的变化
6.PAI-1基因转染对大鼠系膜细胞ECM表达的影响:转染组细胞培养上清FN水平从转染8小时后开始升高,到转染后24~48小时达到最高值,并在5天内保持较高水平,与空质粒对照组相比明显增高(图6)。其水平变化与局部PAI-1活性变化相平行。上清中LN及IV 型胶原的水平变化与FN结果一致(图7,8)。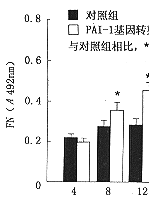

, http://www.100md.com
图6 纤维连接蛋白(FN)水平的变化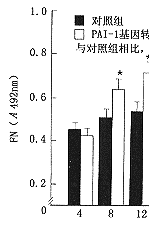

图7 层连蛋白(LN)水平变化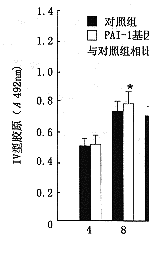

图8 Ⅳ型胶原水平变化
讨论
在引起肾脏进行性损伤的诸多因素中,ECM过度积聚及凝血纤溶系统紊乱可能是导致肾小球硬化的直接因素之一。纤溶系统紊乱不仅可以引起肾小球内凝血而导致肾损伤,在这一过程中活化的凝血因子,特别是凝血酶的激活,还可能与系膜细胞增殖及诱导炎症因子表达有关[6]。另一方面,凝血纤溶系统还与ECM代谢有共同的调节通路。如何维持或调控凝血纤溶状态及ECM代谢之间的平衡可能对肾脏保持其正常的结构与功能,防止或延缓肾小球硬化至关重要。
, 百拇医药
PA/纤溶酶系统可能是维持上述平衡的关键,它不仅可以直接参与降解多种ECM成分,而且是其他ECM降解系统的上游活化系统,从而在ECM降解过程中居于主导地位[7]。PAI-1是PA/纤溶酶系统中最重要的抑制物。PAI-1活性中心的氨基酸为Arg346-Met347,它与t-PA或u-PA活性中心的丝氨酸不可逆结合,导致PA失活,从而对PA/纤溶酶系统进行负调控。体外实验证实,用纤溶酶的抑制物α2抗1纤溶酶几乎可以完全阻止ECM的降解,而PAI-1的单克隆抗体则可以大大加快ECM的降解速度[8],提示PAI-1基因可能是影响ECM积聚过程的关键因素。
为了深入研究PAI-1的功能与表达,在活细胞状态下研究PAI-1的表达与分泌是必要的。本研究以GFP为报告基因,构建了pai-1与gfp融合基因的真核表达质粒,在大鼠系膜细胞高效表达了PAI-1/GFP融合蛋白。GFP在氧存在的条件下,其65-67位氨基酸残基折叠环化(Ser-Tyr-Gly),形成发色团,可被450-492 nm的蓝光激发出绿色荧光。GFP对细胞无毒性作用,因而能在活细胞状态下检测。我们发现,大鼠系膜细胞表达的PAI-1/GFP融合蛋白具有PAI-1与GFP的双重活性,可以在活细胞状态下观察外源基因的表达情况。GFP的存在不影响PAI-1的活性。
, 百拇医药
在体外培养条件下,系膜细胞可以分泌PA及PAI-1 。但PAI-1多以非活性状态存在,机体的纤溶系统及细胞外基质的合成与积聚保持平衡状态。我们的研究表明,体外培养条件下,系膜细胞培养上清仅显示轻度的PAI活性。导入外源PAI-1基因后,随着PAI-1基因产物的过量表达,细胞培养上清PAI活性显著增高,同时,细胞外基质成分FN、LN、IV型胶原水平也明显增高。在基因转染后8小时这一变化即开始出现,而在24~48小时达到顶点。其变化与PAI-1 mRNA表达变化一致,并与局部PAI-1活性的增高相平行。PAI-1基因导入后,在各时间点FN的mRNA表达没有变化。因此,我们推测,转染组细胞培养上清中ECM堆积的原因可能是PAI-1过量表达抑制ECM降解的结果。在整体动物研究条件下,目前,还没有见到类似的实验证据。Erickson等[9]建立的PAI-1转基因鼠模型证实,短时的PAI-1过量表达会导致纤溶系统紊乱,末梢循环微血栓形成,没有报道细胞外基质相关的实验资料。
我们利用体外基因转导的方法,首先建立了大鼠系膜细胞PAI-1过表达体系,在体外直接证实了局部PAI-1活性的增高将导致ECM的积聚。其作用机制是PAI-1对PA/纤溶酶系统进行负调控,导致ECM降解减少而积聚。从而阐明了PAI-1通过抑制ECM降解参与了肾小球硬化的病理生理过程。
, 百拇医药
本课题为国家自然科学基金资助项目(编号:39421005)
参考文献
1 Vassalli JD, Sappino AP, Belin D. The plasminogen activator/plasmin system. J Clin Invest,1991, 88:1067-1072.
2 Schnaper HW. Balance between matrix synthesis and degradation: a determinant of glomerulosclerosis. Pediatr Nephrol, 1995, 9: 104-111.
3 邓义斌,陈香美,廖洪军,等. 纤溶酶原激活物抑制物cDNA克隆及高效表达. 中国科学(C辑), 1998, 28: 89-196.
, 百拇医药
4 Mene P, Dunn MJ. Prostaglandins and rat glomerular mesangial cell proliferation. Kidney Int, 1990, 37: 1256-1262.
5 Sumbrook J, Fritsch EF, Maniatis T. Molecular cloning laboratory manual. 2nd ed. Cold Spring Harbor Laboratry Press, 1989. 345-897.
6 徐启河,陈香美,傅博 等. 凝血酶导致肾小球内皮细胞增殖与脱壁的研究. 中华内科杂志,1997,36:599-602
7 Baricos WH, Cortez SL, El-Dahr SS, etal. ECM degradation by cultured human mesangial cells is mediated by a PA/plasmin/MMP-2 cascade. Kidney Int, 1995, 47: 1039-1047.
, 百拇医药
8 Wong AP, Cortez SL, Baricos WH. Role of plasmin and gelatinase in extracellular matrix degradation by cultured rat mesangial cells. Am J Physiol, 1992,263:F1112-1118.
9 Erickson LA, Fici GJ, Lund JE, et al. Development of venous occlusions in mice transgenic for plasminogen activator inhibitor-1 gene. Nature, 1990,346:74-76.
(收稿:1998-11-04 修回:1999-04-14), 百拇医药
单位:100853 北京,解放军总医院肾科、解放军肾病中心、解放军重点实验室
关键词:纤溶酶原激活物抑制物1;基因表达;肾小球膜
中华内科杂志990811 【摘 要】 目的 利用体外基因转染技术使纤溶酶原激活物抑制物-1(PAI-1)基因过表达,直接观察局部PAI-1对大鼠系膜细胞外基质(ECM)积聚的影响,解析ECM积聚的分子机制。方法 以绿色荧光蛋白(GFP)为报告基因,构建PAI-1/GFP融合基因真核表达载体,利用脂质体将外源PAI-1 cDNA导入体外培养的大鼠系膜细胞。在活细胞状态下,动态观察外源基因的表达。用Northern 杂交、ELISA方法检测大鼠系膜细胞纤维连接蛋白(FN)、层连蛋白(LN)及IV型胶原表达。结果 PAI-1基因转染后,转染组大鼠系膜细胞中的培养上清PAI活性明显增高,到24小时达最高值(8.16±0.62) IU/ml,与对照组(2.27±0.19) IU/ml相比,差异有显著性(P<0.05)。同时基因转染组FN(0.51±0.03)、LN(1.26±0.07)及Ⅳ型胶原(0.98±0.08)水平均较对照组明显增高(P<0.05)。结论 首次建立了系膜细胞PAI-1的过度表达体系,证实细胞过度表达PAI-1可以直接导致ECM的积聚。局部PA/PAI活性的变化可能是调节系膜细胞ECM积聚与降解的重要因素。
, http://www.100md.com
Effect of plasminogen activator inhibitor 1 gene transfer into mesangial cells
on Extracellular matrix accumulation
YU Zhiheng, CHEN Xiangmei, LIAO Hongjun, et al.
Department of Nephrology, General Hospital of PLA, Kidney Center of PLA, Beijing 100853
【Abstract】 Objective To observe the influence of plasminogen activator inhibitor 1 (PAI-1) overexpression on extracellular matrix (ECM) accumulation of rat mesangial cells. Methods PAI-1/GFP green fluorescent protein fusion gene eukaryotic expression vector pCMX-PAI-1-GFP was constructed and delivered into cultured rat mesangial cells by liposome. PAI-1/GFP expression was observed by fluorescent microscope. FN, LN and Type IV collagen levels were measured by Northern blot analysis and ELISA method. Results Northern blot analysis, SDS-PAGE analysis and Western blot analysis demonstrated that PAI-1/GFP gene can be transcripted and translated in rat mesangial cells. PAI-1/GFP gene can express a specific protein. The recombinant PAI-1/GFP had significant inhibition activity on urokinase-type plasminogen activator and displayed autonomous fluorescence. The PA activity of cell supernatants decreased markedly in gene transfer group. FN, LN and Type Ⅳ collagen levels were higher than in a control group. Conclusion Over-expression of PAI-1 gene leads to mesangial ECM accumulation. The changes of PA/PAI-1 activity in supernatants of cultured rat mesangial cells might be the key factor in ECM accumulation regulation.
, 百拇医药
【Key words】 Plasminogen activator inhibitor 1 Gene expression Glomerular mesangial
纤溶酶原激活物(PA)/纤溶酶系统不仅是纤维蛋白(原)降解的调控系统,而且在细胞外基质(ECM)降解过程中起重要作用[1,2]。纤溶酶原激活物抑制物1(PAI-1)是PA/纤溶酶系统的主要抑制物。由于ECM合成与降解失衡是导致肾小球硬化的重要原因,我们认为PAI-1有可能通过抑制ECM的降解参与肾小球硬化的发生机制。但到目前为止,尚未见到PAI-1引起ECM积聚的直接实验证据。因此,有必要深入研究PA/PAI/纤溶酶系统在肾小球系膜细胞基质代谢过程中的作用。我们从培养的人肾脏系膜细胞中克隆了PAI-1的编码区cDNA序列,构建了原核表达质粒pBV220-PAI-1,并得到了高效表达[3]。在此工作的基础上,本研究拟构建以绿色荧光蛋白(GFP)为报告基因的PAI-1/GFP融合基因真核表达载体,用脂质体(liposome)将外源PAI-1 cDNA导入体外培养的大鼠系膜细胞,在活细胞状态下动态观察PAI-1/GFP的表达。检测PAI-1过度表达对大鼠系膜细胞外基质积聚的影响,从而在体外直接证实PAI-1的作用,并为进一步解析PAI-1在体内的功能奠定基础。
, 百拇医药
材料与方法
1.菌株、质粒和细胞株:大肠杆菌DH5由本室保存,质粒pUC19-PAI-1为本室构建,质粒pCMX-GFP由日本九州大学的Ogawa教授惠赠,大鼠系膜细胞为本室培养。
2.试剂:各种限制性内切酶、工具酶及DNA测序试剂盒为美国Promega公司产品,总RNA提取试剂盒、pGEM-T Easy载体购自GIBCO公司,Lipofectin转染试剂盒,随机引物标记试剂盒为宝灵曼公司产品,DNA纯化试剂盒购自QIAGEN公司。纤维蛋白平法测PAI-1活性的试剂均购自中国药品生物制品检定所。纤维连接蛋白(FN)、层连蛋白(LN)、IV 型胶原检测试剂盒购自北京医科大学。
3.细胞的培养及转染:大鼠肾小球系膜细胞的培养和鉴定参照文献[4]。第3代大鼠肾小球系膜细胞在37℃,5% CO2饱和湿度下用10% FCS-1640培养,转染前24小时细胞传代,换2% FCS-1640培养液。细胞密度为5×105/25 cm×25 cm细胞培养瓶。取5 μg质粒pCMX-PAI-1-GFP与30 μg脂质体混合,室温静止15分钟,加入25 cm×25 cm细胞培养瓶。转染10小时后换RPMI 1640培养液。
, 百拇医药
4.PAI-1/GFP融合基因真核表达载体的构建:以含有人类pai-1(hpai-1)全长cDNA序列的质粒pUC19-PAI-1为模板聚合酶链反应(PCR)扩增hpai-1编码区cDNA序列。hpai-1的5′端引物为:CAAGCTTATGCAGATGTCTCCAGCCCTC,3′端引物为:CGGTACCACCACCGGGTTCCATCACTTGGCCCAT。所扩增产物预计大小为1 227 bp,在其5′端加入Hind Ⅲ酶切位点及起始密码ATG,3′端去掉终止密码TGA并加入Asp 718酶切位点及编码3个氨基酸的铰链序列。PCR反应体积为50 μl,扩增参数为94 ℃ 45秒,60℃ 45秒,72℃ 45秒。35个循环后行1%琼脂糖电泳分析。PCR产物克隆至pGEM-T Easy载体测序。将测序证实的hpai-1 cDNA用Asp718及Hind Ⅲ双酶从pGEM-T Easy载体中切下,定向克隆至表达载体pCMX-GFP的Asp718、Hind Ⅲ位点,hpai-1插入点位于gfp之前,并与gfp共用一套转录单元。pai-1与gfp之间由编码3个甘氨酸及2个苏氨酸的碱基链连接。
, 百拇医药
5.DNA测序:按Promega测序试剂盒说明书进行。
6.Northern杂交:转染后4、12、24和48小时分别提取细胞总RNA,细胞总RNA用异硫酸胍一步法提取。用随机引物法制备32P标记的人PAI-1及FN的cDNA探针。20 μg总RNA用1%甲醛变性凝胶电泳分离后,转移到尼龙膜上,65℃预杂交2小时后加入探针,杂交过夜。常规洗膜、压片、放射性自显影。
7.十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE):采用不连续缓冲系统检测细胞培养上清蛋白质浓缩液。积层胶浓度为5%,分离胶浓度为12%,20 μg蛋白质上样,50 mA电泳5小时后考马斯亮蓝染色。
8.Western 印迹:转染后24小时提取细胞总蛋白质。细胞总蛋白的提取方法及Western印迹操作参照文献[5]。
9.PAI-1/GFP活性测定:转染后4、8、12、24小时、2、3、5天在荧光倒置显微镜下用492 nm蓝光激发,观察PAI-1/GFP表达。取上述时间点无血清RPMI 1640培养的细胞上清与等量的u-PA混合,25℃放置30 min后,取30 μl加在纤维蛋白平板上,37℃温育12小时。比较各组溶环面积,溶环面积缩小表示待测样品具有PAI活性。利用u-PA标准品绘制标准曲线,计算各点PAI活性。
, 百拇医药
10.FN、LN、IV型胶原测定:按试剂盒说明书进行。
11.统计学处理:用Statistica统计软件进行统计学处理,结果以均数±标准差(
 ±s)表示,对实验结果进行方差分析及配对t检验,P<0.05即认为有统计学差异。
±s)表示,对实验结果进行方差分析及配对t检验,P<0.05即认为有统计学差异。结果
1.pCMX-PAI-1-GFP表达载体的构建:构建流程(图1)。以含有hpai-1全长cDNA序列的质粒pUC19-PAI-1为模板PCR扩增hpai-1编码区cDNA。PCR产物克隆至pGEM-T Easy载体测序。将测序证实的hpai-1 cDNA用Asp718及Hind Ⅲ双酶从pGEM-T Easy载体中切下,定向克隆至表达载体pCMX-GFP的Asp718、Hind Ⅲ位点,hpai-1 cDNA插入点位于gfp之前,并与gfp共用一套转录单元。pai-1与gfp之间由编码3个甘氨酸及2个苏氨酸的碱基链连接。选用上述酶切位点保持了pai-1与gfp的阅读框架。重组载体pCMX-PAI-1-GFP含有CMV启动子、hpai-1 cDNA、gfp cDNA和完整的SV40polyA序列。经Asp718、Hind Ⅲ双酶切证实有约1.2 kd的插入片段,并经酶切图谱证实。



, http://www.100md.com
图1 pCMX-GFP-PAI-1表达载体构建图
2.PAI-1/GFP融合蛋白在大鼠系膜细胞中的表达:转染后4、12、24和48小时分别收集细胞, 提取总RNA进行Northern 杂交。转染4小时后大鼠系膜细胞PAI-1 mRNA表达开始增强,并于24小时达到最高值(图2a,b)。


图2a Northern杂交检测纤溶酶原激活物抑制物-1(PAI-1) mRNA表达


图2b 相对吸光度扫描PAI-1 mRNA表达
, http://www.100md.com
3.FN mRNA表达:转染后4、12、24和48小时Northern 杂交检测FN mRNA表达。结果显示在转染组与对照组FN表达无明显变化(图3a,b)。


图3a Northern杂交检测FN mRNA表达


图3b 相对吸光度扫描FN mRNA表达
4.SDS-PAGE及Western 印迹分析:转染后4、12、24和48小时分别收集细胞提取总蛋白,进行SDS-PAGE及Western印迹分析。结果显示大鼠系膜细胞表达的PAI-1/GFP融合蛋白特异性条带位于70 kd左右处(图4a,b)。


, 百拇医药
1:标准分子量;2,3:PAI-1基因转染组;4:对照组
图4a、b SDS-PAGE及Western blot检测PAI-1/GFP融合蛋白表达
5.PAI-1/GFP活性检测:倒置荧光显微镜下,用492 nm蓝光激发,转染阳性细胞可见自发绿色荧光。纤维蛋白平板法测大鼠系膜细胞培养上清PA/PAI活性,检测重复6次取平均值。转染组细胞培养上清PAI-1活性从转染8小时后开始上升,24~48小时达到最高值,并在一周内维持较高水平,与空质粒对照组相比差异有显著性,P<0.05(图5)。


图5 PAI-1活性的变化
6.PAI-1基因转染对大鼠系膜细胞ECM表达的影响:转染组细胞培养上清FN水平从转染8小时后开始升高,到转染后24~48小时达到最高值,并在5天内保持较高水平,与空质粒对照组相比明显增高(图6)。其水平变化与局部PAI-1活性变化相平行。上清中LN及IV 型胶原的水平变化与FN结果一致(图7,8)。


, http://www.100md.com
图6 纤维连接蛋白(FN)水平的变化


图7 层连蛋白(LN)水平变化


图8 Ⅳ型胶原水平变化
讨论
在引起肾脏进行性损伤的诸多因素中,ECM过度积聚及凝血纤溶系统紊乱可能是导致肾小球硬化的直接因素之一。纤溶系统紊乱不仅可以引起肾小球内凝血而导致肾损伤,在这一过程中活化的凝血因子,特别是凝血酶的激活,还可能与系膜细胞增殖及诱导炎症因子表达有关[6]。另一方面,凝血纤溶系统还与ECM代谢有共同的调节通路。如何维持或调控凝血纤溶状态及ECM代谢之间的平衡可能对肾脏保持其正常的结构与功能,防止或延缓肾小球硬化至关重要。
, 百拇医药
PA/纤溶酶系统可能是维持上述平衡的关键,它不仅可以直接参与降解多种ECM成分,而且是其他ECM降解系统的上游活化系统,从而在ECM降解过程中居于主导地位[7]。PAI-1是PA/纤溶酶系统中最重要的抑制物。PAI-1活性中心的氨基酸为Arg346-Met347,它与t-PA或u-PA活性中心的丝氨酸不可逆结合,导致PA失活,从而对PA/纤溶酶系统进行负调控。体外实验证实,用纤溶酶的抑制物α2抗1纤溶酶几乎可以完全阻止ECM的降解,而PAI-1的单克隆抗体则可以大大加快ECM的降解速度[8],提示PAI-1基因可能是影响ECM积聚过程的关键因素。
为了深入研究PAI-1的功能与表达,在活细胞状态下研究PAI-1的表达与分泌是必要的。本研究以GFP为报告基因,构建了pai-1与gfp融合基因的真核表达质粒,在大鼠系膜细胞高效表达了PAI-1/GFP融合蛋白。GFP在氧存在的条件下,其65-67位氨基酸残基折叠环化(Ser-Tyr-Gly),形成发色团,可被450-492 nm的蓝光激发出绿色荧光。GFP对细胞无毒性作用,因而能在活细胞状态下检测。我们发现,大鼠系膜细胞表达的PAI-1/GFP融合蛋白具有PAI-1与GFP的双重活性,可以在活细胞状态下观察外源基因的表达情况。GFP的存在不影响PAI-1的活性。
, 百拇医药
在体外培养条件下,系膜细胞可以分泌PA及PAI-1 。但PAI-1多以非活性状态存在,机体的纤溶系统及细胞外基质的合成与积聚保持平衡状态。我们的研究表明,体外培养条件下,系膜细胞培养上清仅显示轻度的PAI活性。导入外源PAI-1基因后,随着PAI-1基因产物的过量表达,细胞培养上清PAI活性显著增高,同时,细胞外基质成分FN、LN、IV型胶原水平也明显增高。在基因转染后8小时这一变化即开始出现,而在24~48小时达到顶点。其变化与PAI-1 mRNA表达变化一致,并与局部PAI-1活性的增高相平行。PAI-1基因导入后,在各时间点FN的mRNA表达没有变化。因此,我们推测,转染组细胞培养上清中ECM堆积的原因可能是PAI-1过量表达抑制ECM降解的结果。在整体动物研究条件下,目前,还没有见到类似的实验证据。Erickson等[9]建立的PAI-1转基因鼠模型证实,短时的PAI-1过量表达会导致纤溶系统紊乱,末梢循环微血栓形成,没有报道细胞外基质相关的实验资料。
我们利用体外基因转导的方法,首先建立了大鼠系膜细胞PAI-1过表达体系,在体外直接证实了局部PAI-1活性的增高将导致ECM的积聚。其作用机制是PAI-1对PA/纤溶酶系统进行负调控,导致ECM降解减少而积聚。从而阐明了PAI-1通过抑制ECM降解参与了肾小球硬化的病理生理过程。
, 百拇医药
本课题为国家自然科学基金资助项目(编号:39421005)
参考文献
1 Vassalli JD, Sappino AP, Belin D. The plasminogen activator/plasmin system. J Clin Invest,1991, 88:1067-1072.
2 Schnaper HW. Balance between matrix synthesis and degradation: a determinant of glomerulosclerosis. Pediatr Nephrol, 1995, 9: 104-111.
3 邓义斌,陈香美,廖洪军,等. 纤溶酶原激活物抑制物cDNA克隆及高效表达. 中国科学(C辑), 1998, 28: 89-196.
, 百拇医药
4 Mene P, Dunn MJ. Prostaglandins and rat glomerular mesangial cell proliferation. Kidney Int, 1990, 37: 1256-1262.
5 Sumbrook J, Fritsch EF, Maniatis T. Molecular cloning laboratory manual. 2nd ed. Cold Spring Harbor Laboratry Press, 1989. 345-897.
6 徐启河,陈香美,傅博 等. 凝血酶导致肾小球内皮细胞增殖与脱壁的研究. 中华内科杂志,1997,36:599-602
7 Baricos WH, Cortez SL, El-Dahr SS, etal. ECM degradation by cultured human mesangial cells is mediated by a PA/plasmin/MMP-2 cascade. Kidney Int, 1995, 47: 1039-1047.
, 百拇医药
8 Wong AP, Cortez SL, Baricos WH. Role of plasmin and gelatinase in extracellular matrix degradation by cultured rat mesangial cells. Am J Physiol, 1992,263:F1112-1118.
9 Erickson LA, Fici GJ, Lund JE, et al. Development of venous occlusions in mice transgenic for plasminogen activator inhibitor-1 gene. Nature, 1990,346:74-76.
(收稿:1998-11-04 修回:1999-04-14), 百拇医药