低氧性肺动脉高压大鼠肺动脉平滑肌细胞钾通道基因表达的研究
作者:陈文彬 程德云 杜国清
单位:610041 成都,华西医科大学附属第一医院呼吸内科
关键词:
中华内科杂志000615 本研究拟通过观察钾通道基因表达的变化,阐明低氧性肺动脉高压(HPH)肺血管重建的形成机制及其在HPH发病中的作用。
一、材料与方法
1.雄性Wistar大鼠20只,体重250~300 g。随机分为低氧组和对照组,每组10只。将低氧组大鼠置于有机玻璃舱内,以氮气调控舱内的氧浓度为(10.0±0.5)%。舱内CO2由钠石灰吸收,水蒸气由硅胶吸收,每日低氧8h,连续3周。对照组置于同一实验室内。
2.腹腔内注射50 mg/kg戊巴比妥钠麻醉。以插入导管法测定肺循环血流动力学,暴露右侧颈外静脉,插入硅胶管经右心房、右心室至肺动脉,导管另一端接压力传感器(TP-200T),经多导生理仪RM-6000(Nihn Kohden)记录平均肺动脉压(mPAP)及计算肺血管阻力(PVR)。血流动力学测定后,即刻取出大鼠心脏,剪去心房组织,沿室间隔边缘分离出右心室(RV)和左心室(LV)加室间隔(S)。以RV与LV加S重量比值[RV/(LV+S)]作为右心室肥厚的指标。
, 百拇医药
3.大鼠肺组织标本于10%中性甲醛缓冲液中固定,石蜡包埋,切片,用于常规HE染色和组织原位杂交。
4.将分别带有人钾离子通道基因RAK(Mayo基金会Claphan教授惠赠)、GIRK1(加州理工技术研究所Davidson教授惠赠)及HH-IRK1(加州大学Vandenberg教授惠赠)cDNA片断的3种质粒,全长分别为1.3 kb、1346 kb及1.3 kb,用于cRNA探针的制备。各质粒DNA分别经转化JM109,扩增,小量提取,电泳酶切鉴定后,进行大量制备各质粒DNA。各质粒DNA分别用EcoRⅠ和XhoⅠ酶切成线状,用Promega公司DNA clean Up 回收,采用DIG-UTP(DIG RNA标记试剂盒,Bochringer mannhein,BM公司产品)标记RNA探针,按说明书分别加入Sp6、T31和T7 RNA聚合酶进行标记反应,反应完毕后取少量标记的cRNA产物进行鉴定。
, http://www.100md.com
5.各种cRNA探针使用前均采用超声波方法处理,使其片断大约为500~700 bp。杂交后染色,封片。阴性对照的肺组织切片在杂交过程中不用标记探针,其余步骤同杂交。
6.在Nikon倒置显微镜下观察原位杂交组织切片,着蓝色者为阳性。每张切片选择8~10条与呼吸性细支气管相伴行的肺小动脉,用QTM970型图像分析仪(英国剑桥仪器公司)进行灰度扫描,计算出均数,作为该只大鼠的肺小动脉壁灰度,以阴性对照切片的肺小血管壁灰度为1,判定两组大鼠肺小血管壁钾通道基因表达的相对强度。
7.统计学方法:两组间数据的比较采用t检验。
二、结果
1.低氧对大鼠肺循环及右心室的影响:见表1。
表1 低氧对大鼠肺循环及右心室的影响(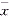 ±s) 组别
±s) 组别
, http://www.100md.com
鼠数
(只)
mPAP
(mm Hg)
PVR
(mm Hg.s-1.L-1)
RV/(LV+S)
对照组
10
16.58±2.03
21 690.0±2 362.5
, 百拇医药 0.261±0.052
低氧组
10
29.70±3.15*
52 177.5±5 280.0*
0.357±0.045*
注:1 mm Hg=0.133 kPa 与对照组比较,* P<0.01
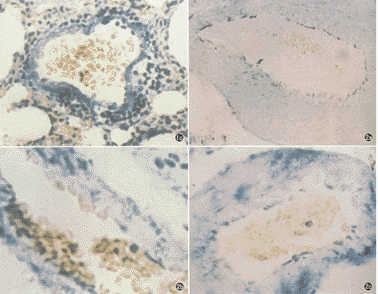
2. 肺组织HE染色显示,低氧组大鼠肺小动脉管壁增厚,管腔狭窄,呈现显著的肺血管重建现象。肺组织原位杂交结果显示,对照组大鼠肺动脉平滑肌细胞(SMCs)对RAK、GIRK1及HH-IRK1的cRNA探针出现强阳性反应,而低氧组大鼠肺动脉平滑肌细胞上,RAK、GIRK1及HH-IRK1的表达均明显减弱,见图1,2。阴性对照的肺组织切片,未见阳性染色。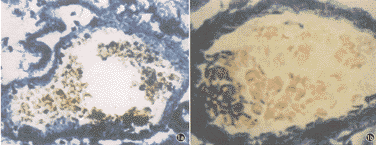
, http://www.100md.com
图1 对照组大鼠肺小动脉平滑肌细胞上延迟整流性钾通道基因的表达
1a RAK基因表达 1b GIRK1基因表达 1c HH-IRK1基因表达
图2 低氧组大鼠肺小动脉壁增生肥厚,延迟整流性钾通道基因
在肺动脉平滑肌细胞上的表达明显减弱
1b RAK基因表达 1b GIRK1基因表达 1c HH-IRK1基因表达 均为原位杂交 ×400
3.低氧对大鼠肺小动脉壁各种基因表达强度的影响:见表2。
表2 低氧对大鼠肺小动脉壁RAK、GIRK1和
, 百拇医药
HH-IRK1基因表达强度的影响(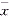 ±s) 组别
±s) 组别
鼠数(只)
RAK
GIRK1
HH-IRK1
对照组
10
2.63±0.18
2.94±0.69
2.52±0.36
, 百拇医药
低氧组
10
1.45±0.55*
1.61±0.37*
1.52±0.63*
注:表达强度为阴性对照切片灰度的倍数 与对照组比较,* P<0.01
讨论 目前认为,低氧性肺血管收缩和肺血管重建是慢性HPH发生的主要机制,在这些机制中,影响血管舒缩的诸多体液因子和SMCs膜离子通道活性的改变尤为人们所重视。然而,近代研究表明,许多体液因子在低氧性肺血管收缩中虽然发挥了一定的作用,但这些因子的拮抗剂却不能完全抑制或逆转低氧所致的肺血管重建[1]。因此,肺动脉SMCs膜离子通道活性的改变在HPH发病中的作用,引起了人们极大的关注。低氧引起肺血管的收缩反应并非完全依赖于血管内皮细胞,在很大程度上直接由血管SMCs内在的电生理活动所介导。最近我们的研究发现[2,3],急、慢性缺氧均可阻断肺血管SMCs钾通道活性,导致细胞膜去极化,继而开放电压门控钙通道,使细胞内钙水平增高,引起兴奋-收缩-耦联增强,最终发生肺动脉收缩和肺动脉高压。此外,慢性低氧还可使肺血管SMCs表型发生变化和钾通道基因如延迟整流性钾通道基因RAK等表达减少,从而引起肺动脉SMCs延迟整流性钾电流的振幅降低、开放概率减少、开放时间缩短、关闭时间延长和该通道的数目下降,并促使血管SMCs增殖和内皮细胞迁移,并发生肺血管重建[4]。由此可见,低氧所致的肺动脉 SMCs钾通道活性降低和钾通道基因表达减少,在HPH发病机制中发挥重要作用。
, http://www.100md.com
Smirnov等[4]发现,慢性低氧4周可引起肺动脉高压大鼠肺动脉平滑肌细胞延迟整流性钾通道的振幅明显降低,且在停止低氧后仍可维持6h以上。认为这种延迟整流性钾离子通道活性的降低、开放概率减少、关闭时间延长,与慢性低氧所致的该离子通道基因表达减少,促进血管平滑肌增生或向动脉内膜迁移,引起肺动脉血管重建有关。Yuan等[5]发现,急性低氧[动脉血氧分压<74 mm Hg(1 mm Hg=0.133 kPa)]可显著抑制大鼠肺动脉平滑肌电压门控性钾通道的外向性钾电流,认为低氧抑制肺动脉平滑肌细胞膜电压门控性钾通道,开放电压门控性钙通道,促进Ca2+进入细胞内,最后导致肺血管收缩反应。我们最近的研究发现[3,4],急、慢性低氧均可使大鼠肺动脉平滑肌细胞上一种4-氨基吡啶敏感的钾通道活性降低,其电生理和药理学特性表明,该通道属延迟整流性钾通道,与Smirnov等[1]的实验结果相符合,亦与Yuan等所观察到的电压门控性钾通道的改变相一致。提示延迟整流性钾通道电流振幅的降低、活性的减弱和肺血管重建,与慢性低氧所致的肺动脉SMCs表型的变化,钾通道基因表达减少有关。
, 百拇医药
本研究的RAK、GIRK1及HH-IRK1均为近年来相继被克隆的延迟整流性钾通道基因,在本研究中均发现这些钾通道基因在正常大鼠肺动脉平滑肌细胞上表达正常,而在HPH大鼠肺动脉SMCs上的表达则降低,可能与低氧导致肺动脉SMCs钾通道活性下降和引起低氧性肺血管收缩,继而发生肺血管重建有关。表明钾离子通道基因表达的减少在慢性HPH发病中发挥重要作用。
(本文图1,2见插页图第11页)
基金项目:国家“九五”科技攻关专题基金资助项目(96-906-02-17);纽约中华医学基金部分资助项目
参考文献
1,陈文彬. 加强对低氧性肺动脉高压肺动脉平滑肌细胞钾通道活性的研究. 中华内科杂志, 1997, 36: 5-6.
2,肖欣荣, 陈文彬, 程德云. 急性缺氧抑制大鼠肺动脉平滑肌细胞钙ATP钾通道. 中华结核和呼吸杂志, 1998, 21: 415-419.
, 百拇医药
3,肖欣荣, 陈文彬, 程德云. 慢性缺氧抑制肺动脉平滑肌细胞钾通道活性. 中华结核和呼吸杂志, 1998, 21: 681-685.
4,Smirnov SV, Robertson TP, Ward JP, et al. Chronic hypoxia is associated with reduced delayed rectifier K+ current in rat pulmonary artery muscle cells. Am J Physiol, 1994, 266(1 Pt 2):H365-370.
5,Yuan XJ, Goldman WF, Tod ML, et al. Hypoxia reduces potassium currents in cultured rat pulmonary but not mesenteric arterial myocytes. Am J Physiol, 1993, 264(2 Pt 1): L116-123.
(收稿日期:1999-10-09), http://www.100md.com
单位:610041 成都,华西医科大学附属第一医院呼吸内科
关键词:
中华内科杂志000615 本研究拟通过观察钾通道基因表达的变化,阐明低氧性肺动脉高压(HPH)肺血管重建的形成机制及其在HPH发病中的作用。
一、材料与方法
1.雄性Wistar大鼠20只,体重250~300 g。随机分为低氧组和对照组,每组10只。将低氧组大鼠置于有机玻璃舱内,以氮气调控舱内的氧浓度为(10.0±0.5)%。舱内CO2由钠石灰吸收,水蒸气由硅胶吸收,每日低氧8h,连续3周。对照组置于同一实验室内。
2.腹腔内注射50 mg/kg戊巴比妥钠麻醉。以插入导管法测定肺循环血流动力学,暴露右侧颈外静脉,插入硅胶管经右心房、右心室至肺动脉,导管另一端接压力传感器(TP-200T),经多导生理仪RM-6000(Nihn Kohden)记录平均肺动脉压(mPAP)及计算肺血管阻力(PVR)。血流动力学测定后,即刻取出大鼠心脏,剪去心房组织,沿室间隔边缘分离出右心室(RV)和左心室(LV)加室间隔(S)。以RV与LV加S重量比值[RV/(LV+S)]作为右心室肥厚的指标。
, 百拇医药
3.大鼠肺组织标本于10%中性甲醛缓冲液中固定,石蜡包埋,切片,用于常规HE染色和组织原位杂交。
4.将分别带有人钾离子通道基因RAK(Mayo基金会Claphan教授惠赠)、GIRK1(加州理工技术研究所Davidson教授惠赠)及HH-IRK1(加州大学Vandenberg教授惠赠)cDNA片断的3种质粒,全长分别为1.3 kb、1346 kb及1.3 kb,用于cRNA探针的制备。各质粒DNA分别经转化JM109,扩增,小量提取,电泳酶切鉴定后,进行大量制备各质粒DNA。各质粒DNA分别用EcoRⅠ和XhoⅠ酶切成线状,用Promega公司DNA clean Up 回收,采用DIG-UTP(DIG RNA标记试剂盒,Bochringer mannhein,BM公司产品)标记RNA探针,按说明书分别加入Sp6、T31和T7 RNA聚合酶进行标记反应,反应完毕后取少量标记的cRNA产物进行鉴定。
, http://www.100md.com
5.各种cRNA探针使用前均采用超声波方法处理,使其片断大约为500~700 bp。杂交后染色,封片。阴性对照的肺组织切片在杂交过程中不用标记探针,其余步骤同杂交。
6.在Nikon倒置显微镜下观察原位杂交组织切片,着蓝色者为阳性。每张切片选择8~10条与呼吸性细支气管相伴行的肺小动脉,用QTM970型图像分析仪(英国剑桥仪器公司)进行灰度扫描,计算出均数,作为该只大鼠的肺小动脉壁灰度,以阴性对照切片的肺小血管壁灰度为1,判定两组大鼠肺小血管壁钾通道基因表达的相对强度。
7.统计学方法:两组间数据的比较采用t检验。
二、结果
1.低氧对大鼠肺循环及右心室的影响:见表1。
表1 低氧对大鼠肺循环及右心室的影响(
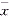 ±s) 组别
±s) 组别, http://www.100md.com
鼠数
(只)
mPAP
(mm Hg)
PVR
(mm Hg.s-1.L-1)
RV/(LV+S)
对照组
10
16.58±2.03
21 690.0±2 362.5
, 百拇医药 0.261±0.052
低氧组
10
29.70±3.15*
52 177.5±5 280.0*
0.357±0.045*
注:1 mm Hg=0.133 kPa 与对照组比较,* P<0.01
2. 肺组织HE染色显示,低氧组大鼠肺小动脉管壁增厚,管腔狭窄,呈现显著的肺血管重建现象。肺组织原位杂交结果显示,对照组大鼠肺动脉平滑肌细胞(SMCs)对RAK、GIRK1及HH-IRK1的cRNA探针出现强阳性反应,而低氧组大鼠肺动脉平滑肌细胞上,RAK、GIRK1及HH-IRK1的表达均明显减弱,见图1,2。阴性对照的肺组织切片,未见阳性染色。


, http://www.100md.com
图1 对照组大鼠肺小动脉平滑肌细胞上延迟整流性钾通道基因的表达
1a RAK基因表达 1b GIRK1基因表达 1c HH-IRK1基因表达
图2 低氧组大鼠肺小动脉壁增生肥厚,延迟整流性钾通道基因
在肺动脉平滑肌细胞上的表达明显减弱
1b RAK基因表达 1b GIRK1基因表达 1c HH-IRK1基因表达 均为原位杂交 ×400
3.低氧对大鼠肺小动脉壁各种基因表达强度的影响:见表2。
表2 低氧对大鼠肺小动脉壁RAK、GIRK1和
, 百拇医药
HH-IRK1基因表达强度的影响(
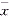 ±s) 组别
±s) 组别鼠数(只)
RAK
GIRK1
HH-IRK1
对照组
10
2.63±0.18
2.94±0.69
2.52±0.36
, 百拇医药
低氧组
10
1.45±0.55*
1.61±0.37*
1.52±0.63*
注:表达强度为阴性对照切片灰度的倍数 与对照组比较,* P<0.01
讨论 目前认为,低氧性肺血管收缩和肺血管重建是慢性HPH发生的主要机制,在这些机制中,影响血管舒缩的诸多体液因子和SMCs膜离子通道活性的改变尤为人们所重视。然而,近代研究表明,许多体液因子在低氧性肺血管收缩中虽然发挥了一定的作用,但这些因子的拮抗剂却不能完全抑制或逆转低氧所致的肺血管重建[1]。因此,肺动脉SMCs膜离子通道活性的改变在HPH发病中的作用,引起了人们极大的关注。低氧引起肺血管的收缩反应并非完全依赖于血管内皮细胞,在很大程度上直接由血管SMCs内在的电生理活动所介导。最近我们的研究发现[2,3],急、慢性缺氧均可阻断肺血管SMCs钾通道活性,导致细胞膜去极化,继而开放电压门控钙通道,使细胞内钙水平增高,引起兴奋-收缩-耦联增强,最终发生肺动脉收缩和肺动脉高压。此外,慢性低氧还可使肺血管SMCs表型发生变化和钾通道基因如延迟整流性钾通道基因RAK等表达减少,从而引起肺动脉SMCs延迟整流性钾电流的振幅降低、开放概率减少、开放时间缩短、关闭时间延长和该通道的数目下降,并促使血管SMCs增殖和内皮细胞迁移,并发生肺血管重建[4]。由此可见,低氧所致的肺动脉 SMCs钾通道活性降低和钾通道基因表达减少,在HPH发病机制中发挥重要作用。
, http://www.100md.com
Smirnov等[4]发现,慢性低氧4周可引起肺动脉高压大鼠肺动脉平滑肌细胞延迟整流性钾通道的振幅明显降低,且在停止低氧后仍可维持6h以上。认为这种延迟整流性钾离子通道活性的降低、开放概率减少、关闭时间延长,与慢性低氧所致的该离子通道基因表达减少,促进血管平滑肌增生或向动脉内膜迁移,引起肺动脉血管重建有关。Yuan等[5]发现,急性低氧[动脉血氧分压<74 mm Hg(1 mm Hg=0.133 kPa)]可显著抑制大鼠肺动脉平滑肌电压门控性钾通道的外向性钾电流,认为低氧抑制肺动脉平滑肌细胞膜电压门控性钾通道,开放电压门控性钙通道,促进Ca2+进入细胞内,最后导致肺血管收缩反应。我们最近的研究发现[3,4],急、慢性低氧均可使大鼠肺动脉平滑肌细胞上一种4-氨基吡啶敏感的钾通道活性降低,其电生理和药理学特性表明,该通道属延迟整流性钾通道,与Smirnov等[1]的实验结果相符合,亦与Yuan等所观察到的电压门控性钾通道的改变相一致。提示延迟整流性钾通道电流振幅的降低、活性的减弱和肺血管重建,与慢性低氧所致的肺动脉SMCs表型的变化,钾通道基因表达减少有关。
, 百拇医药
本研究的RAK、GIRK1及HH-IRK1均为近年来相继被克隆的延迟整流性钾通道基因,在本研究中均发现这些钾通道基因在正常大鼠肺动脉平滑肌细胞上表达正常,而在HPH大鼠肺动脉SMCs上的表达则降低,可能与低氧导致肺动脉SMCs钾通道活性下降和引起低氧性肺血管收缩,继而发生肺血管重建有关。表明钾离子通道基因表达的减少在慢性HPH发病中发挥重要作用。
(本文图1,2见插页图第11页)
基金项目:国家“九五”科技攻关专题基金资助项目(96-906-02-17);纽约中华医学基金部分资助项目
参考文献
1,陈文彬. 加强对低氧性肺动脉高压肺动脉平滑肌细胞钾通道活性的研究. 中华内科杂志, 1997, 36: 5-6.
2,肖欣荣, 陈文彬, 程德云. 急性缺氧抑制大鼠肺动脉平滑肌细胞钙ATP钾通道. 中华结核和呼吸杂志, 1998, 21: 415-419.
, 百拇医药
3,肖欣荣, 陈文彬, 程德云. 慢性缺氧抑制肺动脉平滑肌细胞钾通道活性. 中华结核和呼吸杂志, 1998, 21: 681-685.
4,Smirnov SV, Robertson TP, Ward JP, et al. Chronic hypoxia is associated with reduced delayed rectifier K+ current in rat pulmonary artery muscle cells. Am J Physiol, 1994, 266(1 Pt 2):H365-370.
5,Yuan XJ, Goldman WF, Tod ML, et al. Hypoxia reduces potassium currents in cultured rat pulmonary but not mesenteric arterial myocytes. Am J Physiol, 1993, 264(2 Pt 1): L116-123.
(收稿日期:1999-10-09), http://www.100md.com