谷氨酸脱羧酶可诱导非肥胖糖尿病小鼠免疫耐受
作者:刘芳 俞茂华 朱秋毓 周俊淇 杨秀芳 周江华 朱禧星
单位:俞茂华 朱秋毓 周俊淇 杨秀芳 周江华 朱禧星(上海医科大学附属华山医院内分泌科 200040);刘芳(现在上海市第五人民医院内分泌科,200240)
关键词:谷氨酸脱羧酶;非肥胖型糖尿病小鼠;免疫耐受
中华内科杂志000811 【摘要】 目的 了解猪脑谷氨酸脱羧酶(GAD)是否能预防非肥胖糖尿病(NOD)小鼠的Ⅰ型糖尿病和影响其胰腺自身GAD65表达。方法 将GAD 50 μg 与不完全弗氏佐剂(FIA)50 μl混合后给32只4周龄NOD雌性小鼠腹腔注射,同时19只单独注射FIA作为对照。每周测定体重、血糖,20周龄时处死小鼠,观察其病理、血清C肽和GAD抗体,并用逆转录PCR技术进行胰岛GAD65表达半定量。结果 20周龄时,GAD组小鼠的糖尿病总发病率(6.25%)明显低于FIA组(73.68%),P<0.01,平均发病时间也晚;炎症分数明显降低(0.083±0.011vs 0.692±0.054),炎症程度也明显减轻。GAD组的血清C肽水平(2.41±0.39)μg/L高于FIA组(1.19±1.22) μg/L,但两组间GAD抗体阳性率差异无显著。GAD注射后胰腺GAD65 mRNA表达水平明显高于FIA组。结论 GAD可预防NOD小鼠胰岛炎和糖尿病的发生,其机制可能与使胰岛GAD65表达增加诱导免疫耐受有关。
, 百拇医药
Glutamic acid decarboxylase may protect type Ⅰ diabetes in non-obese diabetic mice through inducing immune tolerance
LIU Fang YU Maohua ZHU Qiuyu et al
(Department of Endocrinology, Shanghai The Fifth People′s Hospital,Shanghai 200240, China)
【Abstract】 Objective To study whether glutamic acid decarboxylase(GAD) purified from pig brain can prevent type Ⅰ diabetes in non-obese diabetic(NOD) mice and influence the expression of GAD65 in islets. Methods GAD 50 μg mixed with Freund incomplete adjuvents(FIA) 50 μl was injected intreperitoneally(ip) into 32 NOD female mice at 4 weeks old, FIA was injected alone to 19 mice as control. All mice had blood glucose and body weight measured weekly. One single injection of cyclophosphamide(CY) was given to accelerate the diabetes at 8 weeks old. After death of the mice at 20 weeks old, the levels of C- peptide and autoantibodies to GAD were detected and the pancreatic histopathology was observed too. The expression of GAD65 mRNA was measured using reverse transcriptase(RT)-PCR technique. Results (1)GAD reduced the total incidence of type Ⅰ diabetes to 6.25% as compared with the FIA group(73.68%,P<0.01) and delayed its onset time(4 weeks vs 1.5 weeks after CY acceleration).(2)The insulitis score and the severity of insulitis in GAD mice were lower than that of the FIA group(P<0.05).(3) The C- peptide levels were higher significantly in GAD group as compared with the FIA group(P<0.05),but the prevalence of GAD antibody was no significantly different between the two groups.(4)The levels of expressing products in islets of GAD mice (1.616±0.146) were much higher than those of FIA mice(1.226±0.018,P<0.05). Conclusion GAD protected the NOD female mice from getting diabetes and insulitis. Its mechanism may be related to induction of immune tolerance by increasing the GAD65 expression in islets.
, 百拇医药
【Key words】 Glutamate decarboxylase; Non-obese diabetic mice; Immune tolerance
Ⅰ型糖尿病(DM)是一种针对胰岛β细胞的自身免疫性疾病,其发病前血清中常伴有自身抗体出现,如胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GAD-Ab)等[1]。GAD-Ab在DM发病前10余年即可检测出[2],其测定可早期筛查Ⅰ型DM高危人群。这为在发病前采取措施干预自身免疫反应预防DM提供了机会。非肥胖糖尿病(NOD)小鼠是一种模拟人类自发性Ⅰ型DM的动物模型[3]。近3年国外已有人进行应用GAD预防Ⅰ型DM的尝试,表明重组人GAD65、GAD67或其活性肽段对NOD小鼠的Ⅰ型DM有一定的预防或延缓发病作用[3-5]。但目前尚不清楚其作用机制。本研究拟应用猪脑GAD早期免疫NOD雌性小鼠,了解其是否具有预防胰岛炎和糖尿病发生的作用,并通过其对胰腺自身GAD65表达的影响,探讨可能的作用机制。
, 百拇医药
材料与方法
一、 材料
1.动物:为NOD/Lt种小鼠。种鼠购自中国科学院实验动物研究所。在标准环境条件下饲养,繁殖出第一代,取雌性小鼠用于实验。
2.试剂:GAD由本实验室自行从猪脑提纯[6],为含GAD65和GAD67的混合液,用时稀释至1 μg/μl;不完全弗氏佐剂(FIA)为Sigma公司产品。其余试剂均为A.R.规格。
二、 实验方法
1.小鼠的分组与处理:小鼠4周龄时,选体重 >10g的雌性小鼠经随机编号后分2组用药:(1) FIA组:19例,生理盐水50 μl 与FIA 50 μl混匀后一次性腹腔注射(ip);(2) GAD组:32例,GAD 50 μg与FIA 50 μl混匀后ip;两组皆于鼠龄8周时腹腔注射环磷酰胺250 mg/kg 1次,以加速糖尿病;从4周龄开始,每周测定小鼠体重、血糖,确诊糖尿病2周或鼠龄20周时处死小鼠;死前取全血,4℃、5 000×g离心10min后血清置-20℃保存备用;死后立即取胰腺做以下处理:(1)置苦味酸-多聚甲醛固定液固定24h,洗涤数次后80%乙醇保存,备做病理检查;(2)铝箔包裹后投液氮罐,备做PCR。
, 百拇医药
2.观察指标测定:用快速血糖仪测定尾静脉血血糖,以血糖 ≥13.3mmol/L且持续1周以上诊为DM。C肽Kit购自天津DPC公司,RIA法测定。GAD-Ab Kit购自美国Biomerica公司,取血清100 μl,用ELISA法测定,结果以<1.00为阴性;1.00~1.05之间为可疑阳性;>1.05则为阳性。
3.胰岛病理学观察:胰腺统一经石蜡包埋,透明后切片,常规HE染色。由3位病理专业人员盲法读片,分别计数5只小鼠的胰小岛数目,并进行胰岛炎分级计数。胰岛炎指数评价:每只鼠胰腺在镜下随机计数5~10个胰岛分值, 无胰岛炎,为0;50%有炎症为0.50; 100%有炎症为1[5,6]。分级标准:仅有胰岛周围淋巴细胞浸润为一级(即胰周围炎);浸润至胰岛内,但浸润程度<50%者为二级;浸润程度>50%者为三级[4,5]。
4.胰岛β细胞GAD65 mRNA表达:
, 百拇医药
(1)抽提总RNA(tRNA):采用GIBCOBRL公司生产的TRIZOL提取液,提取tRNA,提出后稀释在DEPC-水100 μl中, -70℃保存。
(2) tRNA纯度鉴定:①分别在260 nm和280 nm波长下测定吸光度(A)值,A260/A280在1.8~2.0之间为纯净;②经MOPS变性凝胶电泳,显示较深的18 s和28 s rRNA条带,提示RNA未降解。符合两项条件者用于下一步实验。
(3)逆转录PCR(RT-PCR):采用Pharmacia Biotech公司的RT-PCR Kit,按其说明顺序依次加样:①首股cDNA合成:待反应管置冰上,依次加入Oligo pd(T)12-18 primer 0.5 μg,样本tRNA 2 μg,目的基因引物 25 pmol,再加0.1% DEPC-水至50 μl,让其与反应管中原有M-MuLV逆转录酶混匀后,42℃水浴、温育45 min。然后98℃、10 min灭活逆转录酶,终止反应。②PCR:所用扩增各目的基因的引物序列引自文献[7,9], 小鼠GAD65:i.5′AGCACACAAATGTC-TGCTTCTG 3′,ii. 5′ATGTCTTGGTGAGTTGCTGCAG 3′; β-actin:i. 5′TAAAGACCTCTATGCCAACAGT 3′,ii. 5′CACGATGGAGGGGCCCGGACTATC 3′;其特异性经著者证实。各反映管依次加样后,在基因扩增仪上将同一逆转录产物分别进行GAD65及β-actin PCR,β-actin作为所有样本的阳性内标。总反应体积50 μl。上加石蜡油50 μl覆盖后,按下列参数进行反应: GAD65:95℃变性5 min;而后95℃、60s,50℃、60s,72℃、60s,循环40次;最后72℃延伸10 min。β-actin:95℃变性5 min;而后95℃、60s,54℃、60s,72℃、60s,循环25次;最后72℃延伸5 min。将PCR产物置-20℃保存。
, 百拇医药
(4) PCR产物的分析:①琼脂糖凝胶电泳:取各组至少4份样品的PCR产物15 μl,加0.25%溴酚蓝2 μl点样后,上样于2%琼脂糖凝胶(含0.5 mg/L溴化乙锭),1×TAE缓冲液,3~5 V/cm电泳。结束后置紫外灯下拍照,曝光15~30s。根据已知碱基数目的标记物判断目的基因产物。②定量分析与统计:采用SX-100凝胶图像分析系统对凝胶中条带的灰度进行扫描分析,并以内标β-actin的灰度作为内参数,对扩增的DNA进行半定量,将GAD65定量与β-actin定量的比值做统计分析。
三、统计学处理
各指标检测结果均以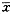 ±s表示,用t检验或样本率的u检验法对结果进行显著性分析。
±s表示,用t检验或样本率的u检验法对结果进行显著性分析。
结果
1. 糖尿病发病率:在20周的观察期内,GAD组小鼠总发病率6.25%(2/32),比相应的FIA组发病率(73.68%,14/19)显著降低(P<0.01);GAD组的平均发病时间为12周(环磷酰胺注射后4周),也比对照组(环磷酰胺注射后1.5周)晚(P<0.05);各组小鼠随着观察期的延长DM累积出现率变化见图1。
, http://www.100md.com
图1 GAD组和FIA组小鼠糖尿病累积发病率变化
2. 胰岛炎:胰腺病理结果显示,雌性NOD小鼠4周龄时开始有胰岛淋巴细胞浸润;20周时,FIA组胰岛数目明显减少[(3.13±1.8)个/只小鼠],残存胰岛的炎症分数(0.692±0.054)高,且(87.4±15.4)%为二、三级胰岛炎;而GAD组胰岛数目[(8.96±2.53)个/只小鼠]明显多于FIA组(P<0.05),胰岛炎症分数低(0.083±0.011,P<0.05),且炎症胰岛中(95.7±3.6)%为胰周围炎,仅(4.2±2.7)%为二级;无达到三级者(图2~5)。
3.血清C肽水平和GAD-Ab测定结果:鼠龄20周时,GAD组的C肽水平明显高于对照组(表1),说明β细胞的分泌功能得到保护。GAD组和FIA组皆可检测出低水平的GAD-Ab,但二者的抗体水平及阳性率差异无显著性(P>0.05)。说明腹腔内注入外源性GAD不会引起机体高水平的GAD-Ab产生。
, 百拇医药
表1 两组血清C肽和GAD-Ab阳性率比较(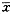 ±s) 组别
±s) 组别
例数
C肽(μg/L)
GAD-Ab阳性率(%)
FIA组
16
1.19±1.22
18.75
GAD组
14
2.41±0.93
, http://www.100md.com
14.28
P值
0.038
0.269
4.早期应用GAD对胰岛β细胞GAD65 mRNA表达的影响: 用RT-PCR方法对胰岛GAD65进行半定量扩增的结果显示,雌性NOD小鼠在4周龄时胰岛即有低水平(0.894±0.101)的GAD65 mRNA表达,20周时GAD组的GAD65 mRNA水平(1.616±0.146)明显高于FIA组(1.226±0.018, P<0.05),见图6。
M: Marker;1、2: 4周组; 3、4: FIA组; 5、6: GAD组
图6 各组GAD65 RT-PCR产物的2%琼脂糖凝胶电泳结果
, http://www.100md.com
讨论
本研究结果表明,给予生后4周的雌性NOD小鼠腹腔注射纯化猪脑GAD(包含GAD65和GAD67两种分子形式),在观察期内,可保护绝大多数(90%以上)小鼠不发展为糖尿病,β细胞分泌C肽的功能保持正常,且胰岛炎症程度显著减轻;而单独注入FIA则对糖尿病发病率无明显影响。胰岛病理学结果显示GAD组小鼠的胰岛数目保存较好,且炎症被局限在胰周;而对照组胰岛绝对数目减少,炎症出现率100%,其中80%以上为二三级胰岛炎。这与国外报道一致[4]。提示早期应用GAD可预防NOD小鼠Ⅰ型糖尿病的发病,防止胰岛炎等自身免疫现象发生。
人类新发病的Ⅰ型糖尿病患者中,70%可检测到GAD-Ab和T细胞增生的反应[2,8],针对胰岛GAD的反应最早可在疾病临床发病前几年甚至十几年出现[2],提示此自身抗原在糖尿病发生的早期阶段起关键作用。然而,目前尚不清楚对GAD的免疫反应是β细胞破坏的原因还是结果,本研究的结果提示,早期给予猪脑GAD几乎可完全中止针对胰岛的细胞免疫反应,反过来提示针对胰岛GAD的自身免疫反应在NOD小鼠DM早期的发生发展中可能起启动作用。因此,用不同种类和来源的GAD预先对NOD小鼠免疫,具有预防或延缓其糖尿病发病的作用,而用其他β细胞抗原如ICA512(IA-2)早期注入却无此保护作用[3] ,提示GAD是参与NOD小鼠糖尿病早期发病机制的一个关键靶抗原。但另一方面,机体也可能耐受不了外源性GAD注入,反而诱使糖尿病发生或加重,国外曾有人观察到这样的结果[8]。然而多数资料认为,应用GAD或GAD肽段不会使机体针对β细胞GAD抗原的反应加强,因为血中并未出现相应的抗体[9]。本研究也发现20周龄时对照组NOD小鼠血中GAD-Ab阳性率为18.75%,而GAD组注射GAD 50 μg后同样的时间GAD-Ab阳性率(14.28%)并无增加。这提示用腹腔注射法给NOD小鼠注入该剂量的猪脑GAD不会使小鼠自身的体液免疫反应加重而诱发糖尿病。
, http://www.100md.com
由于目前尚未弄清楚NOD小鼠胰岛GAD抗原的抗原活性能力强弱,而胰岛GAD表达水平可影响自身免疫进程,故本实验进一步用RT-PCR技术检测了应用GAD后胰岛β细胞GAD65的表达变化。结果发现, 4周龄的雌性NOD小鼠胰岛即有低水平的GAD65表达,与对照组相比,GAD注射组20周龄时的平均GAD65 mRNA水平增高。国外报道雌性NOD/Lt小鼠胰岛GAD65抗原的表达从5~15周龄逐渐增加,且表明GAD表达增多引起胰岛炎加重[10],但本研究观察到GAD65 表达增加的同时并无胰岛炎加重及T细胞参与的细胞免疫反应增强和GAD-Ab产生增多,可能提示如果没有Th细胞介导的细胞免疫的参与,仅GAD抗原表达增加并不能诱发或加剧针对表达该抗原的细胞(β细胞)的免疫反应而导致细胞破坏;或可能因为虽然外源性GAD升调节β细胞GAD65表达,但此时胰岛局部不存在适宜的共同刺激因子(如干扰素γ等),使抗原特异性T细胞对此抗原的决定簇脱敏或使抗原决定簇丢失,从而机体对其产生免疫耐受状态;国外也有人发现GAD等自身抗原表达的增多可引起以向Th2细胞为主的T细胞偏倚反应[6]。抗原表达水平过低,反而可能引起免疫系统对其产生异常反应,尤其是在机体缺乏外周淋巴细胞对该抗原的自我耐受情况下,因为国外研究证实,抗原只有表达到一定浓度时机体才会产生自我免疫耐受[10]。故注入外源性GAD使自身GAD表达增加可能是诱导自我耐受的机制之一。
, 百拇医药
图2 FIA组12周龄时的小鼠胰岛,炎症已侵及胰岛的50%,内部β细胞减少,且有空泡样变 HE
×20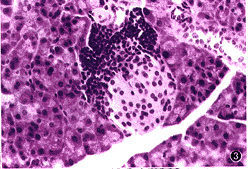
图3 FIA组20周龄的未发病小鼠胰岛,淋巴细胞浸润已达胰岛的40%以上,胰内内分泌细胞
部分破坏 HE ×40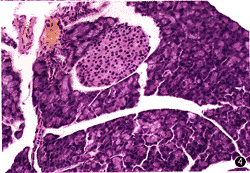
图4 GAD组20周龄,胰岛结构完整,周围及内部β细胞完好 HE×20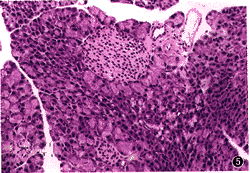
图5 GAD组20周龄,显示2个胰岛,仅有胰周围炎,内部均无淋巴细胞浸润 HE ×20
, 百拇医药
参考文献
1,Atkinson MA, Maclaren NK. The pathogenesis of insulin-dependent diabetes mellitus. N Engl J Med, 1994, 331:1428-1436.
2,Bingley PJ, Bonifacio E, Williams AJ, et al. Prediction of IDDM in the general population: strategies based on combinations of autoantibody markers. Diabetes,1997,46:1701-1710.
3,Ramiya VK, Lan MS, Wasserfall CH, et al. Immunization therapies in the prevention of diabetes. J Autoimmun,1997,10:287-292.
, 百拇医药
4,Pleau JM, Fernandez-Saravia F, Esling A, et al. Prevention of autoimmune diabetes in nonobese diabetic mice by treatment with recombinant glutamic acid decarboxylase(GAD65). Clin Immunol Immunopathol, 1997,6:90-95.
5,Tian J, Atkinson MA, Clare-Salzler M, et al. Nasal ad ministration of glutamate decarboxylase(GAD65) peptides induces Th2 responses and prevents murine insulin-dependent diabetes. J Exp Med, 1996,183:1561-1567.
, 百拇医药 6,刘芳,朱秋毓,俞茂华,等. 猪脑GAD的提取和纯化. 上海医科大学学报,1997, 24:465-467.
7,Pleau JM, Throsby M, Esling A, et al. Ontogeny of glutamic acid decarboxylase ene expression in the mouse pancreas. Biochem Biophys Res Commun, 1997,233:227-230.
8,Ma SW, Rivereau A, Roland T, et al. Transgenic plants expressing autoantigens feed to mice to induce oral immune tolerance. Nat Med, 1997,3:793-798.
9,Plesner A, Worsaae A, Dyrberg T, et al. Immunization of diabetes-prone or non-diabetes-prone mice with GAD65 does not induce diabetes or islet cell pathology. J Autoimmun, 1998,11:335-341.
10,Pleau JM, Esling A, Bach JF, et al. Gene expression of pancreatic glutamic acid decarboxylase in the nonobese diabetic mouse. Biochem Biophys Res Commun, 1996,220:399-404.
(收稿日期:1999-08-10), 百拇医药
单位:俞茂华 朱秋毓 周俊淇 杨秀芳 周江华 朱禧星(上海医科大学附属华山医院内分泌科 200040);刘芳(现在上海市第五人民医院内分泌科,200240)
关键词:谷氨酸脱羧酶;非肥胖型糖尿病小鼠;免疫耐受
中华内科杂志000811 【摘要】 目的 了解猪脑谷氨酸脱羧酶(GAD)是否能预防非肥胖糖尿病(NOD)小鼠的Ⅰ型糖尿病和影响其胰腺自身GAD65表达。方法 将GAD 50 μg 与不完全弗氏佐剂(FIA)50 μl混合后给32只4周龄NOD雌性小鼠腹腔注射,同时19只单独注射FIA作为对照。每周测定体重、血糖,20周龄时处死小鼠,观察其病理、血清C肽和GAD抗体,并用逆转录PCR技术进行胰岛GAD65表达半定量。结果 20周龄时,GAD组小鼠的糖尿病总发病率(6.25%)明显低于FIA组(73.68%),P<0.01,平均发病时间也晚;炎症分数明显降低(0.083±0.011vs 0.692±0.054),炎症程度也明显减轻。GAD组的血清C肽水平(2.41±0.39)μg/L高于FIA组(1.19±1.22) μg/L,但两组间GAD抗体阳性率差异无显著。GAD注射后胰腺GAD65 mRNA表达水平明显高于FIA组。结论 GAD可预防NOD小鼠胰岛炎和糖尿病的发生,其机制可能与使胰岛GAD65表达增加诱导免疫耐受有关。
, 百拇医药
Glutamic acid decarboxylase may protect type Ⅰ diabetes in non-obese diabetic mice through inducing immune tolerance
LIU Fang YU Maohua ZHU Qiuyu et al
(Department of Endocrinology, Shanghai The Fifth People′s Hospital,Shanghai 200240, China)
【Abstract】 Objective To study whether glutamic acid decarboxylase(GAD) purified from pig brain can prevent type Ⅰ diabetes in non-obese diabetic(NOD) mice and influence the expression of GAD65 in islets. Methods GAD 50 μg mixed with Freund incomplete adjuvents(FIA) 50 μl was injected intreperitoneally(ip) into 32 NOD female mice at 4 weeks old, FIA was injected alone to 19 mice as control. All mice had blood glucose and body weight measured weekly. One single injection of cyclophosphamide(CY) was given to accelerate the diabetes at 8 weeks old. After death of the mice at 20 weeks old, the levels of C- peptide and autoantibodies to GAD were detected and the pancreatic histopathology was observed too. The expression of GAD65 mRNA was measured using reverse transcriptase(RT)-PCR technique. Results (1)GAD reduced the total incidence of type Ⅰ diabetes to 6.25% as compared with the FIA group(73.68%,P<0.01) and delayed its onset time(4 weeks vs 1.5 weeks after CY acceleration).(2)The insulitis score and the severity of insulitis in GAD mice were lower than that of the FIA group(P<0.05).(3) The C- peptide levels were higher significantly in GAD group as compared with the FIA group(P<0.05),but the prevalence of GAD antibody was no significantly different between the two groups.(4)The levels of expressing products in islets of GAD mice (1.616±0.146) were much higher than those of FIA mice(1.226±0.018,P<0.05). Conclusion GAD protected the NOD female mice from getting diabetes and insulitis. Its mechanism may be related to induction of immune tolerance by increasing the GAD65 expression in islets.
, 百拇医药
【Key words】 Glutamate decarboxylase; Non-obese diabetic mice; Immune tolerance
Ⅰ型糖尿病(DM)是一种针对胰岛β细胞的自身免疫性疾病,其发病前血清中常伴有自身抗体出现,如胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GAD-Ab)等[1]。GAD-Ab在DM发病前10余年即可检测出[2],其测定可早期筛查Ⅰ型DM高危人群。这为在发病前采取措施干预自身免疫反应预防DM提供了机会。非肥胖糖尿病(NOD)小鼠是一种模拟人类自发性Ⅰ型DM的动物模型[3]。近3年国外已有人进行应用GAD预防Ⅰ型DM的尝试,表明重组人GAD65、GAD67或其活性肽段对NOD小鼠的Ⅰ型DM有一定的预防或延缓发病作用[3-5]。但目前尚不清楚其作用机制。本研究拟应用猪脑GAD早期免疫NOD雌性小鼠,了解其是否具有预防胰岛炎和糖尿病发生的作用,并通过其对胰腺自身GAD65表达的影响,探讨可能的作用机制。
, 百拇医药
材料与方法
一、 材料
1.动物:为NOD/Lt种小鼠。种鼠购自中国科学院实验动物研究所。在标准环境条件下饲养,繁殖出第一代,取雌性小鼠用于实验。
2.试剂:GAD由本实验室自行从猪脑提纯[6],为含GAD65和GAD67的混合液,用时稀释至1 μg/μl;不完全弗氏佐剂(FIA)为Sigma公司产品。其余试剂均为A.R.规格。
二、 实验方法
1.小鼠的分组与处理:小鼠4周龄时,选体重 >10g的雌性小鼠经随机编号后分2组用药:(1) FIA组:19例,生理盐水50 μl 与FIA 50 μl混匀后一次性腹腔注射(ip);(2) GAD组:32例,GAD 50 μg与FIA 50 μl混匀后ip;两组皆于鼠龄8周时腹腔注射环磷酰胺250 mg/kg 1次,以加速糖尿病;从4周龄开始,每周测定小鼠体重、血糖,确诊糖尿病2周或鼠龄20周时处死小鼠;死前取全血,4℃、5 000×g离心10min后血清置-20℃保存备用;死后立即取胰腺做以下处理:(1)置苦味酸-多聚甲醛固定液固定24h,洗涤数次后80%乙醇保存,备做病理检查;(2)铝箔包裹后投液氮罐,备做PCR。
, 百拇医药
2.观察指标测定:用快速血糖仪测定尾静脉血血糖,以血糖 ≥13.3mmol/L且持续1周以上诊为DM。C肽Kit购自天津DPC公司,RIA法测定。GAD-Ab Kit购自美国Biomerica公司,取血清100 μl,用ELISA法测定,结果以<1.00为阴性;1.00~1.05之间为可疑阳性;>1.05则为阳性。
3.胰岛病理学观察:胰腺统一经石蜡包埋,透明后切片,常规HE染色。由3位病理专业人员盲法读片,分别计数5只小鼠的胰小岛数目,并进行胰岛炎分级计数。胰岛炎指数评价:每只鼠胰腺在镜下随机计数5~10个胰岛分值, 无胰岛炎,为0;50%有炎症为0.50; 100%有炎症为1[5,6]。分级标准:仅有胰岛周围淋巴细胞浸润为一级(即胰周围炎);浸润至胰岛内,但浸润程度<50%者为二级;浸润程度>50%者为三级[4,5]。
4.胰岛β细胞GAD65 mRNA表达:
, 百拇医药
(1)抽提总RNA(tRNA):采用GIBCOBRL公司生产的TRIZOL提取液,提取tRNA,提出后稀释在DEPC-水100 μl中, -70℃保存。
(2) tRNA纯度鉴定:①分别在260 nm和280 nm波长下测定吸光度(A)值,A260/A280在1.8~2.0之间为纯净;②经MOPS变性凝胶电泳,显示较深的18 s和28 s rRNA条带,提示RNA未降解。符合两项条件者用于下一步实验。
(3)逆转录PCR(RT-PCR):采用Pharmacia Biotech公司的RT-PCR Kit,按其说明顺序依次加样:①首股cDNA合成:待反应管置冰上,依次加入Oligo pd(T)12-18 primer 0.5 μg,样本tRNA 2 μg,目的基因引物 25 pmol,再加0.1% DEPC-水至50 μl,让其与反应管中原有M-MuLV逆转录酶混匀后,42℃水浴、温育45 min。然后98℃、10 min灭活逆转录酶,终止反应。②PCR:所用扩增各目的基因的引物序列引自文献[7,9], 小鼠GAD65:i.5′AGCACACAAATGTC-TGCTTCTG 3′,ii. 5′ATGTCTTGGTGAGTTGCTGCAG 3′; β-actin:i. 5′TAAAGACCTCTATGCCAACAGT 3′,ii. 5′CACGATGGAGGGGCCCGGACTATC 3′;其特异性经著者证实。各反映管依次加样后,在基因扩增仪上将同一逆转录产物分别进行GAD65及β-actin PCR,β-actin作为所有样本的阳性内标。总反应体积50 μl。上加石蜡油50 μl覆盖后,按下列参数进行反应: GAD65:95℃变性5 min;而后95℃、60s,50℃、60s,72℃、60s,循环40次;最后72℃延伸10 min。β-actin:95℃变性5 min;而后95℃、60s,54℃、60s,72℃、60s,循环25次;最后72℃延伸5 min。将PCR产物置-20℃保存。
, 百拇医药
(4) PCR产物的分析:①琼脂糖凝胶电泳:取各组至少4份样品的PCR产物15 μl,加0.25%溴酚蓝2 μl点样后,上样于2%琼脂糖凝胶(含0.5 mg/L溴化乙锭),1×TAE缓冲液,3~5 V/cm电泳。结束后置紫外灯下拍照,曝光15~30s。根据已知碱基数目的标记物判断目的基因产物。②定量分析与统计:采用SX-100凝胶图像分析系统对凝胶中条带的灰度进行扫描分析,并以内标β-actin的灰度作为内参数,对扩增的DNA进行半定量,将GAD65定量与β-actin定量的比值做统计分析。
三、统计学处理
各指标检测结果均以
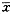 ±s表示,用t检验或样本率的u检验法对结果进行显著性分析。
±s表示,用t检验或样本率的u检验法对结果进行显著性分析。结果
1. 糖尿病发病率:在20周的观察期内,GAD组小鼠总发病率6.25%(2/32),比相应的FIA组发病率(73.68%,14/19)显著降低(P<0.01);GAD组的平均发病时间为12周(环磷酰胺注射后4周),也比对照组(环磷酰胺注射后1.5周)晚(P<0.05);各组小鼠随着观察期的延长DM累积出现率变化见图1。

, http://www.100md.com
图1 GAD组和FIA组小鼠糖尿病累积发病率变化
2. 胰岛炎:胰腺病理结果显示,雌性NOD小鼠4周龄时开始有胰岛淋巴细胞浸润;20周时,FIA组胰岛数目明显减少[(3.13±1.8)个/只小鼠],残存胰岛的炎症分数(0.692±0.054)高,且(87.4±15.4)%为二、三级胰岛炎;而GAD组胰岛数目[(8.96±2.53)个/只小鼠]明显多于FIA组(P<0.05),胰岛炎症分数低(0.083±0.011,P<0.05),且炎症胰岛中(95.7±3.6)%为胰周围炎,仅(4.2±2.7)%为二级;无达到三级者(图2~5)。
3.血清C肽水平和GAD-Ab测定结果:鼠龄20周时,GAD组的C肽水平明显高于对照组(表1),说明β细胞的分泌功能得到保护。GAD组和FIA组皆可检测出低水平的GAD-Ab,但二者的抗体水平及阳性率差异无显著性(P>0.05)。说明腹腔内注入外源性GAD不会引起机体高水平的GAD-Ab产生。
, 百拇医药
表1 两组血清C肽和GAD-Ab阳性率比较(
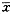 ±s) 组别
±s) 组别例数
C肽(μg/L)
GAD-Ab阳性率(%)
FIA组
16
1.19±1.22
18.75
GAD组
14
2.41±0.93
, http://www.100md.com
14.28
P值
0.038
0.269
4.早期应用GAD对胰岛β细胞GAD65 mRNA表达的影响: 用RT-PCR方法对胰岛GAD65进行半定量扩增的结果显示,雌性NOD小鼠在4周龄时胰岛即有低水平(0.894±0.101)的GAD65 mRNA表达,20周时GAD组的GAD65 mRNA水平(1.616±0.146)明显高于FIA组(1.226±0.018, P<0.05),见图6。

M: Marker;1、2: 4周组; 3、4: FIA组; 5、6: GAD组
图6 各组GAD65 RT-PCR产物的2%琼脂糖凝胶电泳结果
, http://www.100md.com
讨论
本研究结果表明,给予生后4周的雌性NOD小鼠腹腔注射纯化猪脑GAD(包含GAD65和GAD67两种分子形式),在观察期内,可保护绝大多数(90%以上)小鼠不发展为糖尿病,β细胞分泌C肽的功能保持正常,且胰岛炎症程度显著减轻;而单独注入FIA则对糖尿病发病率无明显影响。胰岛病理学结果显示GAD组小鼠的胰岛数目保存较好,且炎症被局限在胰周;而对照组胰岛绝对数目减少,炎症出现率100%,其中80%以上为二三级胰岛炎。这与国外报道一致[4]。提示早期应用GAD可预防NOD小鼠Ⅰ型糖尿病的发病,防止胰岛炎等自身免疫现象发生。
人类新发病的Ⅰ型糖尿病患者中,70%可检测到GAD-Ab和T细胞增生的反应[2,8],针对胰岛GAD的反应最早可在疾病临床发病前几年甚至十几年出现[2],提示此自身抗原在糖尿病发生的早期阶段起关键作用。然而,目前尚不清楚对GAD的免疫反应是β细胞破坏的原因还是结果,本研究的结果提示,早期给予猪脑GAD几乎可完全中止针对胰岛的细胞免疫反应,反过来提示针对胰岛GAD的自身免疫反应在NOD小鼠DM早期的发生发展中可能起启动作用。因此,用不同种类和来源的GAD预先对NOD小鼠免疫,具有预防或延缓其糖尿病发病的作用,而用其他β细胞抗原如ICA512(IA-2)早期注入却无此保护作用[3] ,提示GAD是参与NOD小鼠糖尿病早期发病机制的一个关键靶抗原。但另一方面,机体也可能耐受不了外源性GAD注入,反而诱使糖尿病发生或加重,国外曾有人观察到这样的结果[8]。然而多数资料认为,应用GAD或GAD肽段不会使机体针对β细胞GAD抗原的反应加强,因为血中并未出现相应的抗体[9]。本研究也发现20周龄时对照组NOD小鼠血中GAD-Ab阳性率为18.75%,而GAD组注射GAD 50 μg后同样的时间GAD-Ab阳性率(14.28%)并无增加。这提示用腹腔注射法给NOD小鼠注入该剂量的猪脑GAD不会使小鼠自身的体液免疫反应加重而诱发糖尿病。
, http://www.100md.com
由于目前尚未弄清楚NOD小鼠胰岛GAD抗原的抗原活性能力强弱,而胰岛GAD表达水平可影响自身免疫进程,故本实验进一步用RT-PCR技术检测了应用GAD后胰岛β细胞GAD65的表达变化。结果发现, 4周龄的雌性NOD小鼠胰岛即有低水平的GAD65表达,与对照组相比,GAD注射组20周龄时的平均GAD65 mRNA水平增高。国外报道雌性NOD/Lt小鼠胰岛GAD65抗原的表达从5~15周龄逐渐增加,且表明GAD表达增多引起胰岛炎加重[10],但本研究观察到GAD65 表达增加的同时并无胰岛炎加重及T细胞参与的细胞免疫反应增强和GAD-Ab产生增多,可能提示如果没有Th细胞介导的细胞免疫的参与,仅GAD抗原表达增加并不能诱发或加剧针对表达该抗原的细胞(β细胞)的免疫反应而导致细胞破坏;或可能因为虽然外源性GAD升调节β细胞GAD65表达,但此时胰岛局部不存在适宜的共同刺激因子(如干扰素γ等),使抗原特异性T细胞对此抗原的决定簇脱敏或使抗原决定簇丢失,从而机体对其产生免疫耐受状态;国外也有人发现GAD等自身抗原表达的增多可引起以向Th2细胞为主的T细胞偏倚反应[6]。抗原表达水平过低,反而可能引起免疫系统对其产生异常反应,尤其是在机体缺乏外周淋巴细胞对该抗原的自我耐受情况下,因为国外研究证实,抗原只有表达到一定浓度时机体才会产生自我免疫耐受[10]。故注入外源性GAD使自身GAD表达增加可能是诱导自我耐受的机制之一。

, 百拇医药
图2 FIA组12周龄时的小鼠胰岛,炎症已侵及胰岛的50%,内部β细胞减少,且有空泡样变 HE
×20

图3 FIA组20周龄的未发病小鼠胰岛,淋巴细胞浸润已达胰岛的40%以上,胰内内分泌细胞
部分破坏 HE ×40

图4 GAD组20周龄,胰岛结构完整,周围及内部β细胞完好 HE×20

图5 GAD组20周龄,显示2个胰岛,仅有胰周围炎,内部均无淋巴细胞浸润 HE ×20
, 百拇医药
参考文献
1,Atkinson MA, Maclaren NK. The pathogenesis of insulin-dependent diabetes mellitus. N Engl J Med, 1994, 331:1428-1436.
2,Bingley PJ, Bonifacio E, Williams AJ, et al. Prediction of IDDM in the general population: strategies based on combinations of autoantibody markers. Diabetes,1997,46:1701-1710.
3,Ramiya VK, Lan MS, Wasserfall CH, et al. Immunization therapies in the prevention of diabetes. J Autoimmun,1997,10:287-292.
, 百拇医药
4,Pleau JM, Fernandez-Saravia F, Esling A, et al. Prevention of autoimmune diabetes in nonobese diabetic mice by treatment with recombinant glutamic acid decarboxylase(GAD65). Clin Immunol Immunopathol, 1997,6:90-95.
5,Tian J, Atkinson MA, Clare-Salzler M, et al. Nasal ad ministration of glutamate decarboxylase(GAD65) peptides induces Th2 responses and prevents murine insulin-dependent diabetes. J Exp Med, 1996,183:1561-1567.
, 百拇医药 6,刘芳,朱秋毓,俞茂华,等. 猪脑GAD的提取和纯化. 上海医科大学学报,1997, 24:465-467.
7,Pleau JM, Throsby M, Esling A, et al. Ontogeny of glutamic acid decarboxylase ene expression in the mouse pancreas. Biochem Biophys Res Commun, 1997,233:227-230.
8,Ma SW, Rivereau A, Roland T, et al. Transgenic plants expressing autoantigens feed to mice to induce oral immune tolerance. Nat Med, 1997,3:793-798.
9,Plesner A, Worsaae A, Dyrberg T, et al. Immunization of diabetes-prone or non-diabetes-prone mice with GAD65 does not induce diabetes or islet cell pathology. J Autoimmun, 1998,11:335-341.
10,Pleau JM, Esling A, Bach JF, et al. Gene expression of pancreatic glutamic acid decarboxylase in the nonobese diabetic mouse. Biochem Biophys Res Commun, 1996,220:399-404.
(收稿日期:1999-08-10), 百拇医药