BALB/c胎鼠面突未分化外胚间充质细胞的体外培养
作者:吕红兵 金 岩 李 媛 赵 宇
单位:西安第四军医大学口腔医学院病理科 710032
关键词:面部;干细胞;胚胎
实用口腔医学杂志990119 〔摘要〕 目的:建立BALB/c近交系胎鼠面突的未分化外胚间充质细胞的体外培养模型。方法:处死妊娠12d的孕鼠,取胎鼠面突中的外胚间充质细胞,采用组织块原代培养法进行细胞培养,并进行生长曲线的测定和免疫组化的来源鉴定。结果:成功地培养出面突中未分化的外胚间充质细胞。结论:原代培养的外胚间充质细胞生长稳定,来源明确,为牙齿和颌面部骨骼中各种细胞的定向分化研究提供了体外实验模型。
Culture of BALB/c fetal facial primordial undifferentiated ectomesenchymal cells
, http://www.100md.com
Lu Hongbing, Jin Yan, Li Yuan, et al.
Department of Oral Pathology, Stomatological College, Fourth Military Medical University, Xi'an 710032
〔Abstract〕 Objective: To establish a cell line of undifferentiated ectomesenchymal cells of BALB/c fetal facial primordia in vivo. Methods: BALB/c pregnant mice were sacrificed to obtain facial primordia of fetuses. Primary culture was performed with enzymatic disaggregation and primary explant technique; subculture was carried out with trypsinization. The cells of passages 5 were used to study the growth and origination with cell counting and immunohistochemical staining.Results: Epidermoid, asteroid and fibroblast-like cells were growing in primary culture and the former were removed in subcultures with trypsinization by passage 5. The cells of passageg 5, with doubling time of 29.04 hours, were vimentin-possitive and keratin- and nueron-specific-enolase-negitive. Conclusion: The cultured cells in this study are undifferentiated ectomesenchymal cells and may be used in further research work.
, 百拇医药
Key words Face; Stem cells; Embryo
在面部各突起的发育过程中,来源于外胚层的神经嵴细胞经过定向迁移、增殖,到达面突的中胚层,这些细胞被称为外胚间充质细胞。外胚间充质经过定向分化可形成牙本质、牙髓、牙骨质、牙周韧带以及上、下颌骨和腭骨等组织器官。因此,外胚间充质细胞的培养在研究颌面部骨骼、牙齿等各组织器官的发育中具有重要意义。目前,国内外尚未有外胚间充质细胞培养的报道。本实验旨在建立未分化外胚间充质细胞的体外培养模型。
1 材料和方法
1.1未分化外胚间充质细胞的原代培养 培养方法见参考文献[1]
1.2细胞纯化与传代 倒置显微镜下观察细胞从组织块中游出铺满瓶底约1/2时,在超净工作台内弃瓶内培养液,加入胰酶,利用上皮细胞和间充质细胞对胰蛋白酶的耐受性不同纯化细胞,在消化培养细胞时,间充质细胞先脱壁,而上皮细胞脱壁所需时间较长。培养液换为100ml/L胎牛血清的DMEM,以此方法传至第5 代时用于实验。
, http://www.100md.com
1.3生长曲线的测定 见参考文献[1]。
1.4免疫组化来源鉴定 取第5代BALB/c近交系胎鼠面突的未分化外胚间充质细胞,用ABC免疫组化法进行波形丝蛋白、角蛋白、神经元特异性烯醇化酶单抗染色,苏木精衬染胞核。
2 结 果
2.1原代细胞生长情况 BALB/c近交系胎鼠的外胚间充质组织在3d内有原代细胞从组织块周围游出,以组织块为中心呈放射状排列生长,细胞大多为较小的星状成纤维样细胞,并有2~4个突起。当传至第5代时,已基本去除了残留的上皮细胞,剩余的均为未分化的外胚间充质细胞(图1,2)。
2.2细胞的生长曲线和倍增时间 在接种后1d,面突的未分化外胚间充质细胞总数有所下降,第2d,细胞数量开始增加,第3d细胞进入对数生长期,细胞生长曲线呈"S"形,见参考文献[1]中的正常值。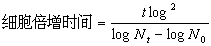
, 百拇医药
t:培养时间
N0:接种后的细胞数
Nt:培养t小时后的细胞数
根据公式推算得知,BALB/c近交系胎鼠面突的未分化外胚间充质细胞的倍增时间为29.04h。
2.3细胞起源鉴定 采用ABC免疫组化的方法对培养的鼠胚面突未分化外胚间充质细胞进行抗波形丝蛋白,抗角蛋白、抗神经元特异性烯醇化酶染色,细胞为明显的抗波形丝蛋白阳性(图3),抗角蛋白、抗神经元特异性烯醇化酶染色均为阴性。
图1 第5代的未分化外胚间充质细胞的生长情况。HE×20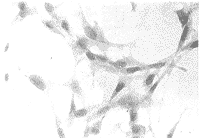
, http://www.100md.com
图2 第5代的未分化外胚间充质细胞的生长情况。HE×200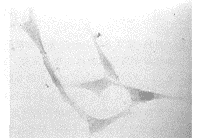
图3 抗波形丝蛋白的免疫组化染色。IHC×228
3 讨 论
外胚间充质细胞与牙齿发育及颌面部各个突起的形成密切相关。外胚间充质细胞的迁移过程受致畸因子的影响后,会使牙齿和面突的生长停滞或减慢,导致面突不能如期联合或融合,牙齿不能正常发育,造成面部畸形(如唇裂、腭裂、面裂等)或牙齿畸形,因此,如能建立外胚间充质细胞的体外培养模型,对于颌面部各组织细胞的定向分化研究将起到推动作用。
在鼠胚面突早期的发育中,面突体积很小,因此,机械去除上皮较困难,用胰酶消化后,立体显微镜下可将上皮层和间充质层分离,这种方法可把大部分上皮去除,再通过多次差别消化法可以彻底去除残留的上皮。体外培养的外胚间充质细胞具有长短不等的数个突起,细胞呈星形,核为卵圆形,位于胞质的中央,并呈栅栏状生长,细胞生长情况符合呈纤维样细胞。抗波形丝蛋白、抗角蛋白、抗神经元特异性烯醇化酶免疫组化染色结果表明细胞来源于中胚层。虽然未分化外胚间充质细胞最初是由神经嵴的上皮细胞演变而来,但在胚胎发育过程中经过迁移,细胞的神经特性和上皮特性均已消失,因此,抗角蛋白和抗神经元特异性烯醇化酶免疫组化染色均为阴性。
, http://www.100md.com
以往的研究表明,外胚间充质细胞在从神经嵴向面突中胚层迁移的过程中,只发生增殖,不发生分化,当细胞到达面突后,在接受特定的信号分子的刺激以后,才能向内釉细胞、外釉细胞、成骨细胞等不同的方向分化,以便形成结构和功能各异的组织和器官[2]。GD12,外胚间充质细胞已迁移至面突中胚层,但还处于未分化状态,所以适宜于进行面部各种不同细胞的定向分化研究。在这些细胞凝聚形成牙胚面突的过程中,已发现其中有多种不同的BMPs和各种转录因子(MSXs)的表达[3]。研究证明,MSX缺陷型小鼠牙胚的蕾状期发育延迟,而加入BMP后可逆转这种情况,使牙胚的发育由蕾状期进入帽状期[4]。由此可见间充质细胞中各种生长因子的正常表达对于维持牙齿、面突的正常发育是十分必要的。另一方面,也说明间充质细胞在颌面部发育中的重要性。
未分化外胚间充质细胞在颌面部的发育中起重要作用,是研究颌面部早期发育的重要模型。通过对未分化外胚间充质细胞的研究,不仅能揭示牙齿、颌骨早期发育的分化机理,而且会使人们对中胚层的研究更加深入。本实验成功地培养了BALB/c近交系胎鼠面突的未分化外胚间充质细胞,为进一步研究细胞的分化提供了重要的实验模型。
, 百拇医药
参考文献
1 吕红兵,金 岩,董绍忠,等. 维甲酸处理未分化间充质细胞后细胞增殖与凋亡的变化. 实用口腔医学杂志,1999,15(1):47
2 Francis PH, Richardson MK, Brickell PM, et al. Bone morphogenetic proteins and a signaling pathway that controls patterning in the developing chick limb. Development, 1994,120: 209
3 Maas R, Bei M. The genetic control of early tooth development. Crit Rev Oral Biol Med, 1997,8(1):4
4 Chen Y, Bei M, Woo I, et al. Msx1 controls inductive signaling in mammalian tooth morphogenesis. Development, 1996,122(10):3035
(收稿:1998-10-19), http://www.100md.com
单位:西安第四军医大学口腔医学院病理科 710032
关键词:面部;干细胞;胚胎
实用口腔医学杂志990119 〔摘要〕 目的:建立BALB/c近交系胎鼠面突的未分化外胚间充质细胞的体外培养模型。方法:处死妊娠12d的孕鼠,取胎鼠面突中的外胚间充质细胞,采用组织块原代培养法进行细胞培养,并进行生长曲线的测定和免疫组化的来源鉴定。结果:成功地培养出面突中未分化的外胚间充质细胞。结论:原代培养的外胚间充质细胞生长稳定,来源明确,为牙齿和颌面部骨骼中各种细胞的定向分化研究提供了体外实验模型。
Culture of BALB/c fetal facial primordial undifferentiated ectomesenchymal cells
, http://www.100md.com
Lu Hongbing, Jin Yan, Li Yuan, et al.
Department of Oral Pathology, Stomatological College, Fourth Military Medical University, Xi'an 710032
〔Abstract〕 Objective: To establish a cell line of undifferentiated ectomesenchymal cells of BALB/c fetal facial primordia in vivo. Methods: BALB/c pregnant mice were sacrificed to obtain facial primordia of fetuses. Primary culture was performed with enzymatic disaggregation and primary explant technique; subculture was carried out with trypsinization. The cells of passages 5 were used to study the growth and origination with cell counting and immunohistochemical staining.Results: Epidermoid, asteroid and fibroblast-like cells were growing in primary culture and the former were removed in subcultures with trypsinization by passage 5. The cells of passageg 5, with doubling time of 29.04 hours, were vimentin-possitive and keratin- and nueron-specific-enolase-negitive. Conclusion: The cultured cells in this study are undifferentiated ectomesenchymal cells and may be used in further research work.
, 百拇医药
Key words Face; Stem cells; Embryo
在面部各突起的发育过程中,来源于外胚层的神经嵴细胞经过定向迁移、增殖,到达面突的中胚层,这些细胞被称为外胚间充质细胞。外胚间充质经过定向分化可形成牙本质、牙髓、牙骨质、牙周韧带以及上、下颌骨和腭骨等组织器官。因此,外胚间充质细胞的培养在研究颌面部骨骼、牙齿等各组织器官的发育中具有重要意义。目前,国内外尚未有外胚间充质细胞培养的报道。本实验旨在建立未分化外胚间充质细胞的体外培养模型。
1 材料和方法
1.1未分化外胚间充质细胞的原代培养 培养方法见参考文献[1]
1.2细胞纯化与传代 倒置显微镜下观察细胞从组织块中游出铺满瓶底约1/2时,在超净工作台内弃瓶内培养液,加入胰酶,利用上皮细胞和间充质细胞对胰蛋白酶的耐受性不同纯化细胞,在消化培养细胞时,间充质细胞先脱壁,而上皮细胞脱壁所需时间较长。培养液换为100ml/L胎牛血清的DMEM,以此方法传至第5 代时用于实验。
, http://www.100md.com
1.3生长曲线的测定 见参考文献[1]。
1.4免疫组化来源鉴定 取第5代BALB/c近交系胎鼠面突的未分化外胚间充质细胞,用ABC免疫组化法进行波形丝蛋白、角蛋白、神经元特异性烯醇化酶单抗染色,苏木精衬染胞核。
2 结 果
2.1原代细胞生长情况 BALB/c近交系胎鼠的外胚间充质组织在3d内有原代细胞从组织块周围游出,以组织块为中心呈放射状排列生长,细胞大多为较小的星状成纤维样细胞,并有2~4个突起。当传至第5代时,已基本去除了残留的上皮细胞,剩余的均为未分化的外胚间充质细胞(图1,2)。
2.2细胞的生长曲线和倍增时间 在接种后1d,面突的未分化外胚间充质细胞总数有所下降,第2d,细胞数量开始增加,第3d细胞进入对数生长期,细胞生长曲线呈"S"形,见参考文献[1]中的正常值。
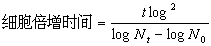
, 百拇医药
t:培养时间
N0:接种后的细胞数
Nt:培养t小时后的细胞数
根据公式推算得知,BALB/c近交系胎鼠面突的未分化外胚间充质细胞的倍增时间为29.04h。
2.3细胞起源鉴定 采用ABC免疫组化的方法对培养的鼠胚面突未分化外胚间充质细胞进行抗波形丝蛋白,抗角蛋白、抗神经元特异性烯醇化酶染色,细胞为明显的抗波形丝蛋白阳性(图3),抗角蛋白、抗神经元特异性烯醇化酶染色均为阴性。

图1 第5代的未分化外胚间充质细胞的生长情况。HE×20

, http://www.100md.com
图2 第5代的未分化外胚间充质细胞的生长情况。HE×200

图3 抗波形丝蛋白的免疫组化染色。IHC×228
3 讨 论
外胚间充质细胞与牙齿发育及颌面部各个突起的形成密切相关。外胚间充质细胞的迁移过程受致畸因子的影响后,会使牙齿和面突的生长停滞或减慢,导致面突不能如期联合或融合,牙齿不能正常发育,造成面部畸形(如唇裂、腭裂、面裂等)或牙齿畸形,因此,如能建立外胚间充质细胞的体外培养模型,对于颌面部各组织细胞的定向分化研究将起到推动作用。
在鼠胚面突早期的发育中,面突体积很小,因此,机械去除上皮较困难,用胰酶消化后,立体显微镜下可将上皮层和间充质层分离,这种方法可把大部分上皮去除,再通过多次差别消化法可以彻底去除残留的上皮。体外培养的外胚间充质细胞具有长短不等的数个突起,细胞呈星形,核为卵圆形,位于胞质的中央,并呈栅栏状生长,细胞生长情况符合呈纤维样细胞。抗波形丝蛋白、抗角蛋白、抗神经元特异性烯醇化酶免疫组化染色结果表明细胞来源于中胚层。虽然未分化外胚间充质细胞最初是由神经嵴的上皮细胞演变而来,但在胚胎发育过程中经过迁移,细胞的神经特性和上皮特性均已消失,因此,抗角蛋白和抗神经元特异性烯醇化酶免疫组化染色均为阴性。
, http://www.100md.com
以往的研究表明,外胚间充质细胞在从神经嵴向面突中胚层迁移的过程中,只发生增殖,不发生分化,当细胞到达面突后,在接受特定的信号分子的刺激以后,才能向内釉细胞、外釉细胞、成骨细胞等不同的方向分化,以便形成结构和功能各异的组织和器官[2]。GD12,外胚间充质细胞已迁移至面突中胚层,但还处于未分化状态,所以适宜于进行面部各种不同细胞的定向分化研究。在这些细胞凝聚形成牙胚面突的过程中,已发现其中有多种不同的BMPs和各种转录因子(MSXs)的表达[3]。研究证明,MSX缺陷型小鼠牙胚的蕾状期发育延迟,而加入BMP后可逆转这种情况,使牙胚的发育由蕾状期进入帽状期[4]。由此可见间充质细胞中各种生长因子的正常表达对于维持牙齿、面突的正常发育是十分必要的。另一方面,也说明间充质细胞在颌面部发育中的重要性。
未分化外胚间充质细胞在颌面部的发育中起重要作用,是研究颌面部早期发育的重要模型。通过对未分化外胚间充质细胞的研究,不仅能揭示牙齿、颌骨早期发育的分化机理,而且会使人们对中胚层的研究更加深入。本实验成功地培养了BALB/c近交系胎鼠面突的未分化外胚间充质细胞,为进一步研究细胞的分化提供了重要的实验模型。
, 百拇医药
参考文献
1 吕红兵,金 岩,董绍忠,等. 维甲酸处理未分化间充质细胞后细胞增殖与凋亡的变化. 实用口腔医学杂志,1999,15(1):47
2 Francis PH, Richardson MK, Brickell PM, et al. Bone morphogenetic proteins and a signaling pathway that controls patterning in the developing chick limb. Development, 1994,120: 209
3 Maas R, Bei M. The genetic control of early tooth development. Crit Rev Oral Biol Med, 1997,8(1):4
4 Chen Y, Bei M, Woo I, et al. Msx1 controls inductive signaling in mammalian tooth morphogenesis. Development, 1996,122(10):3035
(收稿:1998-10-19), http://www.100md.com