人口腔粘膜上皮细胞的培养及生物学特性的研究
作者:丁桂聪 毛天球 杨维东 陈富林 赵晋龙 陶凯
单位:丁桂聪(第四军医大学口腔医学院口腔颌面外科 710032);毛天球(第四军医大学口腔医学院口腔颌面外科 710032);杨维东(第四军医大学口腔医学院口腔颌面外科 710032);陈富林(第四军医大学口腔医学院口腔颌面外科 710032);赵晋龙(第四军医大学口腔医学院口腔颌面外科 710032);陶凯(第四军医大学口腔医学院口腔颌面外科 710032)
关键词:粘膜;细胞培养;上皮组织细胞
实用口腔医学杂志000411〔摘要〕目的:探讨口腔粘膜上皮细胞的培养扩增方法及生物学特性。方法:取手术中切除的多余粘膜,分别用胰酶和Dispase分离后经胰酶消化,接种无血清培养基。将二者细胞数量、活力及融合时间加以比较,同时对细胞各代增殖特点、生长曲线、克隆形成率及血清对细胞分化的影响进行观察。结果:Dispase分离法的细胞总数,活细胞数均高于胰酶分离法。粘膜上皮细胞能够在无血清培养基稳定增殖传代,血清对上皮细胞有诱导分化作用。结论:Dispase分离的无血清培养技术可短期内获得大量具增殖能力的粘膜上皮细胞。
, http://www.100md.com
中图分类号:R329.2+8 文献标识码:A
文章编号:1001-3733(2000)04-0288-03
A study of human oral mucosal epithelial cell culture and characteristics
Ding Guicong,Mao Tianqiu,Yang Weidong,et al.
(Department of Oral and Maxillofacial Surgery,Stomatological College,Fourth Military Medical University,Xi'an,710032)
〔Abstract〕Objective:To study the optimal procedure for the culture and amplification of oral mucosal epithelial cells (OMEC) and their biological characteristics.Methods:OMEC were primarily cultured with trypsin or dispase digestion.The biological characteristics of the cells were observed through phase microscope,cell growth curve,colony forming efficiency.Results:More viable cells were harvested with dispase digestion and the cells reached confluence earlier than with trypsin digestion.The third passage of OMEC grew well in keratinocyte-serum free medium(K-SFM),OMEC were induced to differentiate when serum existed in medium.Conclusion:A large number of OMEC may obtained with dispase digestion and the cells grow well in K-SFM.
, http://www.100md.com
Key words Mucous membrane;Cell cultivation;Epithelial cell.
口腔颌面外科的肿瘤切除,创伤及修复前的牙槽外科往往有大面积口腔粘膜缺损。自体粘膜移植修复是更为符合口腔生理要求的方法,但组织来源有限,因而传统上多采用自体皮肤移植代替缺失的粘膜。皮肤移植修复口腔缺损的同时,存在着明显的缺陷〔1〕。近年来发展起来的组织工程技术为此问题的解决开辟了新的途径。通过体外表皮细胞大量扩增而合成的人工皮肤目前已成功地应用于烧伤患者。因而如何利用组织工程方法合成粘膜来代替皮肤移植修复口腔粘膜,已引起学者的兴趣〔2〕。粘膜组织工程首先要解决种子细胞来源,保证获得足量且纯化的上皮细胞,而该问题的解决关键是建立可靠的上皮细胞培养扩增技术,国内该方面的研究尚少〔3,4〕。本研究目的是研究无血清培养条件下粘膜细胞的培养扩增方法及生物学特性,为粘膜的体外构建奠定基础。
, http://www.100md.com
1 材料和方法
1.1 材料
人角朊细胞培养液(K-SFM, Gibco),胰酶(Sigma),DMEM(Hyclone),Dispase II(Gibco),胎牛血清(浙江金华清湖犊牛利用研究所)。
1.2 方法
1.2.1 标本处理 无菌条件下收集本院颌面外科手术中丢弃的多余粘膜,患者年龄2.5~62岁。置于体积分数为10%血清的DMEM 中。PBS洗净血迹,2.5 g/L洗必泰液浸泡5~8 min,尽量去除粘膜下组织,并切成0.3 cm×1 cm大小的组织块。
1.2.2 标本分组 每个标本分成相等两份,其中一份放入2.5 g/L Dispase II溶液,4 ℃冰箱过夜;另一份则置2.5 g/L胰酶4 ℃冰箱过夜,两组分离时间相同。然后用眼科镊将表皮撕下,将两组的上皮分别用2.5 g/L胰酶37 ℃消化5~10 min,DMEM(含血清)中止消化,吹打成单细胞液。血球板计算细胞数,台盼兰活细胞计数,以4×104个/cm2的细胞密度接种于含K-SFM的25 ml培养瓶中。
, http://www.100md.com
1.3 观测指标
1.3.1 倒置显微镜下观察各代细胞形态。
1.3.2 细胞计数及台盼兰活力染色比较两种酶分离的特点。
1.3.3 细胞生长曲线并计算群体倍增时间 取第2代正常粘膜上皮细胞,以104个/cm2的细胞密度接种24孔板,每一组为3孔,定期用胰酶消化计数,取3孔的平均数,绘制生长曲线,并计算群体倍增时间〔9〕。
1.3.4 细胞克隆形成率 将第二代粘膜上皮细胞用胰酶消化,分别以102、103 、104个/cm2的细胞密度接种培养瓶内,7 d后倒置显微镜下观察含10个以上细胞克隆数并计算克隆形成率〔5〕。
, 百拇医药
1.3.5 血清对细胞生长的影响 培养瓶内细胞融合达60%时,加入含体积分数10%胎牛血清的角朊细胞培养液,显微镜下观察细胞的生长状况。
2 结 果
2.1 粘膜上皮细胞各代形态学观察
粘膜上皮细胞接种K-SFM,可连续传4~5代。消化后细胞大小不一,小而圆的细胞为具增殖能力的基底细胞。细胞逐渐沉降,贴附培养瓶,这一过程持续48 h以上。贴壁细胞渐变为卵圆形,伸出突起,胞浆透亮,边界不明确。从第4、5 天上皮细胞开始增殖,融合时间因分离酶而有差异。Dispase组在接种后10 ~14 d融合,而胰酶组则需13~18 d。第二代与第一代相似,细胞增殖力强。第三代可见少许体积大的细胞,第四代巨型细胞的数量约占10%左右,融合时间延迟。第五代则以巨型细胞为主,胞内出现颗粒,增殖缓慢,细胞甚至变圆,脱落死亡。Dispase组未见成纤维样细胞污染,而胰酶组则混有成纤维细胞,随传代次数增加成纤维细胞的比例增加。年轻患者来源的上皮细胞增殖快,融合早。老年患者的上皮细胞在原代培养即出现一定数量的巨型细胞,传代后巨型细胞的比例明显增加,有的仅能传3代。另外在克隆形成过程中,克隆中心与周缘细胞分化不一致。中心部位呈多角形,出现复层,周边细胞则为单层,仍呈卵圆形,处于增殖状态(图1)。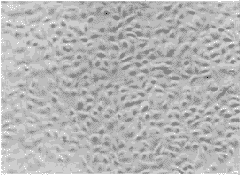
, http://www.100md.com
图1 粘膜上皮细胞 ×100
2.2 两种酶分离效果比较
两组消化后细胞数量,活力比较(表1)。
表1 不同酶分离消化法对细胞活力、细胞数量影响 方法
细胞数
(×106/cm2)
活细胞比例
(%)
融合天数
胰酶
1.7±0.19
, http://www.100md.com
78±4
15
Dispase+胰酶
2.2±0.26①
89±3①
12
n=6 ①<0.012.3 细胞生长曲线、克隆形成率及群体倍增时间
图2示上皮细胞的生长曲线。接种的上皮细胞有明显的迟滞时间,一般为3 d。随后细胞开始增殖活动,在细胞发生接触抑制前有3~4 d的线性生长阶段。细胞群体倍增时间平均为49.6 h,但细胞群体倍增时间与开始接种密度明显相关,个体间也存在着较大的差异。上皮细胞最低接种密度大于1×103个/cm2才能形成克隆,最适接种密度为1×104个/cm2,平均克隆形成率为21.5%。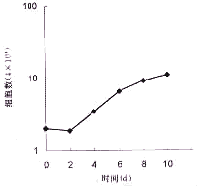
, 百拇医药
图2 粘膜上皮细胞生长曲线
2.4 血清对上皮细胞的作用
对接近融合的上皮细胞,在K-SFM加入体积分数10%的血清,与单纯应用K-SFM的细胞的相比,上皮细胞分化程度明显高,细胞由卵圆形变为多角形状,复层上皮的范围增大,而且在复层上皮中央可见角化物。
3 讨 论
1975年Rheinwald和Green提出用3T3细胞作滋养层培养上皮细胞后,这一方法已被广泛应用于培养各种上皮细胞。对口腔粘膜上皮细胞的培养也多采用这一技术〔1,2〕。但由于该培养法利用血清培养基,血中的某些成分可能对实验结果有干扰作用,而且3T3细胞作为异种蛋白可能对人有不利的影响〔6〕。本研究中在细胞培养时,加入含血清的培养液,发现部分单层上皮细胞出现复层并有角化物出现,这说明血清成分对上皮细胞有诱导分化的作用。提示在细胞扩增传代时加入血清是不利的,可使细胞传代次数减少。近年来发展起来的无血清培养法则可避开这些缺点,无血清培养尚可抑制成纤维细胞增殖,促进上皮细胞生长,因而有利于组织工程粘膜的构建与临床应用〔7〕。关于口腔粘膜上皮细胞的培养国内研究较少,且仅为采用含血清培养基进行的原代培养〔3,4〕,在无3T3细胞存在时难以传代,不能满足组织工程对细胞数量的需要。本实验利用无血清培养基,细胞可稳定传代4 ~ 5代。从各代增殖特点看,前三代细胞增殖能力强,第四代出现一定比例的巨细胞,第五代细胞则衰老。因而从组织工程的角度,本研究支持采用培养的第三代细胞,既满足一定数量,又保证细胞有良好增殖能力。粘膜上皮细胞的传代数与接种细胞数密切相关。形成克隆的适宜细胞浓度为1×104个/cm2,过低的细胞数量使细胞不能自我支持,因为细胞生长尚需依赖细胞本身的局部分泌生长因子。而且过低的细胞接种数使传代次数明显减少,这对大量扩增上皮细胞是不利的。融合时间及传代次数因供体年龄而有所不同,这与随年龄增加,受细胞生物钟的影响,细胞寿命变短,增殖能力降低有关〔5〕。实验观察到老年患者来源的细胞在同样接种密度下与40岁以下相比,传代次数多低于4代。有研究利用1 cm2 皮肤,经体外培养扩增后利用第二代细胞至少可获得1000 cm2皮片,短时间内获1000倍的组织。本实验Dispase组原代少量粘膜可以获得1~2×106 个细胞,第二代则有1~1.5×107个细胞,可满足体外在一定时间内大量扩增和有关细胞学的研究。
, 百拇医药
人口腔粘膜上皮细胞培养关键的一步是上皮细胞与成纤维细胞的分离,有效的分离可避免成纤维细胞的污染〔2〕。传统上使用胰酶时在破坏半桥粒的同时又破坏桥粒,因而易造成基底层细胞的丢失。而Dispase是一种中性蛋白酶,仅作用于表皮与真皮结合处,破坏半桥粒结构,使基底细胞层底完整分离〔8〕。基底细胞是上皮中唯一具有增殖能力的细胞〔6〕,Dispase完整保留基底细胞层的特点意味着Dispase法获得基底细胞数比胰酶分离法多,故增殖细胞的数量就多。此外,胰酶尚可分解细胞膜上的大分子蛋白质,使细胞通透性升高,细胞活力下降,台盼兰细胞活力染色表明,Dispase消化的活细胞数明显高于胰酶法,因而一般Dispase组融合也较早。关于上皮细胞培养中成纤维细胞的污染,在Dispase组中未见污染,而胰酶组则有成纤维细胞混入,长期培养则需进一步纯化细胞,而目前尚无理想的纯化方法〔3,9〕。
因而,本实验结果支持采用Dispase II分离法的无血清培养技术,在短期内稳定地获得大量纯化的上皮细胞,可初步满足组织工程化粘膜的培养需要。
, 百拇医药
参考文献
1,Raghoebar GM,Tomson AM,Scholma J,et al.Use of cultured mucosal grafts to cover defects caused by vestibuloplasty:An in vivo study.J Oral Maxillofac Surg,1995,53:872
2,Tsai CY,Ueda M,Hata KI,et al.Clinical results of cultured epithelial cell grafting in the oral and maxillofacial region.J Craniomaxillofac Surg,1997,25:4
3,石虹,陈安玉.人牙龈上皮细胞原代培养的实验研究.华西口腔医学杂志,1994,12(1):53
, http://www.100md.com
4,汪济广,刘宝林.口腔粘膜基底上皮细胞体外培养模型的建立.中国口腔种植杂志,1997,2(1):1
5,Kasperbauer JL,Neel HB,Scott RE.Proliferation and differentiation characteristics of normal human squamous mucosal cells of the aerodigestive tract.Ann Otol Rhinol Laryngol,1990,99:29
6,Tenchini ML,Ranzati C,Malcovati M.Culture techniques for human keratinocytes.Burns,1992,18(s):11
7,Formanek M,Millesi W,Willheim M,et al.Optimizied growth medium for primary culture of human oral keratinocytes.Int J Oral Maxillofac Surg,1996,25:157
8,Germain L,Rouabhia M,Guignard R,et al.Improvement of human keratinocyte isolation and culture using thermolysin.Burns,1993,19:99
9,司徒镇强,吴军正主编.细胞培养.西安:世界图书出版公司,1996:76
收稿:1999-12-28
修回:2000-04-28, http://www.100md.com
单位:丁桂聪(第四军医大学口腔医学院口腔颌面外科 710032);毛天球(第四军医大学口腔医学院口腔颌面外科 710032);杨维东(第四军医大学口腔医学院口腔颌面外科 710032);陈富林(第四军医大学口腔医学院口腔颌面外科 710032);赵晋龙(第四军医大学口腔医学院口腔颌面外科 710032);陶凯(第四军医大学口腔医学院口腔颌面外科 710032)
关键词:粘膜;细胞培养;上皮组织细胞
实用口腔医学杂志000411〔摘要〕目的:探讨口腔粘膜上皮细胞的培养扩增方法及生物学特性。方法:取手术中切除的多余粘膜,分别用胰酶和Dispase分离后经胰酶消化,接种无血清培养基。将二者细胞数量、活力及融合时间加以比较,同时对细胞各代增殖特点、生长曲线、克隆形成率及血清对细胞分化的影响进行观察。结果:Dispase分离法的细胞总数,活细胞数均高于胰酶分离法。粘膜上皮细胞能够在无血清培养基稳定增殖传代,血清对上皮细胞有诱导分化作用。结论:Dispase分离的无血清培养技术可短期内获得大量具增殖能力的粘膜上皮细胞。
, http://www.100md.com
中图分类号:R329.2+8 文献标识码:A
文章编号:1001-3733(2000)04-0288-03
A study of human oral mucosal epithelial cell culture and characteristics
Ding Guicong,Mao Tianqiu,Yang Weidong,et al.
(Department of Oral and Maxillofacial Surgery,Stomatological College,Fourth Military Medical University,Xi'an,710032)
〔Abstract〕Objective:To study the optimal procedure for the culture and amplification of oral mucosal epithelial cells (OMEC) and their biological characteristics.Methods:OMEC were primarily cultured with trypsin or dispase digestion.The biological characteristics of the cells were observed through phase microscope,cell growth curve,colony forming efficiency.Results:More viable cells were harvested with dispase digestion and the cells reached confluence earlier than with trypsin digestion.The third passage of OMEC grew well in keratinocyte-serum free medium(K-SFM),OMEC were induced to differentiate when serum existed in medium.Conclusion:A large number of OMEC may obtained with dispase digestion and the cells grow well in K-SFM.
, http://www.100md.com
Key words Mucous membrane;Cell cultivation;Epithelial cell.
口腔颌面外科的肿瘤切除,创伤及修复前的牙槽外科往往有大面积口腔粘膜缺损。自体粘膜移植修复是更为符合口腔生理要求的方法,但组织来源有限,因而传统上多采用自体皮肤移植代替缺失的粘膜。皮肤移植修复口腔缺损的同时,存在着明显的缺陷〔1〕。近年来发展起来的组织工程技术为此问题的解决开辟了新的途径。通过体外表皮细胞大量扩增而合成的人工皮肤目前已成功地应用于烧伤患者。因而如何利用组织工程方法合成粘膜来代替皮肤移植修复口腔粘膜,已引起学者的兴趣〔2〕。粘膜组织工程首先要解决种子细胞来源,保证获得足量且纯化的上皮细胞,而该问题的解决关键是建立可靠的上皮细胞培养扩增技术,国内该方面的研究尚少〔3,4〕。本研究目的是研究无血清培养条件下粘膜细胞的培养扩增方法及生物学特性,为粘膜的体外构建奠定基础。
, http://www.100md.com
1 材料和方法
1.1 材料
人角朊细胞培养液(K-SFM, Gibco),胰酶(Sigma),DMEM(Hyclone),Dispase II(Gibco),胎牛血清(浙江金华清湖犊牛利用研究所)。
1.2 方法
1.2.1 标本处理 无菌条件下收集本院颌面外科手术中丢弃的多余粘膜,患者年龄2.5~62岁。置于体积分数为10%血清的DMEM 中。PBS洗净血迹,2.5 g/L洗必泰液浸泡5~8 min,尽量去除粘膜下组织,并切成0.3 cm×1 cm大小的组织块。
1.2.2 标本分组 每个标本分成相等两份,其中一份放入2.5 g/L Dispase II溶液,4 ℃冰箱过夜;另一份则置2.5 g/L胰酶4 ℃冰箱过夜,两组分离时间相同。然后用眼科镊将表皮撕下,将两组的上皮分别用2.5 g/L胰酶37 ℃消化5~10 min,DMEM(含血清)中止消化,吹打成单细胞液。血球板计算细胞数,台盼兰活细胞计数,以4×104个/cm2的细胞密度接种于含K-SFM的25 ml培养瓶中。
, http://www.100md.com
1.3 观测指标
1.3.1 倒置显微镜下观察各代细胞形态。
1.3.2 细胞计数及台盼兰活力染色比较两种酶分离的特点。
1.3.3 细胞生长曲线并计算群体倍增时间 取第2代正常粘膜上皮细胞,以104个/cm2的细胞密度接种24孔板,每一组为3孔,定期用胰酶消化计数,取3孔的平均数,绘制生长曲线,并计算群体倍增时间〔9〕。
1.3.4 细胞克隆形成率 将第二代粘膜上皮细胞用胰酶消化,分别以102、103 、104个/cm2的细胞密度接种培养瓶内,7 d后倒置显微镜下观察含10个以上细胞克隆数并计算克隆形成率〔5〕。
, 百拇医药
1.3.5 血清对细胞生长的影响 培养瓶内细胞融合达60%时,加入含体积分数10%胎牛血清的角朊细胞培养液,显微镜下观察细胞的生长状况。
2 结 果
2.1 粘膜上皮细胞各代形态学观察
粘膜上皮细胞接种K-SFM,可连续传4~5代。消化后细胞大小不一,小而圆的细胞为具增殖能力的基底细胞。细胞逐渐沉降,贴附培养瓶,这一过程持续48 h以上。贴壁细胞渐变为卵圆形,伸出突起,胞浆透亮,边界不明确。从第4、5 天上皮细胞开始增殖,融合时间因分离酶而有差异。Dispase组在接种后10 ~14 d融合,而胰酶组则需13~18 d。第二代与第一代相似,细胞增殖力强。第三代可见少许体积大的细胞,第四代巨型细胞的数量约占10%左右,融合时间延迟。第五代则以巨型细胞为主,胞内出现颗粒,增殖缓慢,细胞甚至变圆,脱落死亡。Dispase组未见成纤维样细胞污染,而胰酶组则混有成纤维细胞,随传代次数增加成纤维细胞的比例增加。年轻患者来源的上皮细胞增殖快,融合早。老年患者的上皮细胞在原代培养即出现一定数量的巨型细胞,传代后巨型细胞的比例明显增加,有的仅能传3代。另外在克隆形成过程中,克隆中心与周缘细胞分化不一致。中心部位呈多角形,出现复层,周边细胞则为单层,仍呈卵圆形,处于增殖状态(图1)。

, http://www.100md.com
图1 粘膜上皮细胞 ×100
2.2 两种酶分离效果比较
两组消化后细胞数量,活力比较(表1)。
表1 不同酶分离消化法对细胞活力、细胞数量影响 方法
细胞数
(×106/cm2)
活细胞比例
(%)
融合天数
胰酶
1.7±0.19
, http://www.100md.com
78±4
15
Dispase+胰酶
2.2±0.26①
89±3①
12
n=6 ①<0.012.3 细胞生长曲线、克隆形成率及群体倍增时间
图2示上皮细胞的生长曲线。接种的上皮细胞有明显的迟滞时间,一般为3 d。随后细胞开始增殖活动,在细胞发生接触抑制前有3~4 d的线性生长阶段。细胞群体倍增时间平均为49.6 h,但细胞群体倍增时间与开始接种密度明显相关,个体间也存在着较大的差异。上皮细胞最低接种密度大于1×103个/cm2才能形成克隆,最适接种密度为1×104个/cm2,平均克隆形成率为21.5%。

, 百拇医药
图2 粘膜上皮细胞生长曲线
2.4 血清对上皮细胞的作用
对接近融合的上皮细胞,在K-SFM加入体积分数10%的血清,与单纯应用K-SFM的细胞的相比,上皮细胞分化程度明显高,细胞由卵圆形变为多角形状,复层上皮的范围增大,而且在复层上皮中央可见角化物。
3 讨 论
1975年Rheinwald和Green提出用3T3细胞作滋养层培养上皮细胞后,这一方法已被广泛应用于培养各种上皮细胞。对口腔粘膜上皮细胞的培养也多采用这一技术〔1,2〕。但由于该培养法利用血清培养基,血中的某些成分可能对实验结果有干扰作用,而且3T3细胞作为异种蛋白可能对人有不利的影响〔6〕。本研究中在细胞培养时,加入含血清的培养液,发现部分单层上皮细胞出现复层并有角化物出现,这说明血清成分对上皮细胞有诱导分化的作用。提示在细胞扩增传代时加入血清是不利的,可使细胞传代次数减少。近年来发展起来的无血清培养法则可避开这些缺点,无血清培养尚可抑制成纤维细胞增殖,促进上皮细胞生长,因而有利于组织工程粘膜的构建与临床应用〔7〕。关于口腔粘膜上皮细胞的培养国内研究较少,且仅为采用含血清培养基进行的原代培养〔3,4〕,在无3T3细胞存在时难以传代,不能满足组织工程对细胞数量的需要。本实验利用无血清培养基,细胞可稳定传代4 ~ 5代。从各代增殖特点看,前三代细胞增殖能力强,第四代出现一定比例的巨细胞,第五代细胞则衰老。因而从组织工程的角度,本研究支持采用培养的第三代细胞,既满足一定数量,又保证细胞有良好增殖能力。粘膜上皮细胞的传代数与接种细胞数密切相关。形成克隆的适宜细胞浓度为1×104个/cm2,过低的细胞数量使细胞不能自我支持,因为细胞生长尚需依赖细胞本身的局部分泌生长因子。而且过低的细胞接种数使传代次数明显减少,这对大量扩增上皮细胞是不利的。融合时间及传代次数因供体年龄而有所不同,这与随年龄增加,受细胞生物钟的影响,细胞寿命变短,增殖能力降低有关〔5〕。实验观察到老年患者来源的细胞在同样接种密度下与40岁以下相比,传代次数多低于4代。有研究利用1 cm2 皮肤,经体外培养扩增后利用第二代细胞至少可获得1000 cm2皮片,短时间内获1000倍的组织。本实验Dispase组原代少量粘膜可以获得1~2×106 个细胞,第二代则有1~1.5×107个细胞,可满足体外在一定时间内大量扩增和有关细胞学的研究。
, 百拇医药
人口腔粘膜上皮细胞培养关键的一步是上皮细胞与成纤维细胞的分离,有效的分离可避免成纤维细胞的污染〔2〕。传统上使用胰酶时在破坏半桥粒的同时又破坏桥粒,因而易造成基底层细胞的丢失。而Dispase是一种中性蛋白酶,仅作用于表皮与真皮结合处,破坏半桥粒结构,使基底细胞层底完整分离〔8〕。基底细胞是上皮中唯一具有增殖能力的细胞〔6〕,Dispase完整保留基底细胞层的特点意味着Dispase法获得基底细胞数比胰酶分离法多,故增殖细胞的数量就多。此外,胰酶尚可分解细胞膜上的大分子蛋白质,使细胞通透性升高,细胞活力下降,台盼兰细胞活力染色表明,Dispase消化的活细胞数明显高于胰酶法,因而一般Dispase组融合也较早。关于上皮细胞培养中成纤维细胞的污染,在Dispase组中未见污染,而胰酶组则有成纤维细胞混入,长期培养则需进一步纯化细胞,而目前尚无理想的纯化方法〔3,9〕。
因而,本实验结果支持采用Dispase II分离法的无血清培养技术,在短期内稳定地获得大量纯化的上皮细胞,可初步满足组织工程化粘膜的培养需要。
, 百拇医药
参考文献
1,Raghoebar GM,Tomson AM,Scholma J,et al.Use of cultured mucosal grafts to cover defects caused by vestibuloplasty:An in vivo study.J Oral Maxillofac Surg,1995,53:872
2,Tsai CY,Ueda M,Hata KI,et al.Clinical results of cultured epithelial cell grafting in the oral and maxillofacial region.J Craniomaxillofac Surg,1997,25:4
3,石虹,陈安玉.人牙龈上皮细胞原代培养的实验研究.华西口腔医学杂志,1994,12(1):53
, http://www.100md.com
4,汪济广,刘宝林.口腔粘膜基底上皮细胞体外培养模型的建立.中国口腔种植杂志,1997,2(1):1
5,Kasperbauer JL,Neel HB,Scott RE.Proliferation and differentiation characteristics of normal human squamous mucosal cells of the aerodigestive tract.Ann Otol Rhinol Laryngol,1990,99:29
6,Tenchini ML,Ranzati C,Malcovati M.Culture techniques for human keratinocytes.Burns,1992,18(s):11
7,Formanek M,Millesi W,Willheim M,et al.Optimizied growth medium for primary culture of human oral keratinocytes.Int J Oral Maxillofac Surg,1996,25:157
8,Germain L,Rouabhia M,Guignard R,et al.Improvement of human keratinocyte isolation and culture using thermolysin.Burns,1993,19:99
9,司徒镇强,吴军正主编.细胞培养.西安:世界图书出版公司,1996:76
收稿:1999-12-28
修回:2000-04-28, http://www.100md.com