复合树指单体对人牙髓细胞毒性的研究
作者:孙皎 高桑美代子 佐藤和子 佐藤温重
单位:孙皎(上海第二医科大学附属第九人民医院 200011);高桑美代子 佐藤和子 佐藤温重(日本东京医科齿科大学齿学部第二理工教室)
关键词:复合树脂类;单体;细胞毒性;牙髓;细胞
实用口腔医学杂志000404〔摘要〕目的:评价复合树脂单体对人牙髓的毒性作用,探讨不同细胞系对检测敏感性的影响。方法:选用人牙髓细胞(LSC)为实验细胞,以L-929小鼠成纤维细胞作为对照细胞系,采用MTT比色分析法,对两种牙科用复合树脂单体(TEGDMA和UDMA)进行体外细胞毒性研究。结果:在低于IC50的各浓度组中,LSC细胞的生存率高于L-929细胞;MTT比色法作为一种能定量检测牙科材料细胞毒性的有效方法,实验时应注重考虑实验细胞的生长活力和倍增时间,及时调整细胞的接种量。结论:人牙髓细胞比小鼠成纤维细胞更具有模拟临床的应用价值;IC50的确对于估测残留单体的毒性以及材料-细胞接触浓度具有重要重义。
, 百拇医药
中图分类号:R783.1 文献标识码:A
文章编号:1001-3733(2000)04-0264-04
Study on cytotoxicity of dental resin monomer exposed to human pulp cells
Sun Jiao,Michiyo Takawuwa,Kazuko Sato,et al.
(NO.9 People's Hospital,Shanghai Second Medical University,Shanghai 200011)
〔Abstracts〕Objective:To evaluate the cytotoxicity of dental resin monomer exposed to human pulp cells and to investigate the sensitivity of different cell lines to the monomer.Method:Cytotoxicity of dental resin monomer against L-929 cell line and a transformed human dental pulp cell line(LSC) was investigated with MTT assay.Results:The IC50 values of the monomer against L-929 and LSC cells were 31 and 34 mg/L respectively.The relative viability of LSC cells was higher than that of L-929 cells when the concentration of monomer was lower than IC50.Conclusion:LSC cells may be more feasible in the cytotoxicity test.Because they mimic clinical condition,it is important to determine IC50 for assessing the toxicity of residual monomer and cell-materials contacting concentration.
, 百拇医药
Key Words Composite resins;Monomers;Cytotoxicity,Dental pulp;Cell
复合树脂是目前临床上较常用的一类牙科修复材料,其中关于残留单体对活髓牙的刺激问题已越来越引起人们的关注。究竟多少微量浓度的单体会产生对牙髓组织的毒性作用?显然有必要进行体外细胞毒性的评价研究。有关细胞毒性试验的方法,国内外已有不少报道,比如同位素吸取或释放〔1〕、蛋白质含量测定〔2〕、细胞计数〔3〕、活性染料吸取〔4〕、涉及范围的测定〔5〕以及酶活性测定方法〔6〕等等。这些检测技术从不同角度反映了被测材料对实验细胞的毒性作用。本研究选用MTT(四唑盐)比色法,首先在确定IC50(引起半数细胞死亡的浓度值)的基础上,通过测定活细胞内线粒体脱氢酶的活性,来探讨复合树脂单体的含量与细胞毒性的关系。由于MTT法最初是用于免疫学领域,在牙科材料的检测方面尚欠成熟,特别是关于细胞的初接种浓度,这与实验的成功与否以及数据的可信度密切相关,本文将在这方面作些探讨。另外,结合被测材料是属于间接地与牙髓组织接触的实际,本研究选择了人牙髓细胞作为实验细胞,其目的在于使实验结果更接近临床应用状况。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 细胞系 实验采用培养2~3 d处于对数生长期的人牙髓细胞(LSC)和小鼠成纤维细胞(L-929)。
1.1.2 培养基 α-MEM(alpha modification of Eagles medium)用于LSC细胞的培养,Eagle MEM(minimum essential medium)用于L-929细胞的培养,两种培养基中均有体积分数(φ)=10%的小牛血清(FBS)。
1.1.3 复合树脂单体 TEGDMA(tri-etylene glycole di-methacrylate)和UDMA(Urethane dimethacrylete) 均由日本东京医科齿科大学提供,TEGDMA由于能溶于水,可用不含FBS的培养液直接配成终浓度从10~900 mg/L的不同试验组,UDMA因不溶于水,需先借助有机溶剂二甲亚砜和界面活性剂(单体∶二甲亚砜∶活性剂=12∶3∶5),然后用无FBS的培养液配成终浓度为5~50 mg/L的各试验组。
, 百拇医药
1.1.4 主要试剂 配制5 g/L MTT[3-(4-5-demethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide]液,溶剂为PBS(-);以及200 g/L SDS液sodium dodecyl sulfate),溶液为0.01 mol/L盐酸。
1.2 试验方法
实验前首先测定实验细胞的活力及细胞倍增时间,然后确定细胞接种浓度与获取细胞的时间。实验取96孔塑料培养板2块,每种材料各用1块,每浓度组为8孔,每孔注入200 μl细胞悬液,其中含细胞数5×103/孔(LSC细胞)和2×103/孔(L-929细胞),细胞经48 h贴壁培养后,吸弃150 μl原培养液,加入50 μl新鲜培养液和100 μl材料试液(由低浓度到高浓度),空白对照为含细胞、不加入任何试剂的同类培养液,继续在37 ℃含φ(CO2)=5%和一定湿度的培养箱中培养48 h,然后弃100 μl,每孔加入10 μ1 MTT液,置入培养箱中4 h,接着取出培养板,每孔加入100 μl 200 g/L SDS液,37 ℃下放置24 h,经充分振荡后,在多孔扫描分光光度仪(labsystems multiskam bichromatic)下以570 nm和630 nm两个波长段测其吸光度值。
, 百拇医药
1.3 评价指标
以空白对照组的吸光度值作为100%细胞生存率,各浓度组的相对生存率可依照下式求得。根据剂量与生存率变化曲线,可直接获得50%生存率时的毒性剂量,即IC50和90%生存率时的剂量,即IC10.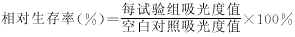
2 结果
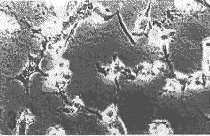
培养2 d后,2组浓度的TEGDMA单体和空白对照在倒置显微镜下观察结果见图1。从图中可以看到,无论是细胞形态还是数量,随着单体浓度的增加,2种细胞株都表现出程度不同的细胞毒性。2种复合树脂单体的剂量与细胞生存率变化曲线见图2;IC50和IC10值见表1。由图表可见,当低于IC50剂量时,2种单体均随单体浓度的递增,细胞相对生存率逐渐下降,同时LSC细胞的细胞生存率高于L-929细胞,其差异程度因不同材料而异;而当高于IC50剂量时,细胞生存率则急剧下跌,此时2种细胞的反应却无明显差别。实验结果表明,细胞相对生存率反映了细胞毒性的程度。

, http://www.100md.com
a对照组 b 100 mg/L组 c 450 mg/L组

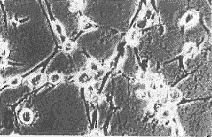
d对照组 e 100 mg/L组 f 450 mg/L组
图1 倒置显微镜下不同单体浓度对LSC细胞(上)和L-929细胞(下)的影响。(Bar 50μm)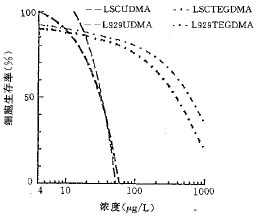
图2 剂量与细胞生存率变化曲线
表1 2种单体的IC50和IC10 (mg/L) 细胞种系
, 百拇医药
TEGDMA
UDMA
IC50
IC10
IC50
IC10
LSC
620
10
34
18
, 百拇医药 L-929
400
7
31
9
3 讨论
在牙科材料的细胞毒性检测试验中,一个比较重要的问题是如何确定受试材料与细胞的接触剂量。以往的细胞毒性试验多数采用的是固体材料的直接接触,或者是制成材料浸提液(浸提介质∶试样表面积=10 ml∶1 cm2),选择50%浸提液作为实验用剂量[7],最终给予毒性评价。这种方法在一定程度上有实验者的主观性,有可能会出现实验结果的假阴性或假阳性。究竟多少含量的有毒物质能被浸出?50%浸提液中又含多少浓度的有害物质?这些仍是未知数。如果在检测细胞毒性前首先确定一个能引起半数细胞死亡的浓度值(IC50),即细胞生存率为50%的剂量,然后选择几组小于IC50的试验剂量,这样,就能较客观地反映受试材料致细胞毒性的剂量浓度。本文就是基于这种设想,对牙科常用的复合树脂单体进行定量细胞毒性评价。由于临床上固化后残余单体存在对牙髓组织的刺激和毒性作用,本研究结果既提供了IC50毒性剂量,又显示了达到90%细胞生存率的单体浓度。同时也避免了单一浓度(50%浸提液)可能带来的主观盲目性,比较客观地反映单体含量与细胞毒性之间的关系。这一实验数据可揭示只要测定固化后残余单体的含量,就可估测该复合树脂的潜在细胞毒性作用,对材料的研制和临床应用具有实际指导意义。
, http://www.100md.com
细胞毒性试验的实验对象是细胞,如何选择实验细胞系,使实验结果更接近临床应用状况,这在细胞相容性评价中是个不容忽视的问题。曾经有一些文献报道,不同的细胞系会出现不同的毒性结果。本文结合受试材料的应用特点,即间接与牙髓组织接触,选用人牙髓细胞为实验细胞,尽可能摸拟临床实际,并以在牙科材料体外细胞毒性检测中常用的L-929细胞作为对照细胞系,观察2种细胞系之间的差异性。结果表明在低于IC50毒性剂量的各浓度组,2种单体都出现L-929细胞比LSC细胞的耐受性差的现象,即在同一浓度组LSC细胞的生存率高于L-929细胞。由此可见人牙髓细胞对毒物的耐受可能大于L-929细胞,采用人牙髓细胞作为评价体外细胞毒性的实验细胞是可取而具有应用价值的。
MTT法是一种检测存活细胞线粒体内脱氢酶活性的试验方法。其原理是这种脱氢酶能够使淡黄色可溶性的MTT分子还原成不溶于水的紫色结晶物〔8〕,而该结晶可溶于SDS有机溶剂,通过比色测定,可直接获得细胞的存活及代谢情况。此方法具有灵敏、简便、能客观定量的优点,近年来已逐渐被对生物材料和牙科材料的细胞毒性评价所采用〔9,10〕。然而,要得到一个重复性好、可信度高的实验结果,以下两个因素不容忽视:①实验细胞生长活力测定,对于不同种系细胞,或者同种细胞在不同的实验室中培养,细胞生长活力是有差异的,正式实验前必须选择达到90%以上活力的细胞进行实验,并绘制细胞生长代谢的标准曲线;②细胞倍增时间的确定,了解实验细胞的细胞倍增时间,(比如,LSC细胞倍增时间为15~18 h),对于确定接种时的细胞量以及实验终止期是有益的。因为96孔板每孔能贴壁生长的细胞数大约是102~105范围内,如果接种的细胞浓度过高,在获取细胞前,孔内细胞已老化脱落,显然影响了实验结果的正确评价。本文在正式实验前对上述两个方面都进行了一定的摸索。首先是测定实验细胞的活力应大于90%,然后确定了细胞的倍增时间,最后根据获取细胞的时间确定细胞接种量分别为5×103/孔(LSC细胞)和2×103/孔(L-929细胞)。这样的实验设计保证了实验数据的科学性和可重复性。
, 百拇医药
参考文献
1,Caughman W F,Caughman G B,Shilett R A,et al.Correlation of cytotoxicity,filler loading and curing time of dental composites,Biomaterials,1991,12:737
2,Naji A,Harmand M F.Study of the effect of the surface state on the cytocompatibility of a Co-Cr alloy using human osteoblasts.J Biomed Mater Res,1990,24:861
3,Rosdy M,Grisoni B,Glauss L C.Proliferation of normal human keratinocytes on silicone substrates.Biomaterials,1991,12:511
, http://www.100md.com
4,Hansen M B,Nielsen S E,Berg K.Re-examination and further development of a precise and rapid dye method for measuring cell growth/cell kill.J Immunol Methods,1989,119:203
5,Hanawa T,Kaga M,Itoh Y,et al.Cytotoxicities of oxides,phosphates and sulphides of metals.Biomaterials,1992,13:20
6,Wenz L M,Merritt K,Brown S A,et al.In vitro biocompatibility of polyetherketone and polysulrone composites.J Biomed Mater Res,1990,24:207
, 百拇医药
7,张彩霞,孙皎,孟爱英.紫外分光光度仪测定不同含铜量银汞合金细胞毒性的新方法.中华口腔医学杂志,1990,25(4):216
8,Mosmann T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays.J Immunol Methods,1983,65(1~2):55
9,Ciapetti G,Cenni E,Pratelli L,et al.In vitro evaluation of cell/biomaterial interaction by MTT assay.Biomaterials,1993,14(5):359
10,吕晓迎,Kappert HF.牙科材料细胞毒性评定的新方法(MTT试验).中华口腔医学杂志,1995,30(6):377
收稿:1999-08-18
修回:1999-11-09, http://www.100md.com
单位:孙皎(上海第二医科大学附属第九人民医院 200011);高桑美代子 佐藤和子 佐藤温重(日本东京医科齿科大学齿学部第二理工教室)
关键词:复合树脂类;单体;细胞毒性;牙髓;细胞
实用口腔医学杂志000404〔摘要〕目的:评价复合树脂单体对人牙髓的毒性作用,探讨不同细胞系对检测敏感性的影响。方法:选用人牙髓细胞(LSC)为实验细胞,以L-929小鼠成纤维细胞作为对照细胞系,采用MTT比色分析法,对两种牙科用复合树脂单体(TEGDMA和UDMA)进行体外细胞毒性研究。结果:在低于IC50的各浓度组中,LSC细胞的生存率高于L-929细胞;MTT比色法作为一种能定量检测牙科材料细胞毒性的有效方法,实验时应注重考虑实验细胞的生长活力和倍增时间,及时调整细胞的接种量。结论:人牙髓细胞比小鼠成纤维细胞更具有模拟临床的应用价值;IC50的确对于估测残留单体的毒性以及材料-细胞接触浓度具有重要重义。
, 百拇医药
中图分类号:R783.1 文献标识码:A
文章编号:1001-3733(2000)04-0264-04
Study on cytotoxicity of dental resin monomer exposed to human pulp cells
Sun Jiao,Michiyo Takawuwa,Kazuko Sato,et al.
(NO.9 People's Hospital,Shanghai Second Medical University,Shanghai 200011)
〔Abstracts〕Objective:To evaluate the cytotoxicity of dental resin monomer exposed to human pulp cells and to investigate the sensitivity of different cell lines to the monomer.Method:Cytotoxicity of dental resin monomer against L-929 cell line and a transformed human dental pulp cell line(LSC) was investigated with MTT assay.Results:The IC50 values of the monomer against L-929 and LSC cells were 31 and 34 mg/L respectively.The relative viability of LSC cells was higher than that of L-929 cells when the concentration of monomer was lower than IC50.Conclusion:LSC cells may be more feasible in the cytotoxicity test.Because they mimic clinical condition,it is important to determine IC50 for assessing the toxicity of residual monomer and cell-materials contacting concentration.
, 百拇医药
Key Words Composite resins;Monomers;Cytotoxicity,Dental pulp;Cell
复合树脂是目前临床上较常用的一类牙科修复材料,其中关于残留单体对活髓牙的刺激问题已越来越引起人们的关注。究竟多少微量浓度的单体会产生对牙髓组织的毒性作用?显然有必要进行体外细胞毒性的评价研究。有关细胞毒性试验的方法,国内外已有不少报道,比如同位素吸取或释放〔1〕、蛋白质含量测定〔2〕、细胞计数〔3〕、活性染料吸取〔4〕、涉及范围的测定〔5〕以及酶活性测定方法〔6〕等等。这些检测技术从不同角度反映了被测材料对实验细胞的毒性作用。本研究选用MTT(四唑盐)比色法,首先在确定IC50(引起半数细胞死亡的浓度值)的基础上,通过测定活细胞内线粒体脱氢酶的活性,来探讨复合树脂单体的含量与细胞毒性的关系。由于MTT法最初是用于免疫学领域,在牙科材料的检测方面尚欠成熟,特别是关于细胞的初接种浓度,这与实验的成功与否以及数据的可信度密切相关,本文将在这方面作些探讨。另外,结合被测材料是属于间接地与牙髓组织接触的实际,本研究选择了人牙髓细胞作为实验细胞,其目的在于使实验结果更接近临床应用状况。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 细胞系 实验采用培养2~3 d处于对数生长期的人牙髓细胞(LSC)和小鼠成纤维细胞(L-929)。
1.1.2 培养基 α-MEM(alpha modification of Eagles medium)用于LSC细胞的培养,Eagle MEM(minimum essential medium)用于L-929细胞的培养,两种培养基中均有体积分数(φ)=10%的小牛血清(FBS)。
1.1.3 复合树脂单体 TEGDMA(tri-etylene glycole di-methacrylate)和UDMA(Urethane dimethacrylete) 均由日本东京医科齿科大学提供,TEGDMA由于能溶于水,可用不含FBS的培养液直接配成终浓度从10~900 mg/L的不同试验组,UDMA因不溶于水,需先借助有机溶剂二甲亚砜和界面活性剂(单体∶二甲亚砜∶活性剂=12∶3∶5),然后用无FBS的培养液配成终浓度为5~50 mg/L的各试验组。
, 百拇医药
1.1.4 主要试剂 配制5 g/L MTT[3-(4-5-demethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide]液,溶剂为PBS(-);以及200 g/L SDS液sodium dodecyl sulfate),溶液为0.01 mol/L盐酸。
1.2 试验方法
实验前首先测定实验细胞的活力及细胞倍增时间,然后确定细胞接种浓度与获取细胞的时间。实验取96孔塑料培养板2块,每种材料各用1块,每浓度组为8孔,每孔注入200 μl细胞悬液,其中含细胞数5×103/孔(LSC细胞)和2×103/孔(L-929细胞),细胞经48 h贴壁培养后,吸弃150 μl原培养液,加入50 μl新鲜培养液和100 μl材料试液(由低浓度到高浓度),空白对照为含细胞、不加入任何试剂的同类培养液,继续在37 ℃含φ(CO2)=5%和一定湿度的培养箱中培养48 h,然后弃100 μl,每孔加入10 μ1 MTT液,置入培养箱中4 h,接着取出培养板,每孔加入100 μl 200 g/L SDS液,37 ℃下放置24 h,经充分振荡后,在多孔扫描分光光度仪(labsystems multiskam bichromatic)下以570 nm和630 nm两个波长段测其吸光度值。
, 百拇医药
1.3 评价指标
以空白对照组的吸光度值作为100%细胞生存率,各浓度组的相对生存率可依照下式求得。根据剂量与生存率变化曲线,可直接获得50%生存率时的毒性剂量,即IC50和90%生存率时的剂量,即IC10.
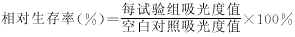
2 结果
培养2 d后,2组浓度的TEGDMA单体和空白对照在倒置显微镜下观察结果见图1。从图中可以看到,无论是细胞形态还是数量,随着单体浓度的增加,2种细胞株都表现出程度不同的细胞毒性。2种复合树脂单体的剂量与细胞生存率变化曲线见图2;IC50和IC10值见表1。由图表可见,当低于IC50剂量时,2种单体均随单体浓度的递增,细胞相对生存率逐渐下降,同时LSC细胞的细胞生存率高于L-929细胞,其差异程度因不同材料而异;而当高于IC50剂量时,细胞生存率则急剧下跌,此时2种细胞的反应却无明显差别。实验结果表明,细胞相对生存率反映了细胞毒性的程度。



, http://www.100md.com
a对照组 b 100 mg/L组 c 450 mg/L组



d对照组 e 100 mg/L组 f 450 mg/L组
图1 倒置显微镜下不同单体浓度对LSC细胞(上)和L-929细胞(下)的影响。(Bar 50μm)

图2 剂量与细胞生存率变化曲线
表1 2种单体的IC50和IC10 (mg/L) 细胞种系
, 百拇医药
TEGDMA
UDMA
IC50
IC10
IC50
IC10
LSC
620
10
34
18
, 百拇医药 L-929
400
7
31
9
3 讨论
在牙科材料的细胞毒性检测试验中,一个比较重要的问题是如何确定受试材料与细胞的接触剂量。以往的细胞毒性试验多数采用的是固体材料的直接接触,或者是制成材料浸提液(浸提介质∶试样表面积=10 ml∶1 cm2),选择50%浸提液作为实验用剂量[7],最终给予毒性评价。这种方法在一定程度上有实验者的主观性,有可能会出现实验结果的假阴性或假阳性。究竟多少含量的有毒物质能被浸出?50%浸提液中又含多少浓度的有害物质?这些仍是未知数。如果在检测细胞毒性前首先确定一个能引起半数细胞死亡的浓度值(IC50),即细胞生存率为50%的剂量,然后选择几组小于IC50的试验剂量,这样,就能较客观地反映受试材料致细胞毒性的剂量浓度。本文就是基于这种设想,对牙科常用的复合树脂单体进行定量细胞毒性评价。由于临床上固化后残余单体存在对牙髓组织的刺激和毒性作用,本研究结果既提供了IC50毒性剂量,又显示了达到90%细胞生存率的单体浓度。同时也避免了单一浓度(50%浸提液)可能带来的主观盲目性,比较客观地反映单体含量与细胞毒性之间的关系。这一实验数据可揭示只要测定固化后残余单体的含量,就可估测该复合树脂的潜在细胞毒性作用,对材料的研制和临床应用具有实际指导意义。
, http://www.100md.com
细胞毒性试验的实验对象是细胞,如何选择实验细胞系,使实验结果更接近临床应用状况,这在细胞相容性评价中是个不容忽视的问题。曾经有一些文献报道,不同的细胞系会出现不同的毒性结果。本文结合受试材料的应用特点,即间接与牙髓组织接触,选用人牙髓细胞为实验细胞,尽可能摸拟临床实际,并以在牙科材料体外细胞毒性检测中常用的L-929细胞作为对照细胞系,观察2种细胞系之间的差异性。结果表明在低于IC50毒性剂量的各浓度组,2种单体都出现L-929细胞比LSC细胞的耐受性差的现象,即在同一浓度组LSC细胞的生存率高于L-929细胞。由此可见人牙髓细胞对毒物的耐受可能大于L-929细胞,采用人牙髓细胞作为评价体外细胞毒性的实验细胞是可取而具有应用价值的。
MTT法是一种检测存活细胞线粒体内脱氢酶活性的试验方法。其原理是这种脱氢酶能够使淡黄色可溶性的MTT分子还原成不溶于水的紫色结晶物〔8〕,而该结晶可溶于SDS有机溶剂,通过比色测定,可直接获得细胞的存活及代谢情况。此方法具有灵敏、简便、能客观定量的优点,近年来已逐渐被对生物材料和牙科材料的细胞毒性评价所采用〔9,10〕。然而,要得到一个重复性好、可信度高的实验结果,以下两个因素不容忽视:①实验细胞生长活力测定,对于不同种系细胞,或者同种细胞在不同的实验室中培养,细胞生长活力是有差异的,正式实验前必须选择达到90%以上活力的细胞进行实验,并绘制细胞生长代谢的标准曲线;②细胞倍增时间的确定,了解实验细胞的细胞倍增时间,(比如,LSC细胞倍增时间为15~18 h),对于确定接种时的细胞量以及实验终止期是有益的。因为96孔板每孔能贴壁生长的细胞数大约是102~105范围内,如果接种的细胞浓度过高,在获取细胞前,孔内细胞已老化脱落,显然影响了实验结果的正确评价。本文在正式实验前对上述两个方面都进行了一定的摸索。首先是测定实验细胞的活力应大于90%,然后确定了细胞的倍增时间,最后根据获取细胞的时间确定细胞接种量分别为5×103/孔(LSC细胞)和2×103/孔(L-929细胞)。这样的实验设计保证了实验数据的科学性和可重复性。
, 百拇医药
参考文献
1,Caughman W F,Caughman G B,Shilett R A,et al.Correlation of cytotoxicity,filler loading and curing time of dental composites,Biomaterials,1991,12:737
2,Naji A,Harmand M F.Study of the effect of the surface state on the cytocompatibility of a Co-Cr alloy using human osteoblasts.J Biomed Mater Res,1990,24:861
3,Rosdy M,Grisoni B,Glauss L C.Proliferation of normal human keratinocytes on silicone substrates.Biomaterials,1991,12:511
, http://www.100md.com
4,Hansen M B,Nielsen S E,Berg K.Re-examination and further development of a precise and rapid dye method for measuring cell growth/cell kill.J Immunol Methods,1989,119:203
5,Hanawa T,Kaga M,Itoh Y,et al.Cytotoxicities of oxides,phosphates and sulphides of metals.Biomaterials,1992,13:20
6,Wenz L M,Merritt K,Brown S A,et al.In vitro biocompatibility of polyetherketone and polysulrone composites.J Biomed Mater Res,1990,24:207
, 百拇医药
7,张彩霞,孙皎,孟爱英.紫外分光光度仪测定不同含铜量银汞合金细胞毒性的新方法.中华口腔医学杂志,1990,25(4):216
8,Mosmann T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays.J Immunol Methods,1983,65(1~2):55
9,Ciapetti G,Cenni E,Pratelli L,et al.In vitro evaluation of cell/biomaterial interaction by MTT assay.Biomaterials,1993,14(5):359
10,吕晓迎,Kappert HF.牙科材料细胞毒性评定的新方法(MTT试验).中华口腔医学杂志,1995,30(6):377
收稿:1999-08-18
修回:1999-11-09, http://www.100md.com