抗乙型肝炎病毒新药——拉米呋啶
作者:刘闯飞
单位:中山医科大学附属第一医院药学部, 广州 510080
关键词:拉米呋啶;核苷;乙型肝炎;病毒
中国新药杂志000305 摘要 综述拉米呋啶(lamivudine,3TC)作为新一代核苷类高效抗乙肝病毒药物的作用机制和特点、药代动力学、临床疗效及不良反应。
LAMIVUDINE——A NEW ANTI-VIRAL AGAINST FOR TREATMENT OF HEPATITIS B
Liu Chuangfei
(The First Affiliated Hospital of Sun Yatsen University of Medical Sciences,Guangzhou 510080)
, 百拇医药
ABSTRACT The mechanism of action,acharacteristics,parmacokinetics,clinical efficacy and side-effects of lamivudine, a new anti-viral agent for treatment of hepatitis B, is reviewed.
KEY WORDS Lamivudine;Nucleoside;Hepatitis B;Virus
慢性乙型肝炎病毒(HBV)是一种病原明确的感染性疾病,对于已形成的慢性HBV感染者,抗病毒化疗是一种重要治疗措施。拉米呋啶(lamivudine,3TC)是一种新一代核苷类高效抗乙肝、丙肝病毒药物[1],与干扰素合用有协同作用。3TC是核苷类似物,全称2',3'-双脱氧-3'-硫胞嘧啶核苷((1)-β-L-2',3'-dideoxy-3'-thiacytidine),是抗乙型肝炎病毒活性最强抗病毒药之一,其结构式[2]为: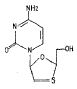
, 百拇医药
1 3TC作用机制及特点
3TC要发挥抗病毒作用必须先在细胞内磷酸化,形成3TC的5'三磷酸盐(3TC-TP),主要为抑制病毒复制必需的逆转录酶活性[3,4]。目前认为3TC有三种可能的机制抑制病毒复制:①3TC-TP与磷酸脱氧胞嘧啶核苷(dCTP)竞争HBV和HCV等多聚酶的三磷酸核苷结合部位;②3TC-TP导致HBV和HCV等反转录酶、多聚酶的不可逆性及剂量依赖性抑制;③3TC-TP掺入病毒 DNA并导致链终止。3TC仅抑制病毒 DNA的复制量及其复制中间体的产量,而对病毒 RNA、病毒抗原和已形成的共价闭环、超螺旋结构的病毒 DNA无作用。HBV及其抗原自肝细胞内的彻底清除,要靠机体自身的特异性免疫清除及病毒抗原的自然半衰期。
3TC的抗病毒作用具有下列特点[5~7]:①在体外或体内实验中,对 HBV-DNA逆转酶有抑制作用;②需长期用药,因短期应用仅有暂时效果;③如与其他不同作用靶点的药物联合应用,有提高疗效、降低耐药性发生的可能;④与干扰素合用有协同作用;⑤能增强机体T细胞的特异性抗病毒能力;⑥经过长期的治疗后,病毒可能出现变异和耐受性。
, 百拇医药
2 3TC的基础研究进展
2.1 体外细胞、动物实验 用2.2.15细胞株作为HBV慢性感染的细胞模型证实,3TC能有效抑制HBV复制。IC50为3.7 nmol/L; 而对肝细胞的细胞毒性作用IC50为30μmol/L[8]。感染HBV的黑猩猩使用后血清中HBV迅速消失,低于可测水平,但对土拔鼠HBV的共价闭合环状DNA(cccDNA)在较长疗程仍无消除作用[9]。
2.2 药代动力学 在土拔鼠中的代谢呈剂量依赖性,300mg以上在人体内的t1/2与土拔鼠相似,分别为2.4及2.0h。对非病毒性肝炎所致的肝功能异常者,应用此药安全,未改变其t1/2,也未见有严重的不良反应。土拔鼠静脉给药20mg/kg,终末半衰期t1/2为(2.84±0.85)h;系统清除率为(0.22±0.078)L/(kg.h),稳态分布容积为(0.75±0.13)L/kg。主要经肾排泄,肾清除率为(0.063±0.016)L/(kg.h),口服生物利用度为18%~54%[10]。又有报道比较不同剂型的3TC在100mg剂量给药时人体药代动力学,静脉给药中数系统清除率(CV)为22.6 L/h (15%),中数表观容积99 L (28%),终末t1/2为8.41~9.11 h。口服剂型胶囊、片剂绝对生物利用度为80%~88%,中数残留时间(MRT)为4.42~5.77h[11]。
, 百拇医药
3 3TC的临床研究进展
3.1 适应证 3TC可用于慢性乙型肝炎及活动性肝硬化患者的治疗及预防和治疗肝移植后HBV再感染。急性乙型肝炎尽管未见报道,但理论上讲是可行的。
HBeAg(+)及ALT正常的HBV“健康”携带者(免疫耐受期)使用3TC不能清除HBV,停药后HBV复制水平回复至治疗前水平。长期服用3TC能否预防肝炎发作和肝癌发生有待研究。血清HBeAg和HBV DNA均阴性、ALT持续正常的HBsAg携带者(静止期),由于HBV复制基本停止,使用3TC意义不大。
由于3TC主要通过抑制HBV DNA而发挥缓解肝脏炎症的作用,因此对起病急骤、血清HBV DNA阴性的暴发型肝炎治疗意义不大。但对病程较长且血清HBV DNA阳性的亚急性重型肝炎、慢性重型肝炎则有治疗意义。3TC能迅速抑制HBV复制,减少新表达的靶抗原量,使炎症反应逐渐缓解。还可同时使用糖皮质激素,能抑制过强的免疫反应,又不致造成HBV复制增加。
, http://www.100md.com
3.2 HBV携带者 尽管3TC也有成功治疗HBV携带者的报道[12],但总的来说,3TC治疗HBV的携带者疗效不佳。Lai等[13]使用3TC随机单盲分组治疗HBeAg阳性的HBV携带者42例,用药4周。结果用药组血清HBV DNA减少98%,血清HBeAg无变化。停药后2~3周,HBV DNA水平即恢复到治疗前水平,ALT无变化。
处于免疫耐受期的HBV携带者,机体缺乏对HBV感染肝细胞的免疫杀伤作用,因此使用3TC治疗只能暂时抑制HBV复制,难以达到清除病毒的目的。由于患者无明显肝损伤,3TC治疗不能减轻病情,停药后亦无ALT反跳及病情加重,治疗意义不大。
3.3 慢性乙型肝炎的治疗[14~18] 迄今为止3TC在全球范围内已进行了Ⅱ期和Ⅲ期的大量临床试验,其中最大系列、服药最长是在我国内地(429例)、香港、台湾和新加坡(358例),服药达1~2年以上,香港等地的研究对治疗前后作了肝活检。总的来说,服用3TC 100mg/d,于2~4周时血清HBV DNA水平明显下降,12周时HBV DNA累计阴转率达90%以上, 52周时持续HBV DNA阴转率为 80%,ALT持续复常率为60%, HBeAg/抗HBe血清转换率为 5%~8%。在第 52周时肝活检复查,肝脏坏死炎症程度明显改善,肝纤维化的进展也比安慰组少。
, 百拇医药
4 国内外研究3TC治疗慢性乙型肝炎的经验
Dienstag等[14]选择上述短期治疗后HBeAg仍阳性的患者24例,口服3TC 100mg/d,持续18个月。连续2月HBsAg(阴性)者停用3TC。结果显示:①长疗程3TC治疗能很好耐受;②在治疗过程中有87%的患者血清HBV DNA持续阴性;③HBV的抑制伴有ALT水平的下降;④有2例迟发性3TC耐药;⑤与<3个月疗程3TC治疗相比,HBeAg清除提高3倍(39%比<12%);⑥HBsAg清除可在3TC治疗后获得,有2例HBsAg阴转。
Lai等[15]报道358例中国患者使用3TC治疗的结果。将患者随机分为3组,25mg/d组142例,100mg/d组143例,安慰剂组73例,疗程52周。结果肝组织学改善者25mg组59%,100mg组为67%,对照组为30%;坏死、炎症加重者3组分别为10%,7%和32%;ALT持续正常者分别为65%,72%和24%;治疗第52周血中HBV DNA水平降低分别为96%,98%和54%;100mg组有16%的患者血清HBeAg转化为抗-HBe,安慰剂组仅4%;肝纤维化加重者100mg组为3%,安慰剂组为15%;服3TC者有14%对该药无反应。因此,100mg/d 3TC可使慢性乙型肝炎患者肝组织学明显改善,并能提高HBeAg-抗HBe转化率。Honkoop等[16]报道51例随机分为25,100,300mg/d的3TC组, 12周HBV DNA至采用PCR(聚合酶链反应)技术不能测出水平的12%;24周至26%;另有20%降至刚可检测的水平。
, 百拇医药
姚光弼等[17]报道322例慢性乙型肝炎患者用3TC治疗(100mg/d),107例患者服用安慰剂作对照,共治疗12周。治疗结束后,两组患者均继续服用3TC 100mg/d至52周。结果治疗12周时3TC组HBV DNA转阴率显著高于安慰剂组(92%对14%);第52周末3TC组和安慰剂/3TC对照组差异无显著性,HBV DNA水平降低接近100%。
慢性乙型肝炎患者是处于免疫清除期的HBV感染者。使用高效的病毒抑制剂后,使肝细胞内HBV复制近乎停止,释放入血中的HBV DNA和抗原减少;免疫清除机制作用的新的靶抗原(主要是HBcAg)合成减少或停止,肝脏炎症亦逐渐减轻或停止;肝细胞内HBV抗原在机体免疫机制作用下逐渐被清除。肝细胞内HBV最终清除与否,主要取决于宿主自身的免疫清除能力。由于慢性乙型肝炎患者用3TC治疗后可以缓解病情,并有可能清除HBV感染,因此是3TC的最佳治疗对象。3TC还可用于伴有HBV复制的肝硬化,甚至失代偿的患者。
, 百拇医药
HBV感染所致终末期肝硬化患者行肝移植后,90%以上患者再次发生HBV感染,使用抗病毒药物可能有预防和治疗再感染的作用。
Markowitz等报道[19]用3TC预防11例肝移植患者再感染HBV,结果术后短期内无1例有再感染证据。Bein等报道4例,术前使血中HBV DNA清除,术后4例均血清HBV DNA PCR检测(-),3例HBeAg,HBsAg(-),3例肝活检HBV PCR(-)。追踪26个月,2例产生耐药。
Perrillo等[20]用3TC治疗52例肝移植后再感染HBV的患者,所有患者于52周治疗后,60%患者血清中HBV DNA消失,病情缓解,14例HBeAg消失,3例HBsAg消失,ALT正常化达71%。另有作者报道治疗4例有2例HBsAg转阴。
HBV所致终末期肝硬化患者为清除期或静止期患者,机体均有较强的HBV特异性清除能力。一旦发生再感染,即可出现明显的肝脏炎症反应。由于使用免疫抑制剂,HBV清除不彻底,导致慢性活动性肝脏炎症,并可在短期内再次形成肝硬化而需再次肝移植。使用3TC预防和治疗移植后HBV再感染是有肯定效果的:①绝大多数患者都能很好耐受;②与乙肝免疫球蛋白 (HBIg)联用能提高预防效果;③能预防和控制移植后HBV再感染所致的肝脏炎症;④部分患者能在机体免疫协同作用下彻底清除HBV;⑤长程使用可有部分患者产生耐药,出现再感染和肝脏活动性炎症。
, http://www.100md.com
5 待探讨及研究的问题
5.1 3TC的不良反应 几乎所有患者均能很好耐受3TC的长期治疗,包括肝移植的患者。常见的不良反应有头痛、头昏、局部肌痛等,偶见有感觉异常和磷酸肌酸激酶(CPK)升高,无血液学及其他生物化学异常改变,也未发生明显骨髓抑制[13,14]。由于3TC不良反应轻微,因此可用于伴有腹水、低蛋白血症、高胆红素血症和失代偿性肝硬化患者。
5.2 3TC的耐药问题[21~23] 3TC是抗HBV最有效的核苷类药物,但在长期使用后,有发生耐药的报道。耐药的发生机制是由于HBV多聚酶上的“酪氨酸-蛋氨酸-天门冬氨酸-天门冬氨酸”(YMDD)主型(motif)发生突变所致。慢性乙型肝炎患者应用3TC长期治疗后,HBV由于选择作用,出现病毒的变异,称为YMDD HBV变异株。大多数的变异系在HBV聚合酶基因(POL基因)第 741个核苷部位,腺嘌呤(A)被鸟嘌呤(G)所置换,因而第 552个 YMDD (酪、蛋、门冬、门冬氨酸)分子中的蛋氨酸被缬氨酸所取代,称为 Ⅰ型 YMDD变异。另一种较少见743个核苷的鸟嘌呤(G)被胸腺嘧啶(T)所置换,第 522个 YMDD的蛋氨酸被异亮氨酸所取代,称为 Ⅱ型 YMDD变异。 Ⅰ型 YMDD常伴有POL基因 669个核苷 C/T→A的置换,使第528个亮氨酸被蛋氨酸取代。
, 百拇医药
分子生物学研究表明,YMDD变异株的复制能力低于原来的野生株。所以,YMDD变异株出现后,患者血清HBV DNA的水平低于治疗前水平。当停止应用3TC治疗后,野生株通常会替代变异株。YMDD变异株在3TC治疗6个月以上出现,治疗前HBV DNA高水平、肝活检HAI积分较高和体重较高的患者,易发生HBV变异。当YMDD变异发生时,可有暂时性ALT增高,并有轻度乏力、恶心等肝脏炎症损伤加剧等症状。研究人员用3TC治疗满1年的396例患者中,在治疗48周时HBV发生变异者有48例(12%)。在此48例中,20例(42%)血清HBV DNA在48周时阳性(>1.6pg/ml),42例(87.5%)HBV DNA低于治疗前水平。48例HBV变异的患者中,37例(77%)ALT为正常,42例(87.5%)的ALT低于治疗前水平。绝大多数患者在继续用3TC治疗过程中仍有临床疗效。另一项研究表明,发生YMDD变异患者继续用3TC治疗,其肝组织学的改善优于安慰剂组。所以我们认为在治疗过程中即使出现YMDD变异,仍需继续治疗,但应注意。
, 百拇医药 有关3TC治疗重症肝炎的资料尚未见报道,有必要进行相关的临床探索。
致谢:符立梧教授校稿。
参考文献
1,Main J,McCarron B, Thomas HC.Treatment of chronic viral hepatitis. Antivir Chem Chemother,1998,9(6)∶449
2,Brind AM, Bennett MK, Bassendine MF.Nucleoside analogue therapy in fibrosing cholestatic hepatitis——a case report in an HBsAg positive renal transplant recipient. Liver, 1998,18(2)∶134
, 百拇医药
3,Jaeckel E, Manns MP. Experience with lamivudine against hepatitis B virus. Intervirology, 1997,40(5-6)∶ 322
4,Bruch HR, Hohner U, Muller R. Hepatitis B and C: current therapy. Schweiz Rundsch Med Prax, 1998,87(42)∶ 1408
5,Angus PW. Review: hepatitis B and liver transplantation. J Gastroenterol Hepatol, 1997,12(3)∶217
6,Boni C, Bertoletti A, Penna A, et al. Lamivudine treatment can restore T cell responsiveness in chronic hepatitis B. J Clin Invest, 1998,102(5)∶968
, 百拇医药
7,Perry CM, Faulds D. Lamivudine. A review of its antiviral activity, pharmacokinetic properties and therapeutic efficacy in the management of HIV infection. Drugs, 1997,53(4)∶657
8,Mason WS, Cullen J, Moraleda G, et al. Lamivudine therapy of WHV-infected woodchucks. Virology, 1998,245(1)∶18
9,Yamanaka G, Wilson T, Innaimo S, et al. Metabolic studies on BMS-200475, a new antiviral compound active against hepatitis B virus. Antimicrob Agents Chemother, 1999,43(1)∶190
, 百拇医药
10,Rajagopalan P, Boudinot FD, Chu CK, et al. Pharmacokinetics of (-)-2'-3'-dideoxy-3'-thiacytidine in woodchucks. Antimicrob Agents Chemother, 1996,40(3)∶ 642
11,Yuen GJ, Morris DM, Mydlow PK, et al. Pharmacokinetics, absolute bioavailability, and absorption characteristics of lamivudine. J Clin Pharmacol, 1995,35(12)∶1174
12,Handa K, Inoue K, Sekiyama K, et al. Successful treatment of an HB carrier developing severe hepatitis using lamivudine——case report. Nippon Shokakibyo Gakkai Zasshi, 1998,95(10)∶1136
, http://www.100md.com
13,Lai CL, Ching CK, Tung AKM, et al. Lamivudine is effective in suppressing hepatitis B virus DNA in chinese. hepatitis B surface antigen carriers∶ a placebo-controlled trial. Hepatology, 1997, 25(1)∶ 242
14,Dienstag JL, Schiff ER, Mitchell M, et al. Extended lamivudine retreatment for chronic hepatitis B. Hepatology, 1996, 24(1)∶188A
15,Lai CL, Chien RN, Leung NW, et al. A one-year trial of lamivudine for chronic hepatitis B. Asia Hepatitis Lamivudine Study Group. N Engl J Med, 1998, 339(2)∶61
, http://www.100md.com
16,Honkoop P, de-Man RA, Niesters HG, et al. Quantitative hepatitis B virus DNA assessment by the limiting-dilution polymerase chain reaction in chronic hepatitis B patients: evidence of continuing viral suppression with longer duration and higher dose of lamivudine therapy. J Viral Hepat, 1998, 5(5)∶307
17,姚光弼,王宝恩,崔振宇,等.拉米呋啶治疗慢性乙型肝炎患者的长期疗效.中华肝脏病杂志,1999,7(2)∶80
18,Nevens F, Main J, Honkoop P, et al. Lamivudine therapy for chronic hepatitis B: a six-month randomized dose-ranging study. Gastroenterology, 1997, 113(4)∶1258
, http://www.100md.com
19,Markowitz J, Pakrasi A, Hollis P, et al. Efficacy of lamivudine for prophylaxis and treatment of hepatitis B in liver transplant patients. Hepatology, 1996, 24(1)∶182A
20,Perrillo R,Rakela J,Dienstag J, et al. Multicenter study of lamivudine therapy for hepatitis B after liver transplantation.Lamivudine Transplant Group.Hepatology, 1999,29(5)∶1581
21,Tipples GA, Ma MM, Fischer KP, et al. Mutation in HBV RNA-dependent DNA polymerase confers resistance to lamivudine in vivo. Hepatology, 1996, 24(3)∶714
, 百拇医药
22,Ladner SK, Miller TJ, Otto MJ,et al. The hepatitis B virus M539V polymerase variation responsible for 3TC resistance also confers cross-resistance to other nucleoside analogues. Antivir Chem Chemother, 1998, 9(1)∶65
23,Liaw YF, Chien RN, Yeh CT, et al. Acute exacerbation and hepatitis B virus clearance after emergence of YMDD motif mutation during lamivudine therapy [see comments]. Hepatology, 1999,30(2)∶ 567
收稿:1999-08-18
修回:2000-01-04, http://www.100md.com
单位:中山医科大学附属第一医院药学部, 广州 510080
关键词:拉米呋啶;核苷;乙型肝炎;病毒
中国新药杂志000305 摘要 综述拉米呋啶(lamivudine,3TC)作为新一代核苷类高效抗乙肝病毒药物的作用机制和特点、药代动力学、临床疗效及不良反应。
LAMIVUDINE——A NEW ANTI-VIRAL AGAINST FOR TREATMENT OF HEPATITIS B
Liu Chuangfei
(The First Affiliated Hospital of Sun Yatsen University of Medical Sciences,Guangzhou 510080)
, 百拇医药
ABSTRACT The mechanism of action,acharacteristics,parmacokinetics,clinical efficacy and side-effects of lamivudine, a new anti-viral agent for treatment of hepatitis B, is reviewed.
KEY WORDS Lamivudine;Nucleoside;Hepatitis B;Virus
慢性乙型肝炎病毒(HBV)是一种病原明确的感染性疾病,对于已形成的慢性HBV感染者,抗病毒化疗是一种重要治疗措施。拉米呋啶(lamivudine,3TC)是一种新一代核苷类高效抗乙肝、丙肝病毒药物[1],与干扰素合用有协同作用。3TC是核苷类似物,全称2',3'-双脱氧-3'-硫胞嘧啶核苷((1)-β-L-2',3'-dideoxy-3'-thiacytidine),是抗乙型肝炎病毒活性最强抗病毒药之一,其结构式[2]为:

, 百拇医药
1 3TC作用机制及特点
3TC要发挥抗病毒作用必须先在细胞内磷酸化,形成3TC的5'三磷酸盐(3TC-TP),主要为抑制病毒复制必需的逆转录酶活性[3,4]。目前认为3TC有三种可能的机制抑制病毒复制:①3TC-TP与磷酸脱氧胞嘧啶核苷(dCTP)竞争HBV和HCV等多聚酶的三磷酸核苷结合部位;②3TC-TP导致HBV和HCV等反转录酶、多聚酶的不可逆性及剂量依赖性抑制;③3TC-TP掺入病毒 DNA并导致链终止。3TC仅抑制病毒 DNA的复制量及其复制中间体的产量,而对病毒 RNA、病毒抗原和已形成的共价闭环、超螺旋结构的病毒 DNA无作用。HBV及其抗原自肝细胞内的彻底清除,要靠机体自身的特异性免疫清除及病毒抗原的自然半衰期。
3TC的抗病毒作用具有下列特点[5~7]:①在体外或体内实验中,对 HBV-DNA逆转酶有抑制作用;②需长期用药,因短期应用仅有暂时效果;③如与其他不同作用靶点的药物联合应用,有提高疗效、降低耐药性发生的可能;④与干扰素合用有协同作用;⑤能增强机体T细胞的特异性抗病毒能力;⑥经过长期的治疗后,病毒可能出现变异和耐受性。
, 百拇医药
2 3TC的基础研究进展
2.1 体外细胞、动物实验 用2.2.15细胞株作为HBV慢性感染的细胞模型证实,3TC能有效抑制HBV复制。IC50为3.7 nmol/L; 而对肝细胞的细胞毒性作用IC50为30μmol/L[8]。感染HBV的黑猩猩使用后血清中HBV迅速消失,低于可测水平,但对土拔鼠HBV的共价闭合环状DNA(cccDNA)在较长疗程仍无消除作用[9]。
2.2 药代动力学 在土拔鼠中的代谢呈剂量依赖性,300mg以上在人体内的t1/2与土拔鼠相似,分别为2.4及2.0h。对非病毒性肝炎所致的肝功能异常者,应用此药安全,未改变其t1/2,也未见有严重的不良反应。土拔鼠静脉给药20mg/kg,终末半衰期t1/2为(2.84±0.85)h;系统清除率为(0.22±0.078)L/(kg.h),稳态分布容积为(0.75±0.13)L/kg。主要经肾排泄,肾清除率为(0.063±0.016)L/(kg.h),口服生物利用度为18%~54%[10]。又有报道比较不同剂型的3TC在100mg剂量给药时人体药代动力学,静脉给药中数系统清除率(CV)为22.6 L/h (15%),中数表观容积99 L (28%),终末t1/2为8.41~9.11 h。口服剂型胶囊、片剂绝对生物利用度为80%~88%,中数残留时间(MRT)为4.42~5.77h[11]。
, 百拇医药
3 3TC的临床研究进展
3.1 适应证 3TC可用于慢性乙型肝炎及活动性肝硬化患者的治疗及预防和治疗肝移植后HBV再感染。急性乙型肝炎尽管未见报道,但理论上讲是可行的。
HBeAg(+)及ALT正常的HBV“健康”携带者(免疫耐受期)使用3TC不能清除HBV,停药后HBV复制水平回复至治疗前水平。长期服用3TC能否预防肝炎发作和肝癌发生有待研究。血清HBeAg和HBV DNA均阴性、ALT持续正常的HBsAg携带者(静止期),由于HBV复制基本停止,使用3TC意义不大。
由于3TC主要通过抑制HBV DNA而发挥缓解肝脏炎症的作用,因此对起病急骤、血清HBV DNA阴性的暴发型肝炎治疗意义不大。但对病程较长且血清HBV DNA阳性的亚急性重型肝炎、慢性重型肝炎则有治疗意义。3TC能迅速抑制HBV复制,减少新表达的靶抗原量,使炎症反应逐渐缓解。还可同时使用糖皮质激素,能抑制过强的免疫反应,又不致造成HBV复制增加。
, http://www.100md.com
3.2 HBV携带者 尽管3TC也有成功治疗HBV携带者的报道[12],但总的来说,3TC治疗HBV的携带者疗效不佳。Lai等[13]使用3TC随机单盲分组治疗HBeAg阳性的HBV携带者42例,用药4周。结果用药组血清HBV DNA减少98%,血清HBeAg无变化。停药后2~3周,HBV DNA水平即恢复到治疗前水平,ALT无变化。
处于免疫耐受期的HBV携带者,机体缺乏对HBV感染肝细胞的免疫杀伤作用,因此使用3TC治疗只能暂时抑制HBV复制,难以达到清除病毒的目的。由于患者无明显肝损伤,3TC治疗不能减轻病情,停药后亦无ALT反跳及病情加重,治疗意义不大。
3.3 慢性乙型肝炎的治疗[14~18] 迄今为止3TC在全球范围内已进行了Ⅱ期和Ⅲ期的大量临床试验,其中最大系列、服药最长是在我国内地(429例)、香港、台湾和新加坡(358例),服药达1~2年以上,香港等地的研究对治疗前后作了肝活检。总的来说,服用3TC 100mg/d,于2~4周时血清HBV DNA水平明显下降,12周时HBV DNA累计阴转率达90%以上, 52周时持续HBV DNA阴转率为 80%,ALT持续复常率为60%, HBeAg/抗HBe血清转换率为 5%~8%。在第 52周时肝活检复查,肝脏坏死炎症程度明显改善,肝纤维化的进展也比安慰组少。
, 百拇医药
4 国内外研究3TC治疗慢性乙型肝炎的经验
Dienstag等[14]选择上述短期治疗后HBeAg仍阳性的患者24例,口服3TC 100mg/d,持续18个月。连续2月HBsAg(阴性)者停用3TC。结果显示:①长疗程3TC治疗能很好耐受;②在治疗过程中有87%的患者血清HBV DNA持续阴性;③HBV的抑制伴有ALT水平的下降;④有2例迟发性3TC耐药;⑤与<3个月疗程3TC治疗相比,HBeAg清除提高3倍(39%比<12%);⑥HBsAg清除可在3TC治疗后获得,有2例HBsAg阴转。
Lai等[15]报道358例中国患者使用3TC治疗的结果。将患者随机分为3组,25mg/d组142例,100mg/d组143例,安慰剂组73例,疗程52周。结果肝组织学改善者25mg组59%,100mg组为67%,对照组为30%;坏死、炎症加重者3组分别为10%,7%和32%;ALT持续正常者分别为65%,72%和24%;治疗第52周血中HBV DNA水平降低分别为96%,98%和54%;100mg组有16%的患者血清HBeAg转化为抗-HBe,安慰剂组仅4%;肝纤维化加重者100mg组为3%,安慰剂组为15%;服3TC者有14%对该药无反应。因此,100mg/d 3TC可使慢性乙型肝炎患者肝组织学明显改善,并能提高HBeAg-抗HBe转化率。Honkoop等[16]报道51例随机分为25,100,300mg/d的3TC组, 12周HBV DNA至采用PCR(聚合酶链反应)技术不能测出水平的12%;24周至26%;另有20%降至刚可检测的水平。
, 百拇医药
姚光弼等[17]报道322例慢性乙型肝炎患者用3TC治疗(100mg/d),107例患者服用安慰剂作对照,共治疗12周。治疗结束后,两组患者均继续服用3TC 100mg/d至52周。结果治疗12周时3TC组HBV DNA转阴率显著高于安慰剂组(92%对14%);第52周末3TC组和安慰剂/3TC对照组差异无显著性,HBV DNA水平降低接近100%。
慢性乙型肝炎患者是处于免疫清除期的HBV感染者。使用高效的病毒抑制剂后,使肝细胞内HBV复制近乎停止,释放入血中的HBV DNA和抗原减少;免疫清除机制作用的新的靶抗原(主要是HBcAg)合成减少或停止,肝脏炎症亦逐渐减轻或停止;肝细胞内HBV抗原在机体免疫机制作用下逐渐被清除。肝细胞内HBV最终清除与否,主要取决于宿主自身的免疫清除能力。由于慢性乙型肝炎患者用3TC治疗后可以缓解病情,并有可能清除HBV感染,因此是3TC的最佳治疗对象。3TC还可用于伴有HBV复制的肝硬化,甚至失代偿的患者。
, 百拇医药
HBV感染所致终末期肝硬化患者行肝移植后,90%以上患者再次发生HBV感染,使用抗病毒药物可能有预防和治疗再感染的作用。
Markowitz等报道[19]用3TC预防11例肝移植患者再感染HBV,结果术后短期内无1例有再感染证据。Bein等报道4例,术前使血中HBV DNA清除,术后4例均血清HBV DNA PCR检测(-),3例HBeAg,HBsAg(-),3例肝活检HBV PCR(-)。追踪26个月,2例产生耐药。
Perrillo等[20]用3TC治疗52例肝移植后再感染HBV的患者,所有患者于52周治疗后,60%患者血清中HBV DNA消失,病情缓解,14例HBeAg消失,3例HBsAg消失,ALT正常化达71%。另有作者报道治疗4例有2例HBsAg转阴。
HBV所致终末期肝硬化患者为清除期或静止期患者,机体均有较强的HBV特异性清除能力。一旦发生再感染,即可出现明显的肝脏炎症反应。由于使用免疫抑制剂,HBV清除不彻底,导致慢性活动性肝脏炎症,并可在短期内再次形成肝硬化而需再次肝移植。使用3TC预防和治疗移植后HBV再感染是有肯定效果的:①绝大多数患者都能很好耐受;②与乙肝免疫球蛋白 (HBIg)联用能提高预防效果;③能预防和控制移植后HBV再感染所致的肝脏炎症;④部分患者能在机体免疫协同作用下彻底清除HBV;⑤长程使用可有部分患者产生耐药,出现再感染和肝脏活动性炎症。
, http://www.100md.com
5 待探讨及研究的问题
5.1 3TC的不良反应 几乎所有患者均能很好耐受3TC的长期治疗,包括肝移植的患者。常见的不良反应有头痛、头昏、局部肌痛等,偶见有感觉异常和磷酸肌酸激酶(CPK)升高,无血液学及其他生物化学异常改变,也未发生明显骨髓抑制[13,14]。由于3TC不良反应轻微,因此可用于伴有腹水、低蛋白血症、高胆红素血症和失代偿性肝硬化患者。
5.2 3TC的耐药问题[21~23] 3TC是抗HBV最有效的核苷类药物,但在长期使用后,有发生耐药的报道。耐药的发生机制是由于HBV多聚酶上的“酪氨酸-蛋氨酸-天门冬氨酸-天门冬氨酸”(YMDD)主型(motif)发生突变所致。慢性乙型肝炎患者应用3TC长期治疗后,HBV由于选择作用,出现病毒的变异,称为YMDD HBV变异株。大多数的变异系在HBV聚合酶基因(POL基因)第 741个核苷部位,腺嘌呤(A)被鸟嘌呤(G)所置换,因而第 552个 YMDD (酪、蛋、门冬、门冬氨酸)分子中的蛋氨酸被缬氨酸所取代,称为 Ⅰ型 YMDD变异。另一种较少见743个核苷的鸟嘌呤(G)被胸腺嘧啶(T)所置换,第 522个 YMDD的蛋氨酸被异亮氨酸所取代,称为 Ⅱ型 YMDD变异。 Ⅰ型 YMDD常伴有POL基因 669个核苷 C/T→A的置换,使第528个亮氨酸被蛋氨酸取代。
, 百拇医药
分子生物学研究表明,YMDD变异株的复制能力低于原来的野生株。所以,YMDD变异株出现后,患者血清HBV DNA的水平低于治疗前水平。当停止应用3TC治疗后,野生株通常会替代变异株。YMDD变异株在3TC治疗6个月以上出现,治疗前HBV DNA高水平、肝活检HAI积分较高和体重较高的患者,易发生HBV变异。当YMDD变异发生时,可有暂时性ALT增高,并有轻度乏力、恶心等肝脏炎症损伤加剧等症状。研究人员用3TC治疗满1年的396例患者中,在治疗48周时HBV发生变异者有48例(12%)。在此48例中,20例(42%)血清HBV DNA在48周时阳性(>1.6pg/ml),42例(87.5%)HBV DNA低于治疗前水平。48例HBV变异的患者中,37例(77%)ALT为正常,42例(87.5%)的ALT低于治疗前水平。绝大多数患者在继续用3TC治疗过程中仍有临床疗效。另一项研究表明,发生YMDD变异患者继续用3TC治疗,其肝组织学的改善优于安慰剂组。所以我们认为在治疗过程中即使出现YMDD变异,仍需继续治疗,但应注意。
, 百拇医药 有关3TC治疗重症肝炎的资料尚未见报道,有必要进行相关的临床探索。
致谢:符立梧教授校稿。
参考文献
1,Main J,McCarron B, Thomas HC.Treatment of chronic viral hepatitis. Antivir Chem Chemother,1998,9(6)∶449
2,Brind AM, Bennett MK, Bassendine MF.Nucleoside analogue therapy in fibrosing cholestatic hepatitis——a case report in an HBsAg positive renal transplant recipient. Liver, 1998,18(2)∶134
, 百拇医药
3,Jaeckel E, Manns MP. Experience with lamivudine against hepatitis B virus. Intervirology, 1997,40(5-6)∶ 322
4,Bruch HR, Hohner U, Muller R. Hepatitis B and C: current therapy. Schweiz Rundsch Med Prax, 1998,87(42)∶ 1408
5,Angus PW. Review: hepatitis B and liver transplantation. J Gastroenterol Hepatol, 1997,12(3)∶217
6,Boni C, Bertoletti A, Penna A, et al. Lamivudine treatment can restore T cell responsiveness in chronic hepatitis B. J Clin Invest, 1998,102(5)∶968
, 百拇医药
7,Perry CM, Faulds D. Lamivudine. A review of its antiviral activity, pharmacokinetic properties and therapeutic efficacy in the management of HIV infection. Drugs, 1997,53(4)∶657
8,Mason WS, Cullen J, Moraleda G, et al. Lamivudine therapy of WHV-infected woodchucks. Virology, 1998,245(1)∶18
9,Yamanaka G, Wilson T, Innaimo S, et al. Metabolic studies on BMS-200475, a new antiviral compound active against hepatitis B virus. Antimicrob Agents Chemother, 1999,43(1)∶190
, 百拇医药
10,Rajagopalan P, Boudinot FD, Chu CK, et al. Pharmacokinetics of (-)-2'-3'-dideoxy-3'-thiacytidine in woodchucks. Antimicrob Agents Chemother, 1996,40(3)∶ 642
11,Yuen GJ, Morris DM, Mydlow PK, et al. Pharmacokinetics, absolute bioavailability, and absorption characteristics of lamivudine. J Clin Pharmacol, 1995,35(12)∶1174
12,Handa K, Inoue K, Sekiyama K, et al. Successful treatment of an HB carrier developing severe hepatitis using lamivudine——case report. Nippon Shokakibyo Gakkai Zasshi, 1998,95(10)∶1136
, http://www.100md.com
13,Lai CL, Ching CK, Tung AKM, et al. Lamivudine is effective in suppressing hepatitis B virus DNA in chinese. hepatitis B surface antigen carriers∶ a placebo-controlled trial. Hepatology, 1997, 25(1)∶ 242
14,Dienstag JL, Schiff ER, Mitchell M, et al. Extended lamivudine retreatment for chronic hepatitis B. Hepatology, 1996, 24(1)∶188A
15,Lai CL, Chien RN, Leung NW, et al. A one-year trial of lamivudine for chronic hepatitis B. Asia Hepatitis Lamivudine Study Group. N Engl J Med, 1998, 339(2)∶61
, http://www.100md.com
16,Honkoop P, de-Man RA, Niesters HG, et al. Quantitative hepatitis B virus DNA assessment by the limiting-dilution polymerase chain reaction in chronic hepatitis B patients: evidence of continuing viral suppression with longer duration and higher dose of lamivudine therapy. J Viral Hepat, 1998, 5(5)∶307
17,姚光弼,王宝恩,崔振宇,等.拉米呋啶治疗慢性乙型肝炎患者的长期疗效.中华肝脏病杂志,1999,7(2)∶80
18,Nevens F, Main J, Honkoop P, et al. Lamivudine therapy for chronic hepatitis B: a six-month randomized dose-ranging study. Gastroenterology, 1997, 113(4)∶1258
, http://www.100md.com
19,Markowitz J, Pakrasi A, Hollis P, et al. Efficacy of lamivudine for prophylaxis and treatment of hepatitis B in liver transplant patients. Hepatology, 1996, 24(1)∶182A
20,Perrillo R,Rakela J,Dienstag J, et al. Multicenter study of lamivudine therapy for hepatitis B after liver transplantation.Lamivudine Transplant Group.Hepatology, 1999,29(5)∶1581
21,Tipples GA, Ma MM, Fischer KP, et al. Mutation in HBV RNA-dependent DNA polymerase confers resistance to lamivudine in vivo. Hepatology, 1996, 24(3)∶714
, 百拇医药
22,Ladner SK, Miller TJ, Otto MJ,et al. The hepatitis B virus M539V polymerase variation responsible for 3TC resistance also confers cross-resistance to other nucleoside analogues. Antivir Chem Chemother, 1998, 9(1)∶65
23,Liaw YF, Chien RN, Yeh CT, et al. Acute exacerbation and hepatitis B virus clearance after emergence of YMDD motif mutation during lamivudine therapy [see comments]. Hepatology, 1999,30(2)∶ 567
收稿:1999-08-18
修回:2000-01-04, http://www.100md.com