盐酸格拉司琼分散片生物等效性评价
作者:熊玉卿 傅颖君 傅军 姜敏 戴群
单位:江西医学院临床药理研究所,南昌 330006
关键词:盐酸格拉司琼;高效液相色谱法;药代动力学;生物等效性
中国新药杂志000712 【摘要】 目的:进行盐酸格拉司琼分散片的药代动力学研究,并与国产盐酸格拉司琼片进行生物利用度的比较。方法:12名健康男性志愿者采用交叉给药方案,分别单剂量口服2mg供试品或对照品后,用高效液相色谱荧光法测定血浆药物浓度。结果:健康志愿者单剂量口服盐酸格拉司琼分散片后体内过程符合开放式血管外一室模型,其Cmax为(7.24±0.86)μg/L,t1/2β为(5.60±0.72)h,Tmax为(1.71±0.26)h,AUC0~24为(59.56±9.84)μg*h/L,与对照品的主要药代动力学参数比较,无显著性差异(P>0.05)。供试品相对于对照品的生物利用度为(101.68±12.35)%。结论:两制剂体内过程相仿,具有生物等效性。
, 百拇医药
【中图分类号】R969.4 【文献标识码】A 【文章编号】1003-3734(2000)07-0468-03
Evaluation of bioequivalence of granisetron HCl dispersible tablet
XIONG Yu-qing FU Ying-jun FU Jun JIANG Min DAI Qun
(Institute of Clinical Pharmacology, Jiangxi Medical College, Nanchang 330006)
【Abstract】 Objective: To study the pharmacokinetics and relative bioquivalence of granisetron HCl tablet and dispersible tablet. Methods: 12 healthy volunteers were treated with a single oral dose of domestic granisetron HCl dispersible tablet or tablet (control)in a randomized crossover study, and their plasma drug concentration were determined by HPLC. Results: The plasma concentration-time curve was fitted to one-compartment model. The pharmacokinetic parameters obtained were: Cmax=(7.24±0.86)μg/L,t1/2β=(5.60±0.72)h,Tmax=(1.71±0.26)h,AUC0~24=(59.56 ±9.84)μg*h/L,without significant difference between the active and control groups. The relative bioavailability obtained was (101.68±12.35)%. Conclusion:The pharmacokinetic profile for the 2 tablets was sim-ilar so it may be concluded that they are bioequivalent.
, 百拇医药
Key words granisetron hydrochloride; HPLC;pharmacokinetics;bioequivalence
盐酸格拉司琼(granisetron hydrocloride)是一种高选择性的5-HT3受体拮抗剂,通过拮抗中枢化学感受区及外周神经末梢的5-HT3受体,抑制由放疗、化疗引起肠嗜铬细胞释放5-HT3,从而激活中枢或神经系统的5-HT3受体而致恶心、呕吐[1]。本试验采用HPLC荧光检测法测定了12名健康志愿受试者口服盐酸格拉司琼分散片(2mg)的经时过程的血药浓度,求出其相应的药代动力学参数,并对其生物等效性作出评价。
材料与方法
1 材料
美国贝克曼高效液相色谱仪(125型溶剂泵)、FL-45A荧光检测器、贝克曼GS-15R高速冷冻离心机。
, 百拇医药
供试品:盐酸格拉司琼分散片(杭州德生医药技术开发有限公司,批号:990106),1mg/片;对照品:盐酸格拉司琼片(宁波市天衡制药厂提供,批号:980401),1mg/片。标准品:盐酸格拉司琼(浙江省药品检验所,批号:970306),含量:99.5%。试剂:甲醇为色谱纯,醋酸钠、三乙胺、乙酸乙酯为分析纯。
志愿者:12名健康男性志愿者,年龄(20±0.9)岁,体重(64.2±4.6)kg,身高(170.5±3.9)cm,试验前经全面体格检查及化验检查,均在正常范围,试验前2周未服用任何药物,试验期间统一进低脂饮食及饮水。不允许吸烟和饮用含酒精或咖啡因的饮料,试验前所有受试者均签署知情同意书。
2 方法
12名受试者随机分成2组(6人/组),受试前12h内禁食,当日早空腹,分别口服盐酸格拉司琼分散片2mg(2片)和盐酸格拉司琼片2mg(2片),服药饮水量150ml,至给药后4h按统一食谱进餐。受试者接受交叉给药供试品和对照品各1次,间隔7d。
, 百拇医药
生物样品采集:服药前及服药后0.5,1.0,1.5,2.0,2.5,3.0,4.0,6.0,8.0,10.0,12.0,24.0h,采集静脉血3ml,置入已用肝素抗凝的试管中,离心分离血浆,置-40℃冰箱保存至测定。
3 血药浓度测定方法
3.1 色谱条件 色谱柱:Beckman CYANO(5μm,4.6mm×150 mm)。流动相为甲醇∶0.05mol/L醋酸钠缓冲液(用0.20%三乙胺调节pH为6.8)=96∶4,流速:1.0ml/min,激发波长302nm,发射波长360nm。
3.2 血样处理 取血浆1.0ml,分2次加入乙酸乙酯3.0ml,旋涡混匀后离心,取上清液50℃水浴挥干,残渣用0.5ml甲醇溶解混旋,高速离心2min,取上清液20μl进样。
3.3 方法学研究 方法专一性:在选定的色谱条件下测得的空白血浆及血样色谱图见图1,血浆中格拉司琼保留时间为5.17min,峰形良好,分离完全(Neff =1.2×104),无内源性杂峰干扰。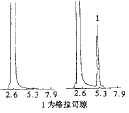
, 百拇医药
图1 空白血样及标准血样色谱图
血样标准曲线:精密称取适量的盐酸格拉司琼标准品,加入少量的甲醇溶解,并用正常人血浆稀释,配制成含盐酸格拉司琼标准品0.25,0.5,1.0,2.0,4.0,8.0,12.0,16.0μg/L的系列血样,按血样处理方法处理后进样,得标准曲线方程Y=6.919×104C+7866.799,r=0.9974(n=6)。线性范围为0.25~16μg/L,最低检测限0.125μg/L。低、中、高浓度的萃取回收率分别为(88.0±2.0)%,(81.5±3.0)%,(83.3±1.2)%,相应的RSD在1.4%~3.7%之间,符合生物样品分析的要求。
方法回收率和精密度试验:结果见表1,盐酸格拉司琼低、中、高浓度的方法回收率在97.4%~105.1%范围内,日内及日间变异系数分别平均为(4.6±2.3)%和(3.3±1.5)%,表明该方法精确度高,重现性好。
, http://www.100md.com
表1 盐酸格拉司琼的方法回收率及日内、日间差异 (n=6) 加入量
日 内
日 间
回收量
(μg/L)
回收率
(%)
RSD
(%)
回收量
(μg/L)
回收率
, 百拇医药 (%)
RSD
(%)
0.5
0.49±0.02
98.0
4.1
0.49±0.02
98.0
4.1
2.0
1.97±0.05
98.5
, 百拇医药
2.5
1.96±0.037
98.0
1.5
8.0
8.41±0.60
105.1
7.1
7.79±0.33
97.4
4.2 ±s
±s
, http://www.100md.com 100.5±4.0
4.6±2.3
97.8±0.4
3.3±1.5
结 果
12名受试者单剂量分别口服2种盐酸格拉司琼不同制剂后0~24h的血药浓度-时间数据经3P97程序拟合,符合开放式血管外一房室模型,平均药时曲线见图2。
图2 单剂量口服格拉司琼分散片与格拉司琼片后的药时曲线
供试品与对照品的t1/2β分别为(5.60±0.72),(5.28±0.73)h,Tmax分别为(1.71±0.26),(1.75±0.45)h;Cmax为(7.24±0.86),(7.21±0.40)μg/L,AUC0~∞分别为(61.34±11.13),(58.17±8.42)μg.h/L。上述药代动力学参数经配对t检验,均无显著性意义(P>0.05),说明这两种制剂在人体内的药代动力学过程相似。供试品和对照品的AUC0~24分别为(59.65±9.84)和(58.55±7.01)μg.h/L,供试品的相对生物利用度为(101.68±12.35)%。
, 百拇医药
将2种制剂实测的Cmax,Tmax及梯形法计算的AUC0~24按多因素方差分析和双单侧t检验进行统计分析比较,结果见表2。
表2 口服盐酸格拉司琼2mg后平均药代动力学参数及比值 药代动力学参数
供试品
对照品
比值
t1
t2
Tmax(h)
1.75±0.34
, http://www.100md.com
1.71±0.33
1.03
3.82
2.99
Cmax(μg/L)
7.10±1.00
7.32±0.62
0.97
8.99
10.23
AUC0~24 (μg.h/L)
, 百拇医药
57.81±12.20
56.21±7.09
1.02
27.18
26.21
表中AUC0~24为梯形法计算值,Cmax,Tmax为实测值,t0.05=1.812
可见盐酸格拉司琼分散片与盐酸格拉司琼片两制剂生物等效。讨 论
本试验选择Hypersil CN柱为分析柱,甲醇-醋酸钠缓冲液系统为流动相,能很好地分离血浆中格拉司琼和内源性物质,加入0.25%三乙胺能有效地改善格拉司琼的峰形和分离度,结果令人满意。
, http://www.100md.com
据文献报道[1,2],人血中格拉司琼的提取多采用苯提取法,但此法提取溶剂毒性较大;我们也曾用过二氯甲烷、三氯甲烷等有机溶剂提取及蛋白沉淀法,前者在血样处理过程中血浆极易乳化,后者在色谱图中有一杂峰干扰,改变流动相系统也无法使杂峰与主峰分开,试用乙酸乙酯2次提取,完全能避开溶剂峰和杂质峰干扰,提高了测定的准确性。通过多次试验证明本法的特异性强,灵敏度高,重现性好,回收率高,测得值准确可靠,符合研究盐酸格拉司琼在人体内药代动力学的要求。
盐酸格拉司琼两种制剂在人体内基本一致的吸收及清除过程,说明两者生物等效,其药代动力学参数与文献报道[3]相似。国外资料显示的AUC(67.30μg*h/L),Cmax(8.49μg/L)略高于本试验,而t1/2β(5.3h)与本试验结果相同,这似提示格拉司琼用于治疗国人时剂量可稍高于国外用量。
整个试验过程中,12名受试者均在医护人员的监护下,结果发现1名受试者自觉轻微头痛,未经治疗3h后症状消失。另1名受试者自诉便秘,追踪观察后大便恢复正常。这为临床应用该药物提示了观察的注意事项。
, 百拇医药
【作者简介】 熊玉卿(1956-),女,教授,硕士学位。主要研究方向为药代动力学、药物代谢及临床药理学相关研究。联系电话:(0791)6360654。
【参考文献】
[1] Lee CR,Plosker L, McTavish D, et al. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential as an antiemetic[J]. Drugs, 1993, 46(5)∶925
[2] Boppana VK. Simultaneous determination of granisetion and 7-hydroxy metabolite in human plasma by reversed-phase high-performance liquid chromatography utilizing fluoresence and electrochemical detection[J].J Chromatogr A, 1995, 692(1-2)∶195
[3] Allen A, Asgill CC, Pierce DM, et al. Pharmacokinetics and tolerability of ascending vintravenous doses of granisetron, a novel 5-HT3 antagonist, in healthy human subjects[J].J Clin Pharmacol, 1994, 46(2)∶159
收稿:1999-11-23
修回:2000-02-24, http://www.100md.com
单位:江西医学院临床药理研究所,南昌 330006
关键词:盐酸格拉司琼;高效液相色谱法;药代动力学;生物等效性
中国新药杂志000712 【摘要】 目的:进行盐酸格拉司琼分散片的药代动力学研究,并与国产盐酸格拉司琼片进行生物利用度的比较。方法:12名健康男性志愿者采用交叉给药方案,分别单剂量口服2mg供试品或对照品后,用高效液相色谱荧光法测定血浆药物浓度。结果:健康志愿者单剂量口服盐酸格拉司琼分散片后体内过程符合开放式血管外一室模型,其Cmax为(7.24±0.86)μg/L,t1/2β为(5.60±0.72)h,Tmax为(1.71±0.26)h,AUC0~24为(59.56±9.84)μg*h/L,与对照品的主要药代动力学参数比较,无显著性差异(P>0.05)。供试品相对于对照品的生物利用度为(101.68±12.35)%。结论:两制剂体内过程相仿,具有生物等效性。
, 百拇医药
【中图分类号】R969.4 【文献标识码】A 【文章编号】1003-3734(2000)07-0468-03
Evaluation of bioequivalence of granisetron HCl dispersible tablet
XIONG Yu-qing FU Ying-jun FU Jun JIANG Min DAI Qun
(Institute of Clinical Pharmacology, Jiangxi Medical College, Nanchang 330006)
【Abstract】 Objective: To study the pharmacokinetics and relative bioquivalence of granisetron HCl tablet and dispersible tablet. Methods: 12 healthy volunteers were treated with a single oral dose of domestic granisetron HCl dispersible tablet or tablet (control)in a randomized crossover study, and their plasma drug concentration were determined by HPLC. Results: The plasma concentration-time curve was fitted to one-compartment model. The pharmacokinetic parameters obtained were: Cmax=(7.24±0.86)μg/L,t1/2β=(5.60±0.72)h,Tmax=(1.71±0.26)h,AUC0~24=(59.56 ±9.84)μg*h/L,without significant difference between the active and control groups. The relative bioavailability obtained was (101.68±12.35)%. Conclusion:The pharmacokinetic profile for the 2 tablets was sim-ilar so it may be concluded that they are bioequivalent.
, 百拇医药
Key words granisetron hydrochloride; HPLC;pharmacokinetics;bioequivalence
盐酸格拉司琼(granisetron hydrocloride)是一种高选择性的5-HT3受体拮抗剂,通过拮抗中枢化学感受区及外周神经末梢的5-HT3受体,抑制由放疗、化疗引起肠嗜铬细胞释放5-HT3,从而激活中枢或神经系统的5-HT3受体而致恶心、呕吐[1]。本试验采用HPLC荧光检测法测定了12名健康志愿受试者口服盐酸格拉司琼分散片(2mg)的经时过程的血药浓度,求出其相应的药代动力学参数,并对其生物等效性作出评价。
材料与方法
1 材料
美国贝克曼高效液相色谱仪(125型溶剂泵)、FL-45A荧光检测器、贝克曼GS-15R高速冷冻离心机。
, 百拇医药
供试品:盐酸格拉司琼分散片(杭州德生医药技术开发有限公司,批号:990106),1mg/片;对照品:盐酸格拉司琼片(宁波市天衡制药厂提供,批号:980401),1mg/片。标准品:盐酸格拉司琼(浙江省药品检验所,批号:970306),含量:99.5%。试剂:甲醇为色谱纯,醋酸钠、三乙胺、乙酸乙酯为分析纯。
志愿者:12名健康男性志愿者,年龄(20±0.9)岁,体重(64.2±4.6)kg,身高(170.5±3.9)cm,试验前经全面体格检查及化验检查,均在正常范围,试验前2周未服用任何药物,试验期间统一进低脂饮食及饮水。不允许吸烟和饮用含酒精或咖啡因的饮料,试验前所有受试者均签署知情同意书。
2 方法
12名受试者随机分成2组(6人/组),受试前12h内禁食,当日早空腹,分别口服盐酸格拉司琼分散片2mg(2片)和盐酸格拉司琼片2mg(2片),服药饮水量150ml,至给药后4h按统一食谱进餐。受试者接受交叉给药供试品和对照品各1次,间隔7d。
, 百拇医药
生物样品采集:服药前及服药后0.5,1.0,1.5,2.0,2.5,3.0,4.0,6.0,8.0,10.0,12.0,24.0h,采集静脉血3ml,置入已用肝素抗凝的试管中,离心分离血浆,置-40℃冰箱保存至测定。
3 血药浓度测定方法
3.1 色谱条件 色谱柱:Beckman CYANO(5μm,4.6mm×150 mm)。流动相为甲醇∶0.05mol/L醋酸钠缓冲液(用0.20%三乙胺调节pH为6.8)=96∶4,流速:1.0ml/min,激发波长302nm,发射波长360nm。
3.2 血样处理 取血浆1.0ml,分2次加入乙酸乙酯3.0ml,旋涡混匀后离心,取上清液50℃水浴挥干,残渣用0.5ml甲醇溶解混旋,高速离心2min,取上清液20μl进样。
3.3 方法学研究 方法专一性:在选定的色谱条件下测得的空白血浆及血样色谱图见图1,血浆中格拉司琼保留时间为5.17min,峰形良好,分离完全(Neff =1.2×104),无内源性杂峰干扰。

, 百拇医药
图1 空白血样及标准血样色谱图
血样标准曲线:精密称取适量的盐酸格拉司琼标准品,加入少量的甲醇溶解,并用正常人血浆稀释,配制成含盐酸格拉司琼标准品0.25,0.5,1.0,2.0,4.0,8.0,12.0,16.0μg/L的系列血样,按血样处理方法处理后进样,得标准曲线方程Y=6.919×104C+7866.799,r=0.9974(n=6)。线性范围为0.25~16μg/L,最低检测限0.125μg/L。低、中、高浓度的萃取回收率分别为(88.0±2.0)%,(81.5±3.0)%,(83.3±1.2)%,相应的RSD在1.4%~3.7%之间,符合生物样品分析的要求。
方法回收率和精密度试验:结果见表1,盐酸格拉司琼低、中、高浓度的方法回收率在97.4%~105.1%范围内,日内及日间变异系数分别平均为(4.6±2.3)%和(3.3±1.5)%,表明该方法精确度高,重现性好。
, http://www.100md.com
表1 盐酸格拉司琼的方法回收率及日内、日间差异 (n=6) 加入量
日 内
日 间
回收量
(μg/L)
回收率
(%)
RSD
(%)
回收量
(μg/L)
回收率
, 百拇医药 (%)
RSD
(%)
0.5
0.49±0.02
98.0
4.1
0.49±0.02
98.0
4.1
2.0
1.97±0.05
98.5
, 百拇医药
2.5
1.96±0.037
98.0
1.5
8.0
8.41±0.60
105.1
7.1
7.79±0.33
97.4
4.2
 ±s
±s, http://www.100md.com 100.5±4.0
4.6±2.3
97.8±0.4
3.3±1.5
结 果
12名受试者单剂量分别口服2种盐酸格拉司琼不同制剂后0~24h的血药浓度-时间数据经3P97程序拟合,符合开放式血管外一房室模型,平均药时曲线见图2。

图2 单剂量口服格拉司琼分散片与格拉司琼片后的药时曲线
供试品与对照品的t1/2β分别为(5.60±0.72),(5.28±0.73)h,Tmax分别为(1.71±0.26),(1.75±0.45)h;Cmax为(7.24±0.86),(7.21±0.40)μg/L,AUC0~∞分别为(61.34±11.13),(58.17±8.42)μg.h/L。上述药代动力学参数经配对t检验,均无显著性意义(P>0.05),说明这两种制剂在人体内的药代动力学过程相似。供试品和对照品的AUC0~24分别为(59.65±9.84)和(58.55±7.01)μg.h/L,供试品的相对生物利用度为(101.68±12.35)%。
, 百拇医药
将2种制剂实测的Cmax,Tmax及梯形法计算的AUC0~24按多因素方差分析和双单侧t检验进行统计分析比较,结果见表2。
表2 口服盐酸格拉司琼2mg后平均药代动力学参数及比值 药代动力学参数
供试品
对照品
比值
t1
t2
Tmax(h)
1.75±0.34
, http://www.100md.com
1.71±0.33
1.03
3.82
2.99
Cmax(μg/L)
7.10±1.00
7.32±0.62
0.97
8.99
10.23
AUC0~24 (μg.h/L)
, 百拇医药
57.81±12.20
56.21±7.09
1.02
27.18
26.21
表中AUC0~24为梯形法计算值,Cmax,Tmax为实测值,t0.05=1.812
可见盐酸格拉司琼分散片与盐酸格拉司琼片两制剂生物等效。讨 论
本试验选择Hypersil CN柱为分析柱,甲醇-醋酸钠缓冲液系统为流动相,能很好地分离血浆中格拉司琼和内源性物质,加入0.25%三乙胺能有效地改善格拉司琼的峰形和分离度,结果令人满意。
, http://www.100md.com
据文献报道[1,2],人血中格拉司琼的提取多采用苯提取法,但此法提取溶剂毒性较大;我们也曾用过二氯甲烷、三氯甲烷等有机溶剂提取及蛋白沉淀法,前者在血样处理过程中血浆极易乳化,后者在色谱图中有一杂峰干扰,改变流动相系统也无法使杂峰与主峰分开,试用乙酸乙酯2次提取,完全能避开溶剂峰和杂质峰干扰,提高了测定的准确性。通过多次试验证明本法的特异性强,灵敏度高,重现性好,回收率高,测得值准确可靠,符合研究盐酸格拉司琼在人体内药代动力学的要求。
盐酸格拉司琼两种制剂在人体内基本一致的吸收及清除过程,说明两者生物等效,其药代动力学参数与文献报道[3]相似。国外资料显示的AUC(67.30μg*h/L),Cmax(8.49μg/L)略高于本试验,而t1/2β(5.3h)与本试验结果相同,这似提示格拉司琼用于治疗国人时剂量可稍高于国外用量。
整个试验过程中,12名受试者均在医护人员的监护下,结果发现1名受试者自觉轻微头痛,未经治疗3h后症状消失。另1名受试者自诉便秘,追踪观察后大便恢复正常。这为临床应用该药物提示了观察的注意事项。
, 百拇医药
【作者简介】 熊玉卿(1956-),女,教授,硕士学位。主要研究方向为药代动力学、药物代谢及临床药理学相关研究。联系电话:(0791)6360654。
【参考文献】
[1] Lee CR,Plosker L, McTavish D, et al. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential as an antiemetic[J]. Drugs, 1993, 46(5)∶925
[2] Boppana VK. Simultaneous determination of granisetion and 7-hydroxy metabolite in human plasma by reversed-phase high-performance liquid chromatography utilizing fluoresence and electrochemical detection[J].J Chromatogr A, 1995, 692(1-2)∶195
[3] Allen A, Asgill CC, Pierce DM, et al. Pharmacokinetics and tolerability of ascending vintravenous doses of granisetron, a novel 5-HT3 antagonist, in healthy human subjects[J].J Clin Pharmacol, 1994, 46(2)∶159
收稿:1999-11-23
修回:2000-02-24, http://www.100md.com