人La多肽融合蛋白在E.coli中的表达
作者:赵晓瑜 刘建荣 静天玉 王会文 王彦芳 王锡民
单位:赵晓瑜(河北大学生物工程研究所,河北保定071002);刘建荣(河北大学生物工程研究所,河北保定071002);静天玉(河北大学生物工程研究所,河北保定071002);王会文(河北大学生物工程研究所,河北保定071002);王彦芳(河北大学生物工程研究所,河北保定071002);王 锡 民(河北省职工医学院附属医院)
关键词:La抗原;PCR;克隆;表达;融合蛋白
细胞与分子免疫学杂志000308
摘要: 目的 构建在E.coli中表达人La多肽的质粒。 方法 以人脾cDNA为模板,通过PCR获得La多 肽(全长)的DNA片段。将此片段利用双酶切定向克隆到MBP(麦芽糖结合蛋白)融合系统的载体pMALTM-c中 , 表达可溶性融合蛋白,并通过亲和层析予以纯化。结果 免疫印迹实验(IBT)证明, 表达的融合蛋白具有La抗原多肽的特异性,而敏感性超过生化制备的ENA制品。 结论 重组融合蛋白与天然ENA制品存在免疫学同一性。
, 百拇医药
中图号 : Q55 文献标识码:A 文章编号: 1007-8738(2000)03-0207-04
Cloning and expression of a fusion protein with human La polypeptide in E.coli
ZHAO Xiao-yu LIU Jian-rong JING Tian-yu WANG Hui-wen WANG Yan-fang WANG Xi-ming
(Institute of Biotechnology, Hebei University, Baoding 071002, Hebei Province, China )
Abstract: Aim To construct a vector expressing human La polypeptide in E.coli. Methods The full length DNA fragment encoding La polypeptide was obtained by PCR from human spleen cDNA. The La DNA fragment was cloned into plasmid pMAL c(a maltose binding protein, MBP fusion vector) and expressed in E.coli. The soluble MBP La fusion proteins were purified by affinity chromatography using amylose resin. Results Western blot showed that the fusion protein could react with anti La antibody as the natural La polypeptide, and the sensitivity was higher than natural antigen. Conclusion The fusion La polypeptide has the immunoidentity with natural La polypeptide. length DNA fragment encoding La polypeptide was obtained by PCR from human spleen cDNA. The La DNA fragment was cloned into plasmid pMAL c(a maltose binding protein, MBP fusion vector) and expressed in E.coli. The soluble MBP La fusion proteins were purified by affinity chromatography using amylose resin. Results Western blot showed that the fusion protein could react with anti La antibody as the natural La polypeptide, and the sensitivity was higher than natural antigen. Conclusion The fusion La polypeptide has the immunoidentity with natural La polypeptide.
, http://www.100md.com
Kaywords:La antigen;PCR; cloning; expression; fusion protein ▲
La(又名SSB)抗原是存在于哺乳动物细胞核中的一种小核RNA/蛋白质复合物(smallnuclearribonucleoproteincomlexes,snRNP),即LaRNP。它是由相对分子质量(Mr)为47000的多肽(磷蛋白)与小核RNA组成〔1〕。这些小核RNA包括7SRNA,5SRNA和tRNA前体,以及某些病毒RNA(如:VARNA和EBERRNA〔2,3〕)。La抗原作为RNA聚合酶Ⅲ的转录终止因子,在基因调控中起重要作用〔4〕。临床上干燥综合症(Sjogren'ssyndrome)和系统性红斑狼疮(SLE)等患者体内往往存在抗La抗体,通常利用含有La抗原的可提取性核抗原(ENA)制品检测患者体内的抗La抗体,可为临床鉴别与诊断上述疾病提供依据〔5〕。
, 百拇医药
实验证明,La抗原的抗原决定簇在La多肽上〔7,8〕。我们根据文献报道的编码La多肽的DNA序列〔1〕设计引物,通过PCR扩增获得编码La多肽的特异性DNA片段。将该片段克隆到pMALTM-c表达载体中,在大肠杆菌中以麦芽糖结合蛋白(MBP)融合蛋白的的形式得到表达,并通过亲和层析获得纯化。
1 材料和方法
1.1材料载体pMALTMc,amyloseresin和兔抗MBP抗血清,为NewEnglandBiolabs公司产品。IPTG,Xgal和T4连接酶,为Promega公司产品。人脾QuickCloneTMcDNA为Clontech公司产品。DH5α和BL21来自中科院生物物理所。PVDF膜为Gelman公司产品。抗La抗体阳性血清来自天津长征医院免疫室。引物由上海生工生物有限公司合成。HRP-羊抗人IgG和HRP-羊抗兔IgG,购于北京生物制品研究所。人脾和猪脾ENA为河北大学生物工程公司产品。
, 百拇医药
1.2方法
1.2.1La质粒的构建我们所用载体pMALTMc(简称pc)为麦芽糖结合蛋白(MBP)融合系统。依据人La多肽编码序列〔1〕设计一对引物,以人脾cDNA为模板进行扩增获得DNA片段。选择pc的多克隆位点(polylinker)中EcoRI和SalI两个酶切位点作为外源DNA的插入点,通过T4DNA连接酶将该片段与pc定向连接,并转化到DH5α受体菌中,在含有IPTG和Xgal的培养基上筛选白色重组子。
1.2.2免疫印迹实验(IBT)样品经100g/LSDSPAGE电泳后,用Minitransblotelectrophoretictransfercell(BIORAD)电转移到PVDF膜上,以50g/L脱脂奶粉封闭。然后相继与抗血清(一抗)、HRP-羊抗人IgG或HRP-羊抗兔IgG(二抗)反应,DBT显色。
1.2.3DNA序列测定以pMALTMc系统malE的正、反向引物,对阳性克隆质粒的插入片段进行DNA序列分析(北京赛百盛公司产品)。
, 百拇医药
1.2.4La多肽融合蛋白的纯化菌体经超声破碎、抽提后,取上清液通过amyloseresin柱,用10mmol/L麦芽糖洗脱。收集洗脱物置低温保存。
1.2.5亲和层析纯化抗体将人脾ENA包被在PVDF膜上,与抗La抗体阳性血清反应后,用甘氨酸洗脱,经1mol/LTris盐中和后,低温保存。
2 结果
2.1La多肽编码DNA片段的扩增根据文献〔1〕报道,本实验设计的PCR引物为:SN:5′GCCGTAATGGCTGAAAATGG3′;ASN:5′CGAAGTGGACCTAATTCGG3′,其中5′端分别加上EcoRI和SalI酶切位点。按此设计要求扩增片段的长度应该为1342bp。以人脾cDNA为模板,利用上述引物进行扩增,扩增条件为:首先94℃变性1min;然后94℃0s,48℃2s,72℃30s,30个循环后,72℃再延伸1min。扩增产物经15g/L琼脂糖凝胶电泳后,显示出1条长度约为1.4kb的DNA片段(图1)。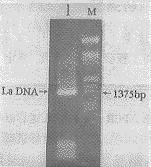
, 百拇医药
图1PCR扩增的LaDNA片段的琼脂糖凝胶电泳
Fig1AgarosegelelectrophoresisofLaDNAamplifiedbyPCR
M:λDNA/HandIII+EcoRI(21207,5048,4973,4268,3530,2027,1904,1586,1375,947,831,564bpfromtoptobottom);
1:AmplifiedDNAsegmentencodingLapolypeptide.
2.2La质粒的构建和阳性克隆的筛选按1.2.1获得许多白色菌落。对这些菌落分别进行培养和诱导,菌体进行SDSPAGE后,检查蛋白质的表达情况。同时,经电转移(Westernblot)至PVDF膜上,筛选既能与亲和洗脱的抗La抗体反应,又能与抗MBP抗血清反应的阳性克隆。如图2所示,阳性克隆77#和79#的表达蛋白与p-c明显不同,并与抗La抗体和抗MBP抗体均出现明显的特异性反应,而且与抗La抗体反应的条带均可与抗MBP抗体反应,说明克隆77#和79#表达的是MBP与La多肽的融合蛋白。不过与克隆77#相比较,克隆79#缺少了1条Mr值最高的带。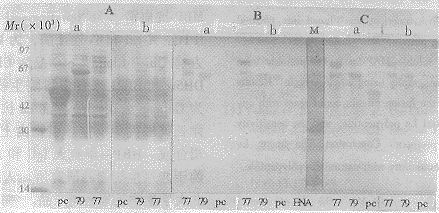
, 百拇医药
图2SDSPAGE和IBT对La阳性克隆的筛选
Fig2ScreeningofLapositiveclonesbySDSPAGEandIBT
A:StainedwithcoomassieblueG250afterSDSPAGE;B:ImmunologicallyreactedtoantiLaantibodyafterWesternblot;
C:ImmunologicallyreactedtoantiMBPantibodyafterWesternblot.a:Induced;b:Notinduced.
ThedigitsinFig2representthenumberofpositiveclones.
2.3阳性克隆插入DNA片段的鉴定分别提取克隆77#和79#的质粒,用EcoRI和SalI双酶切后,在琼脂糖电泳中可以看到除质粒片段外,还出现1条1.4kb的带(图3A)。与此同时,以克隆77#和79#的质粒为模板,利用上述引物进行PCR扩增,同样得到了1.4kb的条带(图3B)。
, 百拇医药
以pMALTMc系统malE的正、反向引物,对克隆77#和79#质粒中的插入片段进行DNA序列测定,结果与LacDNA序列完全相同,对照结果如图4。
2.4融合蛋白的纯化对克隆77#和79#进行培养和诱导,按1.2.4纯化融合蛋白的方法,得到较单一的蛋白质组分。除游离的MBP(Mr为42000)外,克隆77#含有Mr为90000,65000和55000的组分;而克隆79#只有后两个组分(图5)。这些组分与图2中的B,C显色区带相同。
2.5融合蛋白(77#)的La抗原特异性和敏感性
①与天然La抗原(ENA)的免疫学特性相比较:利用对流免疫电泳,将含抗Ro/La抗体的阳性血清与天然La抗原(生化提取的人脾ENA)和融合蛋白(fusionLa)进行反应。如图6所示,抗Ro/La抗体与ENA形成了两条沉淀线,其中靠抗体孔的浓沉淀线是La,另1条弱沉淀线则是Ro。融合蛋白和抗La抗体也形成浓的沉淀线,而且其与ENA的Ro/La形成融合支线,证明融合蛋白与天然ENA制品中的Ro/La抗原具有部分免疫学的同一性。②与天然La抗原(ENA)的特异性和敏感性的比较:用fusionLa进行免疫印迹实验表明,其与30份正常人血清反应均为阴性。用fusionLa检测86份患者血清,与人脾ENA的对流免疫电泳(CID)和免疫印迹(IBT)的检测结果进行了比较。结果用fusionLa测出39例阳性(45%),CID测得34例阳性(40%),而IBT测得25例阳性(29%)。由于方法的差异,CID和IBT检测的阴、阳性有交叉现象,但CID和IBT为阳性者,fusionLa均为阳性。fusionLa和IBT相同,只是使用的抗原不同,然而fusionLa的阳性率明显高于IBT。其中CID检测为阴性、fusionLa检测为阳性者均呈弱阳性,而且能被ENA所抑制,说明fusionLa抗原的敏感性高于天然的La抗原。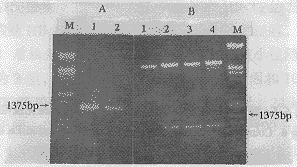
, 百拇医药
图3阳性克隆插入片段的琼脂糖凝胶电泳鉴定
Fig3Agarosegelelectrophoresisforidentifiedinsertfragment
ofpositiveclones77#和79#
A:PCRproductsusingpositiveplasmidsastemplates.1:77#,2:79#;
B:ThepositiveplasmidscutusingEcoRIandSalI.1:pMALccontrol;2,3:Positiveplasmids:77#,79#;M:λDNA/HandIII+EcoRI.
图477#和79#阳性克隆插入片段的DNA序列与LacDNA的比较
, http://www.100md.com
Fig4DNAsequenceoftheinsertsinpositiveclones77#and79#comparedwithLacDNA
Boxedregion:DNAencodingLapolypeptide;GATTCGandGTCGACaretheEcoRIandSalIrestrictionsites.
图5纯化La融合蛋白的SDSPAGE
Fig5SDSPAGEofLafusionproteinspurifiedfromclone
77#and79#cultures
, 百拇医药
图6La融合蛋白和ENA与抗Ro/La抗体的对流免疫电泳
Fig6CountercurrentimmunoelectrophoresisoffusionLaand
ENAwithantiRo/Laantibodies
3 讨论
La抗原多肽是一种Mr为47000的磷蛋白,而MBP的Mr为42000,因此表达的融合蛋白的Mr应为47000加42000等于89000。我们所获得的阳性克隆表达的最大融合蛋白条带正是Mr为90000左右。由于Ro抗原内含有La多肽〔6~8〕,因此,在免疫沉淀反应体系中,fusionLa与天然Ro/La抗原呈现部分免疫学的同一性。同时,上述免疫学测定也证明,尽管表达蛋白中存在MBP,但它并未影响融合蛋白La多肽的抗原特异性和敏感性。
, 百拇医药
利用pMALTMc麦芽糖结合蛋白(MBP)融合系统,所获La多肽的融合蛋白是可溶性蛋白,因此,很容易通过亲和层析纯化,而且不用考虑蛋白质的复性问题〔9~10〕。但是表达蛋白被内源性蛋白酶降解的可能性也比较大。我们所获融合蛋白均不是单一条带,除Mr为90000外,还有Mr为67000和55000的条带,同时还有相当量的游离MBP,这很可能是蛋白酶降解所致。然而,这些条带均表现出很好的La多肽的抗原性,因为决定La抗原性的序列仅占多肽的一小部分〔11〕。
克隆79#是个特例,从图2中可以看到,克隆79#的质粒用EcoRI和SalI双酶切后,切出的片段大小与克隆77#一样,分析它的DNA序列也没有变异,但其却不表达Mr为90000的组分。不管将此质粒转化到其它的受体菌(如JM107,XL1blue和TB1)中,还是蛋白酶缺陷型的BL21中均如此。不过其表达蛋白的抗原性与敏感性均与克隆77#一样,Mr的大小与克隆77#的降解带相同。作者在对其它的PCR片段进行克隆时,也出现类似的现象。是什么原因造成克隆79#这个特例,有待于进一步探讨。■
, 百拇医药
基金项目:河北省自然科学基金,No.396062
作者简介:赵晓瑜,女,55岁,研究员河北省保定市合作路1号,Tel.(0312) 5079735 2000 by J Cell Mol Immunol Press www.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参考文献 :
〔1〕 Chambers JC, Kanan D, Marting BJ, et al. Genomic structure and amino acid sequence domains of the human La autoantigen〔J〕 . J Biol Chem, 1988; 263(24): 18043- 18051.
〔2〕 Stefano JE. Purified lupus antigen La recognizes an oligouridylate stretch common to the 3′ terminal of RNA polymerase III transcripts〔J〕 . Cell,1984;36: 145- 154.
, 百拇医药
〔3〕 McNeilage LJ, Whittingham S, Jack I, et al. Molecular analysis of the RNA and protein components recognized by anti La(SS B) autoantibodies〔J〕 . Clin Exp Immunol, 1985; 62(3): 683- 695.
〔4〕 Topfer F, Gorden T, McCluskey J. Characterization of the mouse autoantigen La(SS B)〔J〕 . J Immunol,1993; 150: 3091- 3100.
〔5〕 Tan EM. Autoantibodies to nuclear antigens(ANA): their immunology and medicin〔J〕 . Adv Immunol, 1982; 33: 167- 240.
, http://www.100md.com
〔6〕 赵 晓 瑜 ,静 天 玉 ,刘 建 荣 , 等 . Ro, La的 组 成 和 相 互 关 系 〔J〕 . 生 物 化 学 杂 志 , 1992;8(3): 263- 265.
〔7〕 Habets WJ, Brok JH, Boerbooms AM, et al. Charaterization of the SS B(La) antigen in adenovirus infected and uninfected HeLa cells〔J〕 . EMBO J, 1983; 2(10): 1625- 1631.
〔8〕 Venables PJW, Smith PS, Maini RN. Purification and characterization of the Sjogren′ s syndrome A and B antigens〔J〕 . Clin Exp Immunol, 1983; 54: 731- 738.
, 百拇医药
〔9〕 Topfer F,Gorden T, McCluskey J. Intra and intermolecular sprea ding of autoimmunity involving the nuclear self antigens La(SS B) and Ro(SS A)〔J〕 . Proc Natl Acad Sci USA,1995; 92:875- 879.
〔10〕 Clair EMS, Pisetsky DS, Reich CF,et al. Quantitative immunoassay of anti La antibodies using purified recombinant La antigen〔J〕 . Arthritis Rheum, 1988;31(4): 506- 514.
〔11〕 Yiannaki EE, Tzioufas AG, Bachmann M, et al.The value of synthetic linear epitope analogues of La/SSB for the detection of autoantibodies to La/SSB;specificity,sensitivity and comparison of methods〔J〕 . Clin Exp Immunol, 1981;12(1):152- 158.
收稿日期:1999-08-09
修回日期:1999-10-18, 百拇医药
单位:赵晓瑜(河北大学生物工程研究所,河北保定071002);刘建荣(河北大学生物工程研究所,河北保定071002);静天玉(河北大学生物工程研究所,河北保定071002);王会文(河北大学生物工程研究所,河北保定071002);王彦芳(河北大学生物工程研究所,河北保定071002);王 锡 民(河北省职工医学院附属医院)
关键词:La抗原;PCR;克隆;表达;融合蛋白
细胞与分子免疫学杂志000308
摘要: 目的 构建在E.coli中表达人La多肽的质粒。 方法 以人脾cDNA为模板,通过PCR获得La多 肽(全长)的DNA片段。将此片段利用双酶切定向克隆到MBP(麦芽糖结合蛋白)融合系统的载体pMALTM-c中 , 表达可溶性融合蛋白,并通过亲和层析予以纯化。结果 免疫印迹实验(IBT)证明, 表达的融合蛋白具有La抗原多肽的特异性,而敏感性超过生化制备的ENA制品。 结论 重组融合蛋白与天然ENA制品存在免疫学同一性。
, 百拇医药
中图号 : Q55 文献标识码:A 文章编号: 1007-8738(2000)03-0207-04
Cloning and expression of a fusion protein with human La polypeptide in E.coli
ZHAO Xiao-yu LIU Jian-rong JING Tian-yu WANG Hui-wen WANG Yan-fang WANG Xi-ming
(Institute of Biotechnology, Hebei University, Baoding 071002, Hebei Province, China )
Abstract: Aim To construct a vector expressing human La polypeptide in E.coli. Methods The full length DNA fragment encoding La polypeptide was obtained by PCR from human spleen cDNA. The La DNA fragment was cloned into plasmid pMAL c(a maltose binding protein, MBP fusion vector) and expressed in E.coli. The soluble MBP La fusion proteins were purified by affinity chromatography using amylose resin. Results Western blot showed that the fusion protein could react with anti La antibody as the natural La polypeptide, and the sensitivity was higher than natural antigen. Conclusion The fusion La polypeptide has the immunoidentity with natural La polypeptide. length DNA fragment encoding La polypeptide was obtained by PCR from human spleen cDNA. The La DNA fragment was cloned into plasmid pMAL c(a maltose binding protein, MBP fusion vector) and expressed in E.coli. The soluble MBP La fusion proteins were purified by affinity chromatography using amylose resin. Results Western blot showed that the fusion protein could react with anti La antibody as the natural La polypeptide, and the sensitivity was higher than natural antigen. Conclusion The fusion La polypeptide has the immunoidentity with natural La polypeptide.
, http://www.100md.com
Kaywords:La antigen;PCR; cloning; expression; fusion protein ▲
La(又名SSB)抗原是存在于哺乳动物细胞核中的一种小核RNA/蛋白质复合物(smallnuclearribonucleoproteincomlexes,snRNP),即LaRNP。它是由相对分子质量(Mr)为47000的多肽(磷蛋白)与小核RNA组成〔1〕。这些小核RNA包括7SRNA,5SRNA和tRNA前体,以及某些病毒RNA(如:VARNA和EBERRNA〔2,3〕)。La抗原作为RNA聚合酶Ⅲ的转录终止因子,在基因调控中起重要作用〔4〕。临床上干燥综合症(Sjogren'ssyndrome)和系统性红斑狼疮(SLE)等患者体内往往存在抗La抗体,通常利用含有La抗原的可提取性核抗原(ENA)制品检测患者体内的抗La抗体,可为临床鉴别与诊断上述疾病提供依据〔5〕。
, 百拇医药
实验证明,La抗原的抗原决定簇在La多肽上〔7,8〕。我们根据文献报道的编码La多肽的DNA序列〔1〕设计引物,通过PCR扩增获得编码La多肽的特异性DNA片段。将该片段克隆到pMALTM-c表达载体中,在大肠杆菌中以麦芽糖结合蛋白(MBP)融合蛋白的的形式得到表达,并通过亲和层析获得纯化。
1 材料和方法
1.1材料载体pMALTMc,amyloseresin和兔抗MBP抗血清,为NewEnglandBiolabs公司产品。IPTG,Xgal和T4连接酶,为Promega公司产品。人脾QuickCloneTMcDNA为Clontech公司产品。DH5α和BL21来自中科院生物物理所。PVDF膜为Gelman公司产品。抗La抗体阳性血清来自天津长征医院免疫室。引物由上海生工生物有限公司合成。HRP-羊抗人IgG和HRP-羊抗兔IgG,购于北京生物制品研究所。人脾和猪脾ENA为河北大学生物工程公司产品。
, 百拇医药
1.2方法
1.2.1La质粒的构建我们所用载体pMALTMc(简称pc)为麦芽糖结合蛋白(MBP)融合系统。依据人La多肽编码序列〔1〕设计一对引物,以人脾cDNA为模板进行扩增获得DNA片段。选择pc的多克隆位点(polylinker)中EcoRI和SalI两个酶切位点作为外源DNA的插入点,通过T4DNA连接酶将该片段与pc定向连接,并转化到DH5α受体菌中,在含有IPTG和Xgal的培养基上筛选白色重组子。
1.2.2免疫印迹实验(IBT)样品经100g/LSDSPAGE电泳后,用Minitransblotelectrophoretictransfercell(BIORAD)电转移到PVDF膜上,以50g/L脱脂奶粉封闭。然后相继与抗血清(一抗)、HRP-羊抗人IgG或HRP-羊抗兔IgG(二抗)反应,DBT显色。
1.2.3DNA序列测定以pMALTMc系统malE的正、反向引物,对阳性克隆质粒的插入片段进行DNA序列分析(北京赛百盛公司产品)。
, 百拇医药
1.2.4La多肽融合蛋白的纯化菌体经超声破碎、抽提后,取上清液通过amyloseresin柱,用10mmol/L麦芽糖洗脱。收集洗脱物置低温保存。
1.2.5亲和层析纯化抗体将人脾ENA包被在PVDF膜上,与抗La抗体阳性血清反应后,用甘氨酸洗脱,经1mol/LTris盐中和后,低温保存。
2 结果
2.1La多肽编码DNA片段的扩增根据文献〔1〕报道,本实验设计的PCR引物为:SN:5′GCCGTAATGGCTGAAAATGG3′;ASN:5′CGAAGTGGACCTAATTCGG3′,其中5′端分别加上EcoRI和SalI酶切位点。按此设计要求扩增片段的长度应该为1342bp。以人脾cDNA为模板,利用上述引物进行扩增,扩增条件为:首先94℃变性1min;然后94℃0s,48℃2s,72℃30s,30个循环后,72℃再延伸1min。扩增产物经15g/L琼脂糖凝胶电泳后,显示出1条长度约为1.4kb的DNA片段(图1)。

, 百拇医药
图1PCR扩增的LaDNA片段的琼脂糖凝胶电泳
Fig1AgarosegelelectrophoresisofLaDNAamplifiedbyPCR
M:λDNA/HandIII+EcoRI(21207,5048,4973,4268,3530,2027,1904,1586,1375,947,831,564bpfromtoptobottom);
1:AmplifiedDNAsegmentencodingLapolypeptide.
2.2La质粒的构建和阳性克隆的筛选按1.2.1获得许多白色菌落。对这些菌落分别进行培养和诱导,菌体进行SDSPAGE后,检查蛋白质的表达情况。同时,经电转移(Westernblot)至PVDF膜上,筛选既能与亲和洗脱的抗La抗体反应,又能与抗MBP抗血清反应的阳性克隆。如图2所示,阳性克隆77#和79#的表达蛋白与p-c明显不同,并与抗La抗体和抗MBP抗体均出现明显的特异性反应,而且与抗La抗体反应的条带均可与抗MBP抗体反应,说明克隆77#和79#表达的是MBP与La多肽的融合蛋白。不过与克隆77#相比较,克隆79#缺少了1条Mr值最高的带。

, 百拇医药
图2SDSPAGE和IBT对La阳性克隆的筛选
Fig2ScreeningofLapositiveclonesbySDSPAGEandIBT
A:StainedwithcoomassieblueG250afterSDSPAGE;B:ImmunologicallyreactedtoantiLaantibodyafterWesternblot;
C:ImmunologicallyreactedtoantiMBPantibodyafterWesternblot.a:Induced;b:Notinduced.
ThedigitsinFig2representthenumberofpositiveclones.
2.3阳性克隆插入DNA片段的鉴定分别提取克隆77#和79#的质粒,用EcoRI和SalI双酶切后,在琼脂糖电泳中可以看到除质粒片段外,还出现1条1.4kb的带(图3A)。与此同时,以克隆77#和79#的质粒为模板,利用上述引物进行PCR扩增,同样得到了1.4kb的条带(图3B)。
, 百拇医药
以pMALTMc系统malE的正、反向引物,对克隆77#和79#质粒中的插入片段进行DNA序列测定,结果与LacDNA序列完全相同,对照结果如图4。
2.4融合蛋白的纯化对克隆77#和79#进行培养和诱导,按1.2.4纯化融合蛋白的方法,得到较单一的蛋白质组分。除游离的MBP(Mr为42000)外,克隆77#含有Mr为90000,65000和55000的组分;而克隆79#只有后两个组分(图5)。这些组分与图2中的B,C显色区带相同。
2.5融合蛋白(77#)的La抗原特异性和敏感性
①与天然La抗原(ENA)的免疫学特性相比较:利用对流免疫电泳,将含抗Ro/La抗体的阳性血清与天然La抗原(生化提取的人脾ENA)和融合蛋白(fusionLa)进行反应。如图6所示,抗Ro/La抗体与ENA形成了两条沉淀线,其中靠抗体孔的浓沉淀线是La,另1条弱沉淀线则是Ro。融合蛋白和抗La抗体也形成浓的沉淀线,而且其与ENA的Ro/La形成融合支线,证明融合蛋白与天然ENA制品中的Ro/La抗原具有部分免疫学的同一性。②与天然La抗原(ENA)的特异性和敏感性的比较:用fusionLa进行免疫印迹实验表明,其与30份正常人血清反应均为阴性。用fusionLa检测86份患者血清,与人脾ENA的对流免疫电泳(CID)和免疫印迹(IBT)的检测结果进行了比较。结果用fusionLa测出39例阳性(45%),CID测得34例阳性(40%),而IBT测得25例阳性(29%)。由于方法的差异,CID和IBT检测的阴、阳性有交叉现象,但CID和IBT为阳性者,fusionLa均为阳性。fusionLa和IBT相同,只是使用的抗原不同,然而fusionLa的阳性率明显高于IBT。其中CID检测为阴性、fusionLa检测为阳性者均呈弱阳性,而且能被ENA所抑制,说明fusionLa抗原的敏感性高于天然的La抗原。

, 百拇医药
图3阳性克隆插入片段的琼脂糖凝胶电泳鉴定
Fig3Agarosegelelectrophoresisforidentifiedinsertfragment
ofpositiveclones77#和79#
A:PCRproductsusingpositiveplasmidsastemplates.1:77#,2:79#;
B:ThepositiveplasmidscutusingEcoRIandSalI.1:pMALccontrol;2,3:Positiveplasmids:77#,79#;M:λDNA/HandIII+EcoRI.

图477#和79#阳性克隆插入片段的DNA序列与LacDNA的比较
, http://www.100md.com
Fig4DNAsequenceoftheinsertsinpositiveclones77#and79#comparedwithLacDNA
Boxedregion:DNAencodingLapolypeptide;GATTCGandGTCGACaretheEcoRIandSalIrestrictionsites.

图5纯化La融合蛋白的SDSPAGE
Fig5SDSPAGEofLafusionproteinspurifiedfromclone
77#and79#cultures

, 百拇医药
图6La融合蛋白和ENA与抗Ro/La抗体的对流免疫电泳
Fig6CountercurrentimmunoelectrophoresisoffusionLaand
ENAwithantiRo/Laantibodies
3 讨论
La抗原多肽是一种Mr为47000的磷蛋白,而MBP的Mr为42000,因此表达的融合蛋白的Mr应为47000加42000等于89000。我们所获得的阳性克隆表达的最大融合蛋白条带正是Mr为90000左右。由于Ro抗原内含有La多肽〔6~8〕,因此,在免疫沉淀反应体系中,fusionLa与天然Ro/La抗原呈现部分免疫学的同一性。同时,上述免疫学测定也证明,尽管表达蛋白中存在MBP,但它并未影响融合蛋白La多肽的抗原特异性和敏感性。
, 百拇医药
利用pMALTMc麦芽糖结合蛋白(MBP)融合系统,所获La多肽的融合蛋白是可溶性蛋白,因此,很容易通过亲和层析纯化,而且不用考虑蛋白质的复性问题〔9~10〕。但是表达蛋白被内源性蛋白酶降解的可能性也比较大。我们所获融合蛋白均不是单一条带,除Mr为90000外,还有Mr为67000和55000的条带,同时还有相当量的游离MBP,这很可能是蛋白酶降解所致。然而,这些条带均表现出很好的La多肽的抗原性,因为决定La抗原性的序列仅占多肽的一小部分〔11〕。
克隆79#是个特例,从图2中可以看到,克隆79#的质粒用EcoRI和SalI双酶切后,切出的片段大小与克隆77#一样,分析它的DNA序列也没有变异,但其却不表达Mr为90000的组分。不管将此质粒转化到其它的受体菌(如JM107,XL1blue和TB1)中,还是蛋白酶缺陷型的BL21中均如此。不过其表达蛋白的抗原性与敏感性均与克隆77#一样,Mr的大小与克隆77#的降解带相同。作者在对其它的PCR片段进行克隆时,也出现类似的现象。是什么原因造成克隆79#这个特例,有待于进一步探讨。■
, 百拇医药
基金项目:河北省自然科学基金,No.396062
作者简介:赵晓瑜,女,55岁,研究员河北省保定市合作路1号,Tel.(0312) 5079735 2000 by J Cell Mol Immunol Press www.immunology. net/jcmi; Email. immuedit@fmmu.edu.cn
参考文献 :
〔1〕 Chambers JC, Kanan D, Marting BJ, et al. Genomic structure and amino acid sequence domains of the human La autoantigen〔J〕 . J Biol Chem, 1988; 263(24): 18043- 18051.
〔2〕 Stefano JE. Purified lupus antigen La recognizes an oligouridylate stretch common to the 3′ terminal of RNA polymerase III transcripts〔J〕 . Cell,1984;36: 145- 154.
, 百拇医药
〔3〕 McNeilage LJ, Whittingham S, Jack I, et al. Molecular analysis of the RNA and protein components recognized by anti La(SS B) autoantibodies〔J〕 . Clin Exp Immunol, 1985; 62(3): 683- 695.
〔4〕 Topfer F, Gorden T, McCluskey J. Characterization of the mouse autoantigen La(SS B)〔J〕 . J Immunol,1993; 150: 3091- 3100.
〔5〕 Tan EM. Autoantibodies to nuclear antigens(ANA): their immunology and medicin〔J〕 . Adv Immunol, 1982; 33: 167- 240.
, http://www.100md.com
〔6〕 赵 晓 瑜 ,静 天 玉 ,刘 建 荣 , 等 . Ro, La的 组 成 和 相 互 关 系 〔J〕 . 生 物 化 学 杂 志 , 1992;8(3): 263- 265.
〔7〕 Habets WJ, Brok JH, Boerbooms AM, et al. Charaterization of the SS B(La) antigen in adenovirus infected and uninfected HeLa cells〔J〕 . EMBO J, 1983; 2(10): 1625- 1631.
〔8〕 Venables PJW, Smith PS, Maini RN. Purification and characterization of the Sjogren′ s syndrome A and B antigens〔J〕 . Clin Exp Immunol, 1983; 54: 731- 738.
, 百拇医药
〔9〕 Topfer F,Gorden T, McCluskey J. Intra and intermolecular sprea ding of autoimmunity involving the nuclear self antigens La(SS B) and Ro(SS A)〔J〕 . Proc Natl Acad Sci USA,1995; 92:875- 879.
〔10〕 Clair EMS, Pisetsky DS, Reich CF,et al. Quantitative immunoassay of anti La antibodies using purified recombinant La antigen〔J〕 . Arthritis Rheum, 1988;31(4): 506- 514.
〔11〕 Yiannaki EE, Tzioufas AG, Bachmann M, et al.The value of synthetic linear epitope analogues of La/SSB for the detection of autoantibodies to La/SSB;specificity,sensitivity and comparison of methods〔J〕 . Clin Exp Immunol, 1981;12(1):152- 158.
收稿日期:1999-08-09
修回日期:1999-10-18, 百拇医药