一例复发性生殖器疱疹的临床及其致病的HSV-2野生株的糖蛋白D基因序列分析
作者:杨慧兰 廖元兴 李明 江悦华 吴锦银 徐广坤
单位:510010 广州军区总医院皮肤科(杨慧兰 廖元兴),医学实验科(李明 江悦华 吴锦银);中山医科大学附属第三医院皮肤科[徐广坤(导师)]
关键词:疱疹病毒2型;糖蛋白D;聚合酶链反应;核酸序列
中国皮肤科杂志980312 【摘要】目的 探讨我国复发性生殖器疱疹的临床表现与糖蛋白D基因序列之间的关系。方法 利用聚合酶链反应从我国一例复发性生殖器疱疹患者分离的野生株中扩增、克隆出糖蛋白D(gD)基因序列。 结果 将野生株gD基因序列同国外已发表的疱疹病毒-2G株进行比较,发现其gD基因的氨基酸序列有个别突变。结论 本课题对研究我国复发性生殖器疱疹的氨基酸序列和抗原结构,开发适用于我国生殖器疱疹的基因工程疫苗有重要意义。
Clinical Feature and Glycoprotein D Gene Sequence Analys is of a Wild S train of HSV-2 Isolated from One Relapsed Patient with Genital Herpes Yang Huila n, Liao Yuangxing, Li Ming,et al. Guangzhou General Hospital of Guangzhou Milita ry Command, Guangzhou 510010
, 百拇医药
【Abstract】 Objective To study the relation between the clinical feat ure and gl ycoprotein D gene sequence analysis of a wild strain of HSV-2 isolated from one relapsed patient with genital herpes. Methods The partial glycoprotein D gene se quence of the above-mentioned strain was a mplified and cloned with PCR. Results The comparison of the ami n o acid sequence of gD gene between the wild strain and HSV-2G strain published showed that there was a mutation at site80 and site159. Conclus ion In order to develop effective vaccine which is suitable for China , it is necessary to investigate the differences of the gene structure and function of g D among HSV isolated from China and other countries.
, 百拇医药
【Key Words】 Herpes simplex virus-2 Glycoprotein D Poly merase chain reaction Sequence analysis
疱疹病毒2型(HSV-2)是引起生殖器疱疹的主要病原,由于HSV-2有潜伏感染 、亚临床感染和复发感染的特征[1],目前临床上尚无特效药物控制其发生和复发。利用分子生物学手段,探讨我国复发型生殖器疱疹的临床表现与其基因序列的关系,研究HSV-2 gD的结构和功能,开发适用于我国国情的生殖器疱疹疫苗是预防生殖器疱疹感染的关键[2]。我们以我科STD门诊一例复发性生殖 器疱疹患者疱液中分离到的HSV-2野生株DNA为模板,利用PCR方法扩增、克隆、测定了gD基 因中部646片段。
材料和方法
1.临床资料:HSV-2野生株由我科STD门诊一例有5年复发性生殖器疱疹患者 的疱液中分离。患者男,42岁。龟头、冠状沟反复起小水疱伴疼痛5年。
, 百拇医药
发病前有非婚性接触 史,病程8~14天,发作间隔1~3个月。每于过度疲劳、饮酒后复发,曾于1991年被诊断为 生殖器疱疹,肌注大量聚肌胞、干扰素,口服无环鸟苷无效。
2.病毒和细胞:HSV-2 Sav株(国际标准毒株),vero细胞株由中国预防医学科学院病毒所提供。
3.细胞和病毒的培养:vero细胞培养于含10%的小牛血清1640培养液中,病毒维持液为含2% 的小牛血清1640培养液(国产分析纯试剂配制)。
4.质粒和菌种:M13mp18、M13mp19购自华美生物工程公司。TG1为本室保留菌种。
5.化学试剂和酶类:X-gal、IPTG为Promega公司产品,抗HSV-2血清由中国预防医学科学 院病毒所提供。使用的限制性核酸内切酶,T4 DNA连接酶,蛋白酶K均购自Promega公司 。
, 百拇医药
6.HSV-2 DNA的提取:用适量的HSV-2野生株及HSV-2 Sav标准株病毒悬液感染成片的vero 细胞。按常规方法[3]进行体外连续培养,待细胞变大变圆,其细胞病理效应病变(CPE)达(),收集病毒,按文献方法[4]提取DNA 。
7.引物的设计和合成:参照文献[5],根据引物设计原则,在上海复旦大学遗传所合成了一对针对gD基因序列的上下游引物,预期扩增片段长度为646bp。
8.PCR扩增HSV-2野生株和Sav株gD基因:在100μl PCR反应体系中,用上述提取的野生株 和Sav株DNA 5μl作模板,200μmol/L dNTP,22pmol/L引物(GDP1+GDP2)。10×PCR buffer 10μl,Taq DNA酶2μl。96℃变性10分钟后加入Taq酶2μl,50μl液体石蜡,进入PCR循环 。94℃变性50秒,66℃复性1分钟,72℃延伸1分钟,共30个循环。然后于64℃复性1分钟,7 2 ℃延伸5分钟。取10μl PCR产物在含0.5μg/μl溴化乙锭(EB)的1%琼脂糖凝胶中电泳,在2 50nm紫外灯下观察结果。
, 百拇医药
9.PCR产物gD基因的克隆[6]:用冻融法从凝胶回收上述两株PCR反 应产物中特异的gD基因片段,酚/氯仿抽干、备用。获得的野生株gD基因用EcoRⅠ和BamHⅠ 双酶切,同已用EcoRⅠ及BamHⅠ双酶切好的M13mp18及M13mp19载体连接,转化入TG1细菌中 ,进行蓝白斑筛选噬菌斑鉴定。
10.HSV-2野生株gD基因序列分析:用M13mp18/gD2和M13mp19/gD2野生株重组噬菌体上清转 染TG1制备单链模板,从两个方向测定野生株gD基因序列。在复旦大学遗传所ABI373A自动测 序仪上进行测定,综合测序结果即得到HSV-2野生株gD基因序列。
11.计算机分析:gD基因的核苷酸序列及推导的氨基酸序列的计算机分析是利用PCGENE软件 在计算机上进行的。
结 果
1.经体外连续培养HSV-2野生株及Sav株出现典型的细胞病理效应病变(CPE) 达75%以上,两株病毒均为阳性。收集上述2株病毒,提取DNA,得到较纯的HSV-2野生株及 标准株DNA。
, 百拇医药
2.HSV-2野生株及Sav株gD基因的扩增及限制性内切酶鉴定:利用合成的引物,以HSV-2野 生株及标准株DNA为模板,通过PCR扩增gD基因,得到了含646基因片段的PCR产物,其大小与 预期值相符,未发现非特异性条带。根据已发表的HSV-2G株gD基因中含有SalⅠ酶切位点, 将扩增的HSV-2野生株及HSV-2 Sav株用SalⅠ酶切分别得到264bp和464bp的酶切产物。野 生株酶切片段与标准株相符(图1)。
3.重组测序载体的鉴定:挑取无色噬菌斑经TG1菌进行扩增,碱法抽提DNA,在琼脂糖上电泳 ,重组DNA泳在M13对照之后。将泳动慢于M13的HSV-2野生株及Sav株gD2-M13重组子用EcoR Ⅰ和BamHⅠ双酶切,分别得到与PCR产物片段一致的646bp片段(图2)。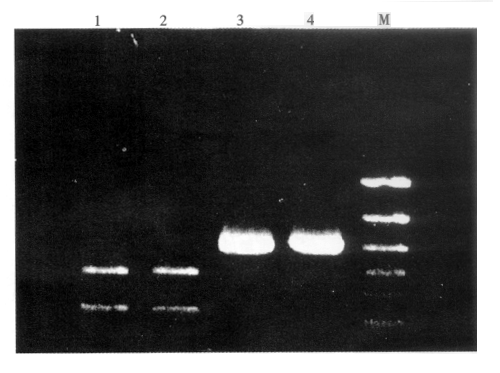
1.野生株gD2/SalⅠ酶切片段,2.Sav株gD2/SalⅠ酶切片段,3.野生株 gD2基因片段,4.Sav株gD2基因片段,M.分子量标准(PCR Marker)
, 百拇医药
图1 HSV-2野生株和Sav株gD基因片段的酶切图谱
1.M13mp18空载体/EcoRⅠ+ BamHⅠ酶切,2.M13mp19空载体/EcoRⅠ+BamH Ⅰ酶切,3.M13mp18-gD2/EcoRⅠ+BamHⅠ酶切,4.M13-mp19-gD2/EcoRⅠ+BamHⅠ 酶切,5.HSV-2 Sav株gD2基因片段,M:分子量标准(PCR Marker)
图2 重组质粒M13-gD2的酶切分析图谱
4.HSV-2野生株gD基因核苷酸序列分析:用M13mp18/gD2和M13mp19/gD2 野生株重组噬菌体上清转染TG1制备单链模板进行自动测序,结果为HSV-2野生株gD基因片 段第235bp和第474bp处发生了T-C、C-T的有意义突变,同国外已发表的HSV-2G株gD基因 的核苷酸序列比较同源性为99.2%。
, 百拇医药
5.HSV-2野生株gD蛋白的氨基酸序列分析:经PCGENE计算机软件分析,HSV-2野生株gD基因 编码的氨基酸序列有两个变异,在第80位V(赖氨酸)—A(丙氨酸),第159位I(异亮氨酸)—T( 苏氨酸)有变异,同国外已发表的HSV-2G株gD基因的氨基酸序列比较同源性为99.1%。
6.抗原结构分析:利用PCGENE软件在计算机上进行抗原结构分析,结果显示HSV-2野生株的 两个氨基酸变异均发生在跨膜区以外,不会影响野生株的抗原结构[7]。
讨 论
全世界人口中70%的人血清疱疹病毒抗体阳性,超过三分之一的人有复发性H SV感染。本例患者(野生株)有5年生殖器疱疹的复发病史,经多种抗病毒药物治疗无效。分 析其核苷酸序列发现HSV-2野生株gD基因片段第235bp和第474bp处发生了T-C、C-T的有意 义突变。gD基因编码的氨基酸序列有两个变异,在第80位V(赖氨酸)-A(丙氨酸),第159位I (异亮氨酸)-T(苏氨酸)有变异。该病例反复发作,久治不愈,考虑与其gD基因的核苷酸和 氨基酸突变有关。有待更多的复发性HSV-2gD基因序列做进一步的证实和探讨。
, 百拇医药
比较HSV-2野生株同国外已发表的G株gD基因核苷酸序列同源性为99.2%,氨基酸序列有两 个变异,同源性为99.1%。说明此例复发型野生株同G株gD基因存在高度的同源性,同时也 有一定的变异(抗原结构无影响),反应了我国的HSV-2野生株gD基因的高度保守性。这种高 度保守性也确保了糖蛋白D基因的遗传稳定性。应用高度保守的gD基因研制HSV-2基因工程 疫苗将克服病毒株抗原变异带来的一系列问题,有利于发展适用性广,稳定可靠的基因工程 疫苗和诊断试剂。
参考文献
1 Cory L. The current trend in genital herpes progress in prevention. Sex Transm Dis, 1994,21∶S28-S44.
2 Mishkin EM. Native HSV glycoprotein D vaccines immunogenecity and prote ction in animal models. Vaccines, 1991,9∶148-152.
, http://www.100md.com
3 鄂征, 陈泉光, 徐新来主编. 组织培养技术. 第二版. 北京: 人民卫生出版社, 1 993.65-66.
4 杨雄虎, 侯云德. 我国单纯疱疹病毒Ⅰ型gD基因168株糖蛋白D基因的克隆及序列 分析. 病毒学报, 1993,4∶311-314.
5 Lasky LA, Dowbarnko DJ. DNA sequence analysis of the type common glycop rotein genes of HSV type 1 and 2 DNA, 1984,3∶36-40.
6 Sambrook J. Molecular cloning, a laboratory manual. 2nd ed. New York: C old Spring Harbor Laboratory, 1989,394-396.
7 Watson RJ. DNA sequence of the herpes simplex virus type 2 glycoprotein D gene. Gene, 1983,26∶308-312.
广东省自然科学基金资助(960671), 百拇医药
单位:510010 广州军区总医院皮肤科(杨慧兰 廖元兴),医学实验科(李明 江悦华 吴锦银);中山医科大学附属第三医院皮肤科[徐广坤(导师)]
关键词:疱疹病毒2型;糖蛋白D;聚合酶链反应;核酸序列
中国皮肤科杂志980312 【摘要】目的 探讨我国复发性生殖器疱疹的临床表现与糖蛋白D基因序列之间的关系。方法 利用聚合酶链反应从我国一例复发性生殖器疱疹患者分离的野生株中扩增、克隆出糖蛋白D(gD)基因序列。 结果 将野生株gD基因序列同国外已发表的疱疹病毒-2G株进行比较,发现其gD基因的氨基酸序列有个别突变。结论 本课题对研究我国复发性生殖器疱疹的氨基酸序列和抗原结构,开发适用于我国生殖器疱疹的基因工程疫苗有重要意义。
Clinical Feature and Glycoprotein D Gene Sequence Analys is of a Wild S train of HSV-2 Isolated from One Relapsed Patient with Genital Herpes Yang Huila n, Liao Yuangxing, Li Ming,et al. Guangzhou General Hospital of Guangzhou Milita ry Command, Guangzhou 510010
, 百拇医药
【Abstract】 Objective To study the relation between the clinical feat ure and gl ycoprotein D gene sequence analysis of a wild strain of HSV-2 isolated from one relapsed patient with genital herpes. Methods The partial glycoprotein D gene se quence of the above-mentioned strain was a mplified and cloned with PCR. Results The comparison of the ami n o acid sequence of gD gene between the wild strain and HSV-2G strain published showed that there was a mutation at site80 and site159. Conclus ion In order to develop effective vaccine which is suitable for China , it is necessary to investigate the differences of the gene structure and function of g D among HSV isolated from China and other countries.
, 百拇医药
【Key Words】 Herpes simplex virus-2 Glycoprotein D Poly merase chain reaction Sequence analysis
疱疹病毒2型(HSV-2)是引起生殖器疱疹的主要病原,由于HSV-2有潜伏感染 、亚临床感染和复发感染的特征[1],目前临床上尚无特效药物控制其发生和复发。利用分子生物学手段,探讨我国复发型生殖器疱疹的临床表现与其基因序列的关系,研究HSV-2 gD的结构和功能,开发适用于我国国情的生殖器疱疹疫苗是预防生殖器疱疹感染的关键[2]。我们以我科STD门诊一例复发性生殖 器疱疹患者疱液中分离到的HSV-2野生株DNA为模板,利用PCR方法扩增、克隆、测定了gD基 因中部646片段。
材料和方法
1.临床资料:HSV-2野生株由我科STD门诊一例有5年复发性生殖器疱疹患者 的疱液中分离。患者男,42岁。龟头、冠状沟反复起小水疱伴疼痛5年。
, 百拇医药
发病前有非婚性接触 史,病程8~14天,发作间隔1~3个月。每于过度疲劳、饮酒后复发,曾于1991年被诊断为 生殖器疱疹,肌注大量聚肌胞、干扰素,口服无环鸟苷无效。
2.病毒和细胞:HSV-2 Sav株(国际标准毒株),vero细胞株由中国预防医学科学院病毒所提供。
3.细胞和病毒的培养:vero细胞培养于含10%的小牛血清1640培养液中,病毒维持液为含2% 的小牛血清1640培养液(国产分析纯试剂配制)。
4.质粒和菌种:M13mp18、M13mp19购自华美生物工程公司。TG1为本室保留菌种。
5.化学试剂和酶类:X-gal、IPTG为Promega公司产品,抗HSV-2血清由中国预防医学科学 院病毒所提供。使用的限制性核酸内切酶,T4 DNA连接酶,蛋白酶K均购自Promega公司 。
, 百拇医药
6.HSV-2 DNA的提取:用适量的HSV-2野生株及HSV-2 Sav标准株病毒悬液感染成片的vero 细胞。按常规方法[3]进行体外连续培养,待细胞变大变圆,其细胞病理效应病变(CPE)达(),收集病毒,按文献方法[4]提取DNA 。
7.引物的设计和合成:参照文献[5],根据引物设计原则,在上海复旦大学遗传所合成了一对针对gD基因序列的上下游引物,预期扩增片段长度为646bp。
8.PCR扩增HSV-2野生株和Sav株gD基因:在100μl PCR反应体系中,用上述提取的野生株 和Sav株DNA 5μl作模板,200μmol/L dNTP,22pmol/L引物(GDP1+GDP2)。10×PCR buffer 10μl,Taq DNA酶2μl。96℃变性10分钟后加入Taq酶2μl,50μl液体石蜡,进入PCR循环 。94℃变性50秒,66℃复性1分钟,72℃延伸1分钟,共30个循环。然后于64℃复性1分钟,7 2 ℃延伸5分钟。取10μl PCR产物在含0.5μg/μl溴化乙锭(EB)的1%琼脂糖凝胶中电泳,在2 50nm紫外灯下观察结果。
, 百拇医药
9.PCR产物gD基因的克隆[6]:用冻融法从凝胶回收上述两株PCR反 应产物中特异的gD基因片段,酚/氯仿抽干、备用。获得的野生株gD基因用EcoRⅠ和BamHⅠ 双酶切,同已用EcoRⅠ及BamHⅠ双酶切好的M13mp18及M13mp19载体连接,转化入TG1细菌中 ,进行蓝白斑筛选噬菌斑鉴定。
10.HSV-2野生株gD基因序列分析:用M13mp18/gD2和M13mp19/gD2野生株重组噬菌体上清转 染TG1制备单链模板,从两个方向测定野生株gD基因序列。在复旦大学遗传所ABI373A自动测 序仪上进行测定,综合测序结果即得到HSV-2野生株gD基因序列。
11.计算机分析:gD基因的核苷酸序列及推导的氨基酸序列的计算机分析是利用PCGENE软件 在计算机上进行的。
结 果
1.经体外连续培养HSV-2野生株及Sav株出现典型的细胞病理效应病变(CPE) 达75%以上,两株病毒均为阳性。收集上述2株病毒,提取DNA,得到较纯的HSV-2野生株及 标准株DNA。
, 百拇医药
2.HSV-2野生株及Sav株gD基因的扩增及限制性内切酶鉴定:利用合成的引物,以HSV-2野 生株及标准株DNA为模板,通过PCR扩增gD基因,得到了含646基因片段的PCR产物,其大小与 预期值相符,未发现非特异性条带。根据已发表的HSV-2G株gD基因中含有SalⅠ酶切位点, 将扩增的HSV-2野生株及HSV-2 Sav株用SalⅠ酶切分别得到264bp和464bp的酶切产物。野 生株酶切片段与标准株相符(图1)。
3.重组测序载体的鉴定:挑取无色噬菌斑经TG1菌进行扩增,碱法抽提DNA,在琼脂糖上电泳 ,重组DNA泳在M13对照之后。将泳动慢于M13的HSV-2野生株及Sav株gD2-M13重组子用EcoR Ⅰ和BamHⅠ双酶切,分别得到与PCR产物片段一致的646bp片段(图2)。

1.野生株gD2/SalⅠ酶切片段,2.Sav株gD2/SalⅠ酶切片段,3.野生株 gD2基因片段,4.Sav株gD2基因片段,M.分子量标准(PCR Marker)
, 百拇医药
图1 HSV-2野生株和Sav株gD基因片段的酶切图谱

1.M13mp18空载体/EcoRⅠ+ BamHⅠ酶切,2.M13mp19空载体/EcoRⅠ+BamH Ⅰ酶切,3.M13mp18-gD2/EcoRⅠ+BamHⅠ酶切,4.M13-mp19-gD2/EcoRⅠ+BamHⅠ 酶切,5.HSV-2 Sav株gD2基因片段,M:分子量标准(PCR Marker)
图2 重组质粒M13-gD2的酶切分析图谱
4.HSV-2野生株gD基因核苷酸序列分析:用M13mp18/gD2和M13mp19/gD2 野生株重组噬菌体上清转染TG1制备单链模板进行自动测序,结果为HSV-2野生株gD基因片 段第235bp和第474bp处发生了T-C、C-T的有意义突变,同国外已发表的HSV-2G株gD基因 的核苷酸序列比较同源性为99.2%。
, 百拇医药
5.HSV-2野生株gD蛋白的氨基酸序列分析:经PCGENE计算机软件分析,HSV-2野生株gD基因 编码的氨基酸序列有两个变异,在第80位V(赖氨酸)—A(丙氨酸),第159位I(异亮氨酸)—T( 苏氨酸)有变异,同国外已发表的HSV-2G株gD基因的氨基酸序列比较同源性为99.1%。
6.抗原结构分析:利用PCGENE软件在计算机上进行抗原结构分析,结果显示HSV-2野生株的 两个氨基酸变异均发生在跨膜区以外,不会影响野生株的抗原结构[7]。
讨 论
全世界人口中70%的人血清疱疹病毒抗体阳性,超过三分之一的人有复发性H SV感染。本例患者(野生株)有5年生殖器疱疹的复发病史,经多种抗病毒药物治疗无效。分 析其核苷酸序列发现HSV-2野生株gD基因片段第235bp和第474bp处发生了T-C、C-T的有意 义突变。gD基因编码的氨基酸序列有两个变异,在第80位V(赖氨酸)-A(丙氨酸),第159位I (异亮氨酸)-T(苏氨酸)有变异。该病例反复发作,久治不愈,考虑与其gD基因的核苷酸和 氨基酸突变有关。有待更多的复发性HSV-2gD基因序列做进一步的证实和探讨。
, 百拇医药
比较HSV-2野生株同国外已发表的G株gD基因核苷酸序列同源性为99.2%,氨基酸序列有两 个变异,同源性为99.1%。说明此例复发型野生株同G株gD基因存在高度的同源性,同时也 有一定的变异(抗原结构无影响),反应了我国的HSV-2野生株gD基因的高度保守性。这种高 度保守性也确保了糖蛋白D基因的遗传稳定性。应用高度保守的gD基因研制HSV-2基因工程 疫苗将克服病毒株抗原变异带来的一系列问题,有利于发展适用性广,稳定可靠的基因工程 疫苗和诊断试剂。
参考文献
1 Cory L. The current trend in genital herpes progress in prevention. Sex Transm Dis, 1994,21∶S28-S44.
2 Mishkin EM. Native HSV glycoprotein D vaccines immunogenecity and prote ction in animal models. Vaccines, 1991,9∶148-152.
, http://www.100md.com
3 鄂征, 陈泉光, 徐新来主编. 组织培养技术. 第二版. 北京: 人民卫生出版社, 1 993.65-66.
4 杨雄虎, 侯云德. 我国单纯疱疹病毒Ⅰ型gD基因168株糖蛋白D基因的克隆及序列 分析. 病毒学报, 1993,4∶311-314.
5 Lasky LA, Dowbarnko DJ. DNA sequence analysis of the type common glycop rotein genes of HSV type 1 and 2 DNA, 1984,3∶36-40.
6 Sambrook J. Molecular cloning, a laboratory manual. 2nd ed. New York: C old Spring Harbor Laboratory, 1989,394-396.
7 Watson RJ. DNA sequence of the herpes simplex virus type 2 glycoprotein D gene. Gene, 1983,26∶308-312.
广东省自然科学基金资助(960671), 百拇医药