门静脉转流下入肝血流阻断动物模型的建立及评价
作者:何效东 董家鸿 蔡景修 李 昆 段恒春
单位:何效东 解放军第一医院肝胆外科中心,兰州 730030;董家鸿 蔡景修 李 昆 段恒春 第三军医大学西南医院肝胆外科中心,重庆 400038
关键词:动物模型;大鼠;肝脏;缺血-再灌注损伤
西北国防医学杂志990307 摘要:目的:设计一种可避免门静脉淤血的动物模型,排除门静脉淤血对肝脏功能恢复的影响,从而为肝脏耐受缺血时限的实验研究提供理想的实验模型。方法:利用大鼠肝脏解剖特点,分别阻断肝左、中、右叶肝蒂(约占全肝95%),造成受累肝叶完全缺血;保留尾叶血供作为肝蒂阻断期间门静脉血经肝脏回流入下腔的通道,到预定观察终点,去除肝蒂阻断夹即恢复肝脏血流,切除尾状叶。经血管造影及染料示踪法观察肝蒂阻断后门静脉流出道的完整性及肝脏缺血的完全性以及肝蒂阻断前后血液动力学变化;并观察了肝脏再灌流后24 h的病理变化及动物7 d存活率,与单纯入肝血流阻断组做对照。结果:这种新设计的门静脉转流下入肝血流阻断动物模型,肝脏缺血可靠,门静脉流出道完整,阻断肝蒂前后血液动力学稳定;肝脏病理变化及动物术后7 d存活率转流组与单纯入肝血流阻断组有明显差异,前者好于后者。结论:该模型复制方法简单、重复性高、对机体附加创伤和生理干扰小,是研究大鼠对入肝血流阻断耐受时限的理想模型。
, 百拇医药
中图分类号:R 575 文献标识码:A 文章编号:1007-8622(1999)03-0175-03
Establishment and assessment of the model with normothermic hepatic inflow occlusion under portal blood bypass in rat
HE Xiao-dong,DONG Jia-hong,CAI Jing-xiu,et al.
(Hepatobiliary Surgery Center,The lst Hospital,PLA,730030)
Abstract:Purpose:To establish a new animal model of hepatic inflow occlusion without portal stasis.Methods:Wister rats weighing from 220 to 250 g were used.The liver pedicles of all liver lobers except for caudate were clamped tempora rily,the caudate which permitted portal blood bypass was resected after liver re-perfusion.Portography was made by injection of urografin or methylene blue solution into portal vein.Mean arterial pressure,portal vein pressure and inferior vena cava pressure were monitored during hepatic pedicles clamped.The survival rate and hepatic pathology were observed 7 days later and 24 hours after liver re-perfusion respectively.Results:There were characterizations in this model,such as stable hemodynamics,reliable liver ischemia,intact passage of portal vein etc.The survival rate and the liver pathology had significant differences between portal triad clamping and portal blood bypass.Conclusion:It is an ideal model to study the tolerance time limit of liver ischemia.
, 百拇医药
Key words:Animal model;Rat;Liver;Ischemia-reperfusion injury
入肝血流阻断的安全时限目前仍不明确,长期以来常温下持续肝血流阻断均以20 min为限,但随着肝切除技术的改进及临床经验的不断积累,不断有超越这一时限的报告[1]。实验研究提示门静脉淤血是影响肝脏耐受缺血时限的重要因素[2~4],既往研究中为避免门静脉淤血设计的多种动物模型均有其不足之处,借助这些模型所得实验结果未必能反映肝脏耐受缺血的真正时限。本研究目的是设计一种可避免门静脉淤血的入肝血流阻断动物模型,为肝脏耐受缺血时限的实验研究提供理想的动物模型。
1 材料和方法
1.1 实验动物及分组:雄性Wister大鼠(第三军医大学实验动物繁育中心提供),体重220~250 g,随机分为2组:门静脉转流下入肝血流阻断(PBB)组,单纯入肝血流阻断(PTC)组,每组50只大鼠,其中各取20只供病理学及存活率观察。另取10只供门静脉造影及染料示踪观察。
, 百拇医药
1.2 动物模型的制作方法:PBB组动物术前禁食12 h,自由饮水;腹腔注射戊巴比妥钠(30 mg/kg体重)麻醉;入腹后切断所有肝周韧带,随后用小号动脉夹分别阻断肝左、中、右叶肝蒂(约占全肝95%),造成受累肝叶完全缺血,保留尾叶(约占全肝5%)血供,作为门静脉血液经肝脏回流入下腔静脉的通道。到预定观察终点,去除肝蒂阻断夹即恢复肝脏灌流;切除尾状叶、缝合腹壁切口。见图1。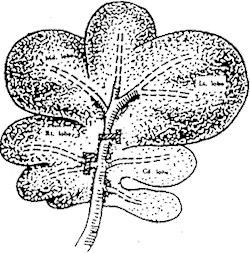
图1 门静脉转流下入肝血流阻断动物模型示意图
PTC组动物术前准备及麻醉同前。用小号动脉夹阻断肝十二指肠韧带,使包括尾状叶在内的全部肝叶完全缺血,肝脏复流后切除尾叶,其余处理均同实验组。
1.3 观察指标及检测方法
1.3.1 入肝血流阻断前后肝脏及胃肠的色质。
, 百拇医药
1.3.2 阻断血流后门静脉流出道的完整性及肝脏缺血的完全性:分别用复方泛影葡胺血管造影及亚甲蓝染色示踪法。
1.3.3 血流动力学
1.3.3.1 平均动脉压(MAP):经颈外动脉插管连接于多功能生理监护仪,观察动物入肝血流阻断前、入肝血流阻断后(30 min)至肝脏复流后30 min期间的MAP值,每5 min测记一次。
1.3.3.2 门静脉压(PVP):门静脉穿刺测压法,观测方法同MAP。
1.3.3.3 下腔静脉压(IVCP):肝下下腔静脉穿刺测压法,观测方法同MAP。
1.3.4 肝脏病理学观察:观察缺血30 min后及再灌注后24 h肝脏组织病理学变化。
1.3.5 动物存活率观察:观察再灌注后7 d动物存活率。
, http://www.100md.com
1.4 统计学处理:实验数据以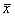 ±s表达,采用方差分析进行组间差异的比较,以P<0.05为差异显著。
±s表达,采用方差分析进行组间差异的比较,以P<0.05为差异显著。
2 结 果
2.1 肝脏及肠道大体形态的变化
2.1.1 PBB组动物阻断及复流前后肠壁无淤血,颜色红润,缺血肝叶由红褐色变为暗灰色;尾叶则呈鲜红,充血,轻度肿大,肝包膜紧张,边缘饱满变钝。缺血30 min复流后肝脏呈紫灰相间的花斑状改变,持续约2~3 min后变为暗褐色。
2.1.2 PTC组动物则于肝门阻断后3~5 min肠壁变为紫黑色,门静脉系统淤血明显,并随阻断时间的延长而进一步加重,全部肝叶均因缺血变成暗灰色。
2.2 门静脉流出道的完整性及肝脏缺血的完全性:PBB组阻断肝蒂后行门静脉穿刺造影可见,造影剂经肝尾叶流注入下腔静脉,随后回流入心脏,分布至全身,而阻断肝叶始终未见造影充盈。门静脉穿刺注射亚甲蓝后可见,肝尾状叶首先染色,随后见心脏、肺脏及胃肠均有染料着色,血流阻断之肝叶始终不着色。
, 百拇医药
2.3 血液动力学参数(见表1)
表1 血液动力学参数(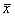 ±s)
±s)
n
肝脏血流阻断前
肝脏血流阻断后(min)
肝脏血流复流后(min)
15
30
15
30
MAP(kPa)
, 百拇医药
PBB
10
16.931±1.410
14.042±2.242△
15.161±1.853△
12.850±2.830
13.771±2.251
PTC
10
16.553±1.124
5.550±1.510★
, 百拇医药
5.274±1.552★
8.791±1.852★
10.870±2.341★
PVP(kPa)
PBB
10
1.050±0.225
1.608±0.407△
1.572±0.380△
0.921±0.105
, http://www.100md.com
0.851±0.108
PTC
10
0.997±0.180
3.112±0.748★
2.888±0.601★
1.323±0.301
1.246±0.884
IVCP(kPa)
PBB
10
, http://www.100md.com
0.631±0.040
0.560±0.032△
0.551±0.050△
0.560±0.035△
0.598±0.048△
PTC
10
0.691±0.071
0.108±0.035★
0.080±0.055★
, 百拇医药
0.232±0.043★
0.288±0.073★
★与肝脏血流阻断前比,P<0.05;△与PTC组比,P<0.05
2.4 肝脏组织病理学变化:缺血后PBB及PTC组均可见局部肝窦淤血及轻度扩张,肝小叶结构完整,汇管区正常;但于再灌注24 h时二者病理改变有所不同,PBB组偶见点状肝细胞失活,而PTC组则见局灶性肝细胞坏死伴炎性细胞浸润,前者明显轻于后者。
2.5 肝脏再灌注后7 d动物存活率:肝脏再灌注后7 d,PBB及PTC组动物存活率分别为100%(20/20)及40%(8/20),二者具有明显差异,P<0.05。
3 讨 论
, 百拇医药 Dochinova于1925年首先用狗进行常温下阻断肝动脉和门静脉的实验,发现阻断肝脏血流时间仅几分钟动物即死亡,死因为阻断肝蒂后迅速发生的门静脉系统淤血和休克。为克服肝蒂阻断后门静脉淤血,一系列动物实验研究资料表明,门静脉转流能显著增强动物对肝蒂阻断的耐受性,从而延长动物耐受入肝血流阻断的时限。因而门静脉转流对入肝血流阻断耐受时限的重要性已受到重视。
在过去研究入肝血流阻断时限所采用的动物模型中主要有下列三种门静脉减压或转流方法:①门腔静脉侧侧吻合将门静脉血分流入下腔静脉[5];②通过门静脉或其束支与腔静脉或其束支之间插管将门静脉血导入腔静脉[3,6];③以复流后切除的非缺血肝叶作为部分肝叶血管蒂阻断期间门静脉血的流出道[7]。
上述模型的缺点是显然的,被动性体外静脉-静脉插管转流,不可能充分引流门静脉血流,动物对入肝血流阻断的耐受性仍然会受到一定程度门静脉淤血的影响。门静脉分流因肝脏复流后丧失部分甚或全部对肝脏功能中有重要作用的门静脉入肝血流,也必然影响受损肝脏功能的恢复和代偿,从而影响肝脏对缺血的耐受性。过去采用大鼠部分肝蒂阻断模型,则因切除了非缺血的右叶及尾叶(约占全肝32%)而显著减少功能性肝细胞群数量和降低肝脏储备功能,无疑会严重影响动物对肝脏缺血性损害的耐受性。
, 百拇医药
本研究设计了一种新的门静脉转流下入肝血流阻断模型,研究结果表明该模型有以下特点:①阻断了各主要肝叶的血流,缺血肝脏占全肝的95%,复流后切除的尾叶仅占5%,后者对功能性肝细胞群总量影响甚小;②主要肝蒂阻断后以尾叶静脉系统引流门静脉血流,腹腔内脏无淤血,血管造影观察证明门静脉血经尾叶回流入下腔静脉,并经心脏分布至全身,说明门静脉流出道完整,腹腔内脏血液回流充分;③入肝血流阻断期间及肝脏复流后动物血流动力学维持稳定;④肝蒂阻断后经门静脉造影及亚甲蓝染色示踪,显示被阻断肝叶始终不显影和无着色,表明肝脏缺血完全可靠;⑤复制方法简便可靠,重复性高,对动物的附加创伤和生理干扰小。
因此,我们认为该模型是研究阻断入肝血流安全时限的理想实验模型。
作者简介:何效东(1962-),男,硕士,主治医师
参考文献:
[1]Huguet C,Gavelli A,Chieco PA,et al.Liver ischemia for hepatic resection:Where is the limit[J]?Surgery,1992,11(3):251-254.
, 百拇医药
[2]吕新生,李建元,韩 明,等.常温下长时间阻断肝门对全身血液动力学、生化及肝脏影响的实验研究[J].中华实验外科杂志,1990,7:16-20.
[3]王 卫,徐 正,王万铁.门静脉阻断及开放对家兔酸碱平稳的影响[J].肝胆外科杂志,1997,9(3):137-139.
[4]Ferri M,Gabriel S,Gavelli A,et al.Bacterial translocation during portal clamping for liver resection:a clinical study[J].Arch Surg,1997,132:162-165.
[5]Drapanas T,Becker DR,Alfano GS,et al.Some effects of interrupting hepatic blood flow[J].Ann Surg,1995,142:831-834.
, http://www.100md.com
[6]Kume M,Yamamoto Y,Saad S,et al.Ischemic preconditioning of the liver in rats:implications of heat shock protein in duction to increase tolerance of ischemia-reperfusion injury[J].J Lab Med,1996,128:251-255.
[7]Shirabe K,Kin S,Shinagawa Y,et al.Inhibition of thromboxama A2 activity during warm ischemia of the liver[J].J Surg Res,1996,61:103-106.
收稿日期:1998-11-18 修稿日期:1999-01-02, http://www.100md.com
单位:何效东 解放军第一医院肝胆外科中心,兰州 730030;董家鸿 蔡景修 李 昆 段恒春 第三军医大学西南医院肝胆外科中心,重庆 400038
关键词:动物模型;大鼠;肝脏;缺血-再灌注损伤
西北国防医学杂志990307 摘要:目的:设计一种可避免门静脉淤血的动物模型,排除门静脉淤血对肝脏功能恢复的影响,从而为肝脏耐受缺血时限的实验研究提供理想的实验模型。方法:利用大鼠肝脏解剖特点,分别阻断肝左、中、右叶肝蒂(约占全肝95%),造成受累肝叶完全缺血;保留尾叶血供作为肝蒂阻断期间门静脉血经肝脏回流入下腔的通道,到预定观察终点,去除肝蒂阻断夹即恢复肝脏血流,切除尾状叶。经血管造影及染料示踪法观察肝蒂阻断后门静脉流出道的完整性及肝脏缺血的完全性以及肝蒂阻断前后血液动力学变化;并观察了肝脏再灌流后24 h的病理变化及动物7 d存活率,与单纯入肝血流阻断组做对照。结果:这种新设计的门静脉转流下入肝血流阻断动物模型,肝脏缺血可靠,门静脉流出道完整,阻断肝蒂前后血液动力学稳定;肝脏病理变化及动物术后7 d存活率转流组与单纯入肝血流阻断组有明显差异,前者好于后者。结论:该模型复制方法简单、重复性高、对机体附加创伤和生理干扰小,是研究大鼠对入肝血流阻断耐受时限的理想模型。
, 百拇医药
中图分类号:R 575 文献标识码:A 文章编号:1007-8622(1999)03-0175-03
Establishment and assessment of the model with normothermic hepatic inflow occlusion under portal blood bypass in rat
HE Xiao-dong,DONG Jia-hong,CAI Jing-xiu,et al.
(Hepatobiliary Surgery Center,The lst Hospital,PLA,730030)
Abstract:Purpose:To establish a new animal model of hepatic inflow occlusion without portal stasis.Methods:Wister rats weighing from 220 to 250 g were used.The liver pedicles of all liver lobers except for caudate were clamped tempora rily,the caudate which permitted portal blood bypass was resected after liver re-perfusion.Portography was made by injection of urografin or methylene blue solution into portal vein.Mean arterial pressure,portal vein pressure and inferior vena cava pressure were monitored during hepatic pedicles clamped.The survival rate and hepatic pathology were observed 7 days later and 24 hours after liver re-perfusion respectively.Results:There were characterizations in this model,such as stable hemodynamics,reliable liver ischemia,intact passage of portal vein etc.The survival rate and the liver pathology had significant differences between portal triad clamping and portal blood bypass.Conclusion:It is an ideal model to study the tolerance time limit of liver ischemia.
, 百拇医药
Key words:Animal model;Rat;Liver;Ischemia-reperfusion injury
入肝血流阻断的安全时限目前仍不明确,长期以来常温下持续肝血流阻断均以20 min为限,但随着肝切除技术的改进及临床经验的不断积累,不断有超越这一时限的报告[1]。实验研究提示门静脉淤血是影响肝脏耐受缺血时限的重要因素[2~4],既往研究中为避免门静脉淤血设计的多种动物模型均有其不足之处,借助这些模型所得实验结果未必能反映肝脏耐受缺血的真正时限。本研究目的是设计一种可避免门静脉淤血的入肝血流阻断动物模型,为肝脏耐受缺血时限的实验研究提供理想的动物模型。
1 材料和方法
1.1 实验动物及分组:雄性Wister大鼠(第三军医大学实验动物繁育中心提供),体重220~250 g,随机分为2组:门静脉转流下入肝血流阻断(PBB)组,单纯入肝血流阻断(PTC)组,每组50只大鼠,其中各取20只供病理学及存活率观察。另取10只供门静脉造影及染料示踪观察。
, 百拇医药
1.2 动物模型的制作方法:PBB组动物术前禁食12 h,自由饮水;腹腔注射戊巴比妥钠(30 mg/kg体重)麻醉;入腹后切断所有肝周韧带,随后用小号动脉夹分别阻断肝左、中、右叶肝蒂(约占全肝95%),造成受累肝叶完全缺血,保留尾叶(约占全肝5%)血供,作为门静脉血液经肝脏回流入下腔静脉的通道。到预定观察终点,去除肝蒂阻断夹即恢复肝脏灌流;切除尾状叶、缝合腹壁切口。见图1。

图1 门静脉转流下入肝血流阻断动物模型示意图
PTC组动物术前准备及麻醉同前。用小号动脉夹阻断肝十二指肠韧带,使包括尾状叶在内的全部肝叶完全缺血,肝脏复流后切除尾叶,其余处理均同实验组。
1.3 观察指标及检测方法
1.3.1 入肝血流阻断前后肝脏及胃肠的色质。
, 百拇医药
1.3.2 阻断血流后门静脉流出道的完整性及肝脏缺血的完全性:分别用复方泛影葡胺血管造影及亚甲蓝染色示踪法。
1.3.3 血流动力学
1.3.3.1 平均动脉压(MAP):经颈外动脉插管连接于多功能生理监护仪,观察动物入肝血流阻断前、入肝血流阻断后(30 min)至肝脏复流后30 min期间的MAP值,每5 min测记一次。
1.3.3.2 门静脉压(PVP):门静脉穿刺测压法,观测方法同MAP。
1.3.3.3 下腔静脉压(IVCP):肝下下腔静脉穿刺测压法,观测方法同MAP。
1.3.4 肝脏病理学观察:观察缺血30 min后及再灌注后24 h肝脏组织病理学变化。
1.3.5 动物存活率观察:观察再灌注后7 d动物存活率。
, http://www.100md.com
1.4 统计学处理:实验数据以
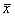 ±s表达,采用方差分析进行组间差异的比较,以P<0.05为差异显著。
±s表达,采用方差分析进行组间差异的比较,以P<0.05为差异显著。2 结 果
2.1 肝脏及肠道大体形态的变化
2.1.1 PBB组动物阻断及复流前后肠壁无淤血,颜色红润,缺血肝叶由红褐色变为暗灰色;尾叶则呈鲜红,充血,轻度肿大,肝包膜紧张,边缘饱满变钝。缺血30 min复流后肝脏呈紫灰相间的花斑状改变,持续约2~3 min后变为暗褐色。
2.1.2 PTC组动物则于肝门阻断后3~5 min肠壁变为紫黑色,门静脉系统淤血明显,并随阻断时间的延长而进一步加重,全部肝叶均因缺血变成暗灰色。
2.2 门静脉流出道的完整性及肝脏缺血的完全性:PBB组阻断肝蒂后行门静脉穿刺造影可见,造影剂经肝尾叶流注入下腔静脉,随后回流入心脏,分布至全身,而阻断肝叶始终未见造影充盈。门静脉穿刺注射亚甲蓝后可见,肝尾状叶首先染色,随后见心脏、肺脏及胃肠均有染料着色,血流阻断之肝叶始终不着色。
, 百拇医药
2.3 血液动力学参数(见表1)
表1 血液动力学参数(
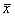 ±s)
±s)n
肝脏血流阻断前
肝脏血流阻断后(min)
肝脏血流复流后(min)
15
30
15
30
MAP(kPa)
, 百拇医药
PBB
10
16.931±1.410
14.042±2.242△
15.161±1.853△
12.850±2.830
13.771±2.251
PTC
10
16.553±1.124
5.550±1.510★
, 百拇医药
5.274±1.552★
8.791±1.852★
10.870±2.341★
PVP(kPa)
PBB
10
1.050±0.225
1.608±0.407△
1.572±0.380△
0.921±0.105
, http://www.100md.com
0.851±0.108
PTC
10
0.997±0.180
3.112±0.748★
2.888±0.601★
1.323±0.301
1.246±0.884
IVCP(kPa)
PBB
10
, http://www.100md.com
0.631±0.040
0.560±0.032△
0.551±0.050△
0.560±0.035△
0.598±0.048△
PTC
10
0.691±0.071
0.108±0.035★
0.080±0.055★
, 百拇医药
0.232±0.043★
0.288±0.073★
★与肝脏血流阻断前比,P<0.05;△与PTC组比,P<0.05
2.4 肝脏组织病理学变化:缺血后PBB及PTC组均可见局部肝窦淤血及轻度扩张,肝小叶结构完整,汇管区正常;但于再灌注24 h时二者病理改变有所不同,PBB组偶见点状肝细胞失活,而PTC组则见局灶性肝细胞坏死伴炎性细胞浸润,前者明显轻于后者。
2.5 肝脏再灌注后7 d动物存活率:肝脏再灌注后7 d,PBB及PTC组动物存活率分别为100%(20/20)及40%(8/20),二者具有明显差异,P<0.05。
3 讨 论
, 百拇医药 Dochinova于1925年首先用狗进行常温下阻断肝动脉和门静脉的实验,发现阻断肝脏血流时间仅几分钟动物即死亡,死因为阻断肝蒂后迅速发生的门静脉系统淤血和休克。为克服肝蒂阻断后门静脉淤血,一系列动物实验研究资料表明,门静脉转流能显著增强动物对肝蒂阻断的耐受性,从而延长动物耐受入肝血流阻断的时限。因而门静脉转流对入肝血流阻断耐受时限的重要性已受到重视。
在过去研究入肝血流阻断时限所采用的动物模型中主要有下列三种门静脉减压或转流方法:①门腔静脉侧侧吻合将门静脉血分流入下腔静脉[5];②通过门静脉或其束支与腔静脉或其束支之间插管将门静脉血导入腔静脉[3,6];③以复流后切除的非缺血肝叶作为部分肝叶血管蒂阻断期间门静脉血的流出道[7]。
上述模型的缺点是显然的,被动性体外静脉-静脉插管转流,不可能充分引流门静脉血流,动物对入肝血流阻断的耐受性仍然会受到一定程度门静脉淤血的影响。门静脉分流因肝脏复流后丧失部分甚或全部对肝脏功能中有重要作用的门静脉入肝血流,也必然影响受损肝脏功能的恢复和代偿,从而影响肝脏对缺血的耐受性。过去采用大鼠部分肝蒂阻断模型,则因切除了非缺血的右叶及尾叶(约占全肝32%)而显著减少功能性肝细胞群数量和降低肝脏储备功能,无疑会严重影响动物对肝脏缺血性损害的耐受性。
, 百拇医药
本研究设计了一种新的门静脉转流下入肝血流阻断模型,研究结果表明该模型有以下特点:①阻断了各主要肝叶的血流,缺血肝脏占全肝的95%,复流后切除的尾叶仅占5%,后者对功能性肝细胞群总量影响甚小;②主要肝蒂阻断后以尾叶静脉系统引流门静脉血流,腹腔内脏无淤血,血管造影观察证明门静脉血经尾叶回流入下腔静脉,并经心脏分布至全身,说明门静脉流出道完整,腹腔内脏血液回流充分;③入肝血流阻断期间及肝脏复流后动物血流动力学维持稳定;④肝蒂阻断后经门静脉造影及亚甲蓝染色示踪,显示被阻断肝叶始终不显影和无着色,表明肝脏缺血完全可靠;⑤复制方法简便可靠,重复性高,对动物的附加创伤和生理干扰小。
因此,我们认为该模型是研究阻断入肝血流安全时限的理想实验模型。
作者简介:何效东(1962-),男,硕士,主治医师
参考文献:
[1]Huguet C,Gavelli A,Chieco PA,et al.Liver ischemia for hepatic resection:Where is the limit[J]?Surgery,1992,11(3):251-254.
, 百拇医药
[2]吕新生,李建元,韩 明,等.常温下长时间阻断肝门对全身血液动力学、生化及肝脏影响的实验研究[J].中华实验外科杂志,1990,7:16-20.
[3]王 卫,徐 正,王万铁.门静脉阻断及开放对家兔酸碱平稳的影响[J].肝胆外科杂志,1997,9(3):137-139.
[4]Ferri M,Gabriel S,Gavelli A,et al.Bacterial translocation during portal clamping for liver resection:a clinical study[J].Arch Surg,1997,132:162-165.
[5]Drapanas T,Becker DR,Alfano GS,et al.Some effects of interrupting hepatic blood flow[J].Ann Surg,1995,142:831-834.
, http://www.100md.com
[6]Kume M,Yamamoto Y,Saad S,et al.Ischemic preconditioning of the liver in rats:implications of heat shock protein in duction to increase tolerance of ischemia-reperfusion injury[J].J Lab Med,1996,128:251-255.
[7]Shirabe K,Kin S,Shinagawa Y,et al.Inhibition of thromboxama A2 activity during warm ischemia of the liver[J].J Surg Res,1996,61:103-106.
收稿日期:1998-11-18 修稿日期:1999-01-02, http://www.100md.com