线粒体在肝脏缺血再灌注损伤中的作用
作者:何效东
单位:何效东:解放军第一医院肝胆外科中心,兰州730030 董家鸿 蔡景修:第三军医大学西南医院肝胆外科中心,重庆 400038
关键词:肝脏疾病;线粒体;缺血-再灌注损伤
线粒体在肝脏缺血再灌注损伤中的作用何效东 综述 董家鸿 蔡景修 审校
摘要:肝脏外科、休克等病理过程中肝脏缺血再灌注损伤不可避免,该过程以缺血、缺氧、能量供应中断为始动因素,经细胞钙超载、氧自由基形成及白细胞浸润三个重要环节,通过细胞因子炎性介质的释放,不但对缺血肝脏造成损伤,而且对全身其它脏器造成一定的伤害;在这一病理过程中,线粒体对细胞内钙的调节、氧自由基形成等具有非常重要的作用。如何防治肝脏缺血再灌注时线粒体损伤将是今后实验研究的重点。
中图分类号:R 575 文献标识码:A 文章编号:1007-8622(1999)04-0295-03
, http://www.100md.com
肝脏是体内最大的代谢器官,线粒体是细胞代谢的中心场所,线粒体的正常呼吸功能和ATP生成对组织器官功能及细胞结构的完整性至关重要。但线粒体对缺血、缺氧非常敏感,缺血、缺氧的肝组织在血流恢复或复氧后其损伤程度不但没有改善,反而进一步加重,这与细胞钙超载、氧自由基等因素有直接的关系[1]。线粒体是联系钙超载、氧自由基形成和细胞死亡的中心环节。近年对线粒体在肝脏缺血再灌注损伤中的作用研究较多,进展较快,本文就这方面的内容做一综述。
1 线粒体膜通透性改变与缺血再灌注钙超载的联系
肝脏缺血再灌注可致细胞钙超载,是引起肝细胞损伤的原因之一,而线粒体具有强大的聚积Ca2+能力,对钙离子稳态起到一定的调节作用,但线粒体摄Ca2+能力有限,若损伤因素不能清除,经各种途径最终可致细胞内钙超载[2,3]。
近年对细胞坏死的研究表明,线粒体膜通透性改变(Mitochondrial membrane permeability transition,MMPT)在细胞死亡中起着关键的作用[4]。在各种损伤因素的作用下,MMPT一旦发生,线粒体膜通透性迅速升高,细胞死亡随之发生。抑制MMPT发生可延缓细胞死亡[5]。目前认为MMPT的发生机制包括线粒体内膜的非特异性损伤和一种巨通道(Megapore)的开放[4,6]。而线粒体内膜非特异性损伤可由钙超载触发的氧自由基损伤等造成。关于导致MMPT的特殊机制的研究表明:线粒体基层中Ca2的大量聚积正是巨通道(Megapore)开放的原因之一[5,6]。故线粒体钙超载通过MMPT可导致细胞致死性损伤。
, http://www.100md.com
对巨通道进一步研究发现,线粒体膜上的巨通道就是直径为20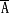 (2 nm)的Ca2+依赖小孔,该小孔具有选择性通透作用[7]。已鉴定出该小孔为线粒体内膜的高电导性、相当低离子特异性大通道。线粒体内Ca2+和Pi的升高或活性氧刺激时小孔即开放[6],当线粒体Ca2+被去除后小孔迅速关闭[4];生理剂量的ATP(>1mM)能抑制其开放。正常情况下,小孔成份环亲和素(cyclophilin)维持其开放。环孢素A(cyclosporin A,CSA)能与环亲合素结合使小孔关闭,同时,CSA具有修补线粒体内膜的功能(patch-clamp technique)[5,7].此外,小孔的开放还与线粒体基质的pH有关,当线粒内pH呈酸性时小孔的开放过程变慢。另外,线粒体通透性改变可由线粒体膜磷脂的去酰化-再酰化循环紊乱引起。
(2 nm)的Ca2+依赖小孔,该小孔具有选择性通透作用[7]。已鉴定出该小孔为线粒体内膜的高电导性、相当低离子特异性大通道。线粒体内Ca2+和Pi的升高或活性氧刺激时小孔即开放[6],当线粒体Ca2+被去除后小孔迅速关闭[4];生理剂量的ATP(>1mM)能抑制其开放。正常情况下,小孔成份环亲和素(cyclophilin)维持其开放。环孢素A(cyclosporin A,CSA)能与环亲合素结合使小孔关闭,同时,CSA具有修补线粒体内膜的功能(patch-clamp technique)[5,7].此外,小孔的开放还与线粒体基质的pH有关,当线粒内pH呈酸性时小孔的开放过程变慢。另外,线粒体通透性改变可由线粒体膜磷脂的去酰化-再酰化循环紊乱引起。
, http://www.100md.com
但另有研究认为,在细胞损伤中,线粒体摄钙增多也许是继发性改变的结果,而线粒体膜通透性改变(MMPT)才是始动因素,因而对胞浆钙超载在组织缺血再灌注损伤中的重要性提出质疑,[8],因为在大鼠肝脏缺氧35 min再灌注10 min的模型中,肝组织电镜下同一视野的两个肝细胞中,一个线粒体正常,而另一个则水肿变性,后者也许已有线粒体通透性改变;而值得注意的是此时仍未见其它细胞器有形态学方面的变化[11]。这仅是初步观察的结果,要阐明其详细机制,还有待更进一步研究。
2 线粒体在氧自由基形成中的作用
黄嘌呤氧化酶和中性白细胞是氧自由基的两个重要来源,[9],缺血和再灌注均可产生较多超氧化物,引起组织损伤。线粒体是肝脏缺血再灌注期间活性氧产生的重要器官[10]。
2.1 肝脏缺血再灌注活性氧释放特点与肝细胞损伤的关系:对肝脏缺血再灌注损伤研究表明,复氧后活性氧释放时相与肝细胞损伤密切相关。Jaeschke等[11]阻断部分肝脏血流45 min后再灌注(RP)不同时间,发现肝组织出现了双相损伤。在恢复灌注的1 h内,血浆转氨酶活性升高,此为肝脏缺血再灌注的Ⅰ相损伤(initial injury);接下去的5 h ,转氨酶的活性维持在Ⅰ相损伤水平而在RP后6~24 h,转氨酶活性再次显著升高,表明缺血再灌注肝脏还存在Ⅱ相损伤(progressive injury)。从而可以看出复氧时肝细胞损伤与活性氧的释放时相具有直接联系。实验还证明RP肝脏的Ⅰ相损伤与肝窦枯否氏细胞(KC)有关。KC可因钙超载、吞噬作用或补体系统而激活,活化的KC除主要释放活性氧外,还可释放蛋白酶及各种细胞因子,介导对肝细胞的毒性作用,导致严重的肝脏再灌注损伤;干扰KC功能的药物具有明显的治疗作用[12,13],而Ⅱ相损伤与白细胞在局部的聚集到一定量并激活后释放毒性介质有关,尽管白细胞在RP初期在肝窦与内皮细胞粘附增强并开始聚集,但并不参与肝组织Ⅰ相损伤[13]。同时还发现KC的Ⅰ相损伤可激活中性白细胞(PMN),使其释放活性氧及蛋白酶等毒性介质攻击肝细胞,坏死肝细胞反过来又可促进补体激化和PMN活化,如此恶性循环,最终导致严重肝细胞损伤。单克隆抗体可减少PMN粘附并使再灌注损伤减轻。[14]。
, http://www.100md.com
2.2 活性氧与缺血再灌注后损伤肝细胞在肝腺泡中的分布:以前研究发现,肝叶切除后肝细胞的再生主要发生在肝泡Ⅰ带,而结扎动物肝血管使肝脏缺氧或营养不良性早期肝硬化所发生的肝损害主要发生在Ⅲ带,这可解释为Ⅰ带肝细胞靠近中轴血管,优先获得富于营养的物质和含氧充足的血液,因此优先再生,而Ⅲ带组织PO2最低,故最容易出现缺氧性肝损害和肝细胞死亡。
那么,肝脏缺血后再灌注损伤的特点是什么呢?Flreeman等的研究认为:还原型谷胱甘肽(GSH)在肝脏是重要的自由基清除剂。研究发现,大鼠肝脏缺血90 min后再灌注,肝组织GSH低者(如禁食)肝脏损害程度较GSH高者更为严重,并且损害肝细胞主要分布在小叶间门静脉周围区域(即Ⅰ带),这种表现在GSH完全消耗者更加明显,因而支持氧自由基引起肝损伤这一论断[15]。同时实验也证明,用氯化钴处理禁食的动物,以增加GSH在肝组织的含量,结果缺血后肝细胞坏死程度明显减轻[15];这种对缺血再灌注损伤的区带性差异,可能与以下因素有关:①与Kupffer细胞在肝窦的不均质性分布有关。大鼠肝Kupffer细胞约占肝实质的2.1%,但以肝小叶周边带分布较多。kupffer细胞的活化在机体防卫机能中有积极的作用,但活化后的Kupffer细胞以其分泌的各种细胞因子(cytotines)作用于肝细胞、邻近组织及全身。缺血、再灌注可直接或间接激活Kupffer细胞(或中性白细胞),可释放多种细胞因子和介质[16],其中包括O2代谢中间产物H2O、O?2、OH?自由基、O2及TNF等。②与缺血后“无灌注”(no-reflow)或“无血再灌注”(reflow-paradox)引起微循环紊乱有关 [17]。肝窦是特化的毛细血管,其直径与其它毛细血管相似,但每个肝细胞紧邻两上肝窦,因而对毛细血管阻塞的耐受较强,在生理情况下也常发生单个血窦的阻塞。但肝脏长时间缺血后由于内皮水肿、血窦内血液浓缩及微静脉阻塞等,使再灌注后缺血缺氧仍在继续(no-reflow),导致再灌注不匀,而再灌注后“无血再灌注”(reflow-paradox)是由于复流或复氧激活了白细胞,经细胞表面粘附分子ICAM-1、CD11/CD18、L、P-选择素与内皮细胞牢固粘附而引起肝窦阻塞。通过以上两种方式,使复流后活性氧释放增多并限制在局部,同时,由于氧自由基平均寿命很短,仅10?3秒[18],在微循环紊乱的情况下不能立即在肝组织播散或大量释放入血循中,造成局部组织严重损伤(如门管区),Rymsa研究发现,RP初期在门脉周围区域分离出具有很强吞噬活性的大KC,其自发产生的O?2增加3倍以上。Suzuki等在肝脏缺血90 min再灌60 min的组织学观察中发现,病变主要分布在肝泡Ⅰ带至Ⅱ带,可见肝细胞严重变性浊肿、肝窦瘀血[9]。关于其损伤分布部位的确切机制还有待进一步研究。
, 百拇医药
但Gonzalez-Flecha[15]研究发现,肝腺泡Ⅱ、Ⅲ带对缺血再灌注损伤比较敏感,目前研究认为肝泡无论在细胞器结构或酶的组份都有所不同,这是它对缺血再灌注损伤敏感性不同的基础。目前对肝脏缺血再灌注损伤敏感性的组织学定位仍有争议,还有待进一步探讨。
3 缺血再灌注线粒体呼吸活性的变化
前面已经提到线粒体在细胞钙超载及氧自由基形成中的调节作用。但当这种调节作用超过一定限度,必然引起线粒体自身损害,这种损害出现前首先出现一系列代偿性改变,故了解其变化规律对缺血再灌注损伤的防治具有积极的作用。
评价线粒体呼吸活性常用呼吸控制率(RCR)和磷氧比(P/O)来表示。它们是反映线粒体完整性、氧化磷酸化偶联程度及氧化磷酸化效率的灵敏指标。肝脏缺血再灌注时线粒体通透性的改变、线粒体内酶和辅酶的丢失,以及由此造成的氧化磷酸化障碍,均可影响线粒体呼吸活性。Isozaki在研究间断及持续肝脏缺血对线粒体功能的影响后发现,肝脏在持续缺血30 min后对RCR及P/O影响不大;若将缺血总时间设定在60 min,经观察发现间断缺血者线粒体功能明显好于持续缺血者,表明随持续缺血时间的延长,线粒体的完整性受到一定的影响。
, 百拇医药
Korokawa等研究肝大部分切除后残肝细胞线粒体的功能时见到,手术后第一天CRC及R3较手术前明显增高,2~5 d后逐渐降低至术前水平,说明残肝代谢活跃线粒体功能代偿性增强。但Kobayashi[19]对缺血再灌注时肝脏线粒体呼吸活性观察发现,缺血120 min线粒体RCR、R3较缺血前明显降低,再灌注后虽有所提高,但仍明显低于术前水平。Gonzalez-Flecha[10]的研究与以上相似,观察了缺血60 min、120 min及180 min及再灌注30 min时线粒体呼吸功能的改变,见缺血后RCR、R3均不同程度降低,并随缺血时间延长,这种变化越明显,R4则无明显变化;再灌注30 min时,以上指标不但没有升高反而较缺血后明显降低,但缺血180 min再灌注30 min组则变化不明显或无变化,也许此时线粒体代偿已到极限,对各种刺激敏感性降低所致。
作者简介:何效东(1962-),男,硕士,主治医师
, 百拇医药
参考文献:
[1]liu W,Schob O, Pugmire JE,et al.Glycohydrolases as markers of hepatic ischemia-reperfusion injury and recovery [J].Hepatology,1996,24:157.
[2]Hatanaka N,Kamijke W,Shimizu S,et al.Ca2release from mitochondrial induces cytosiolic enzyme leakage in anoxis liver [J].J Surg Res,1995,58:485.
[3]Masini A,Gallesi D,Giovannini F,et al. Membrane potential of hepatic mitochondrial after cute cocaine administration in rat-the role of mitochondrial reduced glutathione [J].Hepatology,1997,25:305.
, http://www.100md.com
[4]Saris N-E L,Eriksson KD.Mitochondrial dysfunction in ischemia-reperfusion [J].Acta Anaesthesiologica Scandinavia,1995,29:(suppl 107):171.
[5]Geexaerts MD,Ronveavx-Dupal MF,Lemasters JJ,et al.Cytosilic free Ca2+and proteolysis in lethal oxidative injury in endothelial cell[J].Am J Physiol,1991,261(5):C889.
[6]Szabo I, Zoratti M.The giant channel of the inner mitochondrial membrane is inhibited by cyclosporin A [J].J Biol,Chem,1991,266:3376.
, 百拇医药
[7]Bernard P,Vassanell S,Veronese P,et al.Modulation of the mitochondrial permeability transition pore[J].J Biol Chem,1992,267:2934.
[8]Jacobs WR,Sgambati M,Gomez G,et al.Role of cytosolic Ca 2+ in renal tubule damage induced by anoxia [J].Am J Physiol,1991,260:C545.
[9]Suzuki S,Toledo-pereyra LH,Rodriguez FL,et al. Neutrophil infilration as an important factor in liver ischemia and reperfusion injury[J].Transplantation,1993,55(6):1265.
, 百拇医药
[10]Gonzalez-Flecha B, Cutrin JC,Boveris A.Time course and mechanism of oxidative stress and tissue damage in rat liver subjected to in vivo ischemia-reperfusion[J]. J Clin Invest 1993,91:456.
[11]Jaeschke H,Farbood A,Smith W.Neutrophils contribute to ischemia/reperfusion injury in rat liver in vivo [J].FASEB J ,1990,4:3355.
[12]Brass CA,Roberts TG.Hepatic free radical production after cold storage;kupffer cell-dependent and independent mechanisms in rats [J].Gastroenterology,1995,108:1167.
, http://www.100md.com
[13]Niwano M,Arii S,Monden K,et al. Aneliovation of sinusoided endothelial cell damage by kupffer cell blockade during cell preservation of rat liver [J].J Surg Res,1997,72:36.
[14]Marubayashi S,Oshire Y,Maeda T,et al.Protective effect of monoclonal antibodies to adhesion molecules on rat liver ischemia-reperfusion injury [J].Surgery,1997,122:45.
[15]Jennische E. Possible influence of glutathine on postischemic liver injury [J].Acta Pathol Microbiol Scand,[C]1984,92:55.
, 百拇医药
[16]Shibuyo H,Ohkohchi N,Seya K,et al.Kupffer cell generate superoxide anions and modulate reperfusion injury in rat liver after cold preservation [J].Hepatology,1997,25:356.
[17]Menger MD.Microcirculatory disturbance secondary to ischemia-reperfusion [J].Transplantation,1995,27(5):2863.
[18]卢绮萍,史陈让,汪 红,等.大鼠肝缺血再灌流期间脂质过氧化自由基动态变化及病理改变同步观察.中华实验外科杂志,1992,9:11.
[19]Kobayashi H,Nonami T,Kurokawa T,et al.Mechanism and prevention of ischemia-reperfusion liver injury in rats [J] J Surg Res,1991,51:240.
, http://www.100md.com
收稿日期:1999-01-20
线粒体在肝脏缺血再灌注损伤中的作用
何效东 综述 董家鸿 蔡景修 审校
摘要:肝脏外科、休克等病理过程中肝脏缺血再灌注损伤不可避免,该过程以缺血、缺氧、能量供应中断为始动因素,经细胞钙超载、氧自由基形成及白细胞浸润三个重要环节,通过细胞因子炎性介质的释放,不但对缺血肝脏造成损伤,而且对全身其它脏器造成一定的伤害;在这一病理过程中,线粒体对细胞内钙的调节、氧自由基形成等具有非常重要的作用。如何防治肝脏缺血再灌注时线粒体损伤将是今后实验研究的重点。
关键词:肝脏疾病;线粒体; 缺血-再灌注损伤
中图分类号:R 575 文献标识码:A 文章编号:1007-8622(1999)04-0295-03
, http://www.100md.com
肝脏是体内最大的代谢器官,线粒体是细胞代谢的中心场所,线粒体的正常呼吸功能和ATP生成对组织器官功能及细胞结构的完整性至关重要。但线粒体对缺血、缺氧非常敏感,缺血、缺氧的肝组织在血流恢复或复氧后其损伤程度不但没有改善,反而进一步加重,这与细胞钙超载、氧自由基等因素有直接的关系[1]。线粒体是联系钙超载、氧自由基形成和细胞死亡的中心环节。近年对线粒体在肝脏缺血再灌注损伤中的作用研究较多,进展较快,本文就这方面的内容做一综述。
1 线粒体膜通透性改变与缺血再灌注钙超载的联系
肝脏缺血再灌注可致细胞钙超载,是引起肝细胞损伤的原因之一,而线粒体具有强大的聚积Ca2+能力,对钙离子稳态起到一定的调节作用,但线粒体摄Ca2+能力有限,若损伤因素不能清除,经各种途径最终可致细胞内钙超载[2,3]。
近年对细胞坏死的研究表明,线粒体膜通透性改变(Mitochondrial membrane permeability transition,MMPT)在细胞死亡中起着关键的作用[4]。在各种损伤因素的作用下,MMPT一旦发生,线粒体膜通透性迅速升高,细胞死亡随之发生。抑制MMPT发生可延缓细胞死亡[5]。目前认为MMPT的发生机制包括线粒体内膜的非特异性损伤和一种巨通道(Megapore)的开放[4,6]。而线粒体内膜非特异性损伤可由钙超载触发的氧自由基损伤等造成。关于导致MMPT的特殊机制的研究表明:线粒体基层中Ca2的大量聚积正是巨通道(Megapore)开放的原因之一[5,6]。故线粒体钙超载通过MMPT可导致细胞致死性损伤。
, 百拇医药
对巨通道进一步研究发现,线粒体膜上的巨通道就是直径为20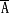 (2 nm)的Ca2+依赖小孔,该小孔具有选择性通透作用[7]。已鉴定出该小孔为线粒体内膜的高电导性、相当低离子特异性大通道。线粒体内Ca2+和Pi的升高或活性氧刺激时小孔即开放[6],当线粒体Ca2+被去除后小孔迅速关闭[4];生理剂量的ATP(>1mM)能抑制其开放。正常情况下,小孔成份环亲和素(cyclophilin)维持其开放。环孢素A(cyclosporin A,CSA)能与环亲合素结合使小孔关闭,同时,CSA具有修补线粒体内膜的功能(patch-clamp technique)[5,7].此外,小孔的开放还与线粒体基质的pH有关,当线粒内pH呈酸性时小孔的开放过程变慢。另外,线粒体通透性改变可由线粒体膜磷脂的去酰化-再酰化循环紊乱引起。
(2 nm)的Ca2+依赖小孔,该小孔具有选择性通透作用[7]。已鉴定出该小孔为线粒体内膜的高电导性、相当低离子特异性大通道。线粒体内Ca2+和Pi的升高或活性氧刺激时小孔即开放[6],当线粒体Ca2+被去除后小孔迅速关闭[4];生理剂量的ATP(>1mM)能抑制其开放。正常情况下,小孔成份环亲和素(cyclophilin)维持其开放。环孢素A(cyclosporin A,CSA)能与环亲合素结合使小孔关闭,同时,CSA具有修补线粒体内膜的功能(patch-clamp technique)[5,7].此外,小孔的开放还与线粒体基质的pH有关,当线粒内pH呈酸性时小孔的开放过程变慢。另外,线粒体通透性改变可由线粒体膜磷脂的去酰化-再酰化循环紊乱引起。
, 百拇医药
但另有研究认为,在细胞损伤中,线粒体摄钙增多也许是继发性改变的结果,而线粒体膜通透性改变(MMPT)才是始动因素,因而对胞浆钙超载在组织缺血再灌注损伤中的重要性提出质疑,[8],因为在大鼠肝脏缺氧35 min再灌注10 min的模型中,肝组织电镜下同一视野的两个肝细胞中,一个线粒体正常,而另一个则水肿变性,后者也许已有线粒体通透性改变;而值得注意的是此时仍未见其它细胞器有形态学方面的变化[11]。这仅是初步观察的结果,要阐明其详细机制,还有待更进一步研究。
2 线粒体在氧自由基形成中的作用
黄嘌呤氧化酶和中性白细胞是氧自由基的两个重要来源,[9],缺血和再灌注均可产生较多超氧化物,引起组织损伤。线粒体是肝脏缺血再灌注期间活性氧产生的重要器官[10]。
2.1 肝脏缺血再灌注活性氧释放特点与肝细胞损伤的关系:对肝脏缺血再灌注损伤研究表明,复氧后活性氧释放时相与肝细胞损伤密切相关。Jaeschke等[11]阻断部分肝脏血流45 min后再灌注(RP)不同时间,发现肝组织出现了双相损伤。在恢复灌注的1 h内,血浆转氨酶活性升高,此为肝脏缺血再灌注的Ⅰ相损伤(initial injury);接下去的5 h ,转氨酶的活性维持在Ⅰ相损伤水平而在RP后6~24 h,转氨酶活性再次显著升高,表明缺血再灌注肝脏还存在Ⅱ相损伤(progressive injury)。从而可以看出复氧时肝细胞损伤与活性氧的释放时相具有直接联系。实验还证明RP肝脏的Ⅰ相损伤与肝窦枯否氏细胞(KC)有关。KC可因钙超载、吞噬作用或补体系统而激活,活化的KC除主要释放活性氧外,还可释放蛋白酶及各种细胞因子,介导对肝细胞的毒性作用,导致严重的肝脏再灌注损伤;干扰KC功能的药物具有明显的治疗作用[12,13],而Ⅱ相损伤与白细胞在局部的聚集到一定量并激活后释放毒性介质有关,尽管白细胞在RP初期在肝窦与内皮细胞粘附增强并开始聚集,但并不参与肝组织Ⅰ相损伤[13]。同时还发现KC的Ⅰ相损伤可激活中性白细胞(PMN),使其释放活性氧及蛋白酶等毒性介质攻击肝细胞,坏死肝细胞反过来又可促进补体激化和PMN活化,如此恶性循环,最终导致严重肝细胞损伤。单克隆抗体可减少PMN粘附并使再灌注损伤减轻。[14]。
, http://www.100md.com
2.2 活性氧与缺血再灌注后损伤肝细胞在肝腺泡中的分布:以前研究发现,肝叶切除后肝细胞的再生主要发生在肝泡Ⅰ带,而结扎动物肝血管使肝脏缺氧或营养不良性早期肝硬化所发生的肝损害主要发生在Ⅲ带,这可解释为Ⅰ带肝细胞靠近中轴血管,优先获得富于营养的物质和含氧充足的血液,因此优先再生,而Ⅲ带组织PO2最低,故最容易出现缺氧性肝损害和肝细胞死亡。
那么,肝脏缺血后再灌注损伤的特点是什么呢?Flreeman等的研究认为:还原型谷胱甘肽(GSH)在肝脏是重要的自由基清除剂。研究发现,大鼠肝脏缺血90 min后再灌注,肝组织GSH低者(如禁食)肝脏损害程度较GSH高者更为严重,并且损害肝细胞主要分布在小叶间门静脉周围区域(即Ⅰ带),这种表现在GSH完全消耗者更加明显,因而支持氧自由基引起肝损伤这一论断[15]。同时实验也证明,用氯化钴处理禁食的动物,以增加GSH在肝组织的含量,结果缺血后肝细胞坏死程度明显减轻[15];这种对缺血再灌注损伤的区带性差异,可能与以下因素有关:①与Kupffer细胞在肝窦的不均质性分布有关。大鼠肝Kupffer细胞约占肝实质的2.1%,但以肝小叶周边带分布较多。kupffer细胞的活化在机体防卫机能中有积极的作用,但活化后的Kupffer细胞以其分泌的各种细胞因子(cytotines)作用于肝细胞、邻近组织及全身。缺血、再灌注可直接或间接激活Kupffer细胞(或中性白细胞),可释放多种细胞因子和介质[16],其中包括O2代谢中间产物H2O、O?2、OH?自由基、O2及TNF等。②与缺血后“无灌注”(no-reflow)或“无血再灌注”(reflow-paradox)引起微循环紊乱有关 [17]。肝窦是特化的毛细血管,其直径与其它毛细血管相似,但每个肝细胞紧邻两上肝窦,因而对毛细血管阻塞的耐受较强,在生理情况下也常发生单个血窦的阻塞。但肝脏长时间缺血后由于内皮水肿、血窦内血液浓缩及微静脉阻塞等,使再灌注后缺血缺氧仍在继续(no-reflow),导致再灌注不匀,而再灌注后“无血再灌注”(reflow-paradox)是由于复流或复氧激活了白细胞,经细胞表面粘附分子ICAM-1、CD11/CD18、L、P-选择素与内皮细胞牢固粘附而引起肝窦阻塞。通过以上两种方式,使复流后活性氧释放增多并限制在局部,同时,由于氧自由基平均寿命很短,仅10?3秒[18],在微循环紊乱的情况下不能立即在肝组织播散或大量释放入血循中,造成局部组织严重损伤(如门管区),Rymsa研究发现,RP初期在门脉周围区域分离出具有很强吞噬活性的大KC,其自发产生的O?2增加3倍以上。Suzuki等在肝脏缺血90 min再灌60 min的组织学观察中发现,病变主要分布在肝泡Ⅰ带至Ⅱ带,可见肝细胞严重变性浊肿、肝窦瘀血[9]。关于其损伤分布部位的确切机制还有待进一步研究。
, 百拇医药
但Gonzalez-Flecha[15]研究发现,肝腺泡Ⅱ、Ⅲ带对缺血再灌注损伤比较敏感,目前研究认为肝泡无论在细胞器结构或酶的组份都有所不同,这是它对缺血再灌注损伤敏感性不同的基础。目前对肝脏缺血再灌注损伤敏感性的组织学定位仍有争议,还有待进一步探讨。
3 缺血再灌注线粒体呼吸活性的变化
前面已经提到线粒体在细胞钙超载及氧自由基形成中的调节作用。但当这种调节作用超过一定限度,必然引起线粒体自身损害,这种损害出现前首先出现一系列代偿性改变,故了解其变化规律对缺血再灌注损伤的防治具有积极的作用。
评价线粒体呼吸活性常用呼吸控制率(RCR)和磷氧比(P/O)来表示。它们是反映线粒体完整性、氧化磷酸化偶联程度及氧化磷酸化效率的灵敏指标。肝脏缺血再灌注时线粒体通透性的改变、线粒体内酶和辅酶的丢失,以及由此造成的氧化磷酸化障碍,均可影响线粒体呼吸活性。Isozaki在研究间断及持续肝脏缺血对线粒体功能的影响后发现,肝脏在持续缺血30 min后对RCR及P/O影响不大;若将缺血总时间设定在60 min,经观察发现间断缺血者线粒体功能明显好于持续缺血者,表明随持续缺血时间的延长,线粒体的完整性受到一定的影响。
, 百拇医药
Korokawa等研究肝大部分切除后残肝细胞线粒体的功能时见到,手术后第一天CRC及R3较手术前明显增高,2~5 d后逐渐降低至术前水平,说明残肝代谢活跃线粒体功能代偿性增强。但Kobayashi[19]对缺血再灌注时肝脏线粒体呼吸活性观察发现,缺血120 min线粒体RCR、R3较缺血前明显降低,再灌注后虽有所提高,但仍明显低于术前水平。Gonzalez-Flecha[10]的研究与以上相似,观察了缺血60 min、120 min及180 min及再灌注30 min时线粒体呼吸功能的改变,见缺血后RCR、R3均不同程度降低,并随缺血时间延长,这种变化越明显,R4则无明显变化;再灌注30 min时,以上指标不但没有升高反而较缺血后明显降低,但缺血180 min再灌注30 min组则变化不明显或无变化,也许此时线粒体代偿已到极限,对各种刺激敏感性降低所致。
作者简介:何效东(1962-),男,硕士,主治医师
, http://www.100md.com
作者单位:何效东:解放军第一医院肝胆外科中心,兰州730030
董家鸿 蔡景修:第三军医大学西南医院肝胆外科中心,重庆 400038
参考文献:
[1]liu W,Schob O, Pugmire JE,et al.Glycohydrolases as markers of hepatic ischemia-reperfusion injury and recovery [J].Hepatology,1996,24:157.
[2]Hatanaka N,Kamijke W,Shimizu S,et al.Ca2release from mitochondrial induces cytosiolic enzyme leakage in anoxis liver [J].J Surg Res,1995,58:485.
, 百拇医药
[3]Masini A,Gallesi D,Giovannini F,et al. Membrane potential of hepatic mitochondrial after cute cocaine administration in rat-the role of mitochondrial reduced glutathione [J].Hepatology,1997,25:305.
[4]Saris N-E L,Eriksson KD.Mitochondrial dysfunction in ischemia-reperfusion [J].Acta Anaesthesiologica Scandinavia,1995,29:(suppl 107):171.
[5]Geexaerts MD,Ronveavx-Dupal MF,Lemasters JJ,et al.Cytosilic free Ca2+and proteolysis in lethal oxidative injury in endothelial cell[J].Am J Physiol,1991,261(5):C889.
, http://www.100md.com
[6]Szabo I, Zoratti M.The giant channel of the inner mitochondrial membrane is inhibited by cyclosporin A [J].J Biol,Chem,1991,266:3376.
[7]Bernard P,Vassanell S,Veronese P,et al.Modulation of the mitochondrial permeability transition pore[J].J Biol Chem,1992,267:2934.
[8]Jacobs WR,Sgambati M,Gomez G,et al.Role of cytosolic Ca 2+ in renal tubule damage induced by anoxia [J].Am J Physiol,1991,260:C545.
, 百拇医药
[9]Suzuki S,Toledo-pereyra LH,Rodriguez FL,et al. Neutrophil infilration as an important factor in liver ischemia and reperfusion injury[J].Transplantation,1993,55(6):1265.
[10]Gonzalez-Flecha B, Cutrin JC,Boveris A.Time course and mechanism of oxidative stress and tissue damage in rat liver subjected to in vivo ischemia-reperfusion[J]. J Clin Invest 1993,91:456.
[11]Jaeschke H,Farbood A,Smith W.Neutrophils contribute to ischemia/reperfusion injury in rat liver in vivo [J].FASEB J ,1990,4:3355.
, http://www.100md.com
[12]Brass CA,Roberts TG.Hepatic free radical production after cold storage;kupffer cell-dependent and independent mechanisms in rats [J].Gastroenterology,1995,108:1167.
[13]Niwano M,Arii S,Monden K,et al. Aneliovation of sinusoided endothelial cell damage by kupffer cell blockade during cell preservation of rat liver [J].J Surg Res,1997,72:36.
[14]Marubayashi S,Oshire Y,Maeda T,et al.Protective effect of monoclonal antibodies to adhesion molecules on rat liver ischemia-reperfusion injury [J].Surgery,1997,122:45.
, 百拇医药
[15]Jennische E. Possible influence of glutathine on postischemic liver injury [J].Acta Pathol Microbiol Scand,[C]1984,92:55.
[16]Shibuyo H,Ohkohchi N,Seya K,et al.Kupffer cell generate superoxide anions and modulate reperfusion injury in rat liver after cold preservation [J].Hepatology,1997,25:356.
[17]Menger MD.Microcirculatory disturbance secondary to ischemia-reperfusion [J].Transplantation,1995,27(5):2863.
[18]卢绮萍,史陈让,汪 红,等.大鼠肝缺血再灌流期间脂质过氧化自由基动态变化及病理改变同步观察.中华实验外科杂志,1992,9:11.
[19]Kobayashi H,Nonami T,Kurokawa T,et al.Mechanism and prevention of ischemia-reperfusion liver injury in rats [J] J Surg Res,1991,51:240.
收稿日期:1999-01-20, 百拇医药
单位:何效东:解放军第一医院肝胆外科中心,兰州730030 董家鸿 蔡景修:第三军医大学西南医院肝胆外科中心,重庆 400038
关键词:肝脏疾病;线粒体;缺血-再灌注损伤
线粒体在肝脏缺血再灌注损伤中的作用何效东 综述 董家鸿 蔡景修 审校
摘要:肝脏外科、休克等病理过程中肝脏缺血再灌注损伤不可避免,该过程以缺血、缺氧、能量供应中断为始动因素,经细胞钙超载、氧自由基形成及白细胞浸润三个重要环节,通过细胞因子炎性介质的释放,不但对缺血肝脏造成损伤,而且对全身其它脏器造成一定的伤害;在这一病理过程中,线粒体对细胞内钙的调节、氧自由基形成等具有非常重要的作用。如何防治肝脏缺血再灌注时线粒体损伤将是今后实验研究的重点。
中图分类号:R 575 文献标识码:A 文章编号:1007-8622(1999)04-0295-03
, http://www.100md.com
肝脏是体内最大的代谢器官,线粒体是细胞代谢的中心场所,线粒体的正常呼吸功能和ATP生成对组织器官功能及细胞结构的完整性至关重要。但线粒体对缺血、缺氧非常敏感,缺血、缺氧的肝组织在血流恢复或复氧后其损伤程度不但没有改善,反而进一步加重,这与细胞钙超载、氧自由基等因素有直接的关系[1]。线粒体是联系钙超载、氧自由基形成和细胞死亡的中心环节。近年对线粒体在肝脏缺血再灌注损伤中的作用研究较多,进展较快,本文就这方面的内容做一综述。
1 线粒体膜通透性改变与缺血再灌注钙超载的联系
肝脏缺血再灌注可致细胞钙超载,是引起肝细胞损伤的原因之一,而线粒体具有强大的聚积Ca2+能力,对钙离子稳态起到一定的调节作用,但线粒体摄Ca2+能力有限,若损伤因素不能清除,经各种途径最终可致细胞内钙超载[2,3]。
近年对细胞坏死的研究表明,线粒体膜通透性改变(Mitochondrial membrane permeability transition,MMPT)在细胞死亡中起着关键的作用[4]。在各种损伤因素的作用下,MMPT一旦发生,线粒体膜通透性迅速升高,细胞死亡随之发生。抑制MMPT发生可延缓细胞死亡[5]。目前认为MMPT的发生机制包括线粒体内膜的非特异性损伤和一种巨通道(Megapore)的开放[4,6]。而线粒体内膜非特异性损伤可由钙超载触发的氧自由基损伤等造成。关于导致MMPT的特殊机制的研究表明:线粒体基层中Ca2的大量聚积正是巨通道(Megapore)开放的原因之一[5,6]。故线粒体钙超载通过MMPT可导致细胞致死性损伤。
, http://www.100md.com
对巨通道进一步研究发现,线粒体膜上的巨通道就是直径为20
, http://www.100md.com
但另有研究认为,在细胞损伤中,线粒体摄钙增多也许是继发性改变的结果,而线粒体膜通透性改变(MMPT)才是始动因素,因而对胞浆钙超载在组织缺血再灌注损伤中的重要性提出质疑,[8],因为在大鼠肝脏缺氧35 min再灌注10 min的模型中,肝组织电镜下同一视野的两个肝细胞中,一个线粒体正常,而另一个则水肿变性,后者也许已有线粒体通透性改变;而值得注意的是此时仍未见其它细胞器有形态学方面的变化[11]。这仅是初步观察的结果,要阐明其详细机制,还有待更进一步研究。
2 线粒体在氧自由基形成中的作用
黄嘌呤氧化酶和中性白细胞是氧自由基的两个重要来源,[9],缺血和再灌注均可产生较多超氧化物,引起组织损伤。线粒体是肝脏缺血再灌注期间活性氧产生的重要器官[10]。
2.1 肝脏缺血再灌注活性氧释放特点与肝细胞损伤的关系:对肝脏缺血再灌注损伤研究表明,复氧后活性氧释放时相与肝细胞损伤密切相关。Jaeschke等[11]阻断部分肝脏血流45 min后再灌注(RP)不同时间,发现肝组织出现了双相损伤。在恢复灌注的1 h内,血浆转氨酶活性升高,此为肝脏缺血再灌注的Ⅰ相损伤(initial injury);接下去的5 h ,转氨酶的活性维持在Ⅰ相损伤水平而在RP后6~24 h,转氨酶活性再次显著升高,表明缺血再灌注肝脏还存在Ⅱ相损伤(progressive injury)。从而可以看出复氧时肝细胞损伤与活性氧的释放时相具有直接联系。实验还证明RP肝脏的Ⅰ相损伤与肝窦枯否氏细胞(KC)有关。KC可因钙超载、吞噬作用或补体系统而激活,活化的KC除主要释放活性氧外,还可释放蛋白酶及各种细胞因子,介导对肝细胞的毒性作用,导致严重的肝脏再灌注损伤;干扰KC功能的药物具有明显的治疗作用[12,13],而Ⅱ相损伤与白细胞在局部的聚集到一定量并激活后释放毒性介质有关,尽管白细胞在RP初期在肝窦与内皮细胞粘附增强并开始聚集,但并不参与肝组织Ⅰ相损伤[13]。同时还发现KC的Ⅰ相损伤可激活中性白细胞(PMN),使其释放活性氧及蛋白酶等毒性介质攻击肝细胞,坏死肝细胞反过来又可促进补体激化和PMN活化,如此恶性循环,最终导致严重肝细胞损伤。单克隆抗体可减少PMN粘附并使再灌注损伤减轻。[14]。
, http://www.100md.com
2.2 活性氧与缺血再灌注后损伤肝细胞在肝腺泡中的分布:以前研究发现,肝叶切除后肝细胞的再生主要发生在肝泡Ⅰ带,而结扎动物肝血管使肝脏缺氧或营养不良性早期肝硬化所发生的肝损害主要发生在Ⅲ带,这可解释为Ⅰ带肝细胞靠近中轴血管,优先获得富于营养的物质和含氧充足的血液,因此优先再生,而Ⅲ带组织PO2最低,故最容易出现缺氧性肝损害和肝细胞死亡。
那么,肝脏缺血后再灌注损伤的特点是什么呢?Flreeman等的研究认为:还原型谷胱甘肽(GSH)在肝脏是重要的自由基清除剂。研究发现,大鼠肝脏缺血90 min后再灌注,肝组织GSH低者(如禁食)肝脏损害程度较GSH高者更为严重,并且损害肝细胞主要分布在小叶间门静脉周围区域(即Ⅰ带),这种表现在GSH完全消耗者更加明显,因而支持氧自由基引起肝损伤这一论断[15]。同时实验也证明,用氯化钴处理禁食的动物,以增加GSH在肝组织的含量,结果缺血后肝细胞坏死程度明显减轻[15];这种对缺血再灌注损伤的区带性差异,可能与以下因素有关:①与Kupffer细胞在肝窦的不均质性分布有关。大鼠肝Kupffer细胞约占肝实质的2.1%,但以肝小叶周边带分布较多。kupffer细胞的活化在机体防卫机能中有积极的作用,但活化后的Kupffer细胞以其分泌的各种细胞因子(cytotines)作用于肝细胞、邻近组织及全身。缺血、再灌注可直接或间接激活Kupffer细胞(或中性白细胞),可释放多种细胞因子和介质[16],其中包括O2代谢中间产物H2O、O?2、OH?自由基、O2及TNF等。②与缺血后“无灌注”(no-reflow)或“无血再灌注”(reflow-paradox)引起微循环紊乱有关 [17]。肝窦是特化的毛细血管,其直径与其它毛细血管相似,但每个肝细胞紧邻两上肝窦,因而对毛细血管阻塞的耐受较强,在生理情况下也常发生单个血窦的阻塞。但肝脏长时间缺血后由于内皮水肿、血窦内血液浓缩及微静脉阻塞等,使再灌注后缺血缺氧仍在继续(no-reflow),导致再灌注不匀,而再灌注后“无血再灌注”(reflow-paradox)是由于复流或复氧激活了白细胞,经细胞表面粘附分子ICAM-1、CD11/CD18、L、P-选择素与内皮细胞牢固粘附而引起肝窦阻塞。通过以上两种方式,使复流后活性氧释放增多并限制在局部,同时,由于氧自由基平均寿命很短,仅10?3秒[18],在微循环紊乱的情况下不能立即在肝组织播散或大量释放入血循中,造成局部组织严重损伤(如门管区),Rymsa研究发现,RP初期在门脉周围区域分离出具有很强吞噬活性的大KC,其自发产生的O?2增加3倍以上。Suzuki等在肝脏缺血90 min再灌60 min的组织学观察中发现,病变主要分布在肝泡Ⅰ带至Ⅱ带,可见肝细胞严重变性浊肿、肝窦瘀血[9]。关于其损伤分布部位的确切机制还有待进一步研究。
, 百拇医药
但Gonzalez-Flecha[15]研究发现,肝腺泡Ⅱ、Ⅲ带对缺血再灌注损伤比较敏感,目前研究认为肝泡无论在细胞器结构或酶的组份都有所不同,这是它对缺血再灌注损伤敏感性不同的基础。目前对肝脏缺血再灌注损伤敏感性的组织学定位仍有争议,还有待进一步探讨。
3 缺血再灌注线粒体呼吸活性的变化
前面已经提到线粒体在细胞钙超载及氧自由基形成中的调节作用。但当这种调节作用超过一定限度,必然引起线粒体自身损害,这种损害出现前首先出现一系列代偿性改变,故了解其变化规律对缺血再灌注损伤的防治具有积极的作用。
评价线粒体呼吸活性常用呼吸控制率(RCR)和磷氧比(P/O)来表示。它们是反映线粒体完整性、氧化磷酸化偶联程度及氧化磷酸化效率的灵敏指标。肝脏缺血再灌注时线粒体通透性的改变、线粒体内酶和辅酶的丢失,以及由此造成的氧化磷酸化障碍,均可影响线粒体呼吸活性。Isozaki在研究间断及持续肝脏缺血对线粒体功能的影响后发现,肝脏在持续缺血30 min后对RCR及P/O影响不大;若将缺血总时间设定在60 min,经观察发现间断缺血者线粒体功能明显好于持续缺血者,表明随持续缺血时间的延长,线粒体的完整性受到一定的影响。
, 百拇医药
Korokawa等研究肝大部分切除后残肝细胞线粒体的功能时见到,手术后第一天CRC及R3较手术前明显增高,2~5 d后逐渐降低至术前水平,说明残肝代谢活跃线粒体功能代偿性增强。但Kobayashi[19]对缺血再灌注时肝脏线粒体呼吸活性观察发现,缺血120 min线粒体RCR、R3较缺血前明显降低,再灌注后虽有所提高,但仍明显低于术前水平。Gonzalez-Flecha[10]的研究与以上相似,观察了缺血60 min、120 min及180 min及再灌注30 min时线粒体呼吸功能的改变,见缺血后RCR、R3均不同程度降低,并随缺血时间延长,这种变化越明显,R4则无明显变化;再灌注30 min时,以上指标不但没有升高反而较缺血后明显降低,但缺血180 min再灌注30 min组则变化不明显或无变化,也许此时线粒体代偿已到极限,对各种刺激敏感性降低所致。
作者简介:何效东(1962-),男,硕士,主治医师
, 百拇医药
参考文献:
[1]liu W,Schob O, Pugmire JE,et al.Glycohydrolases as markers of hepatic ischemia-reperfusion injury and recovery [J].Hepatology,1996,24:157.
[2]Hatanaka N,Kamijke W,Shimizu S,et al.Ca2release from mitochondrial induces cytosiolic enzyme leakage in anoxis liver [J].J Surg Res,1995,58:485.
[3]Masini A,Gallesi D,Giovannini F,et al. Membrane potential of hepatic mitochondrial after cute cocaine administration in rat-the role of mitochondrial reduced glutathione [J].Hepatology,1997,25:305.
, http://www.100md.com
[4]Saris N-E L,Eriksson KD.Mitochondrial dysfunction in ischemia-reperfusion [J].Acta Anaesthesiologica Scandinavia,1995,29:(suppl 107):171.
[5]Geexaerts MD,Ronveavx-Dupal MF,Lemasters JJ,et al.Cytosilic free Ca2+and proteolysis in lethal oxidative injury in endothelial cell[J].Am J Physiol,1991,261(5):C889.
[6]Szabo I, Zoratti M.The giant channel of the inner mitochondrial membrane is inhibited by cyclosporin A [J].J Biol,Chem,1991,266:3376.
, 百拇医药
[7]Bernard P,Vassanell S,Veronese P,et al.Modulation of the mitochondrial permeability transition pore[J].J Biol Chem,1992,267:2934.
[8]Jacobs WR,Sgambati M,Gomez G,et al.Role of cytosolic Ca 2+ in renal tubule damage induced by anoxia [J].Am J Physiol,1991,260:C545.
[9]Suzuki S,Toledo-pereyra LH,Rodriguez FL,et al. Neutrophil infilration as an important factor in liver ischemia and reperfusion injury[J].Transplantation,1993,55(6):1265.
, 百拇医药
[10]Gonzalez-Flecha B, Cutrin JC,Boveris A.Time course and mechanism of oxidative stress and tissue damage in rat liver subjected to in vivo ischemia-reperfusion[J]. J Clin Invest 1993,91:456.
[11]Jaeschke H,Farbood A,Smith W.Neutrophils contribute to ischemia/reperfusion injury in rat liver in vivo [J].FASEB J ,1990,4:3355.
[12]Brass CA,Roberts TG.Hepatic free radical production after cold storage;kupffer cell-dependent and independent mechanisms in rats [J].Gastroenterology,1995,108:1167.
, http://www.100md.com
[13]Niwano M,Arii S,Monden K,et al. Aneliovation of sinusoided endothelial cell damage by kupffer cell blockade during cell preservation of rat liver [J].J Surg Res,1997,72:36.
[14]Marubayashi S,Oshire Y,Maeda T,et al.Protective effect of monoclonal antibodies to adhesion molecules on rat liver ischemia-reperfusion injury [J].Surgery,1997,122:45.
[15]Jennische E. Possible influence of glutathine on postischemic liver injury [J].Acta Pathol Microbiol Scand,[C]1984,92:55.
, 百拇医药
[16]Shibuyo H,Ohkohchi N,Seya K,et al.Kupffer cell generate superoxide anions and modulate reperfusion injury in rat liver after cold preservation [J].Hepatology,1997,25:356.
[17]Menger MD.Microcirculatory disturbance secondary to ischemia-reperfusion [J].Transplantation,1995,27(5):2863.
[18]卢绮萍,史陈让,汪 红,等.大鼠肝缺血再灌流期间脂质过氧化自由基动态变化及病理改变同步观察.中华实验外科杂志,1992,9:11.
[19]Kobayashi H,Nonami T,Kurokawa T,et al.Mechanism and prevention of ischemia-reperfusion liver injury in rats [J] J Surg Res,1991,51:240.
, http://www.100md.com
收稿日期:1999-01-20
线粒体在肝脏缺血再灌注损伤中的作用
何效东 综述 董家鸿 蔡景修 审校
摘要:肝脏外科、休克等病理过程中肝脏缺血再灌注损伤不可避免,该过程以缺血、缺氧、能量供应中断为始动因素,经细胞钙超载、氧自由基形成及白细胞浸润三个重要环节,通过细胞因子炎性介质的释放,不但对缺血肝脏造成损伤,而且对全身其它脏器造成一定的伤害;在这一病理过程中,线粒体对细胞内钙的调节、氧自由基形成等具有非常重要的作用。如何防治肝脏缺血再灌注时线粒体损伤将是今后实验研究的重点。
关键词:肝脏疾病;线粒体; 缺血-再灌注损伤
中图分类号:R 575 文献标识码:A 文章编号:1007-8622(1999)04-0295-03
, http://www.100md.com
肝脏是体内最大的代谢器官,线粒体是细胞代谢的中心场所,线粒体的正常呼吸功能和ATP生成对组织器官功能及细胞结构的完整性至关重要。但线粒体对缺血、缺氧非常敏感,缺血、缺氧的肝组织在血流恢复或复氧后其损伤程度不但没有改善,反而进一步加重,这与细胞钙超载、氧自由基等因素有直接的关系[1]。线粒体是联系钙超载、氧自由基形成和细胞死亡的中心环节。近年对线粒体在肝脏缺血再灌注损伤中的作用研究较多,进展较快,本文就这方面的内容做一综述。
1 线粒体膜通透性改变与缺血再灌注钙超载的联系
肝脏缺血再灌注可致细胞钙超载,是引起肝细胞损伤的原因之一,而线粒体具有强大的聚积Ca2+能力,对钙离子稳态起到一定的调节作用,但线粒体摄Ca2+能力有限,若损伤因素不能清除,经各种途径最终可致细胞内钙超载[2,3]。
近年对细胞坏死的研究表明,线粒体膜通透性改变(Mitochondrial membrane permeability transition,MMPT)在细胞死亡中起着关键的作用[4]。在各种损伤因素的作用下,MMPT一旦发生,线粒体膜通透性迅速升高,细胞死亡随之发生。抑制MMPT发生可延缓细胞死亡[5]。目前认为MMPT的发生机制包括线粒体内膜的非特异性损伤和一种巨通道(Megapore)的开放[4,6]。而线粒体内膜非特异性损伤可由钙超载触发的氧自由基损伤等造成。关于导致MMPT的特殊机制的研究表明:线粒体基层中Ca2的大量聚积正是巨通道(Megapore)开放的原因之一[5,6]。故线粒体钙超载通过MMPT可导致细胞致死性损伤。
, 百拇医药
对巨通道进一步研究发现,线粒体膜上的巨通道就是直径为20
, 百拇医药
但另有研究认为,在细胞损伤中,线粒体摄钙增多也许是继发性改变的结果,而线粒体膜通透性改变(MMPT)才是始动因素,因而对胞浆钙超载在组织缺血再灌注损伤中的重要性提出质疑,[8],因为在大鼠肝脏缺氧35 min再灌注10 min的模型中,肝组织电镜下同一视野的两个肝细胞中,一个线粒体正常,而另一个则水肿变性,后者也许已有线粒体通透性改变;而值得注意的是此时仍未见其它细胞器有形态学方面的变化[11]。这仅是初步观察的结果,要阐明其详细机制,还有待更进一步研究。
2 线粒体在氧自由基形成中的作用
黄嘌呤氧化酶和中性白细胞是氧自由基的两个重要来源,[9],缺血和再灌注均可产生较多超氧化物,引起组织损伤。线粒体是肝脏缺血再灌注期间活性氧产生的重要器官[10]。
2.1 肝脏缺血再灌注活性氧释放特点与肝细胞损伤的关系:对肝脏缺血再灌注损伤研究表明,复氧后活性氧释放时相与肝细胞损伤密切相关。Jaeschke等[11]阻断部分肝脏血流45 min后再灌注(RP)不同时间,发现肝组织出现了双相损伤。在恢复灌注的1 h内,血浆转氨酶活性升高,此为肝脏缺血再灌注的Ⅰ相损伤(initial injury);接下去的5 h ,转氨酶的活性维持在Ⅰ相损伤水平而在RP后6~24 h,转氨酶活性再次显著升高,表明缺血再灌注肝脏还存在Ⅱ相损伤(progressive injury)。从而可以看出复氧时肝细胞损伤与活性氧的释放时相具有直接联系。实验还证明RP肝脏的Ⅰ相损伤与肝窦枯否氏细胞(KC)有关。KC可因钙超载、吞噬作用或补体系统而激活,活化的KC除主要释放活性氧外,还可释放蛋白酶及各种细胞因子,介导对肝细胞的毒性作用,导致严重的肝脏再灌注损伤;干扰KC功能的药物具有明显的治疗作用[12,13],而Ⅱ相损伤与白细胞在局部的聚集到一定量并激活后释放毒性介质有关,尽管白细胞在RP初期在肝窦与内皮细胞粘附增强并开始聚集,但并不参与肝组织Ⅰ相损伤[13]。同时还发现KC的Ⅰ相损伤可激活中性白细胞(PMN),使其释放活性氧及蛋白酶等毒性介质攻击肝细胞,坏死肝细胞反过来又可促进补体激化和PMN活化,如此恶性循环,最终导致严重肝细胞损伤。单克隆抗体可减少PMN粘附并使再灌注损伤减轻。[14]。
, http://www.100md.com
2.2 活性氧与缺血再灌注后损伤肝细胞在肝腺泡中的分布:以前研究发现,肝叶切除后肝细胞的再生主要发生在肝泡Ⅰ带,而结扎动物肝血管使肝脏缺氧或营养不良性早期肝硬化所发生的肝损害主要发生在Ⅲ带,这可解释为Ⅰ带肝细胞靠近中轴血管,优先获得富于营养的物质和含氧充足的血液,因此优先再生,而Ⅲ带组织PO2最低,故最容易出现缺氧性肝损害和肝细胞死亡。
那么,肝脏缺血后再灌注损伤的特点是什么呢?Flreeman等的研究认为:还原型谷胱甘肽(GSH)在肝脏是重要的自由基清除剂。研究发现,大鼠肝脏缺血90 min后再灌注,肝组织GSH低者(如禁食)肝脏损害程度较GSH高者更为严重,并且损害肝细胞主要分布在小叶间门静脉周围区域(即Ⅰ带),这种表现在GSH完全消耗者更加明显,因而支持氧自由基引起肝损伤这一论断[15]。同时实验也证明,用氯化钴处理禁食的动物,以增加GSH在肝组织的含量,结果缺血后肝细胞坏死程度明显减轻[15];这种对缺血再灌注损伤的区带性差异,可能与以下因素有关:①与Kupffer细胞在肝窦的不均质性分布有关。大鼠肝Kupffer细胞约占肝实质的2.1%,但以肝小叶周边带分布较多。kupffer细胞的活化在机体防卫机能中有积极的作用,但活化后的Kupffer细胞以其分泌的各种细胞因子(cytotines)作用于肝细胞、邻近组织及全身。缺血、再灌注可直接或间接激活Kupffer细胞(或中性白细胞),可释放多种细胞因子和介质[16],其中包括O2代谢中间产物H2O、O?2、OH?自由基、O2及TNF等。②与缺血后“无灌注”(no-reflow)或“无血再灌注”(reflow-paradox)引起微循环紊乱有关 [17]。肝窦是特化的毛细血管,其直径与其它毛细血管相似,但每个肝细胞紧邻两上肝窦,因而对毛细血管阻塞的耐受较强,在生理情况下也常发生单个血窦的阻塞。但肝脏长时间缺血后由于内皮水肿、血窦内血液浓缩及微静脉阻塞等,使再灌注后缺血缺氧仍在继续(no-reflow),导致再灌注不匀,而再灌注后“无血再灌注”(reflow-paradox)是由于复流或复氧激活了白细胞,经细胞表面粘附分子ICAM-1、CD11/CD18、L、P-选择素与内皮细胞牢固粘附而引起肝窦阻塞。通过以上两种方式,使复流后活性氧释放增多并限制在局部,同时,由于氧自由基平均寿命很短,仅10?3秒[18],在微循环紊乱的情况下不能立即在肝组织播散或大量释放入血循中,造成局部组织严重损伤(如门管区),Rymsa研究发现,RP初期在门脉周围区域分离出具有很强吞噬活性的大KC,其自发产生的O?2增加3倍以上。Suzuki等在肝脏缺血90 min再灌60 min的组织学观察中发现,病变主要分布在肝泡Ⅰ带至Ⅱ带,可见肝细胞严重变性浊肿、肝窦瘀血[9]。关于其损伤分布部位的确切机制还有待进一步研究。
, 百拇医药
但Gonzalez-Flecha[15]研究发现,肝腺泡Ⅱ、Ⅲ带对缺血再灌注损伤比较敏感,目前研究认为肝泡无论在细胞器结构或酶的组份都有所不同,这是它对缺血再灌注损伤敏感性不同的基础。目前对肝脏缺血再灌注损伤敏感性的组织学定位仍有争议,还有待进一步探讨。
3 缺血再灌注线粒体呼吸活性的变化
前面已经提到线粒体在细胞钙超载及氧自由基形成中的调节作用。但当这种调节作用超过一定限度,必然引起线粒体自身损害,这种损害出现前首先出现一系列代偿性改变,故了解其变化规律对缺血再灌注损伤的防治具有积极的作用。
评价线粒体呼吸活性常用呼吸控制率(RCR)和磷氧比(P/O)来表示。它们是反映线粒体完整性、氧化磷酸化偶联程度及氧化磷酸化效率的灵敏指标。肝脏缺血再灌注时线粒体通透性的改变、线粒体内酶和辅酶的丢失,以及由此造成的氧化磷酸化障碍,均可影响线粒体呼吸活性。Isozaki在研究间断及持续肝脏缺血对线粒体功能的影响后发现,肝脏在持续缺血30 min后对RCR及P/O影响不大;若将缺血总时间设定在60 min,经观察发现间断缺血者线粒体功能明显好于持续缺血者,表明随持续缺血时间的延长,线粒体的完整性受到一定的影响。
, 百拇医药
Korokawa等研究肝大部分切除后残肝细胞线粒体的功能时见到,手术后第一天CRC及R3较手术前明显增高,2~5 d后逐渐降低至术前水平,说明残肝代谢活跃线粒体功能代偿性增强。但Kobayashi[19]对缺血再灌注时肝脏线粒体呼吸活性观察发现,缺血120 min线粒体RCR、R3较缺血前明显降低,再灌注后虽有所提高,但仍明显低于术前水平。Gonzalez-Flecha[10]的研究与以上相似,观察了缺血60 min、120 min及180 min及再灌注30 min时线粒体呼吸功能的改变,见缺血后RCR、R3均不同程度降低,并随缺血时间延长,这种变化越明显,R4则无明显变化;再灌注30 min时,以上指标不但没有升高反而较缺血后明显降低,但缺血180 min再灌注30 min组则变化不明显或无变化,也许此时线粒体代偿已到极限,对各种刺激敏感性降低所致。
作者简介:何效东(1962-),男,硕士,主治医师
, http://www.100md.com
作者单位:何效东:解放军第一医院肝胆外科中心,兰州730030
董家鸿 蔡景修:第三军医大学西南医院肝胆外科中心,重庆 400038
参考文献:
[1]liu W,Schob O, Pugmire JE,et al.Glycohydrolases as markers of hepatic ischemia-reperfusion injury and recovery [J].Hepatology,1996,24:157.
[2]Hatanaka N,Kamijke W,Shimizu S,et al.Ca2release from mitochondrial induces cytosiolic enzyme leakage in anoxis liver [J].J Surg Res,1995,58:485.
, 百拇医药
[3]Masini A,Gallesi D,Giovannini F,et al. Membrane potential of hepatic mitochondrial after cute cocaine administration in rat-the role of mitochondrial reduced glutathione [J].Hepatology,1997,25:305.
[4]Saris N-E L,Eriksson KD.Mitochondrial dysfunction in ischemia-reperfusion [J].Acta Anaesthesiologica Scandinavia,1995,29:(suppl 107):171.
[5]Geexaerts MD,Ronveavx-Dupal MF,Lemasters JJ,et al.Cytosilic free Ca2+and proteolysis in lethal oxidative injury in endothelial cell[J].Am J Physiol,1991,261(5):C889.
, http://www.100md.com
[6]Szabo I, Zoratti M.The giant channel of the inner mitochondrial membrane is inhibited by cyclosporin A [J].J Biol,Chem,1991,266:3376.
[7]Bernard P,Vassanell S,Veronese P,et al.Modulation of the mitochondrial permeability transition pore[J].J Biol Chem,1992,267:2934.
[8]Jacobs WR,Sgambati M,Gomez G,et al.Role of cytosolic Ca 2+ in renal tubule damage induced by anoxia [J].Am J Physiol,1991,260:C545.
, 百拇医药
[9]Suzuki S,Toledo-pereyra LH,Rodriguez FL,et al. Neutrophil infilration as an important factor in liver ischemia and reperfusion injury[J].Transplantation,1993,55(6):1265.
[10]Gonzalez-Flecha B, Cutrin JC,Boveris A.Time course and mechanism of oxidative stress and tissue damage in rat liver subjected to in vivo ischemia-reperfusion[J]. J Clin Invest 1993,91:456.
[11]Jaeschke H,Farbood A,Smith W.Neutrophils contribute to ischemia/reperfusion injury in rat liver in vivo [J].FASEB J ,1990,4:3355.
, http://www.100md.com
[12]Brass CA,Roberts TG.Hepatic free radical production after cold storage;kupffer cell-dependent and independent mechanisms in rats [J].Gastroenterology,1995,108:1167.
[13]Niwano M,Arii S,Monden K,et al. Aneliovation of sinusoided endothelial cell damage by kupffer cell blockade during cell preservation of rat liver [J].J Surg Res,1997,72:36.
[14]Marubayashi S,Oshire Y,Maeda T,et al.Protective effect of monoclonal antibodies to adhesion molecules on rat liver ischemia-reperfusion injury [J].Surgery,1997,122:45.
, 百拇医药
[15]Jennische E. Possible influence of glutathine on postischemic liver injury [J].Acta Pathol Microbiol Scand,[C]1984,92:55.
[16]Shibuyo H,Ohkohchi N,Seya K,et al.Kupffer cell generate superoxide anions and modulate reperfusion injury in rat liver after cold preservation [J].Hepatology,1997,25:356.
[17]Menger MD.Microcirculatory disturbance secondary to ischemia-reperfusion [J].Transplantation,1995,27(5):2863.
[18]卢绮萍,史陈让,汪 红,等.大鼠肝缺血再灌流期间脂质过氧化自由基动态变化及病理改变同步观察.中华实验外科杂志,1992,9:11.
[19]Kobayashi H,Nonami T,Kurokawa T,et al.Mechanism and prevention of ischemia-reperfusion liver injury in rats [J] J Surg Res,1991,51:240.
收稿日期:1999-01-20, 百拇医药