人表皮细胞生长因子基因真核表达质粒pcDNA3-hEGF的构建
作者:胡大海 陈璧 汤朝武 徐明达 惠宏襄 阎小君
单位:胡大海(第四军医大学:西京医院整形外科中心)陈璧(第四军医大学:西京医院整形外科中心)汤朝武(第四军医大学:西京医院整形外科中心)惠宏襄(基础部生物化学教研室)阎小君(全军基因技术诊断研究所,陕西 西安, 710032)
关键词:表皮细胞生长因子;基因;真核表达质粒
西北国防医学杂志000106 摘 要:目的:构建人表皮细胞生长因子(hEGF)基因真核表达质粒,为深入研究hEGF在组织修复中的分子调节机制及临床应用提供物质基础。方法:含hEGF cDNA的pUC18-hEGF质粒于大肠杆菌JM109内扩增;提取及纯化pUC18-hEGF质粒;经DNA序列分析其所含hEGF cDNA;限制性酶切hEGF cDNA片段,连接酶连接到真核表达质粒pcDNA3-neo内, 克隆出真核表达质粒pcDNA3-hEGF;再经限制性酶切鉴定hEGF表达质粒。结果:提取及纯化的pUC18-hEGF质粒含有大小正确的hEGF cDNA碱基片段,其碱基序列为编码目的基因的正确序列;凝胶电泳结果证明已将此片段克隆到pcDNA3-hEGF内。结论:成功地构建了hEGF基因的真核表达质粒pcDNA3-hEGF。
, 百拇医药
分类号:Q 782 文献标识码:A
文章编号:1007-8622(2000)01-0018-05
Construction of eukaryotic expression plasmid for human epidermal growth factor gene
HU Da-hai, CHEN Bi, TANG Chao-wu,et al.
( Xijing Hospital,The 4th Military Medical University,710032)
Abstract:Objective:To construct eukaryotic expression plasmid of human basic epidermal growth factor (hEGF) gene for further study on hEGF function in molecular regulatory mechanism during tissue repair. Methods:The plasmids pUC18-hEGF (supplied from R. D. Systems, BBG7), containing full cDNA length of hEGF inserted between HindⅢ and BamHI restriction sites, were propagated in Escherichia coli JM109; then extracted and purified with the WizardTM Plus Milipre DNA purification kit (Promega) as recommended by the manufacturer. The coding sequence of hEGF in the pUC18-hEGF was confirmed by DNA sequence analysis. After plasmids pUC18-hEGF and plasmids pcDNA3-neo were prepared by double digestion with HindⅢ/BamHI, the hEGF cDNA fragment was ligated with T4 ligase between the HindⅢ and BamHI restriction sites in the linear plasmid pcDNA3-neo to form pcDNA3-hEGF. The pcDNA3-hEGF, digested with HindⅢ/BamHI, was found to contain the hEGF cDNA sequence by agarose gel electrophoresis analysis. Results:The extracted and purified pUC18-hEGF contained the correct nucleotide sequence for the full length of hEGF cDNA fragment. The hEGF cDNA fragment had been inserted into the eukaryotic expression plasmid pcDNA3-neo, which formed the pcDNA3-hEGF. Conclusion:The pcDNA3-hEGF, a eukaryotic expression plasmid, was constructed for hEGF gene.
, 百拇医药
Key words:Epidermal growth factor;Gene;Eukaryotic expression plasmid ▲
作为人类最早发现的多肽生长因子之一的EGF,由于具有促进修复细胞DNA合成、分化、调节细胞外基质蛋白合成、参与其它生长因子的生物学调节等重要作用;因此,在组织修复领域受到广泛地研究[1~4] 。本研究旨在采用pcDNA3-neo构建hEGF的cDNA真核表达质粒,为进一步深入探讨hEGF在组织修复过程中所发挥的分子调控机制及其相应的生物学效应等基础理论问题,以及开展包括基因治疗在内的hEGF的合理有效的临床应用提供重要的物质基础。
1 材料与方法
1.1 材料:限制性内切酶:HindIII,BamHI(Promega);核酸修饰酶:T4 DNA连接酶, RNase A(Sigma); PCR Markers(华美生物工程公司);WizardTM Plus Milipre DNA纯化kit(Promega)。细菌菌株JM109,全军基因诊断研究所提供,基因型:recAl supE44 endA1 hsdR17 gyrA96 relA1 thiA(Lac-proAB)F1[traD36 proAB+ LacI8LacIAM15]。质粒pUC18-hEGF:R & D Systems,BBG7;含一位于HindⅢ和BamHI酶切位点间的180 bp的hEGF cDNA片段,具有hEGF硷基序列(图1)。pcDNA3-neo:基础部校生化教研室提供,含有启动子T7位于多克隆位点前,复制起始点SV40ori,抗氨苄青霉素及G418基因 (图2)。
, 百拇医药
图1 pUC18-hEGF内应具有的hEGF cDNA序列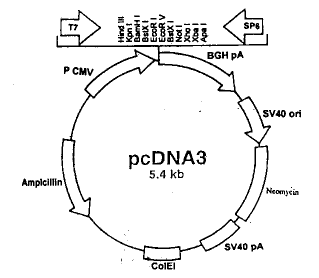
图2 质粒pcDNA3-neo图谱
1.2 方法
1.2.1 质粒的扩增及纯化: 氯化钙法制备感受态菌MJ109;pUC18-hEGF,pcDNA3-neo质粒转化宿主菌、筛选阳性菌落、小量制备质粒DNA,酶切及琼脂糖凝胶电泳分析选出含相应质粒的阳性细菌克隆。对含相应质粒的阳性细菌克隆扩大培养后,按WizardTM Plus Milipre DNA纯化kit 操作说明进行质粒DNA制备及纯化,于DU640型核酸/蛋白检测仪(Beckman)上测定A260 及A280值,判断其纯度,并测定含量。
, http://www.100md.com 1.2.2 限制性内切酶进行酶切及琼脂糖凝胶电泳分析: 应用适当的内切酶加入对应的质粒,37℃温育酶切。将酶切产物于琼脂糖凝胶上50 V电泳30 min,EB染色,紫外透射下观测分析。
1.2.3 目的基因(hEGF cDNA)的序列测定: ①提取及纯化后的质粒pUC18-hEGF,调节核酸浓度0.2 g.L-1;②测序反应:4个0.5 mL的Eppendorf管中分别加入4种荧光标记引物ddNTP混合物(MixA4μL, MixC4μL, Mix G8μL, MixT8μL),模板DNA 1μL,1μL,2μL,2μL,加入20μL石蜡油封。PCR反应:96℃,15s;55℃,1 s;70℃,60s;15个循环后改为95℃,15s;70℃,60s;15个循环。反应产物用950 ml.L-1乙醇100 μL于室温下沉淀15 min,700ml.L-1乙醇洗涤,沉淀用6 μL去离子甲酰胺-EDTAc 5 μL,50mmol.L-1EDTA 1μL(pH8.0)重溶。90℃变性2 min,快速作经顶电泳的聚丙烯酰胺凝胶电泳,用373A型DNA序列分析仪(PE)测定DNA序列。
, 百拇医药
1.2.4 真核表达质粒构建的连接反应: 酶切产物行琼脂糖凝胶电泳,将含有目的片段的凝胶条带切下,酚:氯仿抽提回收目的片。连接反应:pcDNA3-neo fragment 1.0μL(0.1μg),hEGF cDNA fragment 5.0 μL(0.5 μg),T4 ligase 1.0 μL,10×buffer 1.0μL,10 mmol.L-1 ATP 1.0 μL,H2O 1.0 μL,置15℃反应16 h。pcDNA3-hEGF质粒构建过程见图3。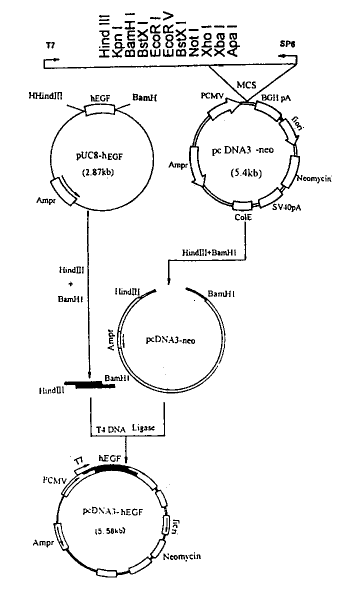
图3 真核表达载体pcDNA3-hEGF的构建过程示意图
1.2.5 构建的pcDNA3-hEGF质粒再转化宿主菌、克隆筛选、质粒提取及酶切鉴定: 所采用的方法同前。
, 百拇医药
2 结果
2.1 pUC18-hEGF酶切鉴定: HindⅢ+BamHI双酶切pUC18-hEGF并经凝胶电泳后观查分析;与预计结果相符合,酶切后获取了分子大小约180 bp的插入在pUC18内的片段,初步证明pUC18-hEGF内有正确的hEGF cDNA片段(图4)。
图4 pUC18-hEGF的酶切鉴定结果
a:pUC18-hEGF digested with HindIII plus BamHI;
b:pUC18-hEGF;
c:PCR markers
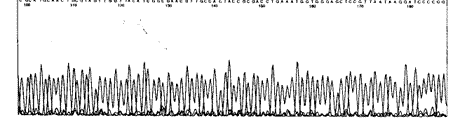
2.2 pUC18-hEGF序列测定: 经对pUC18-hEGF测序证实,pUC18-hEGF内插入片段的碱基组成与R & D Systems公司提供的序列及公开发表的hEGF cDNA序列完全一致(图1,5)。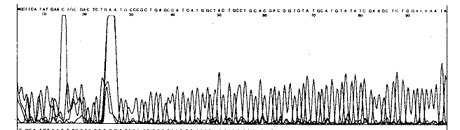
, 百拇医药
图5 pUC18-hEGF测序结果
2.3 构建的真核细胞表达质粒pcDNA3-hEGF的酶切鉴定: 将构建好的真核细胞表达质粒pcDNA3-hEGF经HindⅢ+BamHI双酶切,凝胶电泳后可见切取的片段分子量约大小180 bp,证实已将目的基因hEGF cDNA克隆到pcDNA3-neo载体内,因此真核细胞表达质粒pcDNA3-hEGF构建成功(图6)。
图6 pcDNA3-hEGF的酶切结果
a:pcDNA3-neo
b:pcDNA3-hEGF digested with HindIII plus BamHI;
, http://www.100md.com
c:PCR markers
3 讨论
多肽生长因子在创面愈合中的基础理论和临床应用研究,为现代组织修复领域最受观注的课题之一[1,2]。增殖是愈合过程中所必须的细胞生物活动。细胞的增殖需经过有丝分裂得以实现,大多数生长因子则为创面细胞的有丝分裂原。因此,人们致力于多肽生长因子的研究,以期望做为一种有力的治疗手段促进创面愈合过程。某些临床实验性应用已取得了一定的成绩,如EGF, FGF, IGF, PDGF等,对烧伤、放射性溃疡、糖尿病溃疡、褥疮等都不同程度地显示了促进愈合的作用[5]。但在临床观察中,人们发现生长因子的应用有其一定的限制性。其中关键性的问题有:①尚无理想的载体应用于创面后使局部保持有效的生长因子浓度,需反复用药,造成换药的工作量及病人痛苦均增加;②反复大量应用生物提纯或基因工程重组的产品代价昂贵;③局部坏死组织常阻断所给生长因子达到其应发挥作用的靶细胞;④需联合应用不同作用机制的生长因子,且联合效应的发挥尚需采取合理的给药时相,难以控制。由此可见,多肽生长因子的应用需要从基础研究去寻找更先进、可行、能被人类主动控制的技术方法及物质基础。
, 百拇医药
基因治疗策略为解决生长因子应用中的具体问题提供了新的思路[6]。开放的皮肤创面,为基因治疗技术提供了极其便利的实施部位;此外,研究表明创面愈合过程中的主要修复细胞(角朊细胞、成纤维细胞和血管内皮细胞)对当前研究出来的各种基因载体均具有易感性[7,8]。已有将hEGF、aFGF、TGF-β、GH等基因转移到皮肤或创面的动物实验报道,结果显示经转基因修饰的皮肤角朊细胞,可于局部表达分泌目的蛋白且经皮肤丰富的血液循环运往全身,发挥局部促进创面愈合及全身治疗效应[9,10]。由此可见,运用基因治疗的基本策略,将各种生长因子的基因借助基因工程方法在体外转移到皮肤基本构成细胞内,再将经基因修饰的细胞移植到创面上,或直接在体内将目的基因导入创面的修复细胞内,使这些含有外源性基因的细胞具备适当表达分泌相应生长因子的能力,因而可持续合理地向创面释放愈合过程所需的生长因子,加速创面残余修复细胞的再生及增殖分化,使创面愈合加快;这对解决例如:大面积烧伤需要反复大量给予生长因子促进创面残余细胞增殖、一些慢性难愈创面需较长时间持续应用生长因子等疑难问题都具有值得探索的价值及意义。现代生物细胞学,尤其是皮肤组织细胞体外培养技术的成熟,以及分子生物学的迅速发展,已为人们结合生长因子临床应用开展创面基因治疗提供了一定的基础[11,12]。
, 百拇医药
开展创面基因治疗及进行深入的相关基础理论研究,其关键性物质基础之一,为目的基因真核表达载体的构建。可用于外源性基因真核表达研究的载体分为病毒和非病毒载体两大类[6]。病毒载体具有转染率高、表达稳定等特点,但因其易整合到靶细胞染色体内,故安全性差,尚需慎用。非病毒载体,大部分为各种质粒,进入靶细胞后,以附加体的形式存在,具有安全性好、容量大等特点。实验中采用的质粒pcDNA3-neo,其结构特点为(图2):①含有SV40ori复制元件,因此有可能于宿主细胞分裂时,跟随胞浆遗传给子代细胞,这样可以在一定程度上保证目的基因稳定传送给新增殖的细胞;②其目的基因前(多克隆位点前)装用功能较强的基因启动结构T7, PCMV,而使目的基因的表达有所保证;③该载体具有neo基因,故可应用G418来筛选含此载体的靶细胞;④pcDNA3-neo所含的酶切位点以HindⅢ 起始,其后有BamHI,顺序正好与该研究中拟克隆入载体的目的基因hEGF cDNA末端的酶切位点相同,故使克隆过程中的基因操作简便。1994年,Andree 等曾利用pAbP2;1996年,范青源等则应用 pBK-CMV,均成功地构建了hEGF的真核表达质粒[13,14]。目前尚未见到采用pcDNA3-neo构建hEGF表达质粒的文献报道。
, 百拇医药
我们在已经应用pcDNA3-neo构建了hbFGF表达质粒并进行了相关的研究基础上[15~17],进一步完成了本项实验。现已将质粒pcDNA3-hEGF转染入体外培养的正常人角朊细胞内,并获得阳性转染细胞的克隆及转代培养,分析发现被转染的细胞可稳定地表达hEGF。相信,随着这项研究的不断深入,将为进一步临床应用hEGF 及开展相关的分子调控机制的探索提供更多的实验资料。
基金项目:国家自然科学基金资助项目(39600153)
作者简介:胡大海(1963—),男,博士,主治医师
参考文献:
[1]Lawrence WT, Diegelmann RF. Growth factors in wound healing[J]. Clin Dermatol, 1994,12(1):157-169.
, http://www.100md.com
[2]Hom DB. Growth factors in wound healing[J]. Otolaryngol Clin Nor Am, 1995,28(5):933-953.
[3]Brown GL, Nanney LB, Griffen J,et al. Enhancement of wound healing by topical treatment with epidermal growth factor[J]. N Engl J Med, 1989,321(2):76-79 .
[4]刘 毅,陈 璧,胡大海,等. 深II度烧伤创面愈合过程中EGF/EGFR的表达[J]. 第四军医大学学报,1999,20(5),457-459.
[5]Robson MC, Phillips LG, Thomason A,et al. Platelet-derived growth factor BB for the treatment of chronic pressure ulcers[J]. Lancet, 1992,339(1):23-25.
, 百拇医药
[6]Mulligan RC. The basic science of gene therapy[J]. Science, 1993,260(5110):926-932.
[7]Slama J, Andree C, Winkler T,et al. Gene transfer[J]. Ann Plast Surg, 1995,35(4):429-439.
[8]Sun L, Xu L, Chang H,et al. Transfection with aFGF cDNA improves wound healing[J]. J Invest Dermatol, 1997,108(3):313-318.
[9]Ghahary A, Tredget EE, Chang LJ,et al. Genetically modified dermal keratinocytes express high levels of transforming growth factor-beta1[J]. J Invest Dermatol, 1998,110(5):800-805.
, http://www.100md.com
[10]Wang X, Zinkel S, Polonsky K,et al. Tansgenic studies with a keratin promoter-driven growth hormone transgene:prospects for gene therapy[J]. Proc Natl Acad Sci USA, 1997,94(1):219-226.
[11]Madden MR, Finkelstein JL, Staino CL,et al. Grafting of cultured allogeneic epidermis on second and third degree wounds on 26 patients[J]. J Trauma, 1986,26(7):955-962.
[12]Vogel JC. Keratinocyte gene therapy[J]. Arch Dermatol, 1993,129(11):1478-1483.
, 百拇医药
[13]Andree C, Swain WF, Page CP,et al. In vivo transfer and expression of a human epidermal growth factor gene accelerate wound repair[J]. Proc Natl Acad Sci USA,1994, 91(2):12188-12192.
[14]范青源,谢 毅,戴方平,等. 人表皮细胞生长因子基因真核表达质粒的构建[J]. 第二军医大学学报,1996,17(增刊):1-4.
[15]胡大海,陈 璧,汤朝武,等. 人碱性成纤维细胞生长因子基因真核表达质粒的构建[J]. 第四军医大学学报,1999,20(5):399-403.
[16]胡大海,陈 璧,汤朝武,等. 外源性hbFGF cDNA导入人角朊细胞及其表达[J]. 第四军医大学学报,1999,20(5):404-408.
[17]胡大海,陈 璧,汤朝武,等. pcDNA3-hbFGF转染角朊细胞对真皮成纤维细胞增殖的生物学效应[J]. 第四军医大学学报,1999,20(5):395-398.
收稿日期:1999-12-27, 百拇医药
单位:胡大海(第四军医大学:西京医院整形外科中心)陈璧(第四军医大学:西京医院整形外科中心)汤朝武(第四军医大学:西京医院整形外科中心)惠宏襄(基础部生物化学教研室)阎小君(全军基因技术诊断研究所,陕西 西安, 710032)
关键词:表皮细胞生长因子;基因;真核表达质粒
西北国防医学杂志000106 摘 要:目的:构建人表皮细胞生长因子(hEGF)基因真核表达质粒,为深入研究hEGF在组织修复中的分子调节机制及临床应用提供物质基础。方法:含hEGF cDNA的pUC18-hEGF质粒于大肠杆菌JM109内扩增;提取及纯化pUC18-hEGF质粒;经DNA序列分析其所含hEGF cDNA;限制性酶切hEGF cDNA片段,连接酶连接到真核表达质粒pcDNA3-neo内, 克隆出真核表达质粒pcDNA3-hEGF;再经限制性酶切鉴定hEGF表达质粒。结果:提取及纯化的pUC18-hEGF质粒含有大小正确的hEGF cDNA碱基片段,其碱基序列为编码目的基因的正确序列;凝胶电泳结果证明已将此片段克隆到pcDNA3-hEGF内。结论:成功地构建了hEGF基因的真核表达质粒pcDNA3-hEGF。
, 百拇医药
分类号:Q 782 文献标识码:A
文章编号:1007-8622(2000)01-0018-05
Construction of eukaryotic expression plasmid for human epidermal growth factor gene
HU Da-hai, CHEN Bi, TANG Chao-wu,et al.
( Xijing Hospital,The 4th Military Medical University,710032)
Abstract:Objective:To construct eukaryotic expression plasmid of human basic epidermal growth factor (hEGF) gene for further study on hEGF function in molecular regulatory mechanism during tissue repair. Methods:The plasmids pUC18-hEGF (supplied from R. D. Systems, BBG7), containing full cDNA length of hEGF inserted between HindⅢ and BamHI restriction sites, were propagated in Escherichia coli JM109; then extracted and purified with the WizardTM Plus Milipre DNA purification kit (Promega) as recommended by the manufacturer. The coding sequence of hEGF in the pUC18-hEGF was confirmed by DNA sequence analysis. After plasmids pUC18-hEGF and plasmids pcDNA3-neo were prepared by double digestion with HindⅢ/BamHI, the hEGF cDNA fragment was ligated with T4 ligase between the HindⅢ and BamHI restriction sites in the linear plasmid pcDNA3-neo to form pcDNA3-hEGF. The pcDNA3-hEGF, digested with HindⅢ/BamHI, was found to contain the hEGF cDNA sequence by agarose gel electrophoresis analysis. Results:The extracted and purified pUC18-hEGF contained the correct nucleotide sequence for the full length of hEGF cDNA fragment. The hEGF cDNA fragment had been inserted into the eukaryotic expression plasmid pcDNA3-neo, which formed the pcDNA3-hEGF. Conclusion:The pcDNA3-hEGF, a eukaryotic expression plasmid, was constructed for hEGF gene.
, 百拇医药
Key words:Epidermal growth factor;Gene;Eukaryotic expression plasmid ▲
作为人类最早发现的多肽生长因子之一的EGF,由于具有促进修复细胞DNA合成、分化、调节细胞外基质蛋白合成、参与其它生长因子的生物学调节等重要作用;因此,在组织修复领域受到广泛地研究[1~4] 。本研究旨在采用pcDNA3-neo构建hEGF的cDNA真核表达质粒,为进一步深入探讨hEGF在组织修复过程中所发挥的分子调控机制及其相应的生物学效应等基础理论问题,以及开展包括基因治疗在内的hEGF的合理有效的临床应用提供重要的物质基础。
1 材料与方法
1.1 材料:限制性内切酶:HindIII,BamHI(Promega);核酸修饰酶:T4 DNA连接酶, RNase A(Sigma); PCR Markers(华美生物工程公司);WizardTM Plus Milipre DNA纯化kit(Promega)。细菌菌株JM109,全军基因诊断研究所提供,基因型:recAl supE44 endA1 hsdR17 gyrA96 relA1 thiA(Lac-proAB)F1[traD36 proAB+ LacI8LacIAM15]。质粒pUC18-hEGF:R & D Systems,BBG7;含一位于HindⅢ和BamHI酶切位点间的180 bp的hEGF cDNA片段,具有hEGF硷基序列(图1)。pcDNA3-neo:基础部校生化教研室提供,含有启动子T7位于多克隆位点前,复制起始点SV40ori,抗氨苄青霉素及G418基因 (图2)。

, 百拇医药
图1 pUC18-hEGF内应具有的hEGF cDNA序列

图2 质粒pcDNA3-neo图谱
1.2 方法
1.2.1 质粒的扩增及纯化: 氯化钙法制备感受态菌MJ109;pUC18-hEGF,pcDNA3-neo质粒转化宿主菌、筛选阳性菌落、小量制备质粒DNA,酶切及琼脂糖凝胶电泳分析选出含相应质粒的阳性细菌克隆。对含相应质粒的阳性细菌克隆扩大培养后,按WizardTM Plus Milipre DNA纯化kit 操作说明进行质粒DNA制备及纯化,于DU640型核酸/蛋白检测仪(Beckman)上测定A260 及A280值,判断其纯度,并测定含量。
, http://www.100md.com 1.2.2 限制性内切酶进行酶切及琼脂糖凝胶电泳分析: 应用适当的内切酶加入对应的质粒,37℃温育酶切。将酶切产物于琼脂糖凝胶上50 V电泳30 min,EB染色,紫外透射下观测分析。
1.2.3 目的基因(hEGF cDNA)的序列测定: ①提取及纯化后的质粒pUC18-hEGF,调节核酸浓度0.2 g.L-1;②测序反应:4个0.5 mL的Eppendorf管中分别加入4种荧光标记引物ddNTP混合物(MixA4μL, MixC4μL, Mix G8μL, MixT8μL),模板DNA 1μL,1μL,2μL,2μL,加入20μL石蜡油封。PCR反应:96℃,15s;55℃,1 s;70℃,60s;15个循环后改为95℃,15s;70℃,60s;15个循环。反应产物用950 ml.L-1乙醇100 μL于室温下沉淀15 min,700ml.L-1乙醇洗涤,沉淀用6 μL去离子甲酰胺-EDTAc 5 μL,50mmol.L-1EDTA 1μL(pH8.0)重溶。90℃变性2 min,快速作经顶电泳的聚丙烯酰胺凝胶电泳,用373A型DNA序列分析仪(PE)测定DNA序列。
, 百拇医药
1.2.4 真核表达质粒构建的连接反应: 酶切产物行琼脂糖凝胶电泳,将含有目的片段的凝胶条带切下,酚:氯仿抽提回收目的片。连接反应:pcDNA3-neo fragment 1.0μL(0.1μg),hEGF cDNA fragment 5.0 μL(0.5 μg),T4 ligase 1.0 μL,10×buffer 1.0μL,10 mmol.L-1 ATP 1.0 μL,H2O 1.0 μL,置15℃反应16 h。pcDNA3-hEGF质粒构建过程见图3。

图3 真核表达载体pcDNA3-hEGF的构建过程示意图
1.2.5 构建的pcDNA3-hEGF质粒再转化宿主菌、克隆筛选、质粒提取及酶切鉴定: 所采用的方法同前。
, 百拇医药
2 结果
2.1 pUC18-hEGF酶切鉴定: HindⅢ+BamHI双酶切pUC18-hEGF并经凝胶电泳后观查分析;与预计结果相符合,酶切后获取了分子大小约180 bp的插入在pUC18内的片段,初步证明pUC18-hEGF内有正确的hEGF cDNA片段(图4)。

图4 pUC18-hEGF的酶切鉴定结果
a:pUC18-hEGF digested with HindIII plus BamHI;
b:pUC18-hEGF;
c:PCR markers
2.2 pUC18-hEGF序列测定: 经对pUC18-hEGF测序证实,pUC18-hEGF内插入片段的碱基组成与R & D Systems公司提供的序列及公开发表的hEGF cDNA序列完全一致(图1,5)。


, 百拇医药
图5 pUC18-hEGF测序结果
2.3 构建的真核细胞表达质粒pcDNA3-hEGF的酶切鉴定: 将构建好的真核细胞表达质粒pcDNA3-hEGF经HindⅢ+BamHI双酶切,凝胶电泳后可见切取的片段分子量约大小180 bp,证实已将目的基因hEGF cDNA克隆到pcDNA3-neo载体内,因此真核细胞表达质粒pcDNA3-hEGF构建成功(图6)。

图6 pcDNA3-hEGF的酶切结果
a:pcDNA3-neo
b:pcDNA3-hEGF digested with HindIII plus BamHI;
, http://www.100md.com
c:PCR markers
3 讨论
多肽生长因子在创面愈合中的基础理论和临床应用研究,为现代组织修复领域最受观注的课题之一[1,2]。增殖是愈合过程中所必须的细胞生物活动。细胞的增殖需经过有丝分裂得以实现,大多数生长因子则为创面细胞的有丝分裂原。因此,人们致力于多肽生长因子的研究,以期望做为一种有力的治疗手段促进创面愈合过程。某些临床实验性应用已取得了一定的成绩,如EGF, FGF, IGF, PDGF等,对烧伤、放射性溃疡、糖尿病溃疡、褥疮等都不同程度地显示了促进愈合的作用[5]。但在临床观察中,人们发现生长因子的应用有其一定的限制性。其中关键性的问题有:①尚无理想的载体应用于创面后使局部保持有效的生长因子浓度,需反复用药,造成换药的工作量及病人痛苦均增加;②反复大量应用生物提纯或基因工程重组的产品代价昂贵;③局部坏死组织常阻断所给生长因子达到其应发挥作用的靶细胞;④需联合应用不同作用机制的生长因子,且联合效应的发挥尚需采取合理的给药时相,难以控制。由此可见,多肽生长因子的应用需要从基础研究去寻找更先进、可行、能被人类主动控制的技术方法及物质基础。
, 百拇医药
基因治疗策略为解决生长因子应用中的具体问题提供了新的思路[6]。开放的皮肤创面,为基因治疗技术提供了极其便利的实施部位;此外,研究表明创面愈合过程中的主要修复细胞(角朊细胞、成纤维细胞和血管内皮细胞)对当前研究出来的各种基因载体均具有易感性[7,8]。已有将hEGF、aFGF、TGF-β、GH等基因转移到皮肤或创面的动物实验报道,结果显示经转基因修饰的皮肤角朊细胞,可于局部表达分泌目的蛋白且经皮肤丰富的血液循环运往全身,发挥局部促进创面愈合及全身治疗效应[9,10]。由此可见,运用基因治疗的基本策略,将各种生长因子的基因借助基因工程方法在体外转移到皮肤基本构成细胞内,再将经基因修饰的细胞移植到创面上,或直接在体内将目的基因导入创面的修复细胞内,使这些含有外源性基因的细胞具备适当表达分泌相应生长因子的能力,因而可持续合理地向创面释放愈合过程所需的生长因子,加速创面残余修复细胞的再生及增殖分化,使创面愈合加快;这对解决例如:大面积烧伤需要反复大量给予生长因子促进创面残余细胞增殖、一些慢性难愈创面需较长时间持续应用生长因子等疑难问题都具有值得探索的价值及意义。现代生物细胞学,尤其是皮肤组织细胞体外培养技术的成熟,以及分子生物学的迅速发展,已为人们结合生长因子临床应用开展创面基因治疗提供了一定的基础[11,12]。
, 百拇医药
开展创面基因治疗及进行深入的相关基础理论研究,其关键性物质基础之一,为目的基因真核表达载体的构建。可用于外源性基因真核表达研究的载体分为病毒和非病毒载体两大类[6]。病毒载体具有转染率高、表达稳定等特点,但因其易整合到靶细胞染色体内,故安全性差,尚需慎用。非病毒载体,大部分为各种质粒,进入靶细胞后,以附加体的形式存在,具有安全性好、容量大等特点。实验中采用的质粒pcDNA3-neo,其结构特点为(图2):①含有SV40ori复制元件,因此有可能于宿主细胞分裂时,跟随胞浆遗传给子代细胞,这样可以在一定程度上保证目的基因稳定传送给新增殖的细胞;②其目的基因前(多克隆位点前)装用功能较强的基因启动结构T7, PCMV,而使目的基因的表达有所保证;③该载体具有neo基因,故可应用G418来筛选含此载体的靶细胞;④pcDNA3-neo所含的酶切位点以HindⅢ 起始,其后有BamHI,顺序正好与该研究中拟克隆入载体的目的基因hEGF cDNA末端的酶切位点相同,故使克隆过程中的基因操作简便。1994年,Andree 等曾利用pAbP2;1996年,范青源等则应用 pBK-CMV,均成功地构建了hEGF的真核表达质粒[13,14]。目前尚未见到采用pcDNA3-neo构建hEGF表达质粒的文献报道。
, 百拇医药
我们在已经应用pcDNA3-neo构建了hbFGF表达质粒并进行了相关的研究基础上[15~17],进一步完成了本项实验。现已将质粒pcDNA3-hEGF转染入体外培养的正常人角朊细胞内,并获得阳性转染细胞的克隆及转代培养,分析发现被转染的细胞可稳定地表达hEGF。相信,随着这项研究的不断深入,将为进一步临床应用hEGF 及开展相关的分子调控机制的探索提供更多的实验资料。
基金项目:国家自然科学基金资助项目(39600153)
作者简介:胡大海(1963—),男,博士,主治医师
参考文献:
[1]Lawrence WT, Diegelmann RF. Growth factors in wound healing[J]. Clin Dermatol, 1994,12(1):157-169.
, http://www.100md.com
[2]Hom DB. Growth factors in wound healing[J]. Otolaryngol Clin Nor Am, 1995,28(5):933-953.
[3]Brown GL, Nanney LB, Griffen J,et al. Enhancement of wound healing by topical treatment with epidermal growth factor[J]. N Engl J Med, 1989,321(2):76-79 .
[4]刘 毅,陈 璧,胡大海,等. 深II度烧伤创面愈合过程中EGF/EGFR的表达[J]. 第四军医大学学报,1999,20(5),457-459.
[5]Robson MC, Phillips LG, Thomason A,et al. Platelet-derived growth factor BB for the treatment of chronic pressure ulcers[J]. Lancet, 1992,339(1):23-25.
, 百拇医药
[6]Mulligan RC. The basic science of gene therapy[J]. Science, 1993,260(5110):926-932.
[7]Slama J, Andree C, Winkler T,et al. Gene transfer[J]. Ann Plast Surg, 1995,35(4):429-439.
[8]Sun L, Xu L, Chang H,et al. Transfection with aFGF cDNA improves wound healing[J]. J Invest Dermatol, 1997,108(3):313-318.
[9]Ghahary A, Tredget EE, Chang LJ,et al. Genetically modified dermal keratinocytes express high levels of transforming growth factor-beta1[J]. J Invest Dermatol, 1998,110(5):800-805.
, http://www.100md.com
[10]Wang X, Zinkel S, Polonsky K,et al. Tansgenic studies with a keratin promoter-driven growth hormone transgene:prospects for gene therapy[J]. Proc Natl Acad Sci USA, 1997,94(1):219-226.
[11]Madden MR, Finkelstein JL, Staino CL,et al. Grafting of cultured allogeneic epidermis on second and third degree wounds on 26 patients[J]. J Trauma, 1986,26(7):955-962.
[12]Vogel JC. Keratinocyte gene therapy[J]. Arch Dermatol, 1993,129(11):1478-1483.
, 百拇医药
[13]Andree C, Swain WF, Page CP,et al. In vivo transfer and expression of a human epidermal growth factor gene accelerate wound repair[J]. Proc Natl Acad Sci USA,1994, 91(2):12188-12192.
[14]范青源,谢 毅,戴方平,等. 人表皮细胞生长因子基因真核表达质粒的构建[J]. 第二军医大学学报,1996,17(增刊):1-4.
[15]胡大海,陈 璧,汤朝武,等. 人碱性成纤维细胞生长因子基因真核表达质粒的构建[J]. 第四军医大学学报,1999,20(5):399-403.
[16]胡大海,陈 璧,汤朝武,等. 外源性hbFGF cDNA导入人角朊细胞及其表达[J]. 第四军医大学学报,1999,20(5):404-408.
[17]胡大海,陈 璧,汤朝武,等. pcDNA3-hbFGF转染角朊细胞对真皮成纤维细胞增殖的生物学效应[J]. 第四军医大学学报,1999,20(5):395-398.
收稿日期:1999-12-27, 百拇医药