线性评价和干扰试验中NCCLS评价方案的应用
作者:杨昌国 许叶 张抗
单位:杨昌国 许叶(宁波市临床检验中心,浙江宁波315000);张抗(上海海员医院)
关键词:
临床检验杂志990352 建立一个新的分析方法,或引进新的方法、试剂和仪器,都应对它们的技术性能如精密度,方法比较,线性范围,以及干扰等作出评价。美国国家临床实验室标准化委员会(NCCLS)制订了一套评价方案(Evaluation Protocols),能客观而正确地对上述技术性能作出评价。近年,国外发表的方法学研究和评价研究中采用上述评价方案者逐渐增多,笔者在访美时得到这套文件,开始在方法学研究中应用,现将线性评价和干扰试验的应用实例介绍于下。
1 线性评价
1.1 目的 线性范围是分析方法的一个重要技术指标,它能判断对某一分析方法(试剂或仪器)测得的浓度或活性值与设定的浓度或活性值之间的比例关系的范围。
, 百拇医药
1.2 评价前的准备
1.2.1 对仪器和被评价的方法或试剂应有一个熟悉阶段。
1.2.2 作为线性评价的标本其介质应与实际测定的标本相一致(如血清或其它体液),理想的标本是病人的低或高值标本,这往往不易收集到,亦可用病人的混合标本加入分析物作为高值标本,用正常人标本作为低值标本(必要时可作处理如分析物为酶可以加热,小分子化合物可以透析,脂类可用超离心或多阴离子沉淀)。
1.2.3 浓度范围的确定,应以分析项目的线性要求为准。线性评价应有5个不同浓度,可选择低值和高值标本各一个,低值标本为1号,高值标本为5号,二者3∶1混匀为2号,等份混匀为3号,1:3混匀为4号,2-4号标本的浓度按下式计算: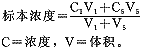
1.3 线性评价方法 (以肌酐酶法测定为例)
, 百拇医药
1.3.1 5个不同浓度的标本,随机排列,每个标本测定4次,因此标本应有足够的量,并且分析要求在当天完成。
1.3.2 离群点检查 将每个标本(X1到X5)4次测定的结果排列在Y1-Y4,见表1。D1和D2中的数据均未超过界限值P0.05=0.765和P0.01=0.889,本组数据未发现离群点。
1.3.3 线性评价统计 采用回归分析,将数据归纳于表2。
1.3.4 数据计算

表1 离群点检查结果
, http://www.100md.com
X1
X2
X3
X4
X5
Y1
Y2
Y3
Y4
D=Y1-Y4
, http://www.100md.com
a) Y1-Y2
D1=(Y1-Y2)/D
b) Y3-Y4
D2=(Y3-Y4)/D
97
97.5
97
96.8
96.5
1.0
, 百拇医药
0.5
0.5
0.3
0.3
760
764
762
760
756
8
2
0.25
4
, http://www.100md.com 0.5
1422
1425
1422
1420
1418
7
3
0.43
2
0.29
2084
2090
, http://www.100md.com
2088
2085
2080
10
2
0.20
5
0.50
2746
2748
2748
2745
2939
, http://www.100md.com
13
4
0.31
6
0.46
界限值 P0.05=0.765,P0.01=0.889
1.3.5 线性回归分析
b=M/D=1.0002
a=Y-bX=0.00564
Y=0.00564+1.0002X
1.3.6 稀释变异试验
, 百拇医药
P=最大SS/TE=90/209.03=0.43
界限值P0.05=0.6841;P0.01=0.7814
现0.05,稀释变异为可接受。
1.3.7 线性失拟检查
LOF=RSS-TE=13.102
G=5 LOF/TE=0.313
界限值F0.05 =3.29;F0.01 =5.42
现G0.05说明线性良好。
, http://www.100md.com
2 干扰试验
2.1 目的 判断某测定方法(或试剂)给出的结果是否受非分析物影响及影响程度。
2.1.1 干扰是指在测定某分析物的浓度或活性时,受另一非分析物影响而导致测定结果增高(正干扰)或降低(负干扰)。
2.1.2 干扰物质可分为内源性(标本中存在的)和外源性(外界污染的)两类。内源性的干扰物有:(1)血清中固有的代谢产物,如TG测定时血清中的FG,肌酐酶法测定时血清中的肌酸等。(2)病理情况下生成的:如胆红素,脂类,蛋白质,血红蛋白等。(3)治疗药物,肠道营养等。外源性干扰有:(1)标本收集中的添加物如抗凝剂,防腐剂,稳定剂,容器和塞子的污染等。(4)试剂中的杂质和杂酶等。
表2 回归分析结果 X
X2
, 百拇医药
Y
∑Y
X∑Y
Y2
∑Y2
SS=∑Y2-(∑Y)2/4
97.5
97
96.8
96.5
9506.25
9409
, 百拇医药
9370.24
9312.25
97
9409
387.8
37616.6
37597.74
0.53
764
762
760
756
583696
, http://www.100md.com
580644
577600
571536
760
577600
3042
2311920
2313476
35
1425
1422
1420
1418
, 百拇医药
2030625
2022084
2016400
2010724
1422
2022084
5685
8084070
8079833
26.75
2090
2088
, 百拇医药 2085
2080
4368100
4359744
4347225
4326400
2084
4343056
8343
17386812
17401469
56.75
2752
, 百拇医药
2748
2745
2739
7523504
7551504
7535025
7502121
2746
7540516
10984
30162064
30162154
, http://www.100md.com 90
2.1.3 干扰的机理,可有物理作用、化学作用以及非特异反应等。
2.1.4 干扰对于临床的重要性 测定结果与“真值”间的偏差,可由测定方法的系统误差,不精密度和干扰所引起,干扰可能是造成误差的一个原因,如果干扰物是恒定的将引起恒定误差,如干扰物随病理生理因素影响,将引起随机误差。因此,实验室应了解各种测定方法的干扰情况,主要是指溶血,黄疸和脂血和某些特殊项目的特殊干扰。
2.2 干扰试验前的准备
2.2.1 干扰试验的对象(1)厂商研制的新产品。(2)检测单位和试剂管理单位,检测商品试剂盒。(3)建立的新方法。(4)新引进的方法或试剂。
2.2.2 应做的主要干扰物(1)病人标本中常常出现的黄疸,脂血和溶血。(2)某些药物如维生素C等。(3)实验常用的抗凝剂,防腐剂和稳定剂。
, 百拇医药
2.2.3 质量保证(1)不存在系统误差。(2)批内精密度在可接受范围内。(3)应不存在前后结果的交叉污染。(4)实验过程有质控监督。
2.2.4 干扰试验方法
(1)“配对差异”试验。即将不同浓度的干扰物加入到实验标本中,然后分别测定加与不加干扰物的标本,比较二者有无偏差,并了解干扰物浓度与偏差程度的关系。
(2)用病人标本作偏差分析。选择病人标本,如心脏,肝脏和肾脏疾病患者,用过某种可能有干扰的药物的病人,以及含有高胆红素,高血脂和血红蛋白的标本,用参考方法和试验方法同时测定,将试验方法的结果和参考方法比较,以确定有否干扰和干扰程度。
这两种干扰试验各有优缺点,第一种方法的不足之处是实验标本的介质可能与病理标本的介质不尽一致,病理标本中的干扰物可能不是原来的药物而是代谢产物,加入的干扰物可能与病理标本中的干扰物不完全相同等。第二种方法的不足之处是①病人通常用多种药物,难以确定干扰物;②不是每种测定项目均有参考方法,而且有的参考方法难以在临床实验室中开展;③参考方法亦可能受某些物质的干扰。两种方法同时使用,会起互补作用。
, 百拇医药
2.3 干扰试验步骤
2.3.1 疑似干扰物的过筛试验
(1)干扰物的试验浓度 内源性干扰物应以临床标本中可能出现的最高浓度为准。药物和某些代谢产物以治疗量10倍的浓度分布在5 L血液中为标准进行实验。
(2)确定干扰的标准 由于某些物质引起测定结果的偏差,足以影响临床解释者谓之干扰,但各项测定的临床要求至今仍未确定,建议将该分析方法批内测定的±1.96 s作为控制限度。
(3)实验过程 配对t检验,选择一份标本一分为二,一份加入疑似干扰物作为测定标本(T),另一份不加作为对照标本(C),如加入的干扰物为液体,对照标本应加同样体积的水,测定按下列顺序C1,T1,C2,T2,……如测定前后可能出现交叉污染,可按C1,T1,Cx,Cx,Cx,C2,T2,Cx,Cx,……所有的结果弃去不用。(4)干扰分析,按下式:干扰值=XT-XC,干扰值在对照组1.96 s(95%可信限)范围内为无显著干扰。
, 百拇医药
2.3.2 干扰物浓度和干扰的关系
(1)实验材料 选择混合血清1份,分成2份,1份加入干扰物,含量为临床标本中可能出现的最高含量,另一份不加,按比例混合成5个不同干扰物浓度。(见线性评价)。
(2)每份标本重复测定n次,计算分析干扰 各组均值-未加干扰物相应组的均值=干扰值。
对照这一浓度±1.96 s,可得出某浓度内有无干扰。
2.3.3 用病人标本作偏差分析
(1)本分析用来证实①某类病人标本中是否存在未知的干扰物;②进一步肯定加入干扰物实验的结论。
(2)选择2组病人标本,一组含疑似干扰物为测定组,另一组不含疑似干扰物作为对照组,两组的分析物浓度范围应大致相同,每组标本需20~40个。
, 百拇医药
(3)两组样品分别用试验方法和比较方法(参考方法)双份测定,并在2小时内完成。
(4)分别比较每组样品,两种方法间的差异,如测定组有差异,对照组无差异说明存在干扰,如两组均无显著差异说明不存在干扰。单用统计学上的差异显著与否来判断干扰存在与否,有时并不确切,因实际测定中随机误差的存在,可能会作出相反的解释,必须结合临床要求的性能来综合判断。
参考资料
[1]NCCLS(EP6-P):Evaluation of the linearity of quantiative analytical methods;Proposed Guideline(1986)
[2]NCCLS(EP7-P):Interference testing in clinical chemistry;Proposed Guideline(1986)
(1998-09-08收稿), 百拇医药
单位:杨昌国 许叶(宁波市临床检验中心,浙江宁波315000);张抗(上海海员医院)
关键词:
临床检验杂志990352 建立一个新的分析方法,或引进新的方法、试剂和仪器,都应对它们的技术性能如精密度,方法比较,线性范围,以及干扰等作出评价。美国国家临床实验室标准化委员会(NCCLS)制订了一套评价方案(Evaluation Protocols),能客观而正确地对上述技术性能作出评价。近年,国外发表的方法学研究和评价研究中采用上述评价方案者逐渐增多,笔者在访美时得到这套文件,开始在方法学研究中应用,现将线性评价和干扰试验的应用实例介绍于下。
1 线性评价
1.1 目的 线性范围是分析方法的一个重要技术指标,它能判断对某一分析方法(试剂或仪器)测得的浓度或活性值与设定的浓度或活性值之间的比例关系的范围。
, 百拇医药
1.2 评价前的准备
1.2.1 对仪器和被评价的方法或试剂应有一个熟悉阶段。
1.2.2 作为线性评价的标本其介质应与实际测定的标本相一致(如血清或其它体液),理想的标本是病人的低或高值标本,这往往不易收集到,亦可用病人的混合标本加入分析物作为高值标本,用正常人标本作为低值标本(必要时可作处理如分析物为酶可以加热,小分子化合物可以透析,脂类可用超离心或多阴离子沉淀)。
1.2.3 浓度范围的确定,应以分析项目的线性要求为准。线性评价应有5个不同浓度,可选择低值和高值标本各一个,低值标本为1号,高值标本为5号,二者3∶1混匀为2号,等份混匀为3号,1:3混匀为4号,2-4号标本的浓度按下式计算:
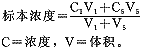
1.3 线性评价方法 (以肌酐酶法测定为例)
, 百拇医药
1.3.1 5个不同浓度的标本,随机排列,每个标本测定4次,因此标本应有足够的量,并且分析要求在当天完成。
1.3.2 离群点检查 将每个标本(X1到X5)4次测定的结果排列在Y1-Y4,见表1。D1和D2中的数据均未超过界限值P0.05=0.765和P0.01=0.889,本组数据未发现离群点。
1.3.3 线性评价统计 采用回归分析,将数据归纳于表2。
1.3.4 数据计算


表1 离群点检查结果
, http://www.100md.com
X1
X2
X3
X4
X5
Y1
Y2
Y3
Y4
D=Y1-Y4
, http://www.100md.com
a) Y1-Y2
D1=(Y1-Y2)/D
b) Y3-Y4
D2=(Y3-Y4)/D
97
97.5
97
96.8
96.5
1.0
, 百拇医药
0.5
0.5
0.3
0.3
760
764
762
760
756
8
2
0.25
4
, http://www.100md.com 0.5
1422
1425
1422
1420
1418
7
3
0.43
2
0.29
2084
2090
, http://www.100md.com
2088
2085
2080
10
2
0.20
5
0.50
2746
2748
2748
2745
2939
, http://www.100md.com
13
4
0.31
6
0.46
界限值 P0.05=0.765,P0.01=0.889
1.3.5 线性回归分析
b=M/D=1.0002
a=Y-bX=0.00564
Y=0.00564+1.0002X
1.3.6 稀释变异试验
, 百拇医药
P=最大SS/TE=90/209.03=0.43
界限值P0.05=0.6841;P0.01=0.7814
现
1.3.7 线性失拟检查
LOF=RSS-TE=13.102
G=5 LOF/TE=0.313
界限值F0.05 =3.29;F0.01 =5.42
现G
, http://www.100md.com
2 干扰试验
2.1 目的 判断某测定方法(或试剂)给出的结果是否受非分析物影响及影响程度。
2.1.1 干扰是指在测定某分析物的浓度或活性时,受另一非分析物影响而导致测定结果增高(正干扰)或降低(负干扰)。
2.1.2 干扰物质可分为内源性(标本中存在的)和外源性(外界污染的)两类。内源性的干扰物有:(1)血清中固有的代谢产物,如TG测定时血清中的FG,肌酐酶法测定时血清中的肌酸等。(2)病理情况下生成的:如胆红素,脂类,蛋白质,血红蛋白等。(3)治疗药物,肠道营养等。外源性干扰有:(1)标本收集中的添加物如抗凝剂,防腐剂,稳定剂,容器和塞子的污染等。(4)试剂中的杂质和杂酶等。
表2 回归分析结果 X
X2
, 百拇医药
Y
∑Y
X∑Y
Y2
∑Y2
SS=∑Y2-(∑Y)2/4
97.5
97
96.8
96.5
9506.25
9409
, 百拇医药
9370.24
9312.25
97
9409
387.8
37616.6
37597.74
0.53
764
762
760
756
583696
, http://www.100md.com
580644
577600
571536
760
577600
3042
2311920
2313476
35
1425
1422
1420
1418
, 百拇医药
2030625
2022084
2016400
2010724
1422
2022084
5685
8084070
8079833
26.75
2090
2088
, 百拇医药 2085
2080
4368100
4359744
4347225
4326400
2084
4343056
8343
17386812
17401469
56.75
2752
, 百拇医药
2748
2745
2739
7523504
7551504
7535025
7502121
2746
7540516
10984
30162064
30162154
, http://www.100md.com 90
2.1.3 干扰的机理,可有物理作用、化学作用以及非特异反应等。
2.1.4 干扰对于临床的重要性 测定结果与“真值”间的偏差,可由测定方法的系统误差,不精密度和干扰所引起,干扰可能是造成误差的一个原因,如果干扰物是恒定的将引起恒定误差,如干扰物随病理生理因素影响,将引起随机误差。因此,实验室应了解各种测定方法的干扰情况,主要是指溶血,黄疸和脂血和某些特殊项目的特殊干扰。
2.2 干扰试验前的准备
2.2.1 干扰试验的对象(1)厂商研制的新产品。(2)检测单位和试剂管理单位,检测商品试剂盒。(3)建立的新方法。(4)新引进的方法或试剂。
2.2.2 应做的主要干扰物(1)病人标本中常常出现的黄疸,脂血和溶血。(2)某些药物如维生素C等。(3)实验常用的抗凝剂,防腐剂和稳定剂。
, 百拇医药
2.2.3 质量保证(1)不存在系统误差。(2)批内精密度在可接受范围内。(3)应不存在前后结果的交叉污染。(4)实验过程有质控监督。
2.2.4 干扰试验方法
(1)“配对差异”试验。即将不同浓度的干扰物加入到实验标本中,然后分别测定加与不加干扰物的标本,比较二者有无偏差,并了解干扰物浓度与偏差程度的关系。
(2)用病人标本作偏差分析。选择病人标本,如心脏,肝脏和肾脏疾病患者,用过某种可能有干扰的药物的病人,以及含有高胆红素,高血脂和血红蛋白的标本,用参考方法和试验方法同时测定,将试验方法的结果和参考方法比较,以确定有否干扰和干扰程度。
这两种干扰试验各有优缺点,第一种方法的不足之处是实验标本的介质可能与病理标本的介质不尽一致,病理标本中的干扰物可能不是原来的药物而是代谢产物,加入的干扰物可能与病理标本中的干扰物不完全相同等。第二种方法的不足之处是①病人通常用多种药物,难以确定干扰物;②不是每种测定项目均有参考方法,而且有的参考方法难以在临床实验室中开展;③参考方法亦可能受某些物质的干扰。两种方法同时使用,会起互补作用。
, 百拇医药
2.3 干扰试验步骤
2.3.1 疑似干扰物的过筛试验
(1)干扰物的试验浓度 内源性干扰物应以临床标本中可能出现的最高浓度为准。药物和某些代谢产物以治疗量10倍的浓度分布在5 L血液中为标准进行实验。
(2)确定干扰的标准 由于某些物质引起测定结果的偏差,足以影响临床解释者谓之干扰,但各项测定的临床要求至今仍未确定,建议将该分析方法批内测定的±1.96 s作为控制限度。
(3)实验过程 配对t检验,选择一份标本一分为二,一份加入疑似干扰物作为测定标本(T),另一份不加作为对照标本(C),如加入的干扰物为液体,对照标本应加同样体积的水,测定按下列顺序C1,T1,C2,T2,……如测定前后可能出现交叉污染,可按C1,T1,Cx,Cx,Cx,C2,T2,Cx,Cx,……所有的结果弃去不用。(4)干扰分析,按下式:干扰值=XT-XC,干扰值在对照组1.96 s(95%可信限)范围内为无显著干扰。
, 百拇医药
2.3.2 干扰物浓度和干扰的关系
(1)实验材料 选择混合血清1份,分成2份,1份加入干扰物,含量为临床标本中可能出现的最高含量,另一份不加,按比例混合成5个不同干扰物浓度。(见线性评价)。
(2)每份标本重复测定n次,计算分析干扰 各组均值-未加干扰物相应组的均值=干扰值。
对照这一浓度±1.96 s,可得出某浓度内有无干扰。
2.3.3 用病人标本作偏差分析
(1)本分析用来证实①某类病人标本中是否存在未知的干扰物;②进一步肯定加入干扰物实验的结论。
(2)选择2组病人标本,一组含疑似干扰物为测定组,另一组不含疑似干扰物作为对照组,两组的分析物浓度范围应大致相同,每组标本需20~40个。
, 百拇医药
(3)两组样品分别用试验方法和比较方法(参考方法)双份测定,并在2小时内完成。
(4)分别比较每组样品,两种方法间的差异,如测定组有差异,对照组无差异说明存在干扰,如两组均无显著差异说明不存在干扰。单用统计学上的差异显著与否来判断干扰存在与否,有时并不确切,因实际测定中随机误差的存在,可能会作出相反的解释,必须结合临床要求的性能来综合判断。
参考资料
[1]NCCLS(EP6-P):Evaluation of the linearity of quantiative analytical methods;Proposed Guideline(1986)
[2]NCCLS(EP7-P):Interference testing in clinical chemistry;Proposed Guideline(1986)
(1998-09-08收稿), 百拇医药