聚合酶链反应诊断军团菌感染的实验研究
作者:朱利平 石尧忠 陈一平 王葆青 胡文雁 翁心华 邬祥惠
单位:200040 上海医科大学华山医院(朱利平、石尧忠、陈一平、翁心华、邬祥惠);上海医科大学中山医院(王葆青);复旦大学分子遗传研究所(胡文雁)
关键词:聚合酶链反应;军团病杆菌属;基因,mip
中华传染病杂志980312 【摘要】 目的 早期诊断军团菌感染。方法 采用聚合酶链反应(PCR)检测嗜肺军团菌(Lp)mip基因的特异性片段,并应用于豚鼠米克戴德军团菌(Lm)感染后的组织标本检测。结果 可以扩增出LpI型和Lm630bp的特异性片段,其他临床分离株不被测得,检测灵敏度为150fg军团菌基因组DNA(相当于15~30个军团菌)。对22份Lm感染后不同时间获取的豚鼠组织标本,应用该法与培养法检测结果比较显示,在感染后3.5天培养法阳性率为88.9%,PCR法100%,在感染后7.5天培养法阳性率为0,而PCR法仍有22.2%的阳性率。结论 本方法敏感、特异,既能检出嗜肺军团菌,又能测得Lm,大大提高了军团病的诊断率。
, http://www.100md.com
Study on the diagnosis of Legionella infection by polymerase chain reaction Zhu Liping, Shi Yaozhong, Cheng Yiping, et al. Department of Infectious Diseases, Hua Shan Hospital, Shanghai Medical University, Shanghai 200040
【Abstract】 Objective To diagnose the infection of legionella early. Methods Polymerase chain reaction(PCR) was used to amplify the specific fragment of Legionella pneumophila(Lp) mip gene, and the tissues of guinea pigs infected by Legionella micdadei were detected by the technique. Results The 630bp sequence of Lp and Lm were specifically amplified, whereas other clinical isolates could not be detected. The lower limit of detection was 150fg DNA of legionella (corresponding to 15~30 organisms). Twenty-two specimens were obtained from tissues of guinea pigs infected by Lm in different time courses, and then detected by PCR and culture, respectively. The positive rate of culture in 3.5 days after infection was 88.9%; however, the positive rate of PCR was 100%. In 7.5 days, all samples were negative by culture, nevertheless the positive rate of PCR was 22.2%. Conclusion These results indicated that the PCR assay was a specific and sensitive technique for the diagnosis of legionella infection.
, 百拇医药
【Key words】 Polymerase chain reaction Legionella Gene mip
军团病(Legionnaires' disease)是由军团菌感染引起的一种急性传染性疾病,因其临床表现不易与普通细菌性肺炎相区别,故临床上常致误诊,未经及时诊断和有效抗生素治疗的患者,病死率较高。其中,米克戴德军团菌(Lm)感染易好发于免疫缺陷患者。因此,对其检测具有相当重要的临床价值。目前公认的实验室诊断方法主要有血清抗体测定、直接免疫荧光抗体法、军团菌分离培养、尿可溶性抗原及核酸探针杂交法[1],但仍缺乏一种在疾病早期使用的敏感、特异的诊断方法。本实验旨在采用聚合酶链反应(PCR)检测军团菌,并应用于诊断豚鼠的Lm感染。
材料与方法
一、菌株及其DNA的提取
嗜肺军团菌血清型I型(Lp1)、Lm标准菌株来自美国CDC,由上海市卫生防疫站提供。铜绿假单胞菌、大肠杆菌、奇异变形杆菌、金黄色葡萄球菌、流感嗜血杆菌、肺炎球菌、肺炎杆菌、结核杆菌均来自临床分离菌株,由上海医科大学华山医院细菌室和抗生素所提供。肺炎支原体、肺炎衣原体DNA为PCR商售试剂盒中的阳性DNA模板,由无锡市三爱斯生化科技开发有限公司提供。菌株的DNA抽提采用蛋白酶K消化,酚氯仿抽提的经典方法进行[2]。紫外分光光度法测定纯化Lp1 DNA含量。
, http://www.100md.com
二、PCR引物及PCR扩增
(一) 引物 选自Lp mip基因区内,参照文献[3]设计引物Lmip-1核酸序列为5′-GGTGACTGCGGCTGTTATGG-3′,引物Lmip-2核酸序列为5′-GGCCAATAGGTCCGCCAACG-3′,扩增产物长度为630bp。引物合成委托中国科学院上海生物化学研究所完成。
(二) PCR扩增 在25μl PCR反应体系中,含10×缓冲液2.5μl,四种dNTP各0.2mmol/L,引物0.2μmol/L,模板DNA 5μl,1 U Taq DNA聚合酶(购自上海Sangon生物工程公司),加灭菌双蒸水至终体积25μl,用无菌石蜡油覆盖液面。混合液经93°C变性5分钟,置PCR自动循环仪(上海复华公司生产),依次循环40次,每次循环条件为93°C 30秒,64°C 60秒,72°C 60秒,最后一循环于72°C延伸7分钟。
三、扩增产物琼脂糖凝胶电泳
, 百拇医药
取5μl扩增产物,经1.5%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察,以出现630bp分子量条带为阳性结果。φ×174/HaeⅢ作为分子量标准。
四、动物实验
豚鼠(250~400g)由上海医科大学动物部提供,实验组豚鼠7只,分别腹腔注射108CFU/ml Lm悬液1ml,并于感染后3.5天、7.5天各解剖豚鼠3只,死亡豚鼠即刻予以解剖;对照组豚鼠2只,腹腔注射1ml灭菌生理盐水,4天后解剖。以无菌手续取肺、肝、脾组织新鲜切面压印于BCYEα平板和血平板上,接种环划种,置37°C、5%CO2条件下培养4~7天,用玻片凝集法和革兰染色鉴定再分离菌;切取各组织标本0.25g,切碎后研钵研磨成匀浆,DNA抽提、PCR扩增方法同前所述;切取小块新鲜肺组织,10%福尔马林固定,石蜡包埋、切片及HE染色。
结果
, http://www.100md.com
一、特异性和敏感性检测
用引物对标准菌株Lp1、Lm DNA进行扩增,可在630bp处出现一条DNA区带,用肺炎球菌、大肠杆菌、铜绿假单胞菌、肺炎支原体、肺炎杆菌等DNA作模板扩增,未见阳性区带出现(图1)。敏感性检测用Lp1 DNA作模板1∶10梯度稀释,最小检出量为150fg DNA片段(图2)。
1.Lp1 2.Lm 3~8.临床常见菌株 9.空白对照
图1 PCR扩增Lp mip基因电泳结果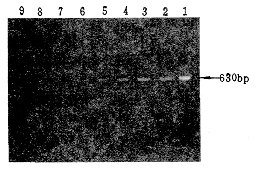
1~8.依次为1.5μg、150ng、15ng、1.5ng、150pg、15pg、1.5pg、150fg、15fg Lp1 DNA,9.阴性
, http://www.100md.com
图2 PCR扩增Lp mip基因敏感性结果
二、组织标本检测
在感染后第3天1只豚鼠死亡(有腹水产生),其他豚鼠在感染后3.5天、7.5天解剖,共获22份组织标本,用培养法、PCR法检测结果见附表。对照组组织标本共6份,两方法检测均阴性。
附表 感染后不同时间培养法、PCR检测阳性率比较 项目
感染后天数
3
3.5
7.5
培养法
100(4/4)
, http://www.100md.com
88.9(8/9)
0(9/9)
PCR
100(4/4)
100(9/9)
22.2(2/9)
注:括号内分子为阳性标本数,分母为标本总数
结果表明,随感染时间的延长,培养与PCR检测的阳性率均逐渐下降,但至感染后第7.5天,9份标本培养均阴性,而PCR法则仍有2份标本阳性。
豚鼠感染后的肺组织结果表明,在感染后均存在不同程度的炎症改变,可见肺泡壁毛细血管扩张、充血,肺泡壁增厚、肺泡间大量炎症细胞浸润及肺泡结构部分破坏,且在感染后随病程延长,组织的病理改变更为严重,与文献报道的嗜肺军团菌感染动物模型结果相一致[4]。讨论
, 百拇医药
在致病性军团菌中Lp占85%以上,Lm占8%以上,而Lm多发生在医院内感染,较嗜肺军团菌更易感染免疫抑制患者,如长期使用肾上腺糖皮质激素、器官移植、恶性肿瘤等[5]。因此,对两者的检测具有重要的临床价值。军团菌分离培养被公认为诊断军团菌感染的“金标准”,由于临床标本中有杂菌污染,故临床上常将BMPAα作为首选培养基,它能抑制标本中的杂菌,又可促进军团菌的生长,但对Lm的生长却有抑制作用[6,7],因而给Lm感染诊断带来了困难。
目前军团菌PCR检测,或采用属特异引物,可测出所有军团菌,但不能区分致病与非致病性,或采用种特异引物,可测出嗜肺军团菌,但不能测出非嗜肺的致病性军团菌[8,9]。我们用Jaulhac等[10,11]设计引物对Lp mip基因特异性片段进行扩增,该引物与Lm扩增靶序列同源性较高,经比较引物Lmip-1与Lm同源性达76%,Lmip-2则完全与Lm配对,故与实验结果一致,能有效地检出Lp和Lm,而临床常见的感染菌株如肺炎球菌、大肠杆菌、铜绿假单胞菌、肺炎支原体、肺炎衣原体等均不被测得。Jaulhac等[3]实验结果亦同样显示可测出致病性军团菌Lp、Lm及Lb,其他军团菌、细菌不被测得。Lb测出原因尚不清楚。
, http://www.100md.com
为了解本方法的敏感性,我们将Lp1标准菌株经经典方法抽提纯化DNA后,1∶10定量稀释并PCR扩增检测,结果可测出150fg Lp基因组DNA,相当于15~30个军团菌,与国外报道的检测水平相一致[8]。
22份豚鼠Lm感染后的组织标本中Lm DNA检测结果表明,PCR与培养法均可测出组织标本中的Lm。尽管有资料表明,豚鼠感染后6天组织中军团菌已明显下降[12,13],且本组实验也显示感染后第7.5天培养阳性率为0,但是,PCR仍有22.2%的阳性率,提示有较好的检测效果。从该法检测的初步结果来看,此方法敏感、特异,可以大大提高军团病的诊断率。
参考文献
1 朱利平,石尧忠.军团菌核酸检测的进展.中华传染病杂志,1995,13:40-42.
2 [美]戴维斯等.分子生物学基本实验方法.张钰等译.上海:复旦大学出版社,1989.305-307.
, 百拇医药
3 Jaulhac B, Nowicki M, Bornstein N, et al. Detection of legionella spp. in bronchoalveolar lavage fluids by DNA amplification. J Clin Microbiol,1992,30:920-924.
4 Chander FW, McDade JE, Hicklin MD, et al. Pathologic findings in guinea pigs inoculated intraperitoneally with the Legionnaires' disease bacterium. Ann Inter Med,1979,90:671-675.
5 Muder RR, Yu VL. Other Legionella species. In: Mandell GL, Bennett JE, Dolin R, eds. Principles and practice of infectious diseases. 4th ed. New York: Churchill Livingstone,1995.2097-2103.
, 百拇医药
6 Edelstein PH. Improved semiselective medium for isolation of Legionella pneumophila from contaminated clinical and enviromental specimens. J Clin Microbiol,1981,14:298-303.
7 Lee TC, Vickers RM, Yu VL, et al. Growth of 28 legionella species on selective culture media: A comparative study. J Clin Microbiol,1993,31:2764-2768.
8 Mahbubani MH, Bej AK, Miller R, et al. Detection of Legionella with polymerase chain reaction and gene probe methods. Mol Cell Probes,1990,4:175-187.
, 百拇医药
9 Lindsay DSJ, Abraham WH, Fallon RJ. Detection of mip gene by PCR for diagnosis of Legionnaires' disease. J Clin Microbiol,1994,32:3068-3069.
10 Engleberg NC, Carter C, Weber DR, et al. DNA sequence of mip, a Legionella pneumophila gene associated with macrophage infectivity. Infect Immun,1989,57:1263-1270.
11 Bangsborg JM, Cianciotto NP, Hindersson P. Nucleotide sequence analysis of the Legionella micdadei mip gene, encoding a 30-kilodalton analog of the Legionella pneumophila mip protein. Infect Immun,1991,59:3836-3840.
, 百拇医药
12 Brieland J, Freeman P, Kunkel R, et al. Replicative Legionella pneumophila lung infection in intratracheally inoculated A/J mice. A murine model of human Legionnaires' disease. Am J Pathol,1994,145:1537-1546.
13 Davis GS, Winn WC, Gump DW, et al. The kinetics of early inflammatory events during experimental pneumonia due to Legionella pneumophila in guinea pigs. J Infect Dis,1983,148:823-835., http://www.100md.com
单位:200040 上海医科大学华山医院(朱利平、石尧忠、陈一平、翁心华、邬祥惠);上海医科大学中山医院(王葆青);复旦大学分子遗传研究所(胡文雁)
关键词:聚合酶链反应;军团病杆菌属;基因,mip
中华传染病杂志980312 【摘要】 目的 早期诊断军团菌感染。方法 采用聚合酶链反应(PCR)检测嗜肺军团菌(Lp)mip基因的特异性片段,并应用于豚鼠米克戴德军团菌(Lm)感染后的组织标本检测。结果 可以扩增出LpI型和Lm630bp的特异性片段,其他临床分离株不被测得,检测灵敏度为150fg军团菌基因组DNA(相当于15~30个军团菌)。对22份Lm感染后不同时间获取的豚鼠组织标本,应用该法与培养法检测结果比较显示,在感染后3.5天培养法阳性率为88.9%,PCR法100%,在感染后7.5天培养法阳性率为0,而PCR法仍有22.2%的阳性率。结论 本方法敏感、特异,既能检出嗜肺军团菌,又能测得Lm,大大提高了军团病的诊断率。
, http://www.100md.com
Study on the diagnosis of Legionella infection by polymerase chain reaction Zhu Liping, Shi Yaozhong, Cheng Yiping, et al. Department of Infectious Diseases, Hua Shan Hospital, Shanghai Medical University, Shanghai 200040
【Abstract】 Objective To diagnose the infection of legionella early. Methods Polymerase chain reaction(PCR) was used to amplify the specific fragment of Legionella pneumophila(Lp) mip gene, and the tissues of guinea pigs infected by Legionella micdadei were detected by the technique. Results The 630bp sequence of Lp and Lm were specifically amplified, whereas other clinical isolates could not be detected. The lower limit of detection was 150fg DNA of legionella (corresponding to 15~30 organisms). Twenty-two specimens were obtained from tissues of guinea pigs infected by Lm in different time courses, and then detected by PCR and culture, respectively. The positive rate of culture in 3.5 days after infection was 88.9%; however, the positive rate of PCR was 100%. In 7.5 days, all samples were negative by culture, nevertheless the positive rate of PCR was 22.2%. Conclusion These results indicated that the PCR assay was a specific and sensitive technique for the diagnosis of legionella infection.
, 百拇医药
【Key words】 Polymerase chain reaction Legionella Gene mip
军团病(Legionnaires' disease)是由军团菌感染引起的一种急性传染性疾病,因其临床表现不易与普通细菌性肺炎相区别,故临床上常致误诊,未经及时诊断和有效抗生素治疗的患者,病死率较高。其中,米克戴德军团菌(Lm)感染易好发于免疫缺陷患者。因此,对其检测具有相当重要的临床价值。目前公认的实验室诊断方法主要有血清抗体测定、直接免疫荧光抗体法、军团菌分离培养、尿可溶性抗原及核酸探针杂交法[1],但仍缺乏一种在疾病早期使用的敏感、特异的诊断方法。本实验旨在采用聚合酶链反应(PCR)检测军团菌,并应用于诊断豚鼠的Lm感染。
材料与方法
一、菌株及其DNA的提取
嗜肺军团菌血清型I型(Lp1)、Lm标准菌株来自美国CDC,由上海市卫生防疫站提供。铜绿假单胞菌、大肠杆菌、奇异变形杆菌、金黄色葡萄球菌、流感嗜血杆菌、肺炎球菌、肺炎杆菌、结核杆菌均来自临床分离菌株,由上海医科大学华山医院细菌室和抗生素所提供。肺炎支原体、肺炎衣原体DNA为PCR商售试剂盒中的阳性DNA模板,由无锡市三爱斯生化科技开发有限公司提供。菌株的DNA抽提采用蛋白酶K消化,酚氯仿抽提的经典方法进行[2]。紫外分光光度法测定纯化Lp1 DNA含量。
, http://www.100md.com
二、PCR引物及PCR扩增
(一) 引物 选自Lp mip基因区内,参照文献[3]设计引物Lmip-1核酸序列为5′-GGTGACTGCGGCTGTTATGG-3′,引物Lmip-2核酸序列为5′-GGCCAATAGGTCCGCCAACG-3′,扩增产物长度为630bp。引物合成委托中国科学院上海生物化学研究所完成。
(二) PCR扩增 在25μl PCR反应体系中,含10×缓冲液2.5μl,四种dNTP各0.2mmol/L,引物0.2μmol/L,模板DNA 5μl,1 U Taq DNA聚合酶(购自上海Sangon生物工程公司),加灭菌双蒸水至终体积25μl,用无菌石蜡油覆盖液面。混合液经93°C变性5分钟,置PCR自动循环仪(上海复华公司生产),依次循环40次,每次循环条件为93°C 30秒,64°C 60秒,72°C 60秒,最后一循环于72°C延伸7分钟。
三、扩增产物琼脂糖凝胶电泳
, 百拇医药
取5μl扩增产物,经1.5%琼脂糖凝胶电泳,溴化乙锭染色,紫外灯下观察,以出现630bp分子量条带为阳性结果。φ×174/HaeⅢ作为分子量标准。
四、动物实验
豚鼠(250~400g)由上海医科大学动物部提供,实验组豚鼠7只,分别腹腔注射108CFU/ml Lm悬液1ml,并于感染后3.5天、7.5天各解剖豚鼠3只,死亡豚鼠即刻予以解剖;对照组豚鼠2只,腹腔注射1ml灭菌生理盐水,4天后解剖。以无菌手续取肺、肝、脾组织新鲜切面压印于BCYEα平板和血平板上,接种环划种,置37°C、5%CO2条件下培养4~7天,用玻片凝集法和革兰染色鉴定再分离菌;切取各组织标本0.25g,切碎后研钵研磨成匀浆,DNA抽提、PCR扩增方法同前所述;切取小块新鲜肺组织,10%福尔马林固定,石蜡包埋、切片及HE染色。
结果
, http://www.100md.com
一、特异性和敏感性检测
用引物对标准菌株Lp1、Lm DNA进行扩增,可在630bp处出现一条DNA区带,用肺炎球菌、大肠杆菌、铜绿假单胞菌、肺炎支原体、肺炎杆菌等DNA作模板扩增,未见阳性区带出现(图1)。敏感性检测用Lp1 DNA作模板1∶10梯度稀释,最小检出量为150fg DNA片段(图2)。

1.Lp1 2.Lm 3~8.临床常见菌株 9.空白对照
图1 PCR扩增Lp mip基因电泳结果

1~8.依次为1.5μg、150ng、15ng、1.5ng、150pg、15pg、1.5pg、150fg、15fg Lp1 DNA,9.阴性
, http://www.100md.com
图2 PCR扩增Lp mip基因敏感性结果
二、组织标本检测
在感染后第3天1只豚鼠死亡(有腹水产生),其他豚鼠在感染后3.5天、7.5天解剖,共获22份组织标本,用培养法、PCR法检测结果见附表。对照组组织标本共6份,两方法检测均阴性。
附表 感染后不同时间培养法、PCR检测阳性率比较 项目
感染后天数
3
3.5
7.5
培养法
100(4/4)
, http://www.100md.com
88.9(8/9)
0(9/9)
PCR
100(4/4)
100(9/9)
22.2(2/9)
注:括号内分子为阳性标本数,分母为标本总数
结果表明,随感染时间的延长,培养与PCR检测的阳性率均逐渐下降,但至感染后第7.5天,9份标本培养均阴性,而PCR法则仍有2份标本阳性。
豚鼠感染后的肺组织结果表明,在感染后均存在不同程度的炎症改变,可见肺泡壁毛细血管扩张、充血,肺泡壁增厚、肺泡间大量炎症细胞浸润及肺泡结构部分破坏,且在感染后随病程延长,组织的病理改变更为严重,与文献报道的嗜肺军团菌感染动物模型结果相一致[4]。讨论
, 百拇医药
在致病性军团菌中Lp占85%以上,Lm占8%以上,而Lm多发生在医院内感染,较嗜肺军团菌更易感染免疫抑制患者,如长期使用肾上腺糖皮质激素、器官移植、恶性肿瘤等[5]。因此,对两者的检测具有重要的临床价值。军团菌分离培养被公认为诊断军团菌感染的“金标准”,由于临床标本中有杂菌污染,故临床上常将BMPAα作为首选培养基,它能抑制标本中的杂菌,又可促进军团菌的生长,但对Lm的生长却有抑制作用[6,7],因而给Lm感染诊断带来了困难。
目前军团菌PCR检测,或采用属特异引物,可测出所有军团菌,但不能区分致病与非致病性,或采用种特异引物,可测出嗜肺军团菌,但不能测出非嗜肺的致病性军团菌[8,9]。我们用Jaulhac等[10,11]设计引物对Lp mip基因特异性片段进行扩增,该引物与Lm扩增靶序列同源性较高,经比较引物Lmip-1与Lm同源性达76%,Lmip-2则完全与Lm配对,故与实验结果一致,能有效地检出Lp和Lm,而临床常见的感染菌株如肺炎球菌、大肠杆菌、铜绿假单胞菌、肺炎支原体、肺炎衣原体等均不被测得。Jaulhac等[3]实验结果亦同样显示可测出致病性军团菌Lp、Lm及Lb,其他军团菌、细菌不被测得。Lb测出原因尚不清楚。
, http://www.100md.com
为了解本方法的敏感性,我们将Lp1标准菌株经经典方法抽提纯化DNA后,1∶10定量稀释并PCR扩增检测,结果可测出150fg Lp基因组DNA,相当于15~30个军团菌,与国外报道的检测水平相一致[8]。
22份豚鼠Lm感染后的组织标本中Lm DNA检测结果表明,PCR与培养法均可测出组织标本中的Lm。尽管有资料表明,豚鼠感染后6天组织中军团菌已明显下降[12,13],且本组实验也显示感染后第7.5天培养阳性率为0,但是,PCR仍有22.2%的阳性率,提示有较好的检测效果。从该法检测的初步结果来看,此方法敏感、特异,可以大大提高军团病的诊断率。
参考文献
1 朱利平,石尧忠.军团菌核酸检测的进展.中华传染病杂志,1995,13:40-42.
2 [美]戴维斯等.分子生物学基本实验方法.张钰等译.上海:复旦大学出版社,1989.305-307.
, 百拇医药
3 Jaulhac B, Nowicki M, Bornstein N, et al. Detection of legionella spp. in bronchoalveolar lavage fluids by DNA amplification. J Clin Microbiol,1992,30:920-924.
4 Chander FW, McDade JE, Hicklin MD, et al. Pathologic findings in guinea pigs inoculated intraperitoneally with the Legionnaires' disease bacterium. Ann Inter Med,1979,90:671-675.
5 Muder RR, Yu VL. Other Legionella species. In: Mandell GL, Bennett JE, Dolin R, eds. Principles and practice of infectious diseases. 4th ed. New York: Churchill Livingstone,1995.2097-2103.
, 百拇医药
6 Edelstein PH. Improved semiselective medium for isolation of Legionella pneumophila from contaminated clinical and enviromental specimens. J Clin Microbiol,1981,14:298-303.
7 Lee TC, Vickers RM, Yu VL, et al. Growth of 28 legionella species on selective culture media: A comparative study. J Clin Microbiol,1993,31:2764-2768.
8 Mahbubani MH, Bej AK, Miller R, et al. Detection of Legionella with polymerase chain reaction and gene probe methods. Mol Cell Probes,1990,4:175-187.
, 百拇医药
9 Lindsay DSJ, Abraham WH, Fallon RJ. Detection of mip gene by PCR for diagnosis of Legionnaires' disease. J Clin Microbiol,1994,32:3068-3069.
10 Engleberg NC, Carter C, Weber DR, et al. DNA sequence of mip, a Legionella pneumophila gene associated with macrophage infectivity. Infect Immun,1989,57:1263-1270.
11 Bangsborg JM, Cianciotto NP, Hindersson P. Nucleotide sequence analysis of the Legionella micdadei mip gene, encoding a 30-kilodalton analog of the Legionella pneumophila mip protein. Infect Immun,1991,59:3836-3840.
, 百拇医药
12 Brieland J, Freeman P, Kunkel R, et al. Replicative Legionella pneumophila lung infection in intratracheally inoculated A/J mice. A murine model of human Legionnaires' disease. Am J Pathol,1994,145:1537-1546.
13 Davis GS, Winn WC, Gump DW, et al. The kinetics of early inflammatory events during experimental pneumonia due to Legionella pneumophila in guinea pigs. J Infect Dis,1983,148:823-835., http://www.100md.com