内分泌因素影响牙槽骨修复的动物实验研究
作者:李德懿 刘瑷如 汪铮 胡庆沈 叶军
单位:李德懿(上海第二医科大学附属第九人民医院 200011);刘瑷如(上海第二医科大学附属第九人民医院 200011);叶军(上海第二医科大学附属第九人民医院 200011);汪铮(上海第二医科大学图像分析室);胡庆沈(上海第二医科大学图像分析室)
关键词:内分泌因素;牙槽骨修复;碱性磷酸酶;酸性磷酸酶;图像分析
华西口腔医学杂志000107 摘 要:目的:明确内分泌因素对牙槽骨修复过程中碱性磷酸酶(ALP)和酸性磷酸酶(ACP)活性的影响,并探讨牙槽骨吸收修复机制。方法:24只狗的牙槽骨二壁骨袋模型,随机分成4组,采用组织学检查、酶组织化学和全自动图像分析等技术定量分析去除卵巢、诱发实验性糖尿病及提高甲状腺素水平情况下,骨缺损修复过程中ALP和ACP活性变化。结果:甲状腺素组除6个月组ACP活性较高外,ALP与ACP活性均较对照组低,有统计学差异(P<0.01);糖尿病组和卵巢切除组仅ALP降低有统计学差异(P<0.05或P<0.01),酶的活性与骨形态结构变化相吻合。结论:牙槽骨修复受全身内分泌因素的调控,且与其破骨细胞和成骨细胞的酶活性密切相关。
, http://www.100md.com
Animal Experimental Study on Endocrine Factors Affecting Alveolar Repair
Li Deyi Liu Airu Ye Jun
(The Ninth Affiliated Renmin Hospital, Shanghai Second Medical University)
Wang Zheng Hu Qingshen
(Image Analysis Office, Shanghai Second Medical University)
Abstract:Objective:To investigate the endocrine effects on activities of alkaline phosphatase (ALP) and acid phosphatase (ACP) and to obtain the mechanism of the resorption and regeneration of the alveolar bone. Methods: 24 dog models with two-side osseous infrabony pocket were divided into 4 groups randomly and were studied by histologic examination, enzyme cytochemistry and image analysis system. Results: The activities of ALP and ACP, except ACP in the sixth month significantly decreased in the group of thyroidism comparing with that of the control group (P<0.01), but only the activities of ALP significantly decreased in groups of ovariectomy and diabetes (P<0.05, P<0.01), and there was close relationship between enzyme activities and histopathologic variations. Conclusion: Alveolar bone repair was regulated by systemic endocrine factors and was associated with the activities of ALP and ACP osteoblasts of and osteoclasts.
, 百拇医药
Key words:endocrine factor alveolar repair alkaline phosphatase (ALP) acid phosphatase (ACP) image analysis system▲
牙槽骨吸收是牙周病进展期的重要特性,目前对牙槽骨破坏修复的认识多数来自体外实验[1~3],而骨修复过程中全身因素对细胞中酶、细胞结构及功能的影响研究较少。本研究对狗二壁骨缺损的动物模型采用组织学观察、酶细胞化学和全自动图像分析等技术,定量分析去除卵巢、实验诱发性糖尿病及提高甲状腺素水平情况下,骨缺损修复过程中碱性磷酸酶(alkaline phosphatase, ALP)和酸性磷酸酶(acid phosphatase, ACP)活性的动态变化。
1 材料和方法
1.1 二壁骨缺损动物模型制备
, http://www.100md.com
成年杂种狗24只,体重8~12 kg,全麻下在上颌尖磨牙区牙间隙处,翻开全厚粘骨膜瓣,制备颊舌向2~2.5 mm、近远中向3~4 mm(以牙间隙长度为限)、深4~5 mm的二壁骨缺损,在远中牙面作刻痕标记深度。
1.2 实验分组和取材部位
24只狗在制备人工二壁骨袋后,根据实验要求随机分成4组,每组6只(除卵巢切除组为雌性外,其余组雌雄不定):①卵巢切除组:手术切除两侧卵巢;②糖尿病组:腹腔注射链脲佐菌素60 mg/kg[4];③甲状腺素组:每日喂服左旋甲状腺素100 μg 1~6月;④对照组:不作其它处理。各组于1、2、6月分别处死2只狗,用细锯和锐利的单面金钢钻刀片截取骨袋部位修复骨作组织学观察和酶组织化学研究。
1.3 碱性和酸性磷酸酶染色
1.3.1 固定和脱钙 将骨缺损修复部位宽约10 mm、长10 mm、厚1.5 mm的组织块,用4%多聚甲醛和0.1 mol/L二甲砷酸钠缓冲液(pH7.2)在4℃条件下固定3 h。然后用4%EDTA-2Na溶液(pH7.2)在4℃条件下脱钙10 d,每天换1次脱钙液,每天振荡3次,每次10 min。
, 百拇医药
1.3.2 冰冻切片染色 每个组织块在-18℃条件下连续切片6张,厚约5 μm,HE、ALP及ACP染色各为2张,采用偶氮色素法进行ALP和ACP染色[5,6],ALP呈紫色,ACP呈桔红色(试剂由上海虹桥医用试剂实验研究所生产)。
1.3.3 组织学观察和图像分析 分别于1、2、6个月进行组织学观察,使用OMSP-30型显微分光光度计(OPTON公司),各选6个视野,在摄像机上得到适当放大的图像,输入VIDAS多功能图像分析仪(德国ZEISS公司),将酶染色深浅程度(即图像的灰度)定阈分为强阳性和阳性2级,自动进行分级。测量出标本中不规整的酶染色面积,自动地转变为量化信息,算出百分比,用分组t检验分析结果。
2 结 果
2.1 镜下观察
各组1~6个月均有不同量新骨形成,新骨与旧骨间可见较明显的分界线,新生的骨小梁细小,常呈网络状,髓腔大,血管较丰富,小梁壁上有单层或双层栅栏状排列的成骨细胞(图1)。酶组织化学染色显示:旧骨部位ALP和ACP染色均弱,偶见ALP阳性的成骨细胞或ACP阳性的破骨细胞,在骨髓腔有时可见少量ALP或ACP反应颗粒;新生骨小梁边缘多见栅栏状排列的ALP阳性染色的成骨细胞(图2),骨陷窝内的破骨细胞体积大,ACP常呈强阳性、深红色染色斑块充满细胞,有时甚至掩盖核染色(图3);未分化细胞未见染色。
, 百拇医药
图1 新骨和旧骨交界处 HE ×140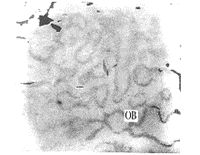
图2 新生骨小梁壁上栅状排列的成骨细胞(OB)
ALP染色 ×600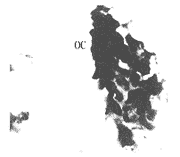
图3 骨陷窝处的破骨细胞(OC) ALP染色 ×1400
2.2 图像分析和统计结果
全自动图像分析仪定量测定分析各组新生骨组织酶活性,根据ALP和ACP染色深浅即图像的灰度(grey level)在镜下(×56倍)定强阳性和阳性阈值,以便在各自统一标准下进行比较(表1)。
各组不同时间的骨组织ALP和ACP活性见表2、3。
, http://www.100md.com
表1 ALP和ACP染色图像灰度分级的阈值 酶染色
强阳性
阳性
ALP
0~30
31~80
ACP
0~40
41~80
表2 各组不同时间骨组织的ALP活性 组别
时间(月)
强阳性(%) ±s
±s
, http://www.100md.com
阳性(%) ±s
±s
对照组
1
6.12±2.30
10.92±2.13
2
8.33±2.21
24.85±5.36
6
3.08±3.23
8.16±5.65
, http://www.100md.com
卵巢切除术
1
3.02±1.41*
9.47±5.19
2
3.53±1.72**
16.03±4.43*
6
1.33±0.39*
5.19±1.17*
糖尿病组
, http://www.100md.com
1
2.56±0.87**
5.33±1.22*
2
3.30±1.02**
6.78±1.29**
6
0.41±0.14**
1.18±0.83**
甲状腺组
1
, http://www.100md.com
1.43±0.40**
8.52±1.37
2
1.53±0.61**
3.16±0.78**
6
0.49±0.25**
0.70±0.32**
n=6, * 与对照组比较P<0.05,** 与对照组比较P<0.01
表3 各组不同时间骨组织的ACP活性 组别
, 百拇医药
时间(月)
强阳性(%) ±s
±s
阳性(%) ±s
±s
对照组
1
8.06±4.22
13.53±5.73
2
13.97±5.06
22.24±2.21
, 百拇医药
6
5.63±1.87
14.04±4.90
卵巢切除术
1
6.02±1.62
12.26±1.53
2
8.01±2.04*
12.47±4.01**
6
8.54±3.24
, http://www.100md.com
13.88±4.36
糖尿病组
1
6.88±6.39
8.44±5.23
2
0.96±0.40**
12.91±3.94**
6
4.09±1.65
13.98±10.25
甲状腺组
, 百拇医药
1
0.78±0.75**
13.36±7.65
2
0.17±0.06**
4.53±1.15**
6
4.08±3.07
23.03±14.30**
n=6, * 与对照组比较P<0.05,** 与对照组比较P<0.01
, 百拇医药
3 讨 论
本实验采用偶氮色素法进行ALP和ACP染色,利用特异的底物,被细胞的ALP或ACP水解,然后与捕获剂偶合,形成有色沉淀,来显示酶在组织中的定位。图像分析系统能客观、精细地用数字表达存在于标本图像上的各种信息。本研究将三种内分泌因素影响下新生牙槽骨的ALP和ACP改变,通过该系统将不规整的酶活性变化转化为量化信息,更客观地分析比较这些成分在细胞中的动态变化,进而阐明其功能。
在骨修复重建过程中,成骨细胞、破骨细胞和骨细胞的活动相互关联,一定条件下可相互转化。本实验观察到新骨形成处ALP强阳性反应的成骨细胞显著增加,ALP为成骨细胞的标记酶[7],主要位于细胞膜、粗面内质网和线粒体等处,可作用于有机磷酸复合物,使组织中局部磷酸根增多,导致钙盐沉积,参与骨基质形成和矿化,使骨小梁结构增粗。成骨活跃处,同时可见破骨细胞活动,破骨细胞的溶酶体、高尔基体和胞内空泡中含大量ACP,使骨基质的有机成分解聚,吞噬分解骨基质碎片,最终可将最初形成的不成熟的原始骨组织改建为成熟骨组织[8]。
, 百拇医药
牙槽骨吸收修复与全身健康状况及全身系统性疾病相关[9]。本实验结果显示,在人工二壁骨袋术后,ALP和ACP活性在1、2个月阶段较高,6个月后降低,和骨修复改建在1、2个月较活跃一致;提高甲状腺素水平组ALP与ACP活性普遍较对照组低,有统计学差别(P<0.01),骨质形成减少,其6个月组ACP阳性值较对照组高(P<0.01),可能系该组动物连续服甲状腺素6个月,甲亢症状严重,此时ACP活性强,表明骨吸收作用强,与组织学观察到的骨质形成少,局部被含大量破骨细胞的纤维结缔组织代替相吻合[10];而在诱发实验性糖尿病组和手术切除卵巢组,仅ALP降低有显著差异(P<0.05或P<0.01),而ACP仅2个月组有显著性降低,说明此时成骨作用较正常组明显减弱,骨形成减弱多,骨吸收减弱较少,造成骨修复成熟较慢。以上资料说明牙槽骨的修复重建是在全身因素的调控下,成骨细胞与破骨细胞协同作用的结果,也即ALP和ACP协同作用的结果。这些资料对评估牙槽骨的修复重建和吸收破坏机制具有理论和实用价值。■
, 百拇医药 基金项目:本课题为国家自然科学基金资助项目(编号 39370738)
参考文献:
[1]Ishihara Y, Hishihara T, Maki E, et al. Role of interleukin 1 and prostaglandin in vitro bone resorption induced by Actinobacillas actinomycetem-comitans lipopolysaccharide. J Periodont Res, 1991, 26(3):155~160
[2]Gowen M, Wood DD, Russell RG. Stimulation of the proliferation of human bone cells in vitro by human monocyte products with interleukin-1 like activity. J Clin Invest, 1985,75(10):1223
, 百拇医药
[3]史凤芹,于世凤.IL-2、TNF-2和PGE2对破骨细胞性骨吸收的作用.中华骨科杂志,1995,15(6):458~461
[4]Harrison R. Oral health, Salivary factors and metabolic control in insulin-dependent diabetic children. Pediatr Dent, 1986,8(2):177~181
[5]Tete A, Grano M, Colucci S, et al. Osteoblast-osteoclast relationship in bone resorption: osteoblasts enhance osteoclast activity in a serum-free co-culture system. Biochem Biophys Res Commun, 1991,179(5):634~640
, 百拇医药
[6]Cruber HE, Marshil GJ, Nolasw LM. Alkaline and acid phosphatase demonstration in human bone and cartilage effects of fixation interval and methacrylate embedments stain. Technology, 1988,63(3):299~302
[7]Wlodarski KH, Reddi AH. Alkaline phosphatase as a marker of osteoinductive cells. Calcif Tissue Int, 1986, 39(3):382~385
[8]Bonucci E. The organic-inorganic relationship in bone matrix undergoing osteoclastic resorption. Calcif Tissue Res, 1974,16(1):13~18
[9]Nishimura I, Damiani PJ, Atwood DA. Resorption of residual ridges (RRR) in rats. J Dent Res, 1987, 66(12):1753~1757
[10]李德懿,王丽珍,刘瑷如,等.全身因素影响狗骨缺损修复的组织学评价.临床口腔医学杂志,1998,14(1):3~5
收稿日期:1998-06-18
修稿日期:1999-06-28, 百拇医药
单位:李德懿(上海第二医科大学附属第九人民医院 200011);刘瑷如(上海第二医科大学附属第九人民医院 200011);叶军(上海第二医科大学附属第九人民医院 200011);汪铮(上海第二医科大学图像分析室);胡庆沈(上海第二医科大学图像分析室)
关键词:内分泌因素;牙槽骨修复;碱性磷酸酶;酸性磷酸酶;图像分析
华西口腔医学杂志000107 摘 要:目的:明确内分泌因素对牙槽骨修复过程中碱性磷酸酶(ALP)和酸性磷酸酶(ACP)活性的影响,并探讨牙槽骨吸收修复机制。方法:24只狗的牙槽骨二壁骨袋模型,随机分成4组,采用组织学检查、酶组织化学和全自动图像分析等技术定量分析去除卵巢、诱发实验性糖尿病及提高甲状腺素水平情况下,骨缺损修复过程中ALP和ACP活性变化。结果:甲状腺素组除6个月组ACP活性较高外,ALP与ACP活性均较对照组低,有统计学差异(P<0.01);糖尿病组和卵巢切除组仅ALP降低有统计学差异(P<0.05或P<0.01),酶的活性与骨形态结构变化相吻合。结论:牙槽骨修复受全身内分泌因素的调控,且与其破骨细胞和成骨细胞的酶活性密切相关。
, http://www.100md.com
Animal Experimental Study on Endocrine Factors Affecting Alveolar Repair
Li Deyi Liu Airu Ye Jun
(The Ninth Affiliated Renmin Hospital, Shanghai Second Medical University)
Wang Zheng Hu Qingshen
(Image Analysis Office, Shanghai Second Medical University)
Abstract:Objective:To investigate the endocrine effects on activities of alkaline phosphatase (ALP) and acid phosphatase (ACP) and to obtain the mechanism of the resorption and regeneration of the alveolar bone. Methods: 24 dog models with two-side osseous infrabony pocket were divided into 4 groups randomly and were studied by histologic examination, enzyme cytochemistry and image analysis system. Results: The activities of ALP and ACP, except ACP in the sixth month significantly decreased in the group of thyroidism comparing with that of the control group (P<0.01), but only the activities of ALP significantly decreased in groups of ovariectomy and diabetes (P<0.05, P<0.01), and there was close relationship between enzyme activities and histopathologic variations. Conclusion: Alveolar bone repair was regulated by systemic endocrine factors and was associated with the activities of ALP and ACP osteoblasts of and osteoclasts.
, 百拇医药
Key words:endocrine factor alveolar repair alkaline phosphatase (ALP) acid phosphatase (ACP) image analysis system▲
牙槽骨吸收是牙周病进展期的重要特性,目前对牙槽骨破坏修复的认识多数来自体外实验[1~3],而骨修复过程中全身因素对细胞中酶、细胞结构及功能的影响研究较少。本研究对狗二壁骨缺损的动物模型采用组织学观察、酶细胞化学和全自动图像分析等技术,定量分析去除卵巢、实验诱发性糖尿病及提高甲状腺素水平情况下,骨缺损修复过程中碱性磷酸酶(alkaline phosphatase, ALP)和酸性磷酸酶(acid phosphatase, ACP)活性的动态变化。
1 材料和方法
1.1 二壁骨缺损动物模型制备
, http://www.100md.com
成年杂种狗24只,体重8~12 kg,全麻下在上颌尖磨牙区牙间隙处,翻开全厚粘骨膜瓣,制备颊舌向2~2.5 mm、近远中向3~4 mm(以牙间隙长度为限)、深4~5 mm的二壁骨缺损,在远中牙面作刻痕标记深度。
1.2 实验分组和取材部位
24只狗在制备人工二壁骨袋后,根据实验要求随机分成4组,每组6只(除卵巢切除组为雌性外,其余组雌雄不定):①卵巢切除组:手术切除两侧卵巢;②糖尿病组:腹腔注射链脲佐菌素60 mg/kg[4];③甲状腺素组:每日喂服左旋甲状腺素100 μg 1~6月;④对照组:不作其它处理。各组于1、2、6月分别处死2只狗,用细锯和锐利的单面金钢钻刀片截取骨袋部位修复骨作组织学观察和酶组织化学研究。
1.3 碱性和酸性磷酸酶染色
1.3.1 固定和脱钙 将骨缺损修复部位宽约10 mm、长10 mm、厚1.5 mm的组织块,用4%多聚甲醛和0.1 mol/L二甲砷酸钠缓冲液(pH7.2)在4℃条件下固定3 h。然后用4%EDTA-2Na溶液(pH7.2)在4℃条件下脱钙10 d,每天换1次脱钙液,每天振荡3次,每次10 min。
, 百拇医药
1.3.2 冰冻切片染色 每个组织块在-18℃条件下连续切片6张,厚约5 μm,HE、ALP及ACP染色各为2张,采用偶氮色素法进行ALP和ACP染色[5,6],ALP呈紫色,ACP呈桔红色(试剂由上海虹桥医用试剂实验研究所生产)。
1.3.3 组织学观察和图像分析 分别于1、2、6个月进行组织学观察,使用OMSP-30型显微分光光度计(OPTON公司),各选6个视野,在摄像机上得到适当放大的图像,输入VIDAS多功能图像分析仪(德国ZEISS公司),将酶染色深浅程度(即图像的灰度)定阈分为强阳性和阳性2级,自动进行分级。测量出标本中不规整的酶染色面积,自动地转变为量化信息,算出百分比,用分组t检验分析结果。
2 结 果
2.1 镜下观察
各组1~6个月均有不同量新骨形成,新骨与旧骨间可见较明显的分界线,新生的骨小梁细小,常呈网络状,髓腔大,血管较丰富,小梁壁上有单层或双层栅栏状排列的成骨细胞(图1)。酶组织化学染色显示:旧骨部位ALP和ACP染色均弱,偶见ALP阳性的成骨细胞或ACP阳性的破骨细胞,在骨髓腔有时可见少量ALP或ACP反应颗粒;新生骨小梁边缘多见栅栏状排列的ALP阳性染色的成骨细胞(图2),骨陷窝内的破骨细胞体积大,ACP常呈强阳性、深红色染色斑块充满细胞,有时甚至掩盖核染色(图3);未分化细胞未见染色。

, 百拇医药
图1 新骨和旧骨交界处 HE ×140

图2 新生骨小梁壁上栅状排列的成骨细胞(OB)
ALP染色 ×600

图3 骨陷窝处的破骨细胞(OC) ALP染色 ×1400
2.2 图像分析和统计结果
全自动图像分析仪定量测定分析各组新生骨组织酶活性,根据ALP和ACP染色深浅即图像的灰度(grey level)在镜下(×56倍)定强阳性和阳性阈值,以便在各自统一标准下进行比较(表1)。
各组不同时间的骨组织ALP和ACP活性见表2、3。
, http://www.100md.com
表1 ALP和ACP染色图像灰度分级的阈值 酶染色
强阳性
阳性
ALP
0~30
31~80
ACP
0~40
41~80
表2 各组不同时间骨组织的ALP活性 组别
时间(月)
强阳性(%)
 ±s
±s, http://www.100md.com
阳性(%)
 ±s
±s对照组
1
6.12±2.30
10.92±2.13
2
8.33±2.21
24.85±5.36
6
3.08±3.23
8.16±5.65
, http://www.100md.com
卵巢切除术
1
3.02±1.41*
9.47±5.19
2
3.53±1.72**
16.03±4.43*
6
1.33±0.39*
5.19±1.17*
糖尿病组
, http://www.100md.com
1
2.56±0.87**
5.33±1.22*
2
3.30±1.02**
6.78±1.29**
6
0.41±0.14**
1.18±0.83**
甲状腺组
1
, http://www.100md.com
1.43±0.40**
8.52±1.37
2
1.53±0.61**
3.16±0.78**
6
0.49±0.25**
0.70±0.32**
n=6, * 与对照组比较P<0.05,** 与对照组比较P<0.01
表3 各组不同时间骨组织的ACP活性 组别
, 百拇医药
时间(月)
强阳性(%)
 ±s
±s阳性(%)
 ±s
±s对照组
1
8.06±4.22
13.53±5.73
2
13.97±5.06
22.24±2.21
, 百拇医药
6
5.63±1.87
14.04±4.90
卵巢切除术
1
6.02±1.62
12.26±1.53
2
8.01±2.04*
12.47±4.01**
6
8.54±3.24
, http://www.100md.com
13.88±4.36
糖尿病组
1
6.88±6.39
8.44±5.23
2
0.96±0.40**
12.91±3.94**
6
4.09±1.65
13.98±10.25
甲状腺组
, 百拇医药
1
0.78±0.75**
13.36±7.65
2
0.17±0.06**
4.53±1.15**
6
4.08±3.07
23.03±14.30**
n=6, * 与对照组比较P<0.05,** 与对照组比较P<0.01
, 百拇医药
3 讨 论
本实验采用偶氮色素法进行ALP和ACP染色,利用特异的底物,被细胞的ALP或ACP水解,然后与捕获剂偶合,形成有色沉淀,来显示酶在组织中的定位。图像分析系统能客观、精细地用数字表达存在于标本图像上的各种信息。本研究将三种内分泌因素影响下新生牙槽骨的ALP和ACP改变,通过该系统将不规整的酶活性变化转化为量化信息,更客观地分析比较这些成分在细胞中的动态变化,进而阐明其功能。
在骨修复重建过程中,成骨细胞、破骨细胞和骨细胞的活动相互关联,一定条件下可相互转化。本实验观察到新骨形成处ALP强阳性反应的成骨细胞显著增加,ALP为成骨细胞的标记酶[7],主要位于细胞膜、粗面内质网和线粒体等处,可作用于有机磷酸复合物,使组织中局部磷酸根增多,导致钙盐沉积,参与骨基质形成和矿化,使骨小梁结构增粗。成骨活跃处,同时可见破骨细胞活动,破骨细胞的溶酶体、高尔基体和胞内空泡中含大量ACP,使骨基质的有机成分解聚,吞噬分解骨基质碎片,最终可将最初形成的不成熟的原始骨组织改建为成熟骨组织[8]。
, 百拇医药
牙槽骨吸收修复与全身健康状况及全身系统性疾病相关[9]。本实验结果显示,在人工二壁骨袋术后,ALP和ACP活性在1、2个月阶段较高,6个月后降低,和骨修复改建在1、2个月较活跃一致;提高甲状腺素水平组ALP与ACP活性普遍较对照组低,有统计学差别(P<0.01),骨质形成减少,其6个月组ACP阳性值较对照组高(P<0.01),可能系该组动物连续服甲状腺素6个月,甲亢症状严重,此时ACP活性强,表明骨吸收作用强,与组织学观察到的骨质形成少,局部被含大量破骨细胞的纤维结缔组织代替相吻合[10];而在诱发实验性糖尿病组和手术切除卵巢组,仅ALP降低有显著差异(P<0.05或P<0.01),而ACP仅2个月组有显著性降低,说明此时成骨作用较正常组明显减弱,骨形成减弱多,骨吸收减弱较少,造成骨修复成熟较慢。以上资料说明牙槽骨的修复重建是在全身因素的调控下,成骨细胞与破骨细胞协同作用的结果,也即ALP和ACP协同作用的结果。这些资料对评估牙槽骨的修复重建和吸收破坏机制具有理论和实用价值。■
, 百拇医药 基金项目:本课题为国家自然科学基金资助项目(编号 39370738)
参考文献:
[1]Ishihara Y, Hishihara T, Maki E, et al. Role of interleukin 1 and prostaglandin in vitro bone resorption induced by Actinobacillas actinomycetem-comitans lipopolysaccharide. J Periodont Res, 1991, 26(3):155~160
[2]Gowen M, Wood DD, Russell RG. Stimulation of the proliferation of human bone cells in vitro by human monocyte products with interleukin-1 like activity. J Clin Invest, 1985,75(10):1223
, 百拇医药
[3]史凤芹,于世凤.IL-2、TNF-2和PGE2对破骨细胞性骨吸收的作用.中华骨科杂志,1995,15(6):458~461
[4]Harrison R. Oral health, Salivary factors and metabolic control in insulin-dependent diabetic children. Pediatr Dent, 1986,8(2):177~181
[5]Tete A, Grano M, Colucci S, et al. Osteoblast-osteoclast relationship in bone resorption: osteoblasts enhance osteoclast activity in a serum-free co-culture system. Biochem Biophys Res Commun, 1991,179(5):634~640
, 百拇医药
[6]Cruber HE, Marshil GJ, Nolasw LM. Alkaline and acid phosphatase demonstration in human bone and cartilage effects of fixation interval and methacrylate embedments stain. Technology, 1988,63(3):299~302
[7]Wlodarski KH, Reddi AH. Alkaline phosphatase as a marker of osteoinductive cells. Calcif Tissue Int, 1986, 39(3):382~385
[8]Bonucci E. The organic-inorganic relationship in bone matrix undergoing osteoclastic resorption. Calcif Tissue Res, 1974,16(1):13~18
[9]Nishimura I, Damiani PJ, Atwood DA. Resorption of residual ridges (RRR) in rats. J Dent Res, 1987, 66(12):1753~1757
[10]李德懿,王丽珍,刘瑷如,等.全身因素影响狗骨缺损修复的组织学评价.临床口腔医学杂志,1998,14(1):3~5
收稿日期:1998-06-18
修稿日期:1999-06-28, 百拇医药