卵巢癌患者γδT细胞对肿瘤细胞的细胞毒活性
作者:牛海涛 张素梅 何维
单位:牛海涛 张素梅 何维(中国医学科学院基础医学研究所中国协和医科大学基础医学院免疫室 北京 100005)
关键词:γδT细胞;细胞毒活性;卵巢癌
中国肿瘤生物治疗杂志000204
摘 要 目的: 研究从卵巢上皮性癌(OEC)患者肿瘤浸润淋巴细胞(TIL)、肿瘤相关淋巴细胞(TAL)及外周血淋巴细胞中分离扩增的γδT细胞对同种异体和自体肿瘤细胞的体外细胞毒作用,同时对αβT细胞的细胞毒活性也作了比较。方法: 用抗体固相法扩增γδ/αβTIL,γδ/αβTAL及外周血γδ/αβT细胞;用密度梯度离心法或组织块培养法扩增原代OEC细胞,并进行鉴定;用MTT法测定γδ/αβTIL,γδ/αβTAL及外周血γδ/αβT细胞对同种异体/自体OEC细胞的细胞毒活性。结果: 体外扩增出的γδ/αβTIL,γδ/αβTAL及外周血γδ/αβT细胞对同种异体/自体OEC细胞均具有较强且水平相近的细胞毒活性;扩增到70%细胞纯度所需时间为:外周血γδT细胞(14 d),γδTAL(21 d)和γδTIL(28 d)。结论: γδTAL有望成为OEC过继细胞治疗的简便获得而有效的候选细胞。
, 百拇医药
《中国图书资料分类法》分类号 R739.8
Cytostasis of γδT Cell Lines Expanded from Patients with Ovarian Epithelial Carcinoma to Tumor Cell Lines in vitro
Niu Haitao Zhang Sumei He Wei
(Department of Immunology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & School of Basic Medicine, Peking Union Medical College, Beijing 100005)
Abstract Objective: To investigate the cytostasis of γδT cell lines expanded from tumor-infiltrating lymphocytes (TIL), tumor-associated lymphocytes (TAL) and blood of ovarian epithelial carcinoma (OEC) patients to autologous/allogeneic tumor cell lines in comparison to αβT cells. Methods: γδ/αβTIL, γδ/αβTAL and blood γδ/αβT cell expanded by immobilized antibodies against TCRγδ and CD3 respectively, whose cytostasis to new established autologous/allogeneic tumor cell lines was detected by MTT method. Meanwhile, several autologous OEC cell lines were established and identified by specific antibody staining. Results: Expanded γδ/αβTIL, γδ/αβTAL and blood γδ/αβT cells were demonstrated marked cytostasis to autologous/allogeneic tumor cell lines at similar level. Time required for obtaining effector cells with highly purification (70%) was shortest at blood γδT cells for 14 days and longest at γδTIL for 28 days, while γδTAL needed for 21days. Conclusion: γδTAL might be a most appropriate candidate for cellular adoptive therapy of OEC with convenience.
, 百拇医药
Key words γδT cell; cytostasis; ovarian epithelial carcinoma
卵巢上皮性癌(OEC)是妇科常见且致死率最高的恶性肿瘤[1],现主要采用手术切除或联合化疗的方法治疗,但复发率较高[2]。近年来,免疫细胞过继疗法在OEC的治疗中产生了一定的疗效。所采用的效应细胞为OEC患者的肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TIL)和腹水中得到的肿瘤相关淋巴细胞(tumor-associated lymphocytes,TAL)[3~5]。我们先前的研究显示了γδT细胞对同种异体肿瘤细胞有良好的体内外细胞毒活性[6]。本研究从OEC患者的TIL,TAL及外周血中分离扩增出γδT淋巴细胞,并对其体外细胞毒作用进行了研究,以期为γδT细胞过继治疗OEC的最终应用奠定实验基础和提供理论指导。
, http://www.100md.com
1 材料与方法
1.1 标本来源
OEC患者11例腹水、3例实体瘤和3例外周血分别来自北京协和医院和同仁医院妇产科。病人术前未经放、化疗。实体瘤为手术无菌采集10 g左右,取材部位位于肿瘤原发灶;腹水为病房无菌采集约500 ml;外周血为术后采集5 ml。
1.2 细胞株
OEC细胞系SKOV3,协和医院沈铿教授惠赠;人Burkitt's淋巴瘤细胞系Daudi为本室自存。
1.3 主要实验试剂
淋巴细胞分离液购自上海试剂二厂;rIL-2由军科院中化生物技术所张明伟教授惠赠;抗CD3抗体购自邦定公司;抗TCR-γδ单抗和荧光标记单抗(抗TCR-αβPE和抗TCRγδ-FITC)购自法国Immunotech公司;四甲基偶氮唑蓝(MTT)、胰酶购自Sigma公司;完全培养基Ⅰ:含10%脐血清、20%PBMC活化上清液,RPMI 1640干粉,100 U/ml青链霉素,10 mmol/L Hepes,2 mmol/L L-谷氨酰胺,0.01 mmol/L丙酮酸钠,5×10-5 mol/L 2-巯基乙醇(RPMI 1640干粉购自GIBCO-BRL公司,脐血清取自北京市妇产医院);完全培养基Ⅱ:含15%小牛血清的RPMI 1640培养基(小牛血清购自华西BIOLOGY研究所);单抗OM-1由协和医院陈杰教授惠赠;单抗AE1/AE3,Envision+TM试剂盒购自美国DAKO公司。
, 百拇医药
1.4 γδT细胞和αβT细胞的分离与体外扩增建系
1.4.1 γδTIL和αβTIL的分离与体外扩增建系
采用抗体固相法分离和扩增γδTIL及αβTIL,其方法见文献[7]。
1.4.2 γδTAL和αβTAL、外周血γδT细胞和αβT细胞的分离与体外扩增建系
OEC患者腹水100 ml、外周血5 ml,以淋巴细胞分离液行密度梯度离心分离单个核细胞。体外扩增建系方法见文献[6,7]。
1.5 原代OEC细胞的分离与体外扩增建系
1.5.1 腹水肿瘤细胞的分离与扩增
取腹水400 ml行密度梯度离心同上,时间延长5 min,吸取界面细胞层(单个核细胞和癌细胞混合液)以PBS洗涤3次,于塑料培养瓶以完全培养基Ⅱ培养;24 h后弃含单个核细胞的上清,并用RPMI 1640培养基轻洗1次后补液,3~4 d后换液,待细胞铺满瓶底才可分瓶。
, 百拇医药
1.5.2 实体瘤癌细胞的分离与扩增
OEC患者术后新鲜肿瘤组织处理同文献[7],然后,将组织块分散均匀加到预涂纯小牛血清的塑料培养瓶中,倒置于CO2孵箱;待组织块牢固贴于瓶壁(3 h左右)后加入完全培养基Ⅱ正置,培养基覆盖组织块即可。5~7 d后换液,待细胞铺满瓶底才可分瓶,同时以反复贴壁法去除成纤维细胞[8]。
1.6 免疫细胞化学法鉴定肿瘤细胞
接种经3次传代的肿瘤细胞于内置载玻片的培养皿,过夜培养后,采用DAKO公司Envision+TM试剂盒进行免疫细胞化学染色,一抗为OM-1或AE1/AE3。以患者自身病理切片为阳性对照,以不加抗体为阴性对照。OM-1抗体用于识别卵巢浆液性乳头状囊腺癌,AE1/AE3抗体用于识别上皮性肿瘤。
1.7 扩增的γδT细胞及αβT细胞的纯度鉴定
, http://www.100md.com
于培养第10,14,21,24和28天分别收集细胞约106个,所获细胞群体纯度分析采用免疫荧光染色和流式细胞仪分析,具体方法及流程见文献[6,7]。
1.8 细胞毒活性测定
采用MTT法检测扩增的T细胞对肿瘤细胞的杀伤活性。其效应细胞为:① γδTIL,γδTAL和外周血γδT细胞,② αβTIL,αβTAL和外周血αβT细胞;靶细胞为:新建系同种异体/自体OEC细胞、已建系OEC细胞系SKOV3和淋巴瘤细胞系Daudi。效靶比为10∶1,20∶1和40∶1。具体操作流程及结果计算见参考文献[6]。
1.9 数据处理
采用方差分析进行显著性检验。
2 结 果
, 百拇医药 2.1 体外扩增的γδT细胞纯度分析
通过体外抗体固相法,可获得高纯度的γδT细胞。如表1所示,在1~2周内开始扩增,3~4周达到对数生长,其纯度随时间逐渐上升。根据来源不同,γδT细胞扩增纯度达到70%的时间为:外周血γδT细胞需14 d左右,γδTAL需21 d左右,γδTIL需28 d左右。
表1 体外扩增的γδT细胞系的纯度分析
Tab.1 Analysis of purification in expanded γδT cell lines in vitro Days of
culture
Percentage of
blood γδT cells(%)
, 百拇医药
Percentage of
γδTAL(%)
Percentage of
γδTIL(%)
10
50±13
27±7
ND
14
71±4
55±9
ND
21
, http://www.100md.com
86±2
74±5
52±11
24
ND
77±4
62±4
28
ND
87±8
80±4
n: eleven samples of TAL, three ones of peripheral blood and three ones of TIL. ND: not determined
, 百拇医药
2.2 体外扩增的αβT细胞纯度分析
通过体外抗体固相法获得的αβT细胞,在1周后开始扩增,2~3周达到对数生长;αβT细胞纯度随时间逐渐上升,在14 d左右即达到70%以上。
2.3 新建系OEC细胞鉴定
2.3.1 显微镜观察
培养的细胞贴壁生长,具有肿瘤细胞特有的多形性、重叠生长和大小异型性。
2.3.2 免疫细胞化学法鉴定
如图1所示,扩增的肿瘤细胞经OM-1和AE1/AE3染色后呈棕黄色。以患者自身病理切片染色结果为阳性对照,阳性呈棕黄色,证实所扩增的细胞为卵巢来源的上皮性肿瘤细胞。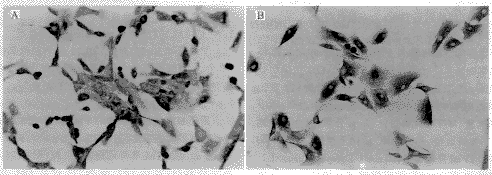
, http://www.100md.com
图1 免疫细胞化学法鉴定新建系OEC细胞
Fig.1 Analysis of new established OEC cell lines with immunohistochemical method
A: Stained with OM-1 antibody; B: Stained with AE1/AE3 antibody
2.4 γδTIL,γδTAL和外周血γδT细胞对同种异体/自体肿瘤细胞的细胞毒作用
2.4.1 γδTIL的细胞毒作用
如表2所示,γδTIL表现出显著的杀瘤活性,其对3种OEC细胞系的细胞毒作用基本处于同一水平(P>0.05);但在效靶比为40∶1时,其细胞毒强度次序为SKOV3细胞>新建系的同种异体OEC细胞(P<0.05)。
, 百拇医药
表2 3种γδT细胞对Daudi、同种异体/自体OEC
细胞的细胞毒作用
Tab.2 The cytostasis of three kinds of γδT cell lines to
Daudi,SKOV3 and new established allogeneic (Allo)/autologous
(Auto) OEC cell lines Effector cell
E∶T
SKOV3
Allo
Auto
, http://www.100md.com
Daudi
γδTIL
10∶1
78±1
78±12
80±5
20∶1
85±4
83±12
80±6
40∶1
93±7
86±11
, 百拇医药
88±9
γδTAL
10∶1
84±8
86±9
75±6
94±3
20∶1
90±6
88±10
78±7
96±4
40∶1
, http://www.100md.com
94±6
93±6
83±6
Blood γδT cell
10∶1
75±12
85±9
73±8
20∶1
84±16
88±10
82±7
40∶1
, http://www.100md.com
89±10
90±9
89±10
Data are expressed as the mean percentages cytostasis(%)±SD(%)
2.4.2 γδTAL的细胞毒作用
如表2所示,γδTAL亦显示了明显的肿瘤杀伤效应,其杀瘤强度次序为:对Daudi细胞杀伤活性最强,其次是对同种异体OEC细胞的细胞毒活性,而对新建系的自体OEC细胞的细胞毒活性相对较低(P<0.05)。
2.4.3 外周血γδT细胞的细胞毒作用
如表2所示,外周血γδT细胞显示了显著的肿瘤细胞毒作用,在效靶比为10∶1时,其细胞毒强度次序为:新建系同种异体OEC细胞>SKOV3/自体OEC细胞(P<0.05);而在效靶比为20∶1或40∶1时,上述作用在同一水平。
, http://www.100md.com
2.5 不同效应细胞对同一肿瘤细胞的细胞毒作用比较
2.5.1 对SKOV3细胞的细胞毒作用
如表3所示,效应细胞对靶细胞杀伤作用的强度顺序表现为,在效靶比为10∶1时,γδTAL>αβTAL(P<0.05);在效靶比20∶1时,γδT细胞均大于相应的αβT细胞(P<0.05),αβTAL>αβTIL/外周血αβT细胞(P<0.05);在效靶比40∶1时,γδTIL>αβTIL,外周血γδT细胞>外周血αβT细胞(P<0.05)。
2.5.2 对新建系同种异体/自体OEC细胞和Daudi的细胞毒作用
如表3所示,所有效应细胞杀伤活性处于同一水平(P>0.05)。表3 6种效应细胞对Daudi、同种异体/自体
OEC细胞的细胞毒作用
, 百拇医药
Tab.3 Cytostasis of six kinds of effector cell lines to
Daudi,SKOV3 and new established allogeneic(Allo)/
autologous(Auto) OEC cell lines E∶T
Effector cell
SKOV3
Allo
Auto
Daudi
10∶1
γδTIL
, 百拇医药
78±1
78±12
80±5
αβTIL
72±1
81±10
81±4
γδTAL
84±8
86±9
75±6
94±3
αβTAL
, 百拇医药
75±7
82±9
76±7
95±4
Blood γδ T cell
75±12
85±9
73±8
Blood αβT cell
68±11
86±12
76±4
, 百拇医药 20∶1
γδTIL
85±4
83±12
80±6
αβTIL
73±5
82±6
86±1
γδTAL
90±6
88±10
78±7
, http://www.100md.com
96±4
αβTAL
82±10
84±10
78±7
99±0.5
Blood γδT cell
84±16
88±10
82±7
Blood αβT cell
70±8
, 百拇医药
85±12
82±4
40∶1
γδTIL
93±7
86±11
88±9
αβTIL
83±5
92±7
87±2
γδTAL
94±6
, 百拇医药
93±6
83±6
αβTAL
89±10
90±8
91±8
Blood γδT cell
89±10
90±9
89±10
Blood αβT cell
82±11
, http://www.100md.com
92±6
89±10
Data are expressed as the mean percentages cytostasis(%)±SD(%)
3 讨 论
本研究检测了6种效应细胞对4种靶细胞的细胞毒作用,观察到多种来源的γδT细胞与对应的αβT细胞对Daudi细胞、新建系同种异体/自体OEC细胞的抗肿瘤活性基本处于同一水平;但对SKOV3的细胞毒作用,γδT细胞均强于相应的αβT细胞。上述情况表明,本实验体系所采用的抗TCRγδ和抗CD3抗体分别诱导γδT细胞和αβT细胞发生了充分活化,使其对各种肿瘤细胞产生了作用强度基本一致的细胞毒效应。在其中,我们并没有观察到αβT细胞对自体OEC细胞的特异性杀伤作用,提示抗体诱导性αβT细胞活化是多克隆的,具有LAK细胞的作用特点。文献报道,自体肿瘤特异性αβT细胞的体外诱导建立一般需要放射性处理的自体肿瘤细胞的反复刺激[9],而在我们的实验体系中无上述处理,所获得的αβT细胞系实质上为抗CD3抗体激活的杀伤细胞(CD3AK)。CD3AK可显示类似但强于LAK细胞的杀瘤活性[10]。抗TCRγδ抗体活化的γδT细胞也表现了类似于CD3AK的杀瘤活性,具有多克隆活化和高细胞毒活性的特点,并且对自体OEC细胞并无特异性。
, 百拇医药
不同来源的γδT细胞抗肿瘤作用强度基本相同,但同一来源的γδT细胞对于不同的肿瘤细胞,其敏感程度不同,如γδTAL对Daudi细胞的细胞毒作用最强,其次是对同种异体OEC细胞,而对自体OEC细胞的细胞毒作用最弱。因为Daudi细胞是γδT细胞杀伤的敏感细胞,因此不难理解γδTAL对其高杀伤活性。至于γδTAL在杀伤同种异体和自体OEC细胞方面的差异机制有待于进一步探究。
就γδT细胞体外扩增到一定纯度所需的时间而言,外周血γδT细胞所需时间最短,γδTAL次之,而γδTIL所需时间最长。外周血γδT细胞来源于单个核细胞,淋巴细胞比例高,故扩增时间短;而分离的TAL中含部分肿瘤细胞,其在培养过程中有可能阻断了部分TAL与抗TCRγδ抗体接触或通过细胞-细胞间作用及分泌免疫抑制因子等来抑制淋巴细胞的生长;γδTIL扩增所需时间最长的原因一方面与γδTAL相同,另一方面可能在于经机械剪碎后,TIL有相当部分的丢失,导致其淋巴细胞比例降低。
本研究的特色为:在体外利用固相抗体法扩增出OEC患者3种来源的γδT细胞和αβT细胞,并分离培养了自体OEC细胞。在此基础上测定了所获的效应细胞对同种异体/自体OEC细胞的体外细胞毒活性。与此类似的研究尚未见文献报道。我们的结果为OEC过继细胞治疗奠定了实验基础并提供了重要的资料。
, 百拇医药
综上所述,γδTIL,γδTAL和外周血γδT细胞对于OEC细胞均有显著的杀伤活性。鉴于其肿瘤杀伤活性基本相仿,而OEC患者常伴有腹水,因此,在作用有效的前提下,腹水来源的γδTAL也许能成为γδT细胞过继治疗OEC的更为简便获得的候选效应细胞。
本研究受国家重点基础研究发展计划规划项目(G1998051200)子课题和国家九五攻关项目(96-920-06-05)子专题(96-920-06-05-26)的资助
牛海涛,男,30岁,免疫学硕士研究生,从事γδT细胞抗肿瘤机制的研究
参 考 文 献
1,Boring CC, Squires TS, Tong T. Cancer statistics, 1992. CA, 1992, 42: 19
, http://www.100md.com 2,连利娟, 林巧稚. 妇科肿瘤学. 北京: 人民卫生出版社, 1994. 489
3,李金锋, 郭静文, 林本耀, 等. 卵巢癌腹水的过继性免疫治疗. 综合临床医学, 1997, 13(6): 546
4,Aoki Y, Takakuwa K, Kodama S, et al. Use of adoptive transfer of tumor-infiltrating lymphocytes alone or in combination with cisplatin-containing chemotherapy in patients with epithlial ovarian cancer. Cancer Res, 1991, 51: 1934
5,Bookman MA, Bast RC. The immunobiology and immunotherapy of ovarian cancer. Semin Oncol, 1991, 18(3): 270
, 百拇医药
6,Songtao Y, Wei H, Juan C, et al. Expansion and immunological study of human tumor infiltrating gamma/delta T lymphocytes in vitro. Int Arch Allergy Immunol, 1999, 119: 31
7,于松涛, 张 芳, 何 维. 抗体固相法体外扩增人肿瘤浸润γδT淋巴细胞. 免疫学杂志, 1997, 13: 260
8,司徒镇强, 吴军正. 细胞培养. 西安: 世界图书出版公司, 1996. 202
9,Chaperot L, Delfau-Larue MH, Jacob MC, et al. Differentiation of antitumor-specific cytotoxic T lymphocytes from autologous tumor infiltrating lymphocytes in non-Hodgkin's lymphomas. Exp Hematol, 1999, 27: 1185
10,Ting CC, Hargrove ME, Henrich P. Anti-CD3 antibody-induced activated killer cells subsets of killer cells that mediate fast or slow lytic reactions. Immunol Invest, 1990, 19: 347
(1999-10-20收稿; 1999-12-18修回), http://www.100md.com
单位:牛海涛 张素梅 何维(中国医学科学院基础医学研究所中国协和医科大学基础医学院免疫室 北京 100005)
关键词:γδT细胞;细胞毒活性;卵巢癌
中国肿瘤生物治疗杂志000204
摘 要 目的: 研究从卵巢上皮性癌(OEC)患者肿瘤浸润淋巴细胞(TIL)、肿瘤相关淋巴细胞(TAL)及外周血淋巴细胞中分离扩增的γδT细胞对同种异体和自体肿瘤细胞的体外细胞毒作用,同时对αβT细胞的细胞毒活性也作了比较。方法: 用抗体固相法扩增γδ/αβTIL,γδ/αβTAL及外周血γδ/αβT细胞;用密度梯度离心法或组织块培养法扩增原代OEC细胞,并进行鉴定;用MTT法测定γδ/αβTIL,γδ/αβTAL及外周血γδ/αβT细胞对同种异体/自体OEC细胞的细胞毒活性。结果: 体外扩增出的γδ/αβTIL,γδ/αβTAL及外周血γδ/αβT细胞对同种异体/自体OEC细胞均具有较强且水平相近的细胞毒活性;扩增到70%细胞纯度所需时间为:外周血γδT细胞(14 d),γδTAL(21 d)和γδTIL(28 d)。结论: γδTAL有望成为OEC过继细胞治疗的简便获得而有效的候选细胞。
, 百拇医药
《中国图书资料分类法》分类号 R739.8
Cytostasis of γδT Cell Lines Expanded from Patients with Ovarian Epithelial Carcinoma to Tumor Cell Lines in vitro
Niu Haitao Zhang Sumei He Wei
(Department of Immunology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences & School of Basic Medicine, Peking Union Medical College, Beijing 100005)
Abstract Objective: To investigate the cytostasis of γδT cell lines expanded from tumor-infiltrating lymphocytes (TIL), tumor-associated lymphocytes (TAL) and blood of ovarian epithelial carcinoma (OEC) patients to autologous/allogeneic tumor cell lines in comparison to αβT cells. Methods: γδ/αβTIL, γδ/αβTAL and blood γδ/αβT cell expanded by immobilized antibodies against TCRγδ and CD3 respectively, whose cytostasis to new established autologous/allogeneic tumor cell lines was detected by MTT method. Meanwhile, several autologous OEC cell lines were established and identified by specific antibody staining. Results: Expanded γδ/αβTIL, γδ/αβTAL and blood γδ/αβT cells were demonstrated marked cytostasis to autologous/allogeneic tumor cell lines at similar level. Time required for obtaining effector cells with highly purification (70%) was shortest at blood γδT cells for 14 days and longest at γδTIL for 28 days, while γδTAL needed for 21days. Conclusion: γδTAL might be a most appropriate candidate for cellular adoptive therapy of OEC with convenience.
, 百拇医药
Key words γδT cell; cytostasis; ovarian epithelial carcinoma
卵巢上皮性癌(OEC)是妇科常见且致死率最高的恶性肿瘤[1],现主要采用手术切除或联合化疗的方法治疗,但复发率较高[2]。近年来,免疫细胞过继疗法在OEC的治疗中产生了一定的疗效。所采用的效应细胞为OEC患者的肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TIL)和腹水中得到的肿瘤相关淋巴细胞(tumor-associated lymphocytes,TAL)[3~5]。我们先前的研究显示了γδT细胞对同种异体肿瘤细胞有良好的体内外细胞毒活性[6]。本研究从OEC患者的TIL,TAL及外周血中分离扩增出γδT淋巴细胞,并对其体外细胞毒作用进行了研究,以期为γδT细胞过继治疗OEC的最终应用奠定实验基础和提供理论指导。
, http://www.100md.com
1 材料与方法
1.1 标本来源
OEC患者11例腹水、3例实体瘤和3例外周血分别来自北京协和医院和同仁医院妇产科。病人术前未经放、化疗。实体瘤为手术无菌采集10 g左右,取材部位位于肿瘤原发灶;腹水为病房无菌采集约500 ml;外周血为术后采集5 ml。
1.2 细胞株
OEC细胞系SKOV3,协和医院沈铿教授惠赠;人Burkitt's淋巴瘤细胞系Daudi为本室自存。
1.3 主要实验试剂
淋巴细胞分离液购自上海试剂二厂;rIL-2由军科院中化生物技术所张明伟教授惠赠;抗CD3抗体购自邦定公司;抗TCR-γδ单抗和荧光标记单抗(抗TCR-αβPE和抗TCRγδ-FITC)购自法国Immunotech公司;四甲基偶氮唑蓝(MTT)、胰酶购自Sigma公司;完全培养基Ⅰ:含10%脐血清、20%PBMC活化上清液,RPMI 1640干粉,100 U/ml青链霉素,10 mmol/L Hepes,2 mmol/L L-谷氨酰胺,0.01 mmol/L丙酮酸钠,5×10-5 mol/L 2-巯基乙醇(RPMI 1640干粉购自GIBCO-BRL公司,脐血清取自北京市妇产医院);完全培养基Ⅱ:含15%小牛血清的RPMI 1640培养基(小牛血清购自华西BIOLOGY研究所);单抗OM-1由协和医院陈杰教授惠赠;单抗AE1/AE3,Envision+TM试剂盒购自美国DAKO公司。
, 百拇医药
1.4 γδT细胞和αβT细胞的分离与体外扩增建系
1.4.1 γδTIL和αβTIL的分离与体外扩增建系
采用抗体固相法分离和扩增γδTIL及αβTIL,其方法见文献[7]。
1.4.2 γδTAL和αβTAL、外周血γδT细胞和αβT细胞的分离与体外扩增建系
OEC患者腹水100 ml、外周血5 ml,以淋巴细胞分离液行密度梯度离心分离单个核细胞。体外扩增建系方法见文献[6,7]。
1.5 原代OEC细胞的分离与体外扩增建系
1.5.1 腹水肿瘤细胞的分离与扩增
取腹水400 ml行密度梯度离心同上,时间延长5 min,吸取界面细胞层(单个核细胞和癌细胞混合液)以PBS洗涤3次,于塑料培养瓶以完全培养基Ⅱ培养;24 h后弃含单个核细胞的上清,并用RPMI 1640培养基轻洗1次后补液,3~4 d后换液,待细胞铺满瓶底才可分瓶。
, 百拇医药
1.5.2 实体瘤癌细胞的分离与扩增
OEC患者术后新鲜肿瘤组织处理同文献[7],然后,将组织块分散均匀加到预涂纯小牛血清的塑料培养瓶中,倒置于CO2孵箱;待组织块牢固贴于瓶壁(3 h左右)后加入完全培养基Ⅱ正置,培养基覆盖组织块即可。5~7 d后换液,待细胞铺满瓶底才可分瓶,同时以反复贴壁法去除成纤维细胞[8]。
1.6 免疫细胞化学法鉴定肿瘤细胞
接种经3次传代的肿瘤细胞于内置载玻片的培养皿,过夜培养后,采用DAKO公司Envision+TM试剂盒进行免疫细胞化学染色,一抗为OM-1或AE1/AE3。以患者自身病理切片为阳性对照,以不加抗体为阴性对照。OM-1抗体用于识别卵巢浆液性乳头状囊腺癌,AE1/AE3抗体用于识别上皮性肿瘤。
1.7 扩增的γδT细胞及αβT细胞的纯度鉴定
, http://www.100md.com
于培养第10,14,21,24和28天分别收集细胞约106个,所获细胞群体纯度分析采用免疫荧光染色和流式细胞仪分析,具体方法及流程见文献[6,7]。
1.8 细胞毒活性测定
采用MTT法检测扩增的T细胞对肿瘤细胞的杀伤活性。其效应细胞为:① γδTIL,γδTAL和外周血γδT细胞,② αβTIL,αβTAL和外周血αβT细胞;靶细胞为:新建系同种异体/自体OEC细胞、已建系OEC细胞系SKOV3和淋巴瘤细胞系Daudi。效靶比为10∶1,20∶1和40∶1。具体操作流程及结果计算见参考文献[6]。
1.9 数据处理
采用方差分析进行显著性检验。
2 结 果
, 百拇医药 2.1 体外扩增的γδT细胞纯度分析
通过体外抗体固相法,可获得高纯度的γδT细胞。如表1所示,在1~2周内开始扩增,3~4周达到对数生长,其纯度随时间逐渐上升。根据来源不同,γδT细胞扩增纯度达到70%的时间为:外周血γδT细胞需14 d左右,γδTAL需21 d左右,γδTIL需28 d左右。
表1 体外扩增的γδT细胞系的纯度分析
Tab.1 Analysis of purification in expanded γδT cell lines in vitro Days of
culture
Percentage of
blood γδT cells(%)
, 百拇医药
Percentage of
γδTAL(%)
Percentage of
γδTIL(%)
10
50±13
27±7
ND
14
71±4
55±9
ND
21
, http://www.100md.com
86±2
74±5
52±11
24
ND
77±4
62±4
28
ND
87±8
80±4
n: eleven samples of TAL, three ones of peripheral blood and three ones of TIL. ND: not determined
, 百拇医药
2.2 体外扩增的αβT细胞纯度分析
通过体外抗体固相法获得的αβT细胞,在1周后开始扩增,2~3周达到对数生长;αβT细胞纯度随时间逐渐上升,在14 d左右即达到70%以上。
2.3 新建系OEC细胞鉴定
2.3.1 显微镜观察
培养的细胞贴壁生长,具有肿瘤细胞特有的多形性、重叠生长和大小异型性。
2.3.2 免疫细胞化学法鉴定
如图1所示,扩增的肿瘤细胞经OM-1和AE1/AE3染色后呈棕黄色。以患者自身病理切片染色结果为阳性对照,阳性呈棕黄色,证实所扩增的细胞为卵巢来源的上皮性肿瘤细胞。

, http://www.100md.com
图1 免疫细胞化学法鉴定新建系OEC细胞
Fig.1 Analysis of new established OEC cell lines with immunohistochemical method
A: Stained with OM-1 antibody; B: Stained with AE1/AE3 antibody
2.4 γδTIL,γδTAL和外周血γδT细胞对同种异体/自体肿瘤细胞的细胞毒作用
2.4.1 γδTIL的细胞毒作用
如表2所示,γδTIL表现出显著的杀瘤活性,其对3种OEC细胞系的细胞毒作用基本处于同一水平(P>0.05);但在效靶比为40∶1时,其细胞毒强度次序为SKOV3细胞>新建系的同种异体OEC细胞(P<0.05)。
, 百拇医药
表2 3种γδT细胞对Daudi、同种异体/自体OEC
细胞的细胞毒作用
Tab.2 The cytostasis of three kinds of γδT cell lines to
Daudi,SKOV3 and new established allogeneic (Allo)/autologous
(Auto) OEC cell lines Effector cell
E∶T
SKOV3
Allo
Auto
, http://www.100md.com
Daudi
γδTIL
10∶1
78±1
78±12
80±5
20∶1
85±4
83±12
80±6
40∶1
93±7
86±11
, 百拇医药
88±9
γδTAL
10∶1
84±8
86±9
75±6
94±3
20∶1
90±6
88±10
78±7
96±4
40∶1
, http://www.100md.com
94±6
93±6
83±6
Blood γδT cell
10∶1
75±12
85±9
73±8
20∶1
84±16
88±10
82±7
40∶1
, http://www.100md.com
89±10
90±9
89±10
Data are expressed as the mean percentages cytostasis(%)±SD(%)
2.4.2 γδTAL的细胞毒作用
如表2所示,γδTAL亦显示了明显的肿瘤杀伤效应,其杀瘤强度次序为:对Daudi细胞杀伤活性最强,其次是对同种异体OEC细胞的细胞毒活性,而对新建系的自体OEC细胞的细胞毒活性相对较低(P<0.05)。
2.4.3 外周血γδT细胞的细胞毒作用
如表2所示,外周血γδT细胞显示了显著的肿瘤细胞毒作用,在效靶比为10∶1时,其细胞毒强度次序为:新建系同种异体OEC细胞>SKOV3/自体OEC细胞(P<0.05);而在效靶比为20∶1或40∶1时,上述作用在同一水平。
, http://www.100md.com
2.5 不同效应细胞对同一肿瘤细胞的细胞毒作用比较
2.5.1 对SKOV3细胞的细胞毒作用
如表3所示,效应细胞对靶细胞杀伤作用的强度顺序表现为,在效靶比为10∶1时,γδTAL>αβTAL(P<0.05);在效靶比20∶1时,γδT细胞均大于相应的αβT细胞(P<0.05),αβTAL>αβTIL/外周血αβT细胞(P<0.05);在效靶比40∶1时,γδTIL>αβTIL,外周血γδT细胞>外周血αβT细胞(P<0.05)。
2.5.2 对新建系同种异体/自体OEC细胞和Daudi的细胞毒作用
如表3所示,所有效应细胞杀伤活性处于同一水平(P>0.05)。表3 6种效应细胞对Daudi、同种异体/自体
OEC细胞的细胞毒作用
, 百拇医药
Tab.3 Cytostasis of six kinds of effector cell lines to
Daudi,SKOV3 and new established allogeneic(Allo)/
autologous(Auto) OEC cell lines E∶T
Effector cell
SKOV3
Allo
Auto
Daudi
10∶1
γδTIL
, 百拇医药
78±1
78±12
80±5
αβTIL
72±1
81±10
81±4
γδTAL
84±8
86±9
75±6
94±3
αβTAL
, 百拇医药
75±7
82±9
76±7
95±4
Blood γδ T cell
75±12
85±9
73±8
Blood αβT cell
68±11
86±12
76±4
, 百拇医药 20∶1
γδTIL
85±4
83±12
80±6
αβTIL
73±5
82±6
86±1
γδTAL
90±6
88±10
78±7
, http://www.100md.com
96±4
αβTAL
82±10
84±10
78±7
99±0.5
Blood γδT cell
84±16
88±10
82±7
Blood αβT cell
70±8
, 百拇医药
85±12
82±4
40∶1
γδTIL
93±7
86±11
88±9
αβTIL
83±5
92±7
87±2
γδTAL
94±6
, 百拇医药
93±6
83±6
αβTAL
89±10
90±8
91±8
Blood γδT cell
89±10
90±9
89±10
Blood αβT cell
82±11
, http://www.100md.com
92±6
89±10
Data are expressed as the mean percentages cytostasis(%)±SD(%)
3 讨 论
本研究检测了6种效应细胞对4种靶细胞的细胞毒作用,观察到多种来源的γδT细胞与对应的αβT细胞对Daudi细胞、新建系同种异体/自体OEC细胞的抗肿瘤活性基本处于同一水平;但对SKOV3的细胞毒作用,γδT细胞均强于相应的αβT细胞。上述情况表明,本实验体系所采用的抗TCRγδ和抗CD3抗体分别诱导γδT细胞和αβT细胞发生了充分活化,使其对各种肿瘤细胞产生了作用强度基本一致的细胞毒效应。在其中,我们并没有观察到αβT细胞对自体OEC细胞的特异性杀伤作用,提示抗体诱导性αβT细胞活化是多克隆的,具有LAK细胞的作用特点。文献报道,自体肿瘤特异性αβT细胞的体外诱导建立一般需要放射性处理的自体肿瘤细胞的反复刺激[9],而在我们的实验体系中无上述处理,所获得的αβT细胞系实质上为抗CD3抗体激活的杀伤细胞(CD3AK)。CD3AK可显示类似但强于LAK细胞的杀瘤活性[10]。抗TCRγδ抗体活化的γδT细胞也表现了类似于CD3AK的杀瘤活性,具有多克隆活化和高细胞毒活性的特点,并且对自体OEC细胞并无特异性。
, 百拇医药
不同来源的γδT细胞抗肿瘤作用强度基本相同,但同一来源的γδT细胞对于不同的肿瘤细胞,其敏感程度不同,如γδTAL对Daudi细胞的细胞毒作用最强,其次是对同种异体OEC细胞,而对自体OEC细胞的细胞毒作用最弱。因为Daudi细胞是γδT细胞杀伤的敏感细胞,因此不难理解γδTAL对其高杀伤活性。至于γδTAL在杀伤同种异体和自体OEC细胞方面的差异机制有待于进一步探究。
就γδT细胞体外扩增到一定纯度所需的时间而言,外周血γδT细胞所需时间最短,γδTAL次之,而γδTIL所需时间最长。外周血γδT细胞来源于单个核细胞,淋巴细胞比例高,故扩增时间短;而分离的TAL中含部分肿瘤细胞,其在培养过程中有可能阻断了部分TAL与抗TCRγδ抗体接触或通过细胞-细胞间作用及分泌免疫抑制因子等来抑制淋巴细胞的生长;γδTIL扩增所需时间最长的原因一方面与γδTAL相同,另一方面可能在于经机械剪碎后,TIL有相当部分的丢失,导致其淋巴细胞比例降低。
本研究的特色为:在体外利用固相抗体法扩增出OEC患者3种来源的γδT细胞和αβT细胞,并分离培养了自体OEC细胞。在此基础上测定了所获的效应细胞对同种异体/自体OEC细胞的体外细胞毒活性。与此类似的研究尚未见文献报道。我们的结果为OEC过继细胞治疗奠定了实验基础并提供了重要的资料。
, 百拇医药
综上所述,γδTIL,γδTAL和外周血γδT细胞对于OEC细胞均有显著的杀伤活性。鉴于其肿瘤杀伤活性基本相仿,而OEC患者常伴有腹水,因此,在作用有效的前提下,腹水来源的γδTAL也许能成为γδT细胞过继治疗OEC的更为简便获得的候选效应细胞。
本研究受国家重点基础研究发展计划规划项目(G1998051200)子课题和国家九五攻关项目(96-920-06-05)子专题(96-920-06-05-26)的资助
牛海涛,男,30岁,免疫学硕士研究生,从事γδT细胞抗肿瘤机制的研究
参 考 文 献
1,Boring CC, Squires TS, Tong T. Cancer statistics, 1992. CA, 1992, 42: 19
, http://www.100md.com 2,连利娟, 林巧稚. 妇科肿瘤学. 北京: 人民卫生出版社, 1994. 489
3,李金锋, 郭静文, 林本耀, 等. 卵巢癌腹水的过继性免疫治疗. 综合临床医学, 1997, 13(6): 546
4,Aoki Y, Takakuwa K, Kodama S, et al. Use of adoptive transfer of tumor-infiltrating lymphocytes alone or in combination with cisplatin-containing chemotherapy in patients with epithlial ovarian cancer. Cancer Res, 1991, 51: 1934
5,Bookman MA, Bast RC. The immunobiology and immunotherapy of ovarian cancer. Semin Oncol, 1991, 18(3): 270
, 百拇医药
6,Songtao Y, Wei H, Juan C, et al. Expansion and immunological study of human tumor infiltrating gamma/delta T lymphocytes in vitro. Int Arch Allergy Immunol, 1999, 119: 31
7,于松涛, 张 芳, 何 维. 抗体固相法体外扩增人肿瘤浸润γδT淋巴细胞. 免疫学杂志, 1997, 13: 260
8,司徒镇强, 吴军正. 细胞培养. 西安: 世界图书出版公司, 1996. 202
9,Chaperot L, Delfau-Larue MH, Jacob MC, et al. Differentiation of antitumor-specific cytotoxic T lymphocytes from autologous tumor infiltrating lymphocytes in non-Hodgkin's lymphomas. Exp Hematol, 1999, 27: 1185
10,Ting CC, Hargrove ME, Henrich P. Anti-CD3 antibody-induced activated killer cells subsets of killer cells that mediate fast or slow lytic reactions. Immunol Invest, 1990, 19: 347
(1999-10-20收稿; 1999-12-18修回), http://www.100md.com