原子力显微镜对自由基损伤的红细胞膜表面精细结构的研究*
作者:黄益民 李 稼 刘丹晶 虞 欣 赵 辉 张平成 白春礼
单位:黄益民 李 稼 刘丹晶 虞 欣 赵 辉;北京市心肺血管疾病研究所(北京 100029);张平成 白春礼 中国科学院化学研究所(北京 100080)
关键词:原子力扫描显微镜;自由基;红细胞膜;分子形貌学
北京生物医学工程990105 ` 摘 要 目的 直接观察自由基损伤、加女贞子保护、H2O2作用等因素对红细胞膜分子形貌学的影响。方法 利用0.1纳米分辨率水平的原子力显微镜对单纯戊二醛固定的经由自由基、H2O2和女贞子作用的红细胞膜表面进行了纳米尺度的扫描观察,并与扫描电子显微镜的结果进行比较。结果 自由基作用后的红细胞膜表面蛋白颗粒呈现直径从几十~几百纳米的、大小不等的团块样聚集体和膜表面纳米水平的凹凸改变,恢复3小时后红细胞的上述变化减轻,加女贞子保护或H2O2作用只引起红细胞膜表面蛋白颗粒轻度聚集和蛋白颗粒间缝隙增加。结论 (1)原子力显微镜具有制样简单、无须染色和临界点干燥、可在室温和空气环境中直接观察活的或固定的生物样本的分子形貌学等优点;(2)原子力显微镜可清晰分辨自由基、H2O2、女贞子作用后细胞膜表面在分子水平的形貌学变化特征,即H2O2和女贞子作用后的红细胞膜表面分子形貌学变化程度轻于自由基的作用;(3)原子力显微镜可对所观察到的红细胞膜表面分子形貌学改变进行三维定量分析。
, 百拇医药
Study of Fine Structures of the Natural Surface of Free RadicalTreated Red Blood Cells with Atomic Force Microscopy
Huang Yimin,Li Jia,Liu Danjing,Yu Xin,Zhao Hui
(Beijing Institute of Heart Lung & Blood Vessel Diseases,Beijing 100029)
Zhang Pingcheng,Bai ChunLi
(STM Lab.,Institute of Chemistry,Chinese Academy of Sciences,Beijing 100080)
, http://www.100md.com
Abstract Objective To observe the effects of free radicals(Fr),ligustrum lucidum ait (LLA)+Fr,and H2O2 on the natural molecular morphology of red blood cell membrane surface directly.Methods Using an atomic force microscopy(AFM) with 0.1 nanometer resolution to scann the glutaraldehyde-fixed membrane surface of RBCs,which have been treated by Fr,LLA+Fr,H2O2 respectively;and on nanometer range,in room temperature and air conditions;and to compare with SEM images results of.Results After Fr treatment, visual polymers with various sizes, ranging from tens to hundred nanometers, aopear at protein particles of RBC membrane surface the membrane surface roughness being at nanometer level.After recovering for 3h,these particle changes decreased partly.LLA+Fr or H2O2 treatment just resulted in smaller size polymers formation,and increase of seams as well between particles.Conclusion (1)AFM offers relatively quick and easy specimen prepar ations than SEM,without requirements to dehydrate in graded ethanol and dry at critical point,and no sputter coating.It also offers direct observing living or fixed biological specimen's surface to get molecular topography at room temperature and air conditions;(2)AFM can clearly distinguish the molecular characteristic structures of RBC membrane surface after treatment with Fr,LLA+Fr or H2O2.That is,the surface change of the RBC membrane,treated by LLA+Fr and H2O2,were less then changes those,treated with Fr at molecular topographical level;(3)AFM can do 3 dimensional quantitatie analysis for the observed RBC molecular mo rphology at membrane surface.
, 百拇医药
Key words:Atomic force microscopy;Free radicals;RBC memb rane;Molecular topography(morphology)
自1982年Binning和Rohrer[1]发明了扫描电子隧道显微镜(scanning tunnelling microscope STM)对导电体材料的原子分布、晶格键长度等参数直接观察及测量后,1986年Binning[2]等人又发明了原子力扫描显微镜(atomic force microscope AFM),它是通过探头扫描样本表面时所测到的与样本表面原子间的力场变化而得到样本表面原子水平分辨率(小于1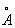 )的三维图像。近几年来一些生物学家利用AFM对生物大分子直接观察的技术并与电子显微镜进行比较,证明AFM具有无须梯度脱水、染色、临界点干燥、喷涂导体物质及真空观察、纳米水平分辨率、可对活细胞表面超精细结构进行三维数据分析等优点[3~14]。虽然我们前期已用AFM对只用戊二醛固定的完整红细胞膜表面超精细结构进行了观察[15],但到目前为止尚无有关用AFM直接观察自由基及保护剂对细胞膜表面分子形貌学影响的报道。
)的三维图像。近几年来一些生物学家利用AFM对生物大分子直接观察的技术并与电子显微镜进行比较,证明AFM具有无须梯度脱水、染色、临界点干燥、喷涂导体物质及真空观察、纳米水平分辨率、可对活细胞表面超精细结构进行三维数据分析等优点[3~14]。虽然我们前期已用AFM对只用戊二醛固定的完整红细胞膜表面超精细结构进行了观察[15],但到目前为止尚无有关用AFM直接观察自由基及保护剂对细胞膜表面分子形貌学影响的报道。
, 百拇医药
为区分H2O2、Fenton体系对红细胞膜表面分子形貌学不同的影响和自由基清除剂女贞子的保护作用,本研究利用AFM对前三者作用后红细胞膜表面分子形貌学的改变进行了直接观察。
1 材料及方法
1.1 Fenton反应体系产生自由基及中药女贞子对自由基的清除率
1.1.1 Fenton反应体系产生自由基的测定
按照下列方法配制Fenton反应体系。以1∶1∶1的溶积比将3%的H2O2、450μmol/L的FeSO4和2.7%的NaCl混合制成等渗、pH7.0的羟自由基(.OH体系。分别在配制后的即刻、和10、30、60min时将1.5M/L的自旋捕捉剂DMPO(5,5-dimethyl-1-pyroline N-oxide,Sigma)15μl加入到0.1ml的相应Fenton反应体系中(DMPO终浓度为225mM/L),捕捉.OH自由基,并于室温用电子自旋共振波谱仪(ESR Bruker ER-200D)在微波功率SP=10mW、调制幅度MA=5G、放大增益GN=5×104、中心磁场CF=3470G、扫场宽度SW=200G等条件下测定自由基ESR信号强度。以上过程重复三次,证明Fenton反应体系配制后即刻自由基信号强度明显增加,且于配制后各点稳定。
, 百拇医药
1.1.2 中药女贞子提取液对自由基的清除作用
将50g女贞子用400ml双蒸去离子水浸泡两小时,于文火煎煮,去渣后用滤纸对提取液过滤,用双蒸去离子水将过滤后的提取液配制到50ml,按1∶15的容积比在上述Fenton反应体系配制后即刻将女贞子提取液加入其中,混匀后分别于加女贞子提取液的第1、10、30、60min时用ESR测定DMPO捕捉到的.OH自由基信号强度(方法同上),并与未加女贞子提取液的Fenton反应体系进行比较。上述过程重复三次。根据式1计算出女贞子提取液在不同时间对自由基的平均清除率分别为65.35%、76.28%、79.5%和81.33%。
清除率=(无女贞子ESR峰强-有女贞子ESR峰强)/无女贞子ESR峰强 (1)
1.2 自由基对人红细胞的损伤及损伤后红细胞的恢复
, 百拇医药
10名健康成人的肝素抗凝新鲜红细胞(男女各5名)经等渗磷酸缓冲液(PBS)清洗两遍后,取0.1ml与10ml的Fenton反应体系在室温条件下作用30min。作用后的红细胞经PBS清洗两遍后,部分立刻固定、分别用SEM和AFM观察,部分再于室温条件下重新悬浮于PBS中静置(恢复)3h。
1.3 女贞子提取液对红细胞的保护
将400μl女贞子提取液加入到10ml的Fenton反应体系中混匀,再与0.1ml的上述10名健康成人新鲜红细胞作用30min,后用PBS清洗两遍。
1.4 H2O2对红细胞的作用
为区分Fenton反应体系中的底物H2O2与Fenton反应体系中·OH对红细胞膜的不同影响,将上述10名成人的红细胞0.1ml再与10ml的1%的H2O2-PBS液作用30min,作用后经PBS清洗两遍。
, 百拇医药
1.5 SEM和AFM观察的红细胞样本的制备
上述各作用后、恢复后的红细胞样本经2.5%的戊二醛固定30min,后用PBS清洗两遍,部分再悬浮于PBS中制成细胞压积为1%的细胞悬液。4μl此悬液被加到载物台表面静置20s使固定的红细胞粘附在载物台上,用滤纸祛除上清液,为防止形成盐结晶再用蒸馏水清洗两遍载物台上的红细胞,空气中干燥后用AFM进行观察。部分戊二醛固定后并经PBS清洗两遍的红细胞再经梯度脱水、临界点干燥、喷金(10nmol)等过程,用SEM对其观察。
1.6 红细胞表面形貌学观察和AFM与SEM的比较
1.6.1 AFM的观察
红细胞是用扣击式AFM(NanoScope Ⅲ SPM,Digital Instruments Inc.,Santa Barbara,CA)进行观察。扣击悬臂长125μm,扣击频率313kHz,用180nm的阶梯式高度标准和水平标尺标定z轴和x、y轴并确定样本中细胞变化基本一致后,对干燥的每个样本中随机5个红细胞膜表面进行不同分辨率的三维形貌学扫描。
, 百拇医药
1.6.2 SEM的观察
按照常规扫描电子显微镜的观察步骤,用S-250型扫描电子显微镜在19kV电压下,对每个样本中的随机5个红细胞进行不同放大倍数的观察、拍片、并与相应放大倍数的AFM结果进行比较。
2 结果
较低倍SEM观察到Fenton反应体系作用引起了红细胞形态学改变,表现为细胞体积大小不
一、细胞中心凹陷变浅、细胞膜表面部分区域有条索状明暗带及隆起的分布,但红细胞仍基本保持扁盘型型貌。继续增加放大倍数并不能清楚分辨红细胞膜表面明暗条索结构特征。与对照细胞相比,H2O2作用和加女贞子保护后,SEM未观察到红细胞形态学方面有明显变化。
AFM于1μm扫描尺度观察到的对照红细胞膜表面为平滑的精细网格状微隆起结构(图1(a))。与之相比,自由基作用后的红细胞膜表面出现了覆盖整个细胞膜的、突出的颗粒堆积型条索状隆起与凹陷或坑洞交替分布的特征,隆起高度可达100nm以上(图1(b))。300nm扫描尺度清晰可见对照红细胞膜表面椭圆形鱼鳞状颗粒取向一致、以云片状分布、分布密集连续、表面平缓,颗粒长短轴约为20~10nm、z轴平均隆起高度只有10.752nm(图2)。自由基作用后的红细胞膜表面的颗粒则呈不典型的多聚体与单体杂乱分布的“卵石堆”及坑洞形貌,其中大聚集团块的直径可达150~200nm。500nm扫描尺度清晰可见自由基作用后的红细胞膜表面表现为大小、分布明显不规则的颗粒和严重的隆起与凹陷混杂的结构,凹陷深度可达200nm以上,这超过了红细胞膜的最大理论厚度(图3)。

, 百拇医药
(a) (b)
图1 (a)和(b)为AFM在1μm扫描尺度条件下观察到的对照与自由基损伤的红细胞膜表面形貌
图2 AFM在300nm扫描尺度条件下观察到的对照组红细胞膜表面形貌
图3 AFM在500nm扫描尺度条件下观察到的自由基损伤组红细胞膜表面形貌
AFM观察到,在自由基损伤的红细胞恢复3小时后,膜表面聚集团块消失,颗粒取向部分恢复,坑洞改变减轻,但是颗粒间出现缝隙,使细胞膜表面失去连续性。加女贞子后红细胞膜表面未形成大聚集团块和坑洞样改变,但仍有二、三、四聚体和颗粒间缝隙的出现。H2O2作用引起了红细胞膜表面颗粒分布紊乱和颗粒间小孔洞出现。无论恢复3小时后、加女贞子保护、H2O2作用,红细胞膜表面颗粒z轴隆起高度均未超出10~50nm范围(图4)。
, http://www.100md.com
图4 Ct1cel.003、fr1cell.004、fr4b.004、f1cell.006和
h1f.005分别是AFM在500nm扫描尺度条件下观察到的
对照、自由基损伤、恢复3h、女贞子保护和H2O2作用后红细胞膜表面形貌
3 讨论
我们前期利用生物物理的技术进行的体外和体内研究发现,自由基不仅引起红细胞膜脂质分子结构改变,同时还造成膜蛋白分子化学结构和构象变化及这些分子流动性降低,而恢复3h使这些改变有所回复[16~18]。我们希望能够进一步直接观察到上述红细胞膜分子化学结构改变所引起的膜分子形貌学变化的特征,但是由于分辨率的限制本文中利用传统的扫描电子显微镜无法观察到分子水平的变化。采用AFM则能完全满足对红细胞膜表面分子形貌的直接观察[19]。
, 百拇医药
红细胞膜的理论厚度为7~10nm左右。根据本文用AFM观察到的正常红细胞膜表面的颗粒直接为10~20nm且表面平滑、多以圆形或卵圆形为主,推断这些颗粒应主要是红细胞膜蛋白分子暴露于膜表面的部分。而AFM所观察到的自由基损伤后红细胞膜表面颗粒大小不一、分布紊乱、凹凸粗糙等特征不仅揭示了我们前期所发现的自由基引起红细胞膜分子结构改变中蛋白分子形貌学表象,同时也从分子形貌学的角度直接证明了过去有关自由基通过导致细胞膜蛋白分子的Shiffet碱形成进而导致膜蛋白分子多聚体形成的假设[20]。恢复3h后红细胞膜表面颗粒的聚集体减少、颗粒的取向性部分回复、表面凹凸粗糙度降低等分子形貌表象支持我们前期有关恢复3h后红细胞膜分子结构及分子流动性变化部分回复的结果[16]。但本研究中发现恢复3h后红细胞膜表面颗粒之间的间隙增多、加宽,提示了上述分子的恢复主要是以红细胞膜蛋白分子解聚为主。
本文AFM观察到,加女贞子保护后红细胞膜表面分子形貌学改变明显减轻,说明女贞子对自由基的清除可减轻自由基对红细胞膜分子的损伤程度,但并不能完全防止自由基所造成的红细胞膜蛋白分子的小聚集体形成。H2O2引起的红细胞膜表面分子形貌学的改变远轻于Fenton反应体系的作用,说明尽管H2O2是Fenton体系中产生.OH的主要反应底物并对红细胞膜分子有一定作用,但是Fenton反应体系作用所引起的红细胞膜表面分子形貌学严重改变仍主要是其中的.OH自由基所为。
, 百拇医药
本文通过AFM与SEM的对比,以及AFM对自由基损伤、加女贞子保护、H2O2作用等红细胞样本的膜表面分子形貌学变化特征的观察证明:(1)AFM比SEM具有制样简单、无须喷涂导体材料及真空条件观察、nm水平的超高分辨率等优点,更适合对细胞和其它生物大分子表面形貌学进行直接观察;(2)自由基主要造成了红细胞膜表面蛋白聚集、隆起与凹陷等分子形貌学变化,恢复3h可使这些变化部分回复;(3)女贞子可减轻自由基对红细胞膜分子的损伤程度;(4)H2O2对红细胞膜分子形貌学的影响远轻于Fenton反应体系的损伤程度。
*国家自然科学基金(No.39370199)、北京市自然科学基金(No.7942013)联合支持项目
The subject is supported by the National N atural Science Foundation of China(No.39270199) and Beijing Municipal Natural S cience Foundation (No.7942013).
, http://www.100md.com
4 参考文献
[1]Binnig G and Rohrer H.Scanning tunneling microscopy.Helv Phys Acta,1982,55:726
[2]Binnig G,Quate C F and Gerber C.Atomic force microscope.Phys Rev Lett ,1986,56:930
[3]Parpura V,Haydon P G and Henderson E.Three-dimensional imaging of living neurous and glia with the atomic force microscope.J Cell Science,1993,104:4 27
[4]Kordylewski L, Saner D and Lal R.Atomic force microscopy of freeze-fracture replicas of rat atrial tissue.J Micros,1994,173(pt3):173
, 百拇医药
[5]Schoenenberger C A and Hoh J H.Slow cellular dynamics in MDCR and R5 cells monitored by time-lapse atomic force microscopy.Bioph J,1994,6 7:929
[6]Shroff S G,Saner D R and Lal R.Dynmaic micromecha nical properties of cultured rat atrial myocytes measured by atomic force miroscopy.Am J Phys,1995,269(1):c286
[7]Allen M J,Bradbury E M and Balhorn R.The natural subcellular surface structure of the bovine sperm cell.J Struct Biol,1995,114:197
, http://www.100md.com
[8]Bonfiglio A,Parodi M T and Tonini G P.Subcellular details of early events of differentiation induced by retinoic acid in human neuroblastoma cells detected by atomic force microscope.Experim Cell Res,1995 ,216:73
[9]Putman C A J,Vander Werf K O,Grooth B G,et al.Viscoel asticity of living cells allows high resolution imaging by tapping mode atomic forca microscopy.Bioph J,1994,67:1749
[10]Ushiki T,Hitomi J,Ogura S,et al.Atomic force microscopy in histology and cytology.Arch Histol Cytol,1996,59(5):421
, 百拇医药
[11]Stine W B Jr,Snyder S W,Ladror U S,et al.The nanometer-scale structure of amyloid-beta visuzlized by atomic force microscopy.J Protein Chem,1996,15(2): 193
[12]Shohei Yamashina and Masatsugu Shigeno.Application of atomic force microscopy to ultrastructural and histochemical studies of fixed and embedded cells.J E lectron Microsc,1995,44:462
[13]Firtel M,Beveridge T J.Scanning probe microscopy in microbiology.Micron,19 95,26(4):347
, 百拇医药
[14]Braet F,De Zanger R,Wisse E.Drying cells for SEM,AFM and TEM by hexamethyl disilzane:a study on hepatic endothelial cells.J Microsce,1997,186(pt1):84
[15]Zhang P C,Bai C,Huang Y M,et al.Atomic force microscopy study of fine stru ctures of the entire surface of red blood cells.Scanning Microsc.,1995,9(4):981
[16]黄益民,赵辉,虞欣,等.自由基损伤红细胞膜分子的机理研究.生物物理学报,1997,13(2):315
[17]黄益民,韩玲,金鸣,等.人心肌缺血/再灌注期间冠状窦血中红细胞流变性的改变.中华胸心血管外科杂志,1997,13(5):305
, 百拇医药
[18]黄益民,陈宝田,韩玲,等.人心肌缺血/再灌注期间红细胞膜分子流动性改变的机理研究.生物物理学报,1997,13(3):499
[19]C M Gupta.Is there any role of membrane bilaryer-skeleton interaction in maintaining the transmembrane phospholipid asymmetry in erythrocytes?Biotech Appl Bioch,1990,12:506
[20]倪静安.微量元素硒与自由基.自然杂志,1992,15(6):438
(1998-04-17收稿), http://www.100md.com
单位:黄益民 李 稼 刘丹晶 虞 欣 赵 辉;北京市心肺血管疾病研究所(北京 100029);张平成 白春礼 中国科学院化学研究所(北京 100080)
关键词:原子力扫描显微镜;自由基;红细胞膜;分子形貌学
北京生物医学工程990105 ` 摘 要 目的 直接观察自由基损伤、加女贞子保护、H2O2作用等因素对红细胞膜分子形貌学的影响。方法 利用0.1纳米分辨率水平的原子力显微镜对单纯戊二醛固定的经由自由基、H2O2和女贞子作用的红细胞膜表面进行了纳米尺度的扫描观察,并与扫描电子显微镜的结果进行比较。结果 自由基作用后的红细胞膜表面蛋白颗粒呈现直径从几十~几百纳米的、大小不等的团块样聚集体和膜表面纳米水平的凹凸改变,恢复3小时后红细胞的上述变化减轻,加女贞子保护或H2O2作用只引起红细胞膜表面蛋白颗粒轻度聚集和蛋白颗粒间缝隙增加。结论 (1)原子力显微镜具有制样简单、无须染色和临界点干燥、可在室温和空气环境中直接观察活的或固定的生物样本的分子形貌学等优点;(2)原子力显微镜可清晰分辨自由基、H2O2、女贞子作用后细胞膜表面在分子水平的形貌学变化特征,即H2O2和女贞子作用后的红细胞膜表面分子形貌学变化程度轻于自由基的作用;(3)原子力显微镜可对所观察到的红细胞膜表面分子形貌学改变进行三维定量分析。
, 百拇医药
Study of Fine Structures of the Natural Surface of Free RadicalTreated Red Blood Cells with Atomic Force Microscopy
Huang Yimin,Li Jia,Liu Danjing,Yu Xin,Zhao Hui
(Beijing Institute of Heart Lung & Blood Vessel Diseases,Beijing 100029)
Zhang Pingcheng,Bai ChunLi
(STM Lab.,Institute of Chemistry,Chinese Academy of Sciences,Beijing 100080)
, http://www.100md.com
Abstract Objective To observe the effects of free radicals(Fr),ligustrum lucidum ait (LLA)+Fr,and H2O2 on the natural molecular morphology of red blood cell membrane surface directly.Methods Using an atomic force microscopy(AFM) with 0.1 nanometer resolution to scann the glutaraldehyde-fixed membrane surface of RBCs,which have been treated by Fr,LLA+Fr,H2O2 respectively;and on nanometer range,in room temperature and air conditions;and to compare with SEM images results of.Results After Fr treatment, visual polymers with various sizes, ranging from tens to hundred nanometers, aopear at protein particles of RBC membrane surface the membrane surface roughness being at nanometer level.After recovering for 3h,these particle changes decreased partly.LLA+Fr or H2O2 treatment just resulted in smaller size polymers formation,and increase of seams as well between particles.Conclusion (1)AFM offers relatively quick and easy specimen prepar ations than SEM,without requirements to dehydrate in graded ethanol and dry at critical point,and no sputter coating.It also offers direct observing living or fixed biological specimen's surface to get molecular topography at room temperature and air conditions;(2)AFM can clearly distinguish the molecular characteristic structures of RBC membrane surface after treatment with Fr,LLA+Fr or H2O2.That is,the surface change of the RBC membrane,treated by LLA+Fr and H2O2,were less then changes those,treated with Fr at molecular topographical level;(3)AFM can do 3 dimensional quantitatie analysis for the observed RBC molecular mo rphology at membrane surface.
, 百拇医药
Key words:Atomic force microscopy;Free radicals;RBC memb rane;Molecular topography(morphology)
自1982年Binning和Rohrer[1]发明了扫描电子隧道显微镜(scanning tunnelling microscope STM)对导电体材料的原子分布、晶格键长度等参数直接观察及测量后,1986年Binning[2]等人又发明了原子力扫描显微镜(atomic force microscope AFM),它是通过探头扫描样本表面时所测到的与样本表面原子间的力场变化而得到样本表面原子水平分辨率(小于1
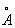 )的三维图像。近几年来一些生物学家利用AFM对生物大分子直接观察的技术并与电子显微镜进行比较,证明AFM具有无须梯度脱水、染色、临界点干燥、喷涂导体物质及真空观察、纳米水平分辨率、可对活细胞表面超精细结构进行三维数据分析等优点[3~14]。虽然我们前期已用AFM对只用戊二醛固定的完整红细胞膜表面超精细结构进行了观察[15],但到目前为止尚无有关用AFM直接观察自由基及保护剂对细胞膜表面分子形貌学影响的报道。
)的三维图像。近几年来一些生物学家利用AFM对生物大分子直接观察的技术并与电子显微镜进行比较,证明AFM具有无须梯度脱水、染色、临界点干燥、喷涂导体物质及真空观察、纳米水平分辨率、可对活细胞表面超精细结构进行三维数据分析等优点[3~14]。虽然我们前期已用AFM对只用戊二醛固定的完整红细胞膜表面超精细结构进行了观察[15],但到目前为止尚无有关用AFM直接观察自由基及保护剂对细胞膜表面分子形貌学影响的报道。, 百拇医药
为区分H2O2、Fenton体系对红细胞膜表面分子形貌学不同的影响和自由基清除剂女贞子的保护作用,本研究利用AFM对前三者作用后红细胞膜表面分子形貌学的改变进行了直接观察。
1 材料及方法
1.1 Fenton反应体系产生自由基及中药女贞子对自由基的清除率
1.1.1 Fenton反应体系产生自由基的测定
按照下列方法配制Fenton反应体系。以1∶1∶1的溶积比将3%的H2O2、450μmol/L的FeSO4和2.7%的NaCl混合制成等渗、pH7.0的羟自由基(.OH体系。分别在配制后的即刻、和10、30、60min时将1.5M/L的自旋捕捉剂DMPO(5,5-dimethyl-1-pyroline N-oxide,Sigma)15μl加入到0.1ml的相应Fenton反应体系中(DMPO终浓度为225mM/L),捕捉.OH自由基,并于室温用电子自旋共振波谱仪(ESR Bruker ER-200D)在微波功率SP=10mW、调制幅度MA=5G、放大增益GN=5×104、中心磁场CF=3470G、扫场宽度SW=200G等条件下测定自由基ESR信号强度。以上过程重复三次,证明Fenton反应体系配制后即刻自由基信号强度明显增加,且于配制后各点稳定。
, 百拇医药
1.1.2 中药女贞子提取液对自由基的清除作用
将50g女贞子用400ml双蒸去离子水浸泡两小时,于文火煎煮,去渣后用滤纸对提取液过滤,用双蒸去离子水将过滤后的提取液配制到50ml,按1∶15的容积比在上述Fenton反应体系配制后即刻将女贞子提取液加入其中,混匀后分别于加女贞子提取液的第1、10、30、60min时用ESR测定DMPO捕捉到的.OH自由基信号强度(方法同上),并与未加女贞子提取液的Fenton反应体系进行比较。上述过程重复三次。根据式1计算出女贞子提取液在不同时间对自由基的平均清除率分别为65.35%、76.28%、79.5%和81.33%。
清除率=(无女贞子ESR峰强-有女贞子ESR峰强)/无女贞子ESR峰强 (1)
1.2 自由基对人红细胞的损伤及损伤后红细胞的恢复
, 百拇医药
10名健康成人的肝素抗凝新鲜红细胞(男女各5名)经等渗磷酸缓冲液(PBS)清洗两遍后,取0.1ml与10ml的Fenton反应体系在室温条件下作用30min。作用后的红细胞经PBS清洗两遍后,部分立刻固定、分别用SEM和AFM观察,部分再于室温条件下重新悬浮于PBS中静置(恢复)3h。
1.3 女贞子提取液对红细胞的保护
将400μl女贞子提取液加入到10ml的Fenton反应体系中混匀,再与0.1ml的上述10名健康成人新鲜红细胞作用30min,后用PBS清洗两遍。
1.4 H2O2对红细胞的作用
为区分Fenton反应体系中的底物H2O2与Fenton反应体系中·OH对红细胞膜的不同影响,将上述10名成人的红细胞0.1ml再与10ml的1%的H2O2-PBS液作用30min,作用后经PBS清洗两遍。
, 百拇医药
1.5 SEM和AFM观察的红细胞样本的制备
上述各作用后、恢复后的红细胞样本经2.5%的戊二醛固定30min,后用PBS清洗两遍,部分再悬浮于PBS中制成细胞压积为1%的细胞悬液。4μl此悬液被加到载物台表面静置20s使固定的红细胞粘附在载物台上,用滤纸祛除上清液,为防止形成盐结晶再用蒸馏水清洗两遍载物台上的红细胞,空气中干燥后用AFM进行观察。部分戊二醛固定后并经PBS清洗两遍的红细胞再经梯度脱水、临界点干燥、喷金(10nmol)等过程,用SEM对其观察。
1.6 红细胞表面形貌学观察和AFM与SEM的比较
1.6.1 AFM的观察
红细胞是用扣击式AFM(NanoScope Ⅲ SPM,Digital Instruments Inc.,Santa Barbara,CA)进行观察。扣击悬臂长125μm,扣击频率313kHz,用180nm的阶梯式高度标准和水平标尺标定z轴和x、y轴并确定样本中细胞变化基本一致后,对干燥的每个样本中随机5个红细胞膜表面进行不同分辨率的三维形貌学扫描。
, 百拇医药
1.6.2 SEM的观察
按照常规扫描电子显微镜的观察步骤,用S-250型扫描电子显微镜在19kV电压下,对每个样本中的随机5个红细胞进行不同放大倍数的观察、拍片、并与相应放大倍数的AFM结果进行比较。
2 结果
较低倍SEM观察到Fenton反应体系作用引起了红细胞形态学改变,表现为细胞体积大小不
一、细胞中心凹陷变浅、细胞膜表面部分区域有条索状明暗带及隆起的分布,但红细胞仍基本保持扁盘型型貌。继续增加放大倍数并不能清楚分辨红细胞膜表面明暗条索结构特征。与对照细胞相比,H2O2作用和加女贞子保护后,SEM未观察到红细胞形态学方面有明显变化。
AFM于1μm扫描尺度观察到的对照红细胞膜表面为平滑的精细网格状微隆起结构(图1(a))。与之相比,自由基作用后的红细胞膜表面出现了覆盖整个细胞膜的、突出的颗粒堆积型条索状隆起与凹陷或坑洞交替分布的特征,隆起高度可达100nm以上(图1(b))。300nm扫描尺度清晰可见对照红细胞膜表面椭圆形鱼鳞状颗粒取向一致、以云片状分布、分布密集连续、表面平缓,颗粒长短轴约为20~10nm、z轴平均隆起高度只有10.752nm(图2)。自由基作用后的红细胞膜表面的颗粒则呈不典型的多聚体与单体杂乱分布的“卵石堆”及坑洞形貌,其中大聚集团块的直径可达150~200nm。500nm扫描尺度清晰可见自由基作用后的红细胞膜表面表现为大小、分布明显不规则的颗粒和严重的隆起与凹陷混杂的结构,凹陷深度可达200nm以上,这超过了红细胞膜的最大理论厚度(图3)。


, 百拇医药
(a) (b)
图1 (a)和(b)为AFM在1μm扫描尺度条件下观察到的对照与自由基损伤的红细胞膜表面形貌

图2 AFM在300nm扫描尺度条件下观察到的对照组红细胞膜表面形貌

图3 AFM在500nm扫描尺度条件下观察到的自由基损伤组红细胞膜表面形貌
AFM观察到,在自由基损伤的红细胞恢复3小时后,膜表面聚集团块消失,颗粒取向部分恢复,坑洞改变减轻,但是颗粒间出现缝隙,使细胞膜表面失去连续性。加女贞子后红细胞膜表面未形成大聚集团块和坑洞样改变,但仍有二、三、四聚体和颗粒间缝隙的出现。H2O2作用引起了红细胞膜表面颗粒分布紊乱和颗粒间小孔洞出现。无论恢复3小时后、加女贞子保护、H2O2作用,红细胞膜表面颗粒z轴隆起高度均未超出10~50nm范围(图4)。

, http://www.100md.com
图4 Ct1cel.003、fr1cell.004、fr4b.004、f1cell.006和
h1f.005分别是AFM在500nm扫描尺度条件下观察到的
对照、自由基损伤、恢复3h、女贞子保护和H2O2作用后红细胞膜表面形貌
3 讨论
我们前期利用生物物理的技术进行的体外和体内研究发现,自由基不仅引起红细胞膜脂质分子结构改变,同时还造成膜蛋白分子化学结构和构象变化及这些分子流动性降低,而恢复3h使这些改变有所回复[16~18]。我们希望能够进一步直接观察到上述红细胞膜分子化学结构改变所引起的膜分子形貌学变化的特征,但是由于分辨率的限制本文中利用传统的扫描电子显微镜无法观察到分子水平的变化。采用AFM则能完全满足对红细胞膜表面分子形貌的直接观察[19]。
, 百拇医药
红细胞膜的理论厚度为7~10nm左右。根据本文用AFM观察到的正常红细胞膜表面的颗粒直接为10~20nm且表面平滑、多以圆形或卵圆形为主,推断这些颗粒应主要是红细胞膜蛋白分子暴露于膜表面的部分。而AFM所观察到的自由基损伤后红细胞膜表面颗粒大小不一、分布紊乱、凹凸粗糙等特征不仅揭示了我们前期所发现的自由基引起红细胞膜分子结构改变中蛋白分子形貌学表象,同时也从分子形貌学的角度直接证明了过去有关自由基通过导致细胞膜蛋白分子的Shiffet碱形成进而导致膜蛋白分子多聚体形成的假设[20]。恢复3h后红细胞膜表面颗粒的聚集体减少、颗粒的取向性部分回复、表面凹凸粗糙度降低等分子形貌表象支持我们前期有关恢复3h后红细胞膜分子结构及分子流动性变化部分回复的结果[16]。但本研究中发现恢复3h后红细胞膜表面颗粒之间的间隙增多、加宽,提示了上述分子的恢复主要是以红细胞膜蛋白分子解聚为主。
本文AFM观察到,加女贞子保护后红细胞膜表面分子形貌学改变明显减轻,说明女贞子对自由基的清除可减轻自由基对红细胞膜分子的损伤程度,但并不能完全防止自由基所造成的红细胞膜蛋白分子的小聚集体形成。H2O2引起的红细胞膜表面分子形貌学的改变远轻于Fenton反应体系的作用,说明尽管H2O2是Fenton体系中产生.OH的主要反应底物并对红细胞膜分子有一定作用,但是Fenton反应体系作用所引起的红细胞膜表面分子形貌学严重改变仍主要是其中的.OH自由基所为。
, 百拇医药
本文通过AFM与SEM的对比,以及AFM对自由基损伤、加女贞子保护、H2O2作用等红细胞样本的膜表面分子形貌学变化特征的观察证明:(1)AFM比SEM具有制样简单、无须喷涂导体材料及真空条件观察、nm水平的超高分辨率等优点,更适合对细胞和其它生物大分子表面形貌学进行直接观察;(2)自由基主要造成了红细胞膜表面蛋白聚集、隆起与凹陷等分子形貌学变化,恢复3h可使这些变化部分回复;(3)女贞子可减轻自由基对红细胞膜分子的损伤程度;(4)H2O2对红细胞膜分子形貌学的影响远轻于Fenton反应体系的损伤程度。
*国家自然科学基金(No.39370199)、北京市自然科学基金(No.7942013)联合支持项目
The subject is supported by the National N atural Science Foundation of China(No.39270199) and Beijing Municipal Natural S cience Foundation (No.7942013).
, http://www.100md.com
4 参考文献
[1]Binnig G and Rohrer H.Scanning tunneling microscopy.Helv Phys Acta,1982,55:726
[2]Binnig G,Quate C F and Gerber C.Atomic force microscope.Phys Rev Lett ,1986,56:930
[3]Parpura V,Haydon P G and Henderson E.Three-dimensional imaging of living neurous and glia with the atomic force microscope.J Cell Science,1993,104:4 27
[4]Kordylewski L, Saner D and Lal R.Atomic force microscopy of freeze-fracture replicas of rat atrial tissue.J Micros,1994,173(pt3):173
, 百拇医药
[5]Schoenenberger C A and Hoh J H.Slow cellular dynamics in MDCR and R5 cells monitored by time-lapse atomic force microscopy.Bioph J,1994,6 7:929
[6]Shroff S G,Saner D R and Lal R.Dynmaic micromecha nical properties of cultured rat atrial myocytes measured by atomic force miroscopy.Am J Phys,1995,269(1):c286
[7]Allen M J,Bradbury E M and Balhorn R.The natural subcellular surface structure of the bovine sperm cell.J Struct Biol,1995,114:197
, http://www.100md.com
[8]Bonfiglio A,Parodi M T and Tonini G P.Subcellular details of early events of differentiation induced by retinoic acid in human neuroblastoma cells detected by atomic force microscope.Experim Cell Res,1995 ,216:73
[9]Putman C A J,Vander Werf K O,Grooth B G,et al.Viscoel asticity of living cells allows high resolution imaging by tapping mode atomic forca microscopy.Bioph J,1994,67:1749
[10]Ushiki T,Hitomi J,Ogura S,et al.Atomic force microscopy in histology and cytology.Arch Histol Cytol,1996,59(5):421
, 百拇医药
[11]Stine W B Jr,Snyder S W,Ladror U S,et al.The nanometer-scale structure of amyloid-beta visuzlized by atomic force microscopy.J Protein Chem,1996,15(2): 193
[12]Shohei Yamashina and Masatsugu Shigeno.Application of atomic force microscopy to ultrastructural and histochemical studies of fixed and embedded cells.J E lectron Microsc,1995,44:462
[13]Firtel M,Beveridge T J.Scanning probe microscopy in microbiology.Micron,19 95,26(4):347
, 百拇医药
[14]Braet F,De Zanger R,Wisse E.Drying cells for SEM,AFM and TEM by hexamethyl disilzane:a study on hepatic endothelial cells.J Microsce,1997,186(pt1):84
[15]Zhang P C,Bai C,Huang Y M,et al.Atomic force microscopy study of fine stru ctures of the entire surface of red blood cells.Scanning Microsc.,1995,9(4):981
[16]黄益民,赵辉,虞欣,等.自由基损伤红细胞膜分子的机理研究.生物物理学报,1997,13(2):315
[17]黄益民,韩玲,金鸣,等.人心肌缺血/再灌注期间冠状窦血中红细胞流变性的改变.中华胸心血管外科杂志,1997,13(5):305
, 百拇医药
[18]黄益民,陈宝田,韩玲,等.人心肌缺血/再灌注期间红细胞膜分子流动性改变的机理研究.生物物理学报,1997,13(3):499
[19]C M Gupta.Is there any role of membrane bilaryer-skeleton interaction in maintaining the transmembrane phospholipid asymmetry in erythrocytes?Biotech Appl Bioch,1990,12:506
[20]倪静安.微量元素硒与自由基.自然杂志,1992,15(6):438
(1998-04-17收稿), http://www.100md.com