HLA-DRA基因逆转录病毒载体重组质粒的构建和包装*
作者:殷 秀 邓宇斌 李树浓n+!p^, 百拇医药
单位:殷 秀(川北医学院病理生理教研室 四川南充 637000);邓宇斌 李树浓(中山医科大学病理生理教研室 广州 510089)n+!p^, 百拇医药
关键词:HLA-DRA基因 基因转移 重组质粒 逆转录病毒载体n+!p^, 百拇医药
免疫学杂志990206摘 要 用逆转录病毒载体将HLA-DRA基因转染供体组织,使供受体之间的HLA-DR抗原表型趋于一致形成嵌合体,可能诱导免疫耐受,从而减缓受者免疫活性细胞对移植物的识别和攻击,延长移植物存活时间。本文采用新一代逆转录病毒载体连接HLA-DRA基因,构建pDOR/HLA-DRA逆转录重组质粒,经Lipofectin法包装双嗜性PA317细胞,获得高滴度感染性病毒上清,为进一步开展移植耐受研究提供了重要的实验基础。n+!p^, 百拇医药
中图号 R392.11n+!p^, 百拇医药
CONSTRUCTION AND PACKAGE OF RETROVIRALn+!p^, 百拇医药
VECTOR ENCODING HLA-DRA GENEn+!p^, 百拇医药
Yin Xiu, Deng Yubin, Li Shunongn+!p^, 百拇医药
(Department of Pathophysiology,North Sichuan Medical College,Nanchong 637000)n+!p^, 百拇医药
Abstract By gene transfer technique,the retroviral vector with HLA-DRA gene was got into the donor. Then the phenotype of HLA-DR antigen between the donor and the recipient tended to identity.It may induce immune tolerance to a certain degree,and reduce the immune cells recognition and response to the graft,and prolonged the survival of graft.In this paper,a recombination plamid was constructed by using new retroviral vector linked HLA-DRA gene.The retroviral vector encoding pDOR/HLA-DRA after packaging PA317 cell have higher infectivity.It may be used to further study on haemopoietic stem cell and to inquire into the relationship between antigenic expression of HLA-DR and graft rejection.
Key words HLA-DRA gene, Construction and package,Retroviral vetoruf-cq*, 百拇医药
众所周知,组织不相容是组织器官移植失败的主要原因,HLA不相合的脐血干细胞移植可引起严重移植物抗宿主反应(GVHR)。如何利用HLA不相适合的供体进行移植,如何提高HLA配型不完全相同的移植物的存活率,这是一个迫切需要解决的难题[1]。近年来国外研究者已进行HLA-DR的α链、β链cDNA克隆,对其核苷酸序列进行分析[2]。Korman等应用逆转录病毒载体,将HLA-DR分子α链、β链基因导入小鼠成纤维细胞NIH3T3细胞系中,获得表达产物[3]。Lotteau等应用逆转录病毒载体,将正向和反向的DRα cDNA分别插入B淋巴瘤细胞系,观察HLA-DR抗原表达的改变[4]。上述研究结果表明,转导DRα cDNA可改变细胞HLA-DR抗原的表达,为调控器官移植供受者组织相容性抗原的表达提供了线索。本研究拟构建HLA-DR基因逆转录病毒重组质粒,用Lipofectin包装PA317细胞,制备高感染性的分泌性病毒细胞克隆。为进一步将HLA-DR基因导入造血干细胞奠定了实验基础。uf-cq*, 百拇医药
1 材料与方法uf-cq*, 百拇医药
1.1 质粒、细胞系 逆转录病毒载体pDOR-neoSV(X)由中国医科院肿瘤研究所惠赠;pCDV1质粒含编码人HLA-DRα cDNA全部序列由美国NIH的Long博士惠赠;PA317细胞由第一军医大学免疫学教研室张力博士提供。uf-cq*, 百拇医药
1.2 引物设计及合成 由上海细胞生物所设计合成一对引物,上游引物在65~92bp位点,下游引物在616~642bp位点。HLA-DRA基因cDNA引物:uf-cq*, 百拇医药
5′—TGGCCATAAGTGGAGTCCCTGTGCTAGGuf-cq*, 百拇医药
3′—CCAGTGCTCCACCCTGCAGTCGTAAACuf-cq*, 百拇医药
1.3 克隆基因 方法参见文献[5],用低溶点琼脂糖回收HLA-DRA cDNA基因片段与BamH I酶切的pDOR-neo SV(X)质粒粘端连接,转化到大肠杆菌HB101菌中,涂平皿后培养过夜,挑出白色菌落进行小量扩增,硷法快速抽提质粒DNA后,电泳筛选。
1.4 筛选 取质粒DNA 10μl,0.8%琼脂糖电泳,用空载体作对照筛选已插入HLA-DRA基因的重组质粒。u]-, 百拇医药
1.5 酶切图谱鉴定 将电泳阳性的质粒DNA按常规方法用HindⅢ、SacⅠ双酶切,在溴化乙锭琼脂糖电泳中检测片段数量和游动速度,以确定插入方向。u]-, 百拇医药
1.6 重组质粒导入包装细胞 Lipofectin包裹法,参照试剂盒说明及本室常规方法进行[6]。用G418(300μg/ml)连续筛选14d,获得抗性细胞克隆,将抗性克隆用胰酶消化后转入24孔板培养,然后逐步转入50ml培养瓶扩大培养,细胞铺满后收集上清离心,过滤,冻存于-70°C备用。u]-, 百拇医药
1.7 逆转录病毒滴度的测定 用G418(400μg/ml)DMEM培养基连续筛选14d,计细胞克隆数。u]-, 百拇医药
1.8 分泌性病毒细胞系的鉴定 常规方法提取细胞组基因DNA,用苯酚∶氯仿∶异戊醇抽取2次,无水乙醇沉淀,TE溶解备用。PCR反应参照本实验室方法。扩增产物用1%琼脂糖电泳检测产物片段大小。u]-, 百拇医药
2 结果u]-, 百拇医药
2.1 构建重组质粒 质粒pCDV1带有HLA-DRA基因的cDNA,其中HLA-DRA基因cDNA长度为1236bp,5′和3′端分别有BamH I酶切位点。用BamH I限制性内切酶切得1236bp HLA-DRA基因cDNA片段,低溶点胶回收纯化后,在T4DNA连接酶的作用下与载体pDOR-neo SV(X)连接,见图1。连接物转化大肠杆菌HB101钙化菌,涂布在含氨苄青霉素的LB琼脂平板上,获得散在分布的白色菌株。 u]-, 百拇医药
u]-, 百拇医药
图 1 pDOR/HLA-DRA重组质粒构建图u]-, 百拇医药
Fig 1 The constructed map of pDOR/HLA-DRA re-combinant vectoru]-, 百拇医药
2.2 筛选 挑取分散良好的菌落接种到氨苄LB培养基中扩增,硷法小量快速制备质粒DNA,将提取上清10μl加样至0.8%琼脂糖电泳,以空载体为对照,选泳动速率缓慢的质粒DNA,筛选出5个插入HLA-DRA基因的重组质粒,见图2。
图 2 转染质粒电泳分析结果?k)elgt, 百拇医药
Fig 2 Electrophoresis analysis of transfective plasmid?k)elgt, 百拇医药
Lane A:marker (λ DNA/Hind Ⅲ) Lane B:pDOR-neo SV(X) Vector?k)elgt, 百拇医药
Lane D,H:positive clone Lane C,E,F,G:negative clone?k)elgt, 百拇医药
2.3 鉴定插入方向 逆转录病毒载体pDOR-neo SV(X)在1245bp有HindⅢ单酶切位点,HLA-DRA基因的cDNA在31bp有Sac Ⅰ单酶切位点。另外,载体pDOR-neo SV(X)3695bp有Sst Ⅰ酶切位点,该酶与Sac Ⅰ属同裂酶,用HindⅢ、SacⅠ双酶切时,获得3条片段,电泳结果出现1550bp、2450bp、3786bp片段即为正向插入;出现386bp、2450bp、4950bp片段即为反向插入。经筛选获得3个正向插入克隆,见图3。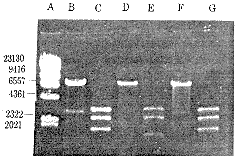 ?k)elgt, 百拇医药
?k)elgt, 百拇医药
图 3 pDOR/HLA-DRα cDNA重组质粒酶切鉴定?k)elgt, 百拇医药
Fig 3 Identification of pDOR/HLA-DRA cDNA plasmid by restriction enzyme?k)elgt, 百拇医药
Lane A:marker (λ DNA/Hind Ⅲ)?k)elgt, 百拇医药
Lane B,D,F:pDOR/HLA-DRA cleaved by Hind Ⅲ?k)elgt, 百拇医药
Lane C,E,G:pDOR/HLA-DRA bi-cleaved by HindⅢ,Sac Ⅰ?k)elgt, 百拇医药
2.4 抗性细胞克隆 用Lipofectin将pDOR/HLA-DRA基因逆转录病毒重组质粒导入PA317包装细胞,用含G418选择性培养基筛选抗性细胞克隆,第3~4d可见非抗性细胞开始死亡,第7d大量非抗性细胞死亡,有散在抗性细胞生长,第10~14d逐渐形成肉眼可见的抗性细胞克隆,见图4。
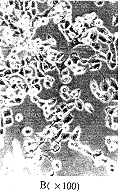
图 4 分泌双嗜性重组质粒逆转录病毒pDOR/HLA-DRA的抗G418细胞克隆hs, 百拇医药
Fig 4 The G418-resistant clone capable of secreting am-phophilic recombinant retrovirus pDOR/HLA-DRAhs, 百拇医药
2.5 病毒滴度 用反复感染的PA317细胞上清感染NIH3T3细胞,G418选择培养连续筛选14d。2周后根据克隆数计算出病毒滴度为2.8×104CFU/ml。hs, 百拇医药
2.6 分泌病毒细胞系的鉴定 提取PA317细胞DNA,以HLA-DRA基因特异引物进行PCR扩增反应,结果显示转染外源基因的PA317细胞出现扩增产物577bp,未转染的PA317细胞未见相应扩增产物。证明转染的PA317细胞基因组中已整合HLA-DRA基因,提示转染成功。hs, 百拇医药
3 讨论hs, 百拇医药
组织、器官移植成败的关键与MHC相合与否有密切关系,MHC-Ⅱ类分子对外源性抗原提呈具有关键作用。已证明MHC-Ⅱ类抗原,尤其是DR抗原的相配可显著减轻排斥反应,延长移植物的存活。HLA-DRα,β链分别由DRA和DRB基因编码。DRA基因有5个外显子,DRB基因有6个外显子,它们分别编码α和β链相应的结构区域,共同决定DR抗原的表达,DR亚区有1个A基因,9个B基因,其中5个B基因是假基因(Pseudogene),多态性程度最高的是DRB1,A基因无多态性。目前DRA基因和DRB基因都已被克隆并且制成cDNA探针。本实验选用DRA基因cDNA作为目的基因进行研究。hs, 百拇医药
人工构建的目的基因一般不含启动子等调控序列,导入靶细胞后难以获得表达。因此,必须将目的基因重组于表达载体的合适位置,在特定调控序列指导下进行表达。目前常选用逆转录病毒载体,该类载体转染靶细胞具有高度感染性,结构基因编码的整合酶(integrase)可以催化外源基因与靶细胞染色体DNA的整合,表达稳定,宿主细胞通常不受损伤。本研究选用的逆转录病毒载体pDOR-neoSV(X)是Moloney小鼠白血病病毒(Mo-MLV)改建的一类前病毒DNA序列,全长6550bp,结构见图1。hs, 百拇医药
利用其5′端的长末端重复序列(5′-LTR)能有效地转录及表达外源基因的特性。用BamH I限制性内切酶把pDOR-neoSV(X)的5′-LTR下游890bp处切开成为线性分子,将HLA-DRA基因(1236bp)克隆到该载体上,构建成pDOR/HLA-DRA基因重组质粒。利用抗药性筛选,取氨苄LB培养板上生长的白色菌株进一步做琼脂糖电泳,以空载体为对照,筛选移动速度缓慢的克隆DNA,即为插入目的基因的重组质粒,利用pDOR-neo SV(X)5′端1245bp在HindⅢ限制性内切位点,3695bp有SstⅠ限制性内切酶位点,目的基因31bp有SacⅠ限制内切酶位点,鉴定克隆插入方向,选出插入pDOR-DRA基因的逆转录病毒重组质粒,为进一步研究奠定了基础。
目的基因与病毒载体重组形成重组质粒载体,可应用物理的、化学的以及融合的方法将其导入靶细胞而得到表达,也可将这种重组质粒进行不同方式的包装,再感染靶细胞,以将目的基因带入靶细胞,并得到表达产物。本文将重组载体导入PA317细胞包装,形成具有感染性的假病毒颗粒(pseudoviral particle),后者在感染靶细胞的同时,也将目的基因导入靶细胞内,从而实现基因转移。p, 百拇医药
本研究使用的逆转录病毒载体pDOR-neoSV(X)去除了野生型病毒编码基因gag,pol和env,保留了顺式作用序列5′-LTR,3′-LTR,Ψ2包装序列和PBR322细菌质粒及新霉素转移酶-neo基因。该酶对氨基甙类抗菌素G418具有抗药性,可用于筛选。G418主要干扰真核细胞80S核糖体的功能,从而抑制蛋白质合成使细胞死亡,对分裂期细胞的杀伤力更明显。新霉素转移酶对新霉素衍生物G418具有磷酸化作用,使之灭活,故含有neo基因重组体的细胞可以在含G418培养基中存活,增殖,用于筛选抗性克隆。p, 百拇医药
由于pDOR-neo SV(X)逆转录病毒载体缺失反式功能部分,不能自行装配成完整病毒颗粒,需借助包装细胞的包装才能形成假病毒颗粒。本研究选用PA317包装细胞系,属于Amphotropic双嗜性包装细胞,它已删除了包装信号Ψ2,3′-LTR被SV40的转录终止步骤化A信号取代。另外,5′-LTR的部分序列、剪切供体位点及Ψ信号上游等多处位点均被改造,经过上述改造的辅助病毒与逆转录病毒载体之间要经过至少2次以上的独立重组才能产生野生型病毒,使其应用安全性得到了明显提高。PA317包装细胞以反式方式给相继转入的逆转录病毒载体提供gag、pol、env等反式功能基因表达的蛋白,使逆转录病毒载体可以包装成仅具有一次感染性,仍不能自行装配成完整病毒颗粒的缺陷形成—假病毒颗粒。这种假病毒颗粒可以分泌到包装细胞的培养上清液中,具有对靶细胞的感染能力,能成功地将外源基因导入并整合到宿主细胞的染色体DNA上,使外源基因成为宿主细胞染色体DNA的一部分,靶细胞成为稳定表达目的基因的转化细胞。p, 百拇医药
逆转录病毒载体-包装细胞系的基因转移,无论是转移效率还是稳定表达的形成率均较高,若将包装细胞的培养上清与基因治疗的靶细胞共孵,则假病毒颗粒可借助包膜上的糖蛋白与宿主细胞膜上的特异性受体相结合,将其遗传物质导入靶细胞,与靶细胞染色体DNA整合,这一过程也同时将外源基因变成了靶细胞基因组的一部分,从而实现目的基因的转移。p, 百拇医药
本实验用Lipofectin(脂质体)将重组质粒导入双嗜性包装细胞中。Lipofectin为一种阳离子脂质体,在加入待转移的呈负电性DNA水溶液后,该正电性络合物很容易与负电性细胞表面结合,经内吞作用进入细胞。Ieay-Te报导了通过脂质体介导的方法将人HLA-B7基因导入动物系统的肿瘤细胞导致肿瘤排斥,获得较好的结果[7]。脂质体介导的基因转移安全无副作用,操作简便,结果稳定。其特点是:①脂质体制备及转化方法简单;②能络合100%DNA,适用DNA和RDA;③可转化几乎任何类型细胞;④较其它非病毒体相比其转化率高;⑤不具免疫原性和生物毒性,在体内可直接介导基因转移;⑥可反复使用。对导入重组质粒的包装细胞,用G418(300μg/ml)培养基进行筛选,获得阳性细胞克隆,每60mm平板有5~20个克隆,说明Lipofectin介导的重组质粒方法可靠。
本文用PCR技术检测转染的PA317包装细胞基因组是否有目的基因存在,其方法特异、灵敏、简便。结果表明扩增产物与理论值片段大小一样,可判定外源性目的基因已插入成功。逆转录病毒载体经过包装细胞包装后可产生高滴度的重组病毒颗粒[8],可用于感染靶细胞,深入进行基础研究以及临床应用[9,10]。qe/0, http://www.100md.com
* 美国中华医学基金会(CMB)资助课题qe/0, http://www.100md.com
作者简介 第一作者:女,36岁,硕士,副教授,CMB访问学者qe/0, http://www.100md.com
参考文献qe/0, http://www.100md.com
1 Brenner MK,Mc Garrity GJ,Kohn DB,et al.The practice of clinical gene therapy.Hematology, Education Program American Society of Hematology,1995.93qe/0, http://www.100md.com
2 Lee JS,Trowsdale J,Bodmer WF,et al.cDNA clones coding for the heavy chain of human HLA-DR antigen.Proc Natl Acad Sci USA,1982,79:545qe/0, http://www.100md.com
3 Korman AJ,Frantz JD,Strominger JL,et al.Expression of human class Ⅱ major histocompatibility complex antigens using retrovirus vector.Proc Nat1 Acad Sci USA,1987,84(8):2150qe/0, http://www.100md.com
4 Lotteau V,Sands J,Teyton L,et al.Modulation of HLA class Ⅱ antigen expression by transfection of sense and antisense DRA cDNA.J Exp Med,1989,169(1):351qe/0, http://www.100md.com
5 萨姆布鲁克.分子克隆实验指南.第2版.金冬雁,译.北京:科学技术出版社,1989.152qe/0, http://www.100md.com
6 姜 泊,张亚历,周殿元.分子生物学常用实验方法.北京:人民军医出版社,1996.152qe/0, http://www.100md.com
7 Wckert W,Welther W.Retrovirus-mediated gene transfer in cancer therapy.Pharmac,1994, 63:323qe/0, http://www.100md.com
8 Kozak SL,Kabat D.Ping-pong amplification of retroviral vector achieves high-level gene expression:human growth hormone production.J Virology,1990,64(7):3500qe/0, http://www.100md.com
9 Thomas R,Bauer JR,Dennis D,et al.Transduction of human hematopoietic cells and cell lines using a retroviral vector containing a modified murine CD4 reporter gene.Human Gene Therapy,1997,8(2):243qe/0, http://www.100md.com
10 王建安,马宏进,赖春宁,等.外源基因在人造血干祖细胞中的转移和表达.中国免疫学杂志,1996,12:335qe/0, http://www.100md.com
(1998-09-07收稿;1998-11-02修回)(殷 秀 邓宇斌 李树浓)
单位:殷 秀(川北医学院病理生理教研室 四川南充 637000);邓宇斌 李树浓(中山医科大学病理生理教研室 广州 510089)n+!p^, 百拇医药
关键词:HLA-DRA基因 基因转移 重组质粒 逆转录病毒载体n+!p^, 百拇医药
免疫学杂志990206摘 要 用逆转录病毒载体将HLA-DRA基因转染供体组织,使供受体之间的HLA-DR抗原表型趋于一致形成嵌合体,可能诱导免疫耐受,从而减缓受者免疫活性细胞对移植物的识别和攻击,延长移植物存活时间。本文采用新一代逆转录病毒载体连接HLA-DRA基因,构建pDOR/HLA-DRA逆转录重组质粒,经Lipofectin法包装双嗜性PA317细胞,获得高滴度感染性病毒上清,为进一步开展移植耐受研究提供了重要的实验基础。n+!p^, 百拇医药
中图号 R392.11n+!p^, 百拇医药
CONSTRUCTION AND PACKAGE OF RETROVIRALn+!p^, 百拇医药
VECTOR ENCODING HLA-DRA GENEn+!p^, 百拇医药
Yin Xiu, Deng Yubin, Li Shunongn+!p^, 百拇医药
(Department of Pathophysiology,North Sichuan Medical College,Nanchong 637000)n+!p^, 百拇医药
Abstract By gene transfer technique,the retroviral vector with HLA-DRA gene was got into the donor. Then the phenotype of HLA-DR antigen between the donor and the recipient tended to identity.It may induce immune tolerance to a certain degree,and reduce the immune cells recognition and response to the graft,and prolonged the survival of graft.In this paper,a recombination plamid was constructed by using new retroviral vector linked HLA-DRA gene.The retroviral vector encoding pDOR/HLA-DRA after packaging PA317 cell have higher infectivity.It may be used to further study on haemopoietic stem cell and to inquire into the relationship between antigenic expression of HLA-DR and graft rejection.
Key words HLA-DRA gene, Construction and package,Retroviral vetoruf-cq*, 百拇医药
众所周知,组织不相容是组织器官移植失败的主要原因,HLA不相合的脐血干细胞移植可引起严重移植物抗宿主反应(GVHR)。如何利用HLA不相适合的供体进行移植,如何提高HLA配型不完全相同的移植物的存活率,这是一个迫切需要解决的难题[1]。近年来国外研究者已进行HLA-DR的α链、β链cDNA克隆,对其核苷酸序列进行分析[2]。Korman等应用逆转录病毒载体,将HLA-DR分子α链、β链基因导入小鼠成纤维细胞NIH3T3细胞系中,获得表达产物[3]。Lotteau等应用逆转录病毒载体,将正向和反向的DRα cDNA分别插入B淋巴瘤细胞系,观察HLA-DR抗原表达的改变[4]。上述研究结果表明,转导DRα cDNA可改变细胞HLA-DR抗原的表达,为调控器官移植供受者组织相容性抗原的表达提供了线索。本研究拟构建HLA-DR基因逆转录病毒重组质粒,用Lipofectin包装PA317细胞,制备高感染性的分泌性病毒细胞克隆。为进一步将HLA-DR基因导入造血干细胞奠定了实验基础。uf-cq*, 百拇医药
1 材料与方法uf-cq*, 百拇医药
1.1 质粒、细胞系 逆转录病毒载体pDOR-neoSV(X)由中国医科院肿瘤研究所惠赠;pCDV1质粒含编码人HLA-DRα cDNA全部序列由美国NIH的Long博士惠赠;PA317细胞由第一军医大学免疫学教研室张力博士提供。uf-cq*, 百拇医药
1.2 引物设计及合成 由上海细胞生物所设计合成一对引物,上游引物在65~92bp位点,下游引物在616~642bp位点。HLA-DRA基因cDNA引物:uf-cq*, 百拇医药
5′—TGGCCATAAGTGGAGTCCCTGTGCTAGGuf-cq*, 百拇医药
3′—CCAGTGCTCCACCCTGCAGTCGTAAACuf-cq*, 百拇医药
1.3 克隆基因 方法参见文献[5],用低溶点琼脂糖回收HLA-DRA cDNA基因片段与BamH I酶切的pDOR-neo SV(X)质粒粘端连接,转化到大肠杆菌HB101菌中,涂平皿后培养过夜,挑出白色菌落进行小量扩增,硷法快速抽提质粒DNA后,电泳筛选。
1.4 筛选 取质粒DNA 10μl,0.8%琼脂糖电泳,用空载体作对照筛选已插入HLA-DRA基因的重组质粒。u]-, 百拇医药
1.5 酶切图谱鉴定 将电泳阳性的质粒DNA按常规方法用HindⅢ、SacⅠ双酶切,在溴化乙锭琼脂糖电泳中检测片段数量和游动速度,以确定插入方向。u]-, 百拇医药
1.6 重组质粒导入包装细胞 Lipofectin包裹法,参照试剂盒说明及本室常规方法进行[6]。用G418(300μg/ml)连续筛选14d,获得抗性细胞克隆,将抗性克隆用胰酶消化后转入24孔板培养,然后逐步转入50ml培养瓶扩大培养,细胞铺满后收集上清离心,过滤,冻存于-70°C备用。u]-, 百拇医药
1.7 逆转录病毒滴度的测定 用G418(400μg/ml)DMEM培养基连续筛选14d,计细胞克隆数。u]-, 百拇医药
1.8 分泌性病毒细胞系的鉴定 常规方法提取细胞组基因DNA,用苯酚∶氯仿∶异戊醇抽取2次,无水乙醇沉淀,TE溶解备用。PCR反应参照本实验室方法。扩增产物用1%琼脂糖电泳检测产物片段大小。u]-, 百拇医药
2 结果u]-, 百拇医药
2.1 构建重组质粒 质粒pCDV1带有HLA-DRA基因的cDNA,其中HLA-DRA基因cDNA长度为1236bp,5′和3′端分别有BamH I酶切位点。用BamH I限制性内切酶切得1236bp HLA-DRA基因cDNA片段,低溶点胶回收纯化后,在T4DNA连接酶的作用下与载体pDOR-neo SV(X)连接,见图1。连接物转化大肠杆菌HB101钙化菌,涂布在含氨苄青霉素的LB琼脂平板上,获得散在分布的白色菌株。
 u]-, 百拇医药
u]-, 百拇医药图 1 pDOR/HLA-DRA重组质粒构建图u]-, 百拇医药
Fig 1 The constructed map of pDOR/HLA-DRA re-combinant vectoru]-, 百拇医药
2.2 筛选 挑取分散良好的菌落接种到氨苄LB培养基中扩增,硷法小量快速制备质粒DNA,将提取上清10μl加样至0.8%琼脂糖电泳,以空载体为对照,选泳动速率缓慢的质粒DNA,筛选出5个插入HLA-DRA基因的重组质粒,见图2。

图 2 转染质粒电泳分析结果?k)elgt, 百拇医药
Fig 2 Electrophoresis analysis of transfective plasmid?k)elgt, 百拇医药
Lane A:marker (λ DNA/Hind Ⅲ) Lane B:pDOR-neo SV(X) Vector?k)elgt, 百拇医药
Lane D,H:positive clone Lane C,E,F,G:negative clone?k)elgt, 百拇医药
2.3 鉴定插入方向 逆转录病毒载体pDOR-neo SV(X)在1245bp有HindⅢ单酶切位点,HLA-DRA基因的cDNA在31bp有Sac Ⅰ单酶切位点。另外,载体pDOR-neo SV(X)3695bp有Sst Ⅰ酶切位点,该酶与Sac Ⅰ属同裂酶,用HindⅢ、SacⅠ双酶切时,获得3条片段,电泳结果出现1550bp、2450bp、3786bp片段即为正向插入;出现386bp、2450bp、4950bp片段即为反向插入。经筛选获得3个正向插入克隆,见图3。
 ?k)elgt, 百拇医药
?k)elgt, 百拇医药图 3 pDOR/HLA-DRα cDNA重组质粒酶切鉴定?k)elgt, 百拇医药
Fig 3 Identification of pDOR/HLA-DRA cDNA plasmid by restriction enzyme?k)elgt, 百拇医药
Lane A:marker (λ DNA/Hind Ⅲ)?k)elgt, 百拇医药
Lane B,D,F:pDOR/HLA-DRA cleaved by Hind Ⅲ?k)elgt, 百拇医药
Lane C,E,G:pDOR/HLA-DRA bi-cleaved by HindⅢ,Sac Ⅰ?k)elgt, 百拇医药
2.4 抗性细胞克隆 用Lipofectin将pDOR/HLA-DRA基因逆转录病毒重组质粒导入PA317包装细胞,用含G418选择性培养基筛选抗性细胞克隆,第3~4d可见非抗性细胞开始死亡,第7d大量非抗性细胞死亡,有散在抗性细胞生长,第10~14d逐渐形成肉眼可见的抗性细胞克隆,见图4。


图 4 分泌双嗜性重组质粒逆转录病毒pDOR/HLA-DRA的抗G418细胞克隆hs, 百拇医药
Fig 4 The G418-resistant clone capable of secreting am-phophilic recombinant retrovirus pDOR/HLA-DRAhs, 百拇医药
2.5 病毒滴度 用反复感染的PA317细胞上清感染NIH3T3细胞,G418选择培养连续筛选14d。2周后根据克隆数计算出病毒滴度为2.8×104CFU/ml。hs, 百拇医药
2.6 分泌病毒细胞系的鉴定 提取PA317细胞DNA,以HLA-DRA基因特异引物进行PCR扩增反应,结果显示转染外源基因的PA317细胞出现扩增产物577bp,未转染的PA317细胞未见相应扩增产物。证明转染的PA317细胞基因组中已整合HLA-DRA基因,提示转染成功。hs, 百拇医药
3 讨论hs, 百拇医药
组织、器官移植成败的关键与MHC相合与否有密切关系,MHC-Ⅱ类分子对外源性抗原提呈具有关键作用。已证明MHC-Ⅱ类抗原,尤其是DR抗原的相配可显著减轻排斥反应,延长移植物的存活。HLA-DRα,β链分别由DRA和DRB基因编码。DRA基因有5个外显子,DRB基因有6个外显子,它们分别编码α和β链相应的结构区域,共同决定DR抗原的表达,DR亚区有1个A基因,9个B基因,其中5个B基因是假基因(Pseudogene),多态性程度最高的是DRB1,A基因无多态性。目前DRA基因和DRB基因都已被克隆并且制成cDNA探针。本实验选用DRA基因cDNA作为目的基因进行研究。hs, 百拇医药
人工构建的目的基因一般不含启动子等调控序列,导入靶细胞后难以获得表达。因此,必须将目的基因重组于表达载体的合适位置,在特定调控序列指导下进行表达。目前常选用逆转录病毒载体,该类载体转染靶细胞具有高度感染性,结构基因编码的整合酶(integrase)可以催化外源基因与靶细胞染色体DNA的整合,表达稳定,宿主细胞通常不受损伤。本研究选用的逆转录病毒载体pDOR-neoSV(X)是Moloney小鼠白血病病毒(Mo-MLV)改建的一类前病毒DNA序列,全长6550bp,结构见图1。hs, 百拇医药
利用其5′端的长末端重复序列(5′-LTR)能有效地转录及表达外源基因的特性。用BamH I限制性内切酶把pDOR-neoSV(X)的5′-LTR下游890bp处切开成为线性分子,将HLA-DRA基因(1236bp)克隆到该载体上,构建成pDOR/HLA-DRA基因重组质粒。利用抗药性筛选,取氨苄LB培养板上生长的白色菌株进一步做琼脂糖电泳,以空载体为对照,筛选移动速度缓慢的克隆DNA,即为插入目的基因的重组质粒,利用pDOR-neo SV(X)5′端1245bp在HindⅢ限制性内切位点,3695bp有SstⅠ限制性内切酶位点,目的基因31bp有SacⅠ限制内切酶位点,鉴定克隆插入方向,选出插入pDOR-DRA基因的逆转录病毒重组质粒,为进一步研究奠定了基础。
目的基因与病毒载体重组形成重组质粒载体,可应用物理的、化学的以及融合的方法将其导入靶细胞而得到表达,也可将这种重组质粒进行不同方式的包装,再感染靶细胞,以将目的基因带入靶细胞,并得到表达产物。本文将重组载体导入PA317细胞包装,形成具有感染性的假病毒颗粒(pseudoviral particle),后者在感染靶细胞的同时,也将目的基因导入靶细胞内,从而实现基因转移。p, 百拇医药
本研究使用的逆转录病毒载体pDOR-neoSV(X)去除了野生型病毒编码基因gag,pol和env,保留了顺式作用序列5′-LTR,3′-LTR,Ψ2包装序列和PBR322细菌质粒及新霉素转移酶-neo基因。该酶对氨基甙类抗菌素G418具有抗药性,可用于筛选。G418主要干扰真核细胞80S核糖体的功能,从而抑制蛋白质合成使细胞死亡,对分裂期细胞的杀伤力更明显。新霉素转移酶对新霉素衍生物G418具有磷酸化作用,使之灭活,故含有neo基因重组体的细胞可以在含G418培养基中存活,增殖,用于筛选抗性克隆。p, 百拇医药
由于pDOR-neo SV(X)逆转录病毒载体缺失反式功能部分,不能自行装配成完整病毒颗粒,需借助包装细胞的包装才能形成假病毒颗粒。本研究选用PA317包装细胞系,属于Amphotropic双嗜性包装细胞,它已删除了包装信号Ψ2,3′-LTR被SV40的转录终止步骤化A信号取代。另外,5′-LTR的部分序列、剪切供体位点及Ψ信号上游等多处位点均被改造,经过上述改造的辅助病毒与逆转录病毒载体之间要经过至少2次以上的独立重组才能产生野生型病毒,使其应用安全性得到了明显提高。PA317包装细胞以反式方式给相继转入的逆转录病毒载体提供gag、pol、env等反式功能基因表达的蛋白,使逆转录病毒载体可以包装成仅具有一次感染性,仍不能自行装配成完整病毒颗粒的缺陷形成—假病毒颗粒。这种假病毒颗粒可以分泌到包装细胞的培养上清液中,具有对靶细胞的感染能力,能成功地将外源基因导入并整合到宿主细胞的染色体DNA上,使外源基因成为宿主细胞染色体DNA的一部分,靶细胞成为稳定表达目的基因的转化细胞。p, 百拇医药
逆转录病毒载体-包装细胞系的基因转移,无论是转移效率还是稳定表达的形成率均较高,若将包装细胞的培养上清与基因治疗的靶细胞共孵,则假病毒颗粒可借助包膜上的糖蛋白与宿主细胞膜上的特异性受体相结合,将其遗传物质导入靶细胞,与靶细胞染色体DNA整合,这一过程也同时将外源基因变成了靶细胞基因组的一部分,从而实现目的基因的转移。p, 百拇医药
本实验用Lipofectin(脂质体)将重组质粒导入双嗜性包装细胞中。Lipofectin为一种阳离子脂质体,在加入待转移的呈负电性DNA水溶液后,该正电性络合物很容易与负电性细胞表面结合,经内吞作用进入细胞。Ieay-Te报导了通过脂质体介导的方法将人HLA-B7基因导入动物系统的肿瘤细胞导致肿瘤排斥,获得较好的结果[7]。脂质体介导的基因转移安全无副作用,操作简便,结果稳定。其特点是:①脂质体制备及转化方法简单;②能络合100%DNA,适用DNA和RDA;③可转化几乎任何类型细胞;④较其它非病毒体相比其转化率高;⑤不具免疫原性和生物毒性,在体内可直接介导基因转移;⑥可反复使用。对导入重组质粒的包装细胞,用G418(300μg/ml)培养基进行筛选,获得阳性细胞克隆,每60mm平板有5~20个克隆,说明Lipofectin介导的重组质粒方法可靠。
本文用PCR技术检测转染的PA317包装细胞基因组是否有目的基因存在,其方法特异、灵敏、简便。结果表明扩增产物与理论值片段大小一样,可判定外源性目的基因已插入成功。逆转录病毒载体经过包装细胞包装后可产生高滴度的重组病毒颗粒[8],可用于感染靶细胞,深入进行基础研究以及临床应用[9,10]。qe/0, http://www.100md.com
* 美国中华医学基金会(CMB)资助课题qe/0, http://www.100md.com
作者简介 第一作者:女,36岁,硕士,副教授,CMB访问学者qe/0, http://www.100md.com
参考文献qe/0, http://www.100md.com
1 Brenner MK,Mc Garrity GJ,Kohn DB,et al.The practice of clinical gene therapy.Hematology, Education Program American Society of Hematology,1995.93qe/0, http://www.100md.com
2 Lee JS,Trowsdale J,Bodmer WF,et al.cDNA clones coding for the heavy chain of human HLA-DR antigen.Proc Natl Acad Sci USA,1982,79:545qe/0, http://www.100md.com
3 Korman AJ,Frantz JD,Strominger JL,et al.Expression of human class Ⅱ major histocompatibility complex antigens using retrovirus vector.Proc Nat1 Acad Sci USA,1987,84(8):2150qe/0, http://www.100md.com
4 Lotteau V,Sands J,Teyton L,et al.Modulation of HLA class Ⅱ antigen expression by transfection of sense and antisense DRA cDNA.J Exp Med,1989,169(1):351qe/0, http://www.100md.com
5 萨姆布鲁克.分子克隆实验指南.第2版.金冬雁,译.北京:科学技术出版社,1989.152qe/0, http://www.100md.com
6 姜 泊,张亚历,周殿元.分子生物学常用实验方法.北京:人民军医出版社,1996.152qe/0, http://www.100md.com
7 Wckert W,Welther W.Retrovirus-mediated gene transfer in cancer therapy.Pharmac,1994, 63:323qe/0, http://www.100md.com
8 Kozak SL,Kabat D.Ping-pong amplification of retroviral vector achieves high-level gene expression:human growth hormone production.J Virology,1990,64(7):3500qe/0, http://www.100md.com
9 Thomas R,Bauer JR,Dennis D,et al.Transduction of human hematopoietic cells and cell lines using a retroviral vector containing a modified murine CD4 reporter gene.Human Gene Therapy,1997,8(2):243qe/0, http://www.100md.com
10 王建安,马宏进,赖春宁,等.外源基因在人造血干祖细胞中的转移和表达.中国免疫学杂志,1996,12:335qe/0, http://www.100md.com
(1998-09-07收稿;1998-11-02修回)(殷 秀 邓宇斌 李树浓)