植物双生病毒的复制及转录调控研究进展
作者:谢迎秋 朱祯
单位:中国科学院遗传研究所,北京 100101
关键词:
病毒学报990413 中图分类号:S432.4 文献标识码:A 文章编号:1000-8721(1999)-0372-10
双生病毒(Geminiviruses)是一类具有孪生颗粒形态的植物病毒,颗粒大小约为18nm×30nm。双生病毒成员众多,大致可分为三个亚组。双生病毒通常以粉虱或叶蝉为媒介进行传播,侵染范围十分广泛,对农业生产造成巨大的危害。感病植株一般表现为花叶、曲叶、黄化等症状,严重地影响了植物的正常生长。最近几年,属于双生病毒亚组Ⅲ的棉花曲叶病毒(Cotton leaf curl virus,CLCuV)在印巴次大陆广泛流行,严重时可使棉花绝收。双生病毒基因组DNA为单链环状形式,长度约为2 400nt~3 000nt。对双生病毒基因组结构、遗传表达机制,及其分类和进化进行深入的了解,有助于揭示寄主植物与病毒相互间的作用方式,进而为防治由双生病毒引起的植物病害奠定基础。本文就上述内容的最新进展作一简要综述。
, http://www.100md.com
1 双生病毒的分类及进化
依据病毒基因组结构、寄主范围及其昆虫传播媒体,双生病毒可划分为三个亚组[1](表1)。亚组Ⅰ和亚组Ⅱ双生病毒基因组为单组份,即只含有一个单链环状DNA基因组成分,这两类双生病毒主要由叶蝉传播。亚组Ⅲ双生病毒依赖粉虱传播,基因组大多为双组份,较大的为DNA A,小的为DNA B。亚组Ⅲ中也有些为单组份,如棉花曲叶病毒巴基斯坦株系(CLCuV-PK)。亚组Ⅱ毒粒链(virion-sense strand)的读码框(ORF)与亚组Ⅰ的相似,互补链(complementary-sense strand)ORF则与亚组Ⅲ的相似。双生病毒的分类及基因组结构特点详见表1、图1[2,3]。
表1 双生病毒分类
Table 1 Classification of geminiviruses
, 百拇医药
亚组Subgroup
Ⅰ
Ⅱ
Ⅲ
基因组成分Component of genome
A
A
A、B或A
主要昆虫介体Main insect vector
叶蝉
叶蝉或树蝉
粉虱
, http://www.100md.com
寄主范围Host range
单子叶植物
双子叶植物
双子叶植物
代表成员Type member
玉米条纹病毒(MSV)
甜菜曲顶病毒(BCTV)
蚕豆金色花叶病毒(BGMV)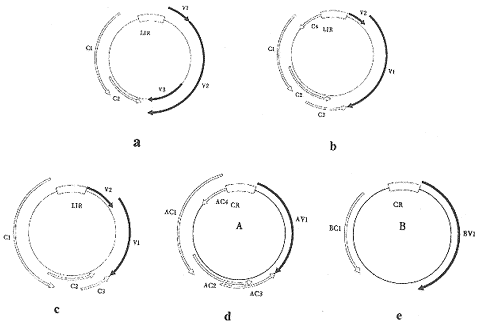
图1 亚组Ⅰ、亚组Ⅱ、亚组Ⅲ双生病毒基因组结构[3,4]
a:亚组Ⅰ,玉米条纹病毒-尼日利亚株系;b:亚组Ⅱ,甜菜曲顶病毒;c:亚组Ⅲ,单组份病毒棉花曲叶病毒-巴基斯坦株系;d:亚组Ⅲ,双组份病毒番茄金色花叶病毒A组份;e:亚组Ⅲ,双组份病毒番茄金色花叶病毒B组份。 CR:共同区;LIR:大基因间区;黑色箭头示毒粒链读码框;空心箭头示互补链读码框。
, 百拇医药
Figure 1 Genome structures of Subgroup Ⅰ, subgroupⅡ(beet curly top virus) and subgroupⅢ (cotton leaf curl virus-Pakistan, tomato golden mosaic virus)
a: SubgroupⅠ, maize streak virus-Nigerian; b: SubgroupⅡ, Beet curly top virus; c: SubgroupⅢ, monopartite cotton leaf curl virus-Pakistan; d: Subgroup Ⅲ, bipartite tomato golden mosaic virus DNA A; e: SubgroupⅢ, bipartite tomato golden mosaic virus DNA B.CR: common region; LIR: large intergenic region. Shaded arrow represents viron-sense ORF; unfilled arrow represents complementary-sense ORF.
, http://www.100md.com
双生病毒类群很可能是由叶蝉传播侵染单子叶植物的单组份双生病毒(亚组Ⅰ)演化来的。在长期的进化过程中,由于地理隔离,媒体昆虫的交叉传播,病毒基因组间重组,以及寄主植物进化等诸多因素的影响,逐渐进化产生了由粉虱传播侵染双子叶植物的亚组Ⅲ病毒。CLCuV-PK是新近发现的一种亚组Ⅲ病毒,其基因组中含有许多未知序列的小DNA分子,这很可能是近期进化的结果[3,4]。亚组Ⅱ双生病毒仅发现了4种,其进化方式尚不清楚。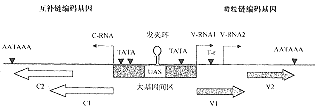
图2 单组份双生病毒(亚组Ⅰ)基因组结构[5]
AATAAA:Poly(A)信号;TATA:TATA盒;T-r:T富集区;UAS:上游激活序列;V-RNA1:毒粒链转录物1 5'端区域;V-RNA2:毒粒链转录物2 5'端区域;C-RNA:互补链转录物5'端区域;V1:V1基因,编码运动蛋白;V2:V2基因,编码外壳蛋白;C1:C1读码框;C2:C2读码框。
, 百拇医药
Figure 2 Genome structure of the monopartite geminivirus (Subgroup Ⅰ)
AATAAA:Poly(A) signal;l TATA:TATA box; T-r: T rich region; UAS: Upstream activating region; V-RNA1: 5′ end of mRNA1 of virion-sense strand; V-RNA2: 5′ end of mRNA2 of virion-sense strand; C-RNA : 5′ end of mRNA of complementary-sense strand ; V1:V1 gene, coding movement protein; V2:V2 gene, coding coat protein; C1: C1 open reading frame; C2: C2 open reading frame.
, 百拇医药
2 双生病毒基因组结构
植物双生病毒基因组是通过毒粒链和互补链共同编码的(图2)[5]。毒粒链编码外壳蛋白等,互补链编码复制相关蛋白及一些调控蛋白(表2)。单组份双生病毒基因组编码产物根据所在毒粒链或互补链而分别命名为Vn(n为ORF序数)或Cn;双组份基因组ORF依其所在组份、所在毒粒链或互补链而分别命名为AVn、ACn或BVn、BCn。然而,有些文献按转录方向进行命名,称毒粒链为右向转录链,ORF命名为ARn(Rn)或BRn;相应的互补链即左向转录链,ORF命名为ALn(Ln)或BLn(本文为叙述方便,除特别注明外一律采用前者)。亚组Ⅰ双生病毒如小麦矮缩病毒(Wheat dwarf virus,WDV)、玉米条纹病毒(Maize streak virus,MSV)等(参见图2)互补链ORF与亚组Ⅲ显著不同,其C1和C2读码框重叠处含有一内含子,经剪接加工后产生的RNA转译产物为C1:C2融合蛋白,约41kD。在WDV中,C1:C2蛋白是一种多功能蛋白(Multifunctional protein),兼有亚组Ⅲ的AC1和AC2蛋白功能[6]。
, 百拇医药
表2 亚组Ⅲ双组份双生病毒基因组编码产物(包括亚组Ⅰ、Ⅱ同源的基因产物)
Table 2 Genomic coding products of bipartite geminivirus in subgroupⅢ(homologous products from subgroup Ⅰand subgroupⅡalso are involved) 基因产物
分子量(kD)
蛋白的功能
Gene products
M.W.(kD)
Function of proteins
AC1(或C1、C1:C2)
, 百拇医药
40
参与毒粒链复制的起始,具有位点特异性核酸酶及连接酶活性,能在转录水平自我抑制表达。同时,它还是一种DNA序列特异性结合蛋白,可能也参与寄主细胞周期调控。
AC2(或C2、C1:C2)
15~20
反式激活因子,可刺激AV1及BV1等晚期基因的表达,可能具有非特异性DNA结合蛋白功能。
AC3(C3)
14~16
增强病毒的复制效率。
AC4(C4)
15
, 百拇医药
可能与病状发生及病毒在植物体内运动有关;其有可能抑制AC1的表达。
AV1(V1)
27~30
病毒外壳蛋白,亚组Ⅰ中与病毒运动有关。
AV2(V2)
13
在亚组Ⅲ中的功能未知,在亚组Ⅰ中为病毒外壳蛋白,亚组Ⅱ中与病毒运动有关。
BC1
34
与病毒运动、症状发生及寄主范围有关。
BV1
, 百拇医药
30
与病毒运动及寄主范围有关。
3 双生病毒复制及转录调控的相关序列
毒粒链第一个ORF和互补链第一个ORF之间存在一大基因间区(large intergenic region,LIR)(图2),约300nt;对于双组份病毒而言,LIR称为共同区(common region,CR),A、B两组份的CR序列相似,但不同种双生病毒之间CR差异较大。LIR(CR)通常包括位于中部的上游激活序列(upstream activating sequence,UAS),以及位于两端的双向启动子序列,LIR(CR)序列与基因组复制和基因转录密切相关。
3.1 上游激活序列(UAS)
UAS通常具有一个约30nt的发夹环结构(hairpin loop)(图2,图3)[7],它的茎部(Stem)富含GC碱基,环区(loop)则富含AT,环中有一保守的TAATATTAC序列[2]与病毒复制起始有关。DNA序列分析表明,位于LIR中TATA盒附近通常存在由3~6个8nt~11nt组成的重复序列,其对病毒的复制是非常必要的[8]。此外,亚组Ⅰ双生病毒WDV的复制除了需要LIR的调控序列外,在C1:C2和V2基因之间(与LIR相对)的小基因间区(small intergenic region,SIR)也是必要的[5]。
, 百拇医药
图3 番茄金色花叶病毒(TGMV)的LIR区发夹环结构[7]
TGMV A:番茄金色花叶病毒基因组A组份;TGMV B:番茄金色花叶病毒基因组B组份。
Figure 3 Hairpin loop structures of the tomato golden mosaic virus DNA A and DNA B located in LIR
TGMV A: A component of tomato golden mosaic virus genome; TGMV B: B component of tomato golden mosaic virus genome.
亚组I MSV的UAS长122bp,它的存在可以增强位于MSV毒粒链启动子核心区的转录活性,同时也能进一步增强异源CaMV35S启动子的活性。研究表明,MSV UAS的转录增强功能具有方向性,但没有明显的位置效应,其功能上类似于增强子的功能[9]。
, 百拇医药
3.2 双向启动子区(bidirectional promoter)
位于LIR的双向启动子具有典型的真核启动子特征,毒粒链和互补链转录起始位点上游均存在TATA盒序列。属于亚组Ⅲ的番茄金色花叶病毒(Tomato golden mosaic virus,TGMV)互补链启动子的TATA盒位于基因组第88至94核苷酸处,相当于转录起始位点的-47处,其序列为TATATAA[10]。此外,位于TATA盒上游15bp处有一G盒(CACGTG),对于TGMV互补链的转录也是非常必要的[10]。GUS基因瞬时表达和转基因研究表明,毒粒链启动子活性远远大于互补链启动子的活性[11,12]。双组份病毒的基因组中,A和B两组份的双向启动子序列相似,然而前者的活性明显高于后者[11]。
WDV的LIR中,除TATA盒外,转录调控元件还包括第81至299核苷酸处的GC富集区序列,该序列包括毒粒链转录起始位点及其上游的105bp序列[5],在MSV的LIR中还发现了与转录有关的T富集区(图2)和GC富集区[13]。
, http://www.100md.com
一些序列在复制和转录调控过程中均有作用,如位于TGMV CR中的13bp序列(5'-GGTAGTAAGGTAG-3')可被AC1(AL1)识别,其对于病毒复制是必需的;同时,又可调控病毒基因组的转录过程[14]。发夹环也同样具有上述两种功能,缺失突变表明,与复制密切相关的发夹环及其5'端序列对AC1启动子的转录活性也是非常重要的[10]。
4 双生病毒的复制
双生病毒的复制过程分为三个阶段:互补链DNA合成,dsDNA复制中间体的形成以及由复制中间体产生毒粒链ssDNA。在整个复制过程中,寄主细胞为病毒DNA合成提供了复制酶系统。
4.1 寄主细胞复制系统的激活
在双生病毒侵染的寄主细胞中,寄主细胞编码的DNA聚合酶δ辅助因子PCNA(proliferating cell nuclear antigen,PCNA)大量积累在细胞核中,而正常细胞中未发现有PCNA。进一步研究表明,TGMV编码的AC1可以诱导PCNA的大量积累[15],从而激活寄主细胞的DNA复制系统,促进病毒基因组的大量复制。WDV的C1:C2蛋白也具有同样的特性[16]。
, http://www.100md.com
4.2 互补链的合成
互补链的合成需要以一短的小分子量DNA或RNA为引物。亚组I WDV[17]及MSV[18]的互补链合成引物为80nt左右的小分子DNA,在病毒颗粒中就已存在;而亚组Ⅱ、Ⅲ双生病毒颗粒中未发现这种小分子引物,很可能是在病毒脱壳后立即合成的。亚组Ⅲ的非洲木薯花叶病毒(African cassava mosaic virus,ACMV)DNA组份A的复制以RNA为引物,引物可与CR 2581nt~221nt区域互补[19],暗示互补链合成在此处开始。互补链DNA合成至引物5'端后,引物便被去除,互补链继续合成并进一步环化,形成环状dsDNA形式的复制中间体[20]。
4.3 新生毒粒链的产生
与噬菌体ΦX174等原核病毒类似,双生病毒采取滚环方式进行基因组DNA的复制[21]。双生病毒滚环复制的起始点(origin,ori)位于CR的5'端。亚组ⅢTGMV和南瓜曲叶病毒(Squash leaf curl virus,SqLCV)的复制起始点至少包括两个不同的元件:上面提到的发夹环结构以及发夹环上游的保守序列,它们共同决定了复制的特异性。发夹环的碱基组成特性决定了复制的效率,其中发夹环(TGMV)茎区中部的GC碱基较其它碱基更为重要,又以右茎碱基的影响更大[22]。
, 百拇医药
毒粒链合成时,AC1首先对发夹环中的保守序列(5'-TAATATTA-3')进行切割,由此产生一个缺刻[23]。已发现TGMV的AC1可形成寡聚体,并与TATA盒附近的重复序列相结合,促进复制的起始[24]。关于缺刻的产生,目前已提出了两种模型,其中一个模型认为,AC1蛋白首先使双链DNA解旋,然后从结合位点开始沿着单链DNA移动,直至发夹环中的保守序列,使之产生缺刻,并起始新的毒粒链的复制;另一种模型认为,寄主细胞转录因子在发夹环结构附近结合(图4A),并与结合在TATA盒上的TBP(TATA盒结合蛋白,TATA-binding protein)相互作用,引起DNA弯曲,使AC1靠近发夹环,并诱发缺刻的产生(图4B)[8]。已知亚组Ⅲ番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)AC1蛋白的切割序列为TAATATT↓AC[25]。切割之后AC1蛋白仍然与缺刻链的5'端相结合,3'端作为毒粒链合成的引物,以互补链为模板进行滚环复制,形成的连体(concatameric)DNA毒粒链可被AC1切割成单位长度,并进一步连接形成环状ssDNA[25](图5)。由于AC1参与了复制起始过程,因此有些文献又称其为复制蛋白(replication protein,Rep)。新形成的毒粒链DNA可直接形成病毒颗粒,也可作为模板合成新的复制型dsDNA。亚组Ⅲ双生病毒基因组B不能单独进行复制,只有在A基因组存在的情况下才能进行[22]。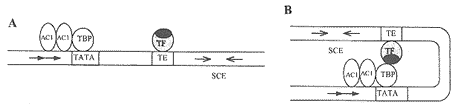
, 百拇医药
图4 双子叶植物双生病毒复制起始模型[8]
TBP:TATA盒结合蛋白;TE:顺式转录调控元件;TF:寄主细胞转录因子;SCE:发夹环结构;→:重复序列。A:TBP与TATA盒结合之后,AC1与TATA盒附近的重复序列结合,同时,TF与SCE 5'端的转录调控元件TE结合;B:TF与TBP相互作用,诱发DNA弯曲,使SCE与AC1接近,导致AC1在毒粒链SCE环中产生缺刻。
Figure 4 Hypothetical model for the functional organization of the replication origin in dicot-geminiviruses
TBP: TATA-binding protein; TE: transcriptional cis-element; TF: transcription factor of the host cell; SCE: stem loop element; Filled arrows: iterons; A: AC1 bind to the iterons associated with the TATA box, where a TBP was previously bound. TF binds to TE, nearby the 5′ border of the SCE; B: TF interacts with TBP, looping the intervening DNA, this event would place the SCE in an accessible position so that the AC1 can nick viral strand in SCE loop.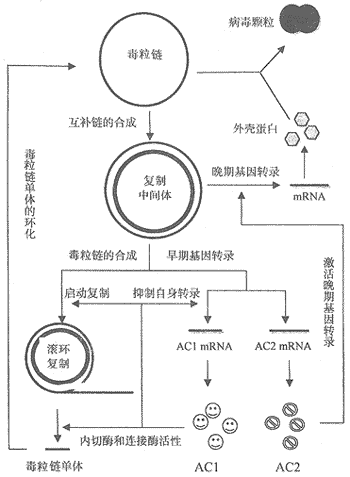
, 百拇医药
图5 双生病毒复制和转录调控示意图
AC1还可诱导寄主细胞PCNA的大量积累,激活寄主细胞复制系统;寄主细胞可通过磷酸化过程调节反式激活因子AC2的功能。详见正文。
Figure 5 Diagram of regulation of replication and transcription of geminivirus AC1 also can activate host cell DNA replication system by inducing mass accumulation of PCNA. The function of trans-acting factor may be regulated by phosphorylation of host cell. Further details are illustrated in the text.
亚组Ⅱ、亚组Ⅲ编码的AC3(AL3)也涉及病毒的复制,AC3能与AC1形成二聚体,并提高AC1与复制起始点的亲和力,进而促进复制起始物的形成[24,26]。AC3与AC1相互作用的特异性不高,BGMV与TGMV异源之间可互换结合[24]。
, 百拇医药
5 双生病毒的转录调控
5.1 双生病毒转录的特点
dsDNA复制中间体不仅对滚环复制至关重要,同时还可作为转录模板。双生病毒的转录发生在寄主细胞的细胞核内,所需的RNA聚合酶Ⅱ系统及一些转录因子主要由寄主细胞提供。
毒粒链和互补链的转录均起始于LIR(CR),毒粒链编码产物有些来自同一条转录物,如WDV的V1、V2蛋白可采用不同的读码框进行翻译[5];而有的双生病毒则转录两条长短不同的RNA,如MSV[4]。互补链ORF的转录比毒粒链复杂,有的转录物在3'或5'端互相重叠,有的则包含在大的转录物中。TGMV A组份互补链转录物可能受不同启动子控制,结果产生不同种类的RNA[4]。
双生病毒基因组的转录分为早期和晚期两个阶段,早期阶段表达的是AC1、AC2蛋白,以及其它一些由互补链编码的转录调控蛋白;晚期阶段则表达毒粒链编码的外壳蛋白AV1及运动蛋白如BV1。早期基因和晚期基因转录的过渡主要是通过AC1及AC2蛋白调控实现的。
, 百拇医药
5.2 AC1(C1)的自主调控功能
AC1不但可以识别CR的复制起始区(ori),启动毒粒链的复制,同时还可识别自身转录起始区,并抑制自身基因的转录[27](图5)。BC1的转录起始区虽然与AC1的相似,然而AC1蛋白并不能抑制BC1基因的表达[27]。已知TGMV AC1的结合位点位于启动子TATA盒与转录起始位点之间,由两个边缘的5核苷酸直接重复序列及一个3bp核心组成(5'-GGTAGTAAGGTAG-3')[28],该序列位点对于DNA的复制也是至关重要的。两个重复序列(GGTAG)对于AC1的抑制作用的重要性有所不同,AC1与3'端重复序列的亲和力要比5'端高四倍,重复序列中GG的缺失会极大地降低AC1的抑制作用[28]。
AC1可能通过两种方式抑制自身转录:其一,AC1与TATA盒下游(5nt)的结合位点相结合,阻碍了转录起始复合物的装配或降低起始复合物的活性;其二,AC1与通用转录因子TFⅡD和TFⅡB形成复合物竞争转录起始区的结合位点,从而抑制转录[14]。 研究还发现,TGMV中与AC1读码框重叠的AC4(AL4)表达产物对AC1基因表达具有抑制作用,可使AC1启动子活性降低3倍[29]。AC4的DNA结合位点位于第136至326核苷酸处,与AC1的结合位点并不重叠[24],AC4抑制AC1基因表达的细节还不清楚。
, 百拇医药
5.3 AC2(C1:C2)的反式激活调控(trans-activation regulation)
作为反式作用因子,AC2蛋白的功能是激活晚期基因的转录,如AV1基因和BV1基因等(TGMV)[30,31]。同属于亚组Ⅲ的ACMV中也发现了这种调控现象,在转基因植物中,感染病毒提供的AC2蛋白能使AV1、BV1和BC1基因启动子控制下的GUS表达活性提高2~3倍[32]。亚组I(WDV、MSV)编码的C1:C2蛋白具有类似的功能,参与毒粒链相应基因的转录调控过程[5,6]。
新合成的毒粒链有两种命运,一方面可进一步形成复制中间体,同时也可直接与外壳蛋白装配成病毒颗粒(图5),AC2在此分支点上起到了关键的调控作用。AC2激活外壳蛋白基因(AV1)的表达,有利于毒粒链DNA在寄主植物体内装配成病毒颗粒,抑制复制中间体进一步形成。实验表明,外壳蛋白基因在烟草原生质体中表达的同时,双链和单链病毒DNA已开始大量积累[12]。双生病毒是以单链DNA形式在寄主细胞间运输的,需要运动蛋白的参与,运动蛋白基因(BV1)的表达可促进病毒在寄主细胞间的运输[31],引起植株系统症状的产生。
, 百拇医药
通过对几种双组份双生病毒AC2蛋白氨基酸序列的分析发现,AC2蛋白具有反式作用因子的基本特征。其N端主要由碱性氨基酸组成,C端富含酸性氨基酸。在碱性区下游存在有几个保守的半胱氨酸和组氨酸残基,是一个典型的锌指形成结构[33]。在TGMV AC2蛋白中,保守的氨基酸残基为:Cys-X1-Cys-X4-His-X2-Cys-X6-His-X4-His-Cys(X为非保守氨基酸)。通过同源性分析发现,AC2蛋白、C1:C2蛋白的DNA结合区中至少存在有两个潜在的磷酸化位点[5,31]。据推测,AC2蛋白、C1:C2蛋白可能受磷酸化的调节。业已证明,致癌基因C-Myb编码的蛋白通过磷酸化调节来控制其与DNA结合的活性,这种调节与寄主细胞的信号传递途径有关[34]。由此看来,寄主细胞在双生病毒转录调控过程中可能起重要的作用。
5.4 寄主细胞因子的作用
瞬时表达和转基因植物研究表明,ACMV B组份的启动子活性明显低于组份A启动子的活性。两者核苷酸序列几乎相同,而其活性相差很大,很可能是由于B基因组的表达还需要寄主细胞提供的转录因子[11]。
, 百拇医药
MSV的UAS(122bp)对转录活性是非常重要的,其中包括两个GC盒,位于发夹环上游。凝胶阻滞分析表明,玉米核因子与MSV的UAS结合可产生快慢两条阻滞带,分别代表该因子与一个或两个GC盒结合的产物,甲基化干扰实验表明,核因子与GC盒的结合不是以协同方式进行的。两个GC盒分别位于相对的两个DNA螺旋大沟中,因此核因子可分别与两个GC盒结合[13]。发夹环中的保守序列TAATATTAC可被寄主细胞的核因子识别,并增强启动子的转录活性[13]。
6 结语
双生病毒的基因组结构较为简单,但其复制及转录调控却相当复杂。该过程不仅涉及病毒自身编码蛋白的调控作用,还与寄主细胞密切相关。双生病毒往往采用较经济的方式调控基因表达,这反映在其编码蛋白具有多种功能。如AC1不仅参与病毒DNA的复制,而且还参与自身转录的调控过程。此外,AC1还能诱导寄主植物PCNA的表达,从而调控寄主的细胞周期。与病状表现有关的C4蛋白也可诱导寄主细胞的分裂[35]。这些均为研究植物细胞周期调控过程以及植物与病毒间相互作用的机理提供了新的线索,也为防治双生病毒引起的病害提供了理论基础。
, http://www.100md.com
研究双生病毒复制及转录调控机制,不仅具有重要的理论意义,还具有潜在的应用价值。双生病毒可以直接作为基因的表达载体,在植物细胞内大量表达外源基因产物[36]。同时,双生病毒基因组的某些特殊的DNA序列也可作为植物基因表达载体的调控元件。Hong等使用ACMV毒粒链启动子控制核糖体失活蛋白基因的表达,获得了抗双生病毒的转基因烟草[37];并利用AC2蛋白激活毒粒链启动子的特点,使毒粒链启动子控制下的核糖体失活蛋白基因在病毒侵染的情况下高效表达[38],起到了抗病的作用。对双生病毒分子生物学的深入了解,有助于我们采取多种策略进行遗传操作,为植物基因工程开辟新的途径。
基金项目:中国科学院重大项目基金(KY951-A1-302-12-08);国家“863”计划基金(863-BH-02-01-01、863-101-01-01-01)。
作者简介:谢迎秋,男,博士,研究方向为基因表达调控。
, http://www.100md.com
联系作者:朱祯
参考文献
1 Murphy F A, Fauquet C M, Bishop D H L, et al. Geminiviridae, virus taxonomy[A]. Sixth Report of the International Committee on Taxonomy of Virus[C], New York:Spring-Verlag Wein, 1995, 158-165.
2 Lazarowitz S G. The molecular characterization of geminiviruses[J]. Plant Mol Biol Rep, 1987,4: 177-192.
3 Zhou X, Liu Y, Robinson D J, et al. Four DNA-A variants among Pakistani isolates of cotton leaf curl virus and their affinities to DNA-A of geminivirus isolates from Okra[J]. J Gen Virol, 1998, 79: 915-923.
, http://www.100md.com
4 Liu Y, Robinson D J, Harrison B D. Defective forms of cotton leaf curl virus DNA-A that have different combinations of sequence deletion, duplication, inversion and rearrangement[J]. J Gen Virol, 1998, 79(In press).
5 Michael T, Wilson A, Davies J W. Genetic engineering with plant viruses[M].London: CRC Press, 1994, 193-194.
6 Hofer J M I, Dekker E L, Reynolds H V, et al. Coordinate regulation of replication and virion sense gene expression in wheat dwarf virus[J]. Plant Cell, 1992, 4: 213-223.
, 百拇医药
7 Hamilton W O O, Stein V E, Coutts R H A, et al. Complete nucleotide sequence of the infectious cloned DNA components of tomato golden mosaic virus: potential coding regions and regulatory sequences[J]. EMBOJ, 1984, 3: 2197-2205.
8 ArgUello-Astorga G, Herrera-Estrella L, Rivera-Bustamante R. Experimental and theoretical definition of geminivirus origin of replication[J]. Plant Mol Biol, 1994, 26: 553-556.
9 Fenoll C, Black D, Howell S H. The intergenic region of maize streak virus contains promoter involved in rightward transcription of viral genome[J]. EMBO J, 1988, 7:1589-1596.
, http://www.100md.com
10 Eagle P A, Hanley-Bowdoin L. cis elements that contribute to geminivirus transcriptional regulation and the efficiency of DNA replication[J]. J Virol, 1997, 71: 6947-6955.
11 Zhan X, Haley A, Richardson K, et al. Analysis of the potential promoter sequence of African cassava mosaic virus by transient expression of the β-glucuronidase gene[J]. J Gen Virol, 1994, 72: 2849-2852.
12 Brough C, Sunter G, Gardiner W E, et al. Kinetics of tomato golden mosaic virus DNA replication and coat protein promoter activity in Nicotiana tabacum protoplast[J]. Virology, 1992, 187:1-9.
, 百拇医药
13 Fenoll C, Schwarz J J, Black D M, et al. The intergenic region of maize streak virus contains a GC-rich element that activates rightward transcription and binds maize nuclear factors[J]. Plant Mol Biol, 1990, 15: 865-877.
14 Eagle P A, Orozco B M, Hanley-Bowdoin L A. A DNA sequence required for geminivirus replication also mediate transcription regulation[J]. Plant Cell, 1994, 6: 1157-1170.
15 Negar S, Pedersen T J, Carrick K M, et al. A geminivirus induces expression of a host DNA synthesis protein in terminally differentiated plant cells[J]. Plant Cell, 1995, 7: 705-719.
, 百拇医药
16 Xie Q, Suarezlopez P, Gutierrez C. Identification and analysis of a retinoblastoma binding motif in the replication protein of a plant DNA virus-requirement for efficient viral DNA replication[J]. EMBO J, 1995, 14: 4073-4083.
17 Hayes R J, MacDonald H, Coutts R H A, et al. Primering of complementary DNA synthesis in virto by small DNA molecules tightly bound to virion DNA of wheat dwarf virus[J]. J Gen Virol, 1988, 69: 1345-1350
, 百拇医药
18 Donson J, Morris-Krsinich B A M, Mullineaux P M,et al. A putative primer for second strand DNA synthesis of maize streak virus is virion associated[J]. EMBO J, 1984, 3: 3069-3073.
19 Saunders K, Lucy A, Stanley J. RNA-primed complementary-sense DNA synthesis of the geminivirus African cassava mosaic virus[J]. Nucleic Acids Res, 1992, 20: 6311-6315.
20 Stenger D C, Revington G N, Stevenson M C, et al. Replicational release of geminivirus genomes from tandemly repeated copies: evidence for rolling-circle replication of a plant viral DNA[J]. Proc Natl Acad Sci USA, 1991, 88: 8029-8033.
, 百拇医药
21 Dhar A K, Singh R P. Geminiviruses, pathologenesis and host specificity in plant diseases[A], VolⅢ: Viruses & Viroids[M], Published by Elsevier Science Ltd, 1995, 289-309.
22 Orozco B M, Hanley-bowdain L. A DNA structure is required for geminivirus replication origin function[J]. J Virol, 1996, 70: 148-158.
23 Heyraudnitschke F, Schumacher S, Laufs J, et al. Determination of the origin cleavage and joining domain of geminivirus rep proteins[J]. Nucleic Acids Res, 1995, 23: 910-916.
, 百拇医药
24 Settlage S B, Miller A B, Hanley-Bowdoin L. Interactions between geminivirus replication proteins[J]. J Virol, 1996, 70: 6790-6795.
25 Laufs J, Traut W, Heyraud F, et al. In virto cleavage and joining at the viral origin of replication by the replication initiator protein of tomato yellow leaf curl virus[J]. Proc Natl Acad Sci USA, 1995, 92: 3879-3883.
26 Sunter G, Hartitz M D, Hormuzdi S G, et al. Genetic analysis of tomato golden mosaic virus: ORF AL2 is required for coat protein accumulation while ORF AL3 is necessary for efficient DNA replication[J]. Virology, 1990, 179: 69-77.
, http://www.100md.com
27 Sunter G, Hartitz M D, Bisaro D M. Tomato golden mosaic virus leftward gene expression: autoregulation of geminivirus replication protein[J]. Virology, 1993, 185: 2275-2280.
28 Fontes E P B, Eagle P A, Sipe P A, et al. Interaction between a geminivirus replication protein and origin DNA is essential for viral replication[J]. J Biol Chem, 1994, 269: 8459-8465.
29 Groning B R, Hages R J, Buck K W. Simultaneous regulation of tomato golden mosaic virus coat protein and AL1 gene expression: expression of the AL4 gene may contribute to suppression of the AL1 gene[J]. J Gen Virol, 1994, 75: 721-726.
, 百拇医药
30 Sunter G, Bisaro D M. Transactivation in a geminivirus: AL2 gene product is needed for coat protein expression[J]. Virology, 1991, 180: 416-419.
31 Sunter G, Bisaro D M. Transactivation of geminivirus AR1 and BR1 gene expression by the viral AL2 gene product occurs at the level of transcription[J]. Plant Cell, 1992, 4: 1321-1331.
32 Haley A, Zhan X, Richardson K, et al. Regulation of the activities of African cassava mosaic virus promoters by the AC1, AC2, and AC3 gene products[J]. Virology, 1992, 188: 905-909.
, http://www.100md.com
33 Berg J M. Zinc fingers and other metal binding domains[J]. J Biol Chem, 1990, 265: 6513-6516.
34 Luscher B, Christenson E, Litchfield D W, et al. Myb DNA binding inhibited at a site deleted during oncogenic by phosphorylation activation[J]. Nature, 1990, 344: 517-522.
35 Chasan R. Geminivirus: a twin approach to replication[J]. Plant Cell, 1995, 7: 659-660.
36 Ward A, Etessami P, Stanley J. Expression of a bacterial gene in plants mediated by infectious geminivirus DNA[J]. EMBO J, 1988, 7: 1583-1587.
, 百拇医药
37 Hong Y, Saunders K, Stanley J. Transactivation of dianthin transgene expression by African mosaic virus AC2[J]. Virology, 1997, 228: 383-387.
38 Hong Y, Saunder K, Hartley M R, et al. Resistance to geminivirus infection by virus induced expression of dianthin in transgenic plants[J]. Virology, 1996, 220: 119-127.
收稿日期:1998-04-14;修回日期:1998-06-15, 百拇医药
单位:中国科学院遗传研究所,北京 100101
关键词:
病毒学报990413 中图分类号:S432.4 文献标识码:A 文章编号:1000-8721(1999)-0372-10
双生病毒(Geminiviruses)是一类具有孪生颗粒形态的植物病毒,颗粒大小约为18nm×30nm。双生病毒成员众多,大致可分为三个亚组。双生病毒通常以粉虱或叶蝉为媒介进行传播,侵染范围十分广泛,对农业生产造成巨大的危害。感病植株一般表现为花叶、曲叶、黄化等症状,严重地影响了植物的正常生长。最近几年,属于双生病毒亚组Ⅲ的棉花曲叶病毒(Cotton leaf curl virus,CLCuV)在印巴次大陆广泛流行,严重时可使棉花绝收。双生病毒基因组DNA为单链环状形式,长度约为2 400nt~3 000nt。对双生病毒基因组结构、遗传表达机制,及其分类和进化进行深入的了解,有助于揭示寄主植物与病毒相互间的作用方式,进而为防治由双生病毒引起的植物病害奠定基础。本文就上述内容的最新进展作一简要综述。
, http://www.100md.com
1 双生病毒的分类及进化
依据病毒基因组结构、寄主范围及其昆虫传播媒体,双生病毒可划分为三个亚组[1](表1)。亚组Ⅰ和亚组Ⅱ双生病毒基因组为单组份,即只含有一个单链环状DNA基因组成分,这两类双生病毒主要由叶蝉传播。亚组Ⅲ双生病毒依赖粉虱传播,基因组大多为双组份,较大的为DNA A,小的为DNA B。亚组Ⅲ中也有些为单组份,如棉花曲叶病毒巴基斯坦株系(CLCuV-PK)。亚组Ⅱ毒粒链(virion-sense strand)的读码框(ORF)与亚组Ⅰ的相似,互补链(complementary-sense strand)ORF则与亚组Ⅲ的相似。双生病毒的分类及基因组结构特点详见表1、图1[2,3]。
表1 双生病毒分类
Table 1 Classification of geminiviruses
, 百拇医药
亚组Subgroup
Ⅰ
Ⅱ
Ⅲ
基因组成分Component of genome
A
A
A、B或A
主要昆虫介体Main insect vector
叶蝉
叶蝉或树蝉
粉虱
, http://www.100md.com
寄主范围Host range
单子叶植物
双子叶植物
双子叶植物
代表成员Type member
玉米条纹病毒(MSV)
甜菜曲顶病毒(BCTV)
蚕豆金色花叶病毒(BGMV)

图1 亚组Ⅰ、亚组Ⅱ、亚组Ⅲ双生病毒基因组结构[3,4]
a:亚组Ⅰ,玉米条纹病毒-尼日利亚株系;b:亚组Ⅱ,甜菜曲顶病毒;c:亚组Ⅲ,单组份病毒棉花曲叶病毒-巴基斯坦株系;d:亚组Ⅲ,双组份病毒番茄金色花叶病毒A组份;e:亚组Ⅲ,双组份病毒番茄金色花叶病毒B组份。 CR:共同区;LIR:大基因间区;黑色箭头示毒粒链读码框;空心箭头示互补链读码框。
, 百拇医药
Figure 1 Genome structures of Subgroup Ⅰ, subgroupⅡ(beet curly top virus) and subgroupⅢ (cotton leaf curl virus-Pakistan, tomato golden mosaic virus)
a: SubgroupⅠ, maize streak virus-Nigerian; b: SubgroupⅡ, Beet curly top virus; c: SubgroupⅢ, monopartite cotton leaf curl virus-Pakistan; d: Subgroup Ⅲ, bipartite tomato golden mosaic virus DNA A; e: SubgroupⅢ, bipartite tomato golden mosaic virus DNA B.CR: common region; LIR: large intergenic region. Shaded arrow represents viron-sense ORF; unfilled arrow represents complementary-sense ORF.
, http://www.100md.com
双生病毒类群很可能是由叶蝉传播侵染单子叶植物的单组份双生病毒(亚组Ⅰ)演化来的。在长期的进化过程中,由于地理隔离,媒体昆虫的交叉传播,病毒基因组间重组,以及寄主植物进化等诸多因素的影响,逐渐进化产生了由粉虱传播侵染双子叶植物的亚组Ⅲ病毒。CLCuV-PK是新近发现的一种亚组Ⅲ病毒,其基因组中含有许多未知序列的小DNA分子,这很可能是近期进化的结果[3,4]。亚组Ⅱ双生病毒仅发现了4种,其进化方式尚不清楚。

图2 单组份双生病毒(亚组Ⅰ)基因组结构[5]
AATAAA:Poly(A)信号;TATA:TATA盒;T-r:T富集区;UAS:上游激活序列;V-RNA1:毒粒链转录物1 5'端区域;V-RNA2:毒粒链转录物2 5'端区域;C-RNA:互补链转录物5'端区域;V1:V1基因,编码运动蛋白;V2:V2基因,编码外壳蛋白;C1:C1读码框;C2:C2读码框。
, 百拇医药
Figure 2 Genome structure of the monopartite geminivirus (Subgroup Ⅰ)
AATAAA:Poly(A) signal;l TATA:TATA box; T-r: T rich region; UAS: Upstream activating region; V-RNA1: 5′ end of mRNA1 of virion-sense strand; V-RNA2: 5′ end of mRNA2 of virion-sense strand; C-RNA : 5′ end of mRNA of complementary-sense strand ; V1:V1 gene, coding movement protein; V2:V2 gene, coding coat protein; C1: C1 open reading frame; C2: C2 open reading frame.
, 百拇医药
2 双生病毒基因组结构
植物双生病毒基因组是通过毒粒链和互补链共同编码的(图2)[5]。毒粒链编码外壳蛋白等,互补链编码复制相关蛋白及一些调控蛋白(表2)。单组份双生病毒基因组编码产物根据所在毒粒链或互补链而分别命名为Vn(n为ORF序数)或Cn;双组份基因组ORF依其所在组份、所在毒粒链或互补链而分别命名为AVn、ACn或BVn、BCn。然而,有些文献按转录方向进行命名,称毒粒链为右向转录链,ORF命名为ARn(Rn)或BRn;相应的互补链即左向转录链,ORF命名为ALn(Ln)或BLn(本文为叙述方便,除特别注明外一律采用前者)。亚组Ⅰ双生病毒如小麦矮缩病毒(Wheat dwarf virus,WDV)、玉米条纹病毒(Maize streak virus,MSV)等(参见图2)互补链ORF与亚组Ⅲ显著不同,其C1和C2读码框重叠处含有一内含子,经剪接加工后产生的RNA转译产物为C1:C2融合蛋白,约41kD。在WDV中,C1:C2蛋白是一种多功能蛋白(Multifunctional protein),兼有亚组Ⅲ的AC1和AC2蛋白功能[6]。
, 百拇医药
表2 亚组Ⅲ双组份双生病毒基因组编码产物(包括亚组Ⅰ、Ⅱ同源的基因产物)
Table 2 Genomic coding products of bipartite geminivirus in subgroupⅢ(homologous products from subgroup Ⅰand subgroupⅡalso are involved) 基因产物
分子量(kD)
蛋白的功能
Gene products
M.W.(kD)
Function of proteins
AC1(或C1、C1:C2)
, 百拇医药
40
参与毒粒链复制的起始,具有位点特异性核酸酶及连接酶活性,能在转录水平自我抑制表达。同时,它还是一种DNA序列特异性结合蛋白,可能也参与寄主细胞周期调控。
AC2(或C2、C1:C2)
15~20
反式激活因子,可刺激AV1及BV1等晚期基因的表达,可能具有非特异性DNA结合蛋白功能。
AC3(C3)
14~16
增强病毒的复制效率。
AC4(C4)
15
, 百拇医药
可能与病状发生及病毒在植物体内运动有关;其有可能抑制AC1的表达。
AV1(V1)
27~30
病毒外壳蛋白,亚组Ⅰ中与病毒运动有关。
AV2(V2)
13
在亚组Ⅲ中的功能未知,在亚组Ⅰ中为病毒外壳蛋白,亚组Ⅱ中与病毒运动有关。
BC1
34
与病毒运动、症状发生及寄主范围有关。
BV1
, 百拇医药
30
与病毒运动及寄主范围有关。
3 双生病毒复制及转录调控的相关序列
毒粒链第一个ORF和互补链第一个ORF之间存在一大基因间区(large intergenic region,LIR)(图2),约300nt;对于双组份病毒而言,LIR称为共同区(common region,CR),A、B两组份的CR序列相似,但不同种双生病毒之间CR差异较大。LIR(CR)通常包括位于中部的上游激活序列(upstream activating sequence,UAS),以及位于两端的双向启动子序列,LIR(CR)序列与基因组复制和基因转录密切相关。
3.1 上游激活序列(UAS)
UAS通常具有一个约30nt的发夹环结构(hairpin loop)(图2,图3)[7],它的茎部(Stem)富含GC碱基,环区(loop)则富含AT,环中有一保守的TAATATTAC序列[2]与病毒复制起始有关。DNA序列分析表明,位于LIR中TATA盒附近通常存在由3~6个8nt~11nt组成的重复序列,其对病毒的复制是非常必要的[8]。此外,亚组Ⅰ双生病毒WDV的复制除了需要LIR的调控序列外,在C1:C2和V2基因之间(与LIR相对)的小基因间区(small intergenic region,SIR)也是必要的[5]。

, 百拇医药
图3 番茄金色花叶病毒(TGMV)的LIR区发夹环结构[7]
TGMV A:番茄金色花叶病毒基因组A组份;TGMV B:番茄金色花叶病毒基因组B组份。
Figure 3 Hairpin loop structures of the tomato golden mosaic virus DNA A and DNA B located in LIR
TGMV A: A component of tomato golden mosaic virus genome; TGMV B: B component of tomato golden mosaic virus genome.
亚组I MSV的UAS长122bp,它的存在可以增强位于MSV毒粒链启动子核心区的转录活性,同时也能进一步增强异源CaMV35S启动子的活性。研究表明,MSV UAS的转录增强功能具有方向性,但没有明显的位置效应,其功能上类似于增强子的功能[9]。
, 百拇医药
3.2 双向启动子区(bidirectional promoter)
位于LIR的双向启动子具有典型的真核启动子特征,毒粒链和互补链转录起始位点上游均存在TATA盒序列。属于亚组Ⅲ的番茄金色花叶病毒(Tomato golden mosaic virus,TGMV)互补链启动子的TATA盒位于基因组第88至94核苷酸处,相当于转录起始位点的-47处,其序列为TATATAA[10]。此外,位于TATA盒上游15bp处有一G盒(CACGTG),对于TGMV互补链的转录也是非常必要的[10]。GUS基因瞬时表达和转基因研究表明,毒粒链启动子活性远远大于互补链启动子的活性[11,12]。双组份病毒的基因组中,A和B两组份的双向启动子序列相似,然而前者的活性明显高于后者[11]。
WDV的LIR中,除TATA盒外,转录调控元件还包括第81至299核苷酸处的GC富集区序列,该序列包括毒粒链转录起始位点及其上游的105bp序列[5],在MSV的LIR中还发现了与转录有关的T富集区(图2)和GC富集区[13]。
, http://www.100md.com
一些序列在复制和转录调控过程中均有作用,如位于TGMV CR中的13bp序列(5'-GGTAGTAAGGTAG-3')可被AC1(AL1)识别,其对于病毒复制是必需的;同时,又可调控病毒基因组的转录过程[14]。发夹环也同样具有上述两种功能,缺失突变表明,与复制密切相关的发夹环及其5'端序列对AC1启动子的转录活性也是非常重要的[10]。
4 双生病毒的复制
双生病毒的复制过程分为三个阶段:互补链DNA合成,dsDNA复制中间体的形成以及由复制中间体产生毒粒链ssDNA。在整个复制过程中,寄主细胞为病毒DNA合成提供了复制酶系统。
4.1 寄主细胞复制系统的激活
在双生病毒侵染的寄主细胞中,寄主细胞编码的DNA聚合酶δ辅助因子PCNA(proliferating cell nuclear antigen,PCNA)大量积累在细胞核中,而正常细胞中未发现有PCNA。进一步研究表明,TGMV编码的AC1可以诱导PCNA的大量积累[15],从而激活寄主细胞的DNA复制系统,促进病毒基因组的大量复制。WDV的C1:C2蛋白也具有同样的特性[16]。
, http://www.100md.com
4.2 互补链的合成
互补链的合成需要以一短的小分子量DNA或RNA为引物。亚组I WDV[17]及MSV[18]的互补链合成引物为80nt左右的小分子DNA,在病毒颗粒中就已存在;而亚组Ⅱ、Ⅲ双生病毒颗粒中未发现这种小分子引物,很可能是在病毒脱壳后立即合成的。亚组Ⅲ的非洲木薯花叶病毒(African cassava mosaic virus,ACMV)DNA组份A的复制以RNA为引物,引物可与CR 2581nt~221nt区域互补[19],暗示互补链合成在此处开始。互补链DNA合成至引物5'端后,引物便被去除,互补链继续合成并进一步环化,形成环状dsDNA形式的复制中间体[20]。
4.3 新生毒粒链的产生
与噬菌体ΦX174等原核病毒类似,双生病毒采取滚环方式进行基因组DNA的复制[21]。双生病毒滚环复制的起始点(origin,ori)位于CR的5'端。亚组ⅢTGMV和南瓜曲叶病毒(Squash leaf curl virus,SqLCV)的复制起始点至少包括两个不同的元件:上面提到的发夹环结构以及发夹环上游的保守序列,它们共同决定了复制的特异性。发夹环的碱基组成特性决定了复制的效率,其中发夹环(TGMV)茎区中部的GC碱基较其它碱基更为重要,又以右茎碱基的影响更大[22]。
, 百拇医药
毒粒链合成时,AC1首先对发夹环中的保守序列(5'-TAATATTA-3')进行切割,由此产生一个缺刻[23]。已发现TGMV的AC1可形成寡聚体,并与TATA盒附近的重复序列相结合,促进复制的起始[24]。关于缺刻的产生,目前已提出了两种模型,其中一个模型认为,AC1蛋白首先使双链DNA解旋,然后从结合位点开始沿着单链DNA移动,直至发夹环中的保守序列,使之产生缺刻,并起始新的毒粒链的复制;另一种模型认为,寄主细胞转录因子在发夹环结构附近结合(图4A),并与结合在TATA盒上的TBP(TATA盒结合蛋白,TATA-binding protein)相互作用,引起DNA弯曲,使AC1靠近发夹环,并诱发缺刻的产生(图4B)[8]。已知亚组Ⅲ番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)AC1蛋白的切割序列为TAATATT↓AC[25]。切割之后AC1蛋白仍然与缺刻链的5'端相结合,3'端作为毒粒链合成的引物,以互补链为模板进行滚环复制,形成的连体(concatameric)DNA毒粒链可被AC1切割成单位长度,并进一步连接形成环状ssDNA[25](图5)。由于AC1参与了复制起始过程,因此有些文献又称其为复制蛋白(replication protein,Rep)。新形成的毒粒链DNA可直接形成病毒颗粒,也可作为模板合成新的复制型dsDNA。亚组Ⅲ双生病毒基因组B不能单独进行复制,只有在A基因组存在的情况下才能进行[22]。

, 百拇医药
图4 双子叶植物双生病毒复制起始模型[8]
TBP:TATA盒结合蛋白;TE:顺式转录调控元件;TF:寄主细胞转录因子;SCE:发夹环结构;→:重复序列。A:TBP与TATA盒结合之后,AC1与TATA盒附近的重复序列结合,同时,TF与SCE 5'端的转录调控元件TE结合;B:TF与TBP相互作用,诱发DNA弯曲,使SCE与AC1接近,导致AC1在毒粒链SCE环中产生缺刻。
Figure 4 Hypothetical model for the functional organization of the replication origin in dicot-geminiviruses
TBP: TATA-binding protein; TE: transcriptional cis-element; TF: transcription factor of the host cell; SCE: stem loop element; Filled arrows: iterons; A: AC1 bind to the iterons associated with the TATA box, where a TBP was previously bound. TF binds to TE, nearby the 5′ border of the SCE; B: TF interacts with TBP, looping the intervening DNA, this event would place the SCE in an accessible position so that the AC1 can nick viral strand in SCE loop.

, 百拇医药
图5 双生病毒复制和转录调控示意图
AC1还可诱导寄主细胞PCNA的大量积累,激活寄主细胞复制系统;寄主细胞可通过磷酸化过程调节反式激活因子AC2的功能。详见正文。
Figure 5 Diagram of regulation of replication and transcription of geminivirus AC1 also can activate host cell DNA replication system by inducing mass accumulation of PCNA. The function of trans-acting factor may be regulated by phosphorylation of host cell. Further details are illustrated in the text.
亚组Ⅱ、亚组Ⅲ编码的AC3(AL3)也涉及病毒的复制,AC3能与AC1形成二聚体,并提高AC1与复制起始点的亲和力,进而促进复制起始物的形成[24,26]。AC3与AC1相互作用的特异性不高,BGMV与TGMV异源之间可互换结合[24]。
, 百拇医药
5 双生病毒的转录调控
5.1 双生病毒转录的特点
dsDNA复制中间体不仅对滚环复制至关重要,同时还可作为转录模板。双生病毒的转录发生在寄主细胞的细胞核内,所需的RNA聚合酶Ⅱ系统及一些转录因子主要由寄主细胞提供。
毒粒链和互补链的转录均起始于LIR(CR),毒粒链编码产物有些来自同一条转录物,如WDV的V1、V2蛋白可采用不同的读码框进行翻译[5];而有的双生病毒则转录两条长短不同的RNA,如MSV[4]。互补链ORF的转录比毒粒链复杂,有的转录物在3'或5'端互相重叠,有的则包含在大的转录物中。TGMV A组份互补链转录物可能受不同启动子控制,结果产生不同种类的RNA[4]。
双生病毒基因组的转录分为早期和晚期两个阶段,早期阶段表达的是AC1、AC2蛋白,以及其它一些由互补链编码的转录调控蛋白;晚期阶段则表达毒粒链编码的外壳蛋白AV1及运动蛋白如BV1。早期基因和晚期基因转录的过渡主要是通过AC1及AC2蛋白调控实现的。
, 百拇医药
5.2 AC1(C1)的自主调控功能
AC1不但可以识别CR的复制起始区(ori),启动毒粒链的复制,同时还可识别自身转录起始区,并抑制自身基因的转录[27](图5)。BC1的转录起始区虽然与AC1的相似,然而AC1蛋白并不能抑制BC1基因的表达[27]。已知TGMV AC1的结合位点位于启动子TATA盒与转录起始位点之间,由两个边缘的5核苷酸直接重复序列及一个3bp核心组成(5'-GGTAGTAAGGTAG-3')[28],该序列位点对于DNA的复制也是至关重要的。两个重复序列(GGTAG)对于AC1的抑制作用的重要性有所不同,AC1与3'端重复序列的亲和力要比5'端高四倍,重复序列中GG的缺失会极大地降低AC1的抑制作用[28]。
AC1可能通过两种方式抑制自身转录:其一,AC1与TATA盒下游(5nt)的结合位点相结合,阻碍了转录起始复合物的装配或降低起始复合物的活性;其二,AC1与通用转录因子TFⅡD和TFⅡB形成复合物竞争转录起始区的结合位点,从而抑制转录[14]。 研究还发现,TGMV中与AC1读码框重叠的AC4(AL4)表达产物对AC1基因表达具有抑制作用,可使AC1启动子活性降低3倍[29]。AC4的DNA结合位点位于第136至326核苷酸处,与AC1的结合位点并不重叠[24],AC4抑制AC1基因表达的细节还不清楚。
, 百拇医药
5.3 AC2(C1:C2)的反式激活调控(trans-activation regulation)
作为反式作用因子,AC2蛋白的功能是激活晚期基因的转录,如AV1基因和BV1基因等(TGMV)[30,31]。同属于亚组Ⅲ的ACMV中也发现了这种调控现象,在转基因植物中,感染病毒提供的AC2蛋白能使AV1、BV1和BC1基因启动子控制下的GUS表达活性提高2~3倍[32]。亚组I(WDV、MSV)编码的C1:C2蛋白具有类似的功能,参与毒粒链相应基因的转录调控过程[5,6]。
新合成的毒粒链有两种命运,一方面可进一步形成复制中间体,同时也可直接与外壳蛋白装配成病毒颗粒(图5),AC2在此分支点上起到了关键的调控作用。AC2激活外壳蛋白基因(AV1)的表达,有利于毒粒链DNA在寄主植物体内装配成病毒颗粒,抑制复制中间体进一步形成。实验表明,外壳蛋白基因在烟草原生质体中表达的同时,双链和单链病毒DNA已开始大量积累[12]。双生病毒是以单链DNA形式在寄主细胞间运输的,需要运动蛋白的参与,运动蛋白基因(BV1)的表达可促进病毒在寄主细胞间的运输[31],引起植株系统症状的产生。
, 百拇医药
通过对几种双组份双生病毒AC2蛋白氨基酸序列的分析发现,AC2蛋白具有反式作用因子的基本特征。其N端主要由碱性氨基酸组成,C端富含酸性氨基酸。在碱性区下游存在有几个保守的半胱氨酸和组氨酸残基,是一个典型的锌指形成结构[33]。在TGMV AC2蛋白中,保守的氨基酸残基为:Cys-X1-Cys-X4-His-X2-Cys-X6-His-X4-His-Cys(X为非保守氨基酸)。通过同源性分析发现,AC2蛋白、C1:C2蛋白的DNA结合区中至少存在有两个潜在的磷酸化位点[5,31]。据推测,AC2蛋白、C1:C2蛋白可能受磷酸化的调节。业已证明,致癌基因C-Myb编码的蛋白通过磷酸化调节来控制其与DNA结合的活性,这种调节与寄主细胞的信号传递途径有关[34]。由此看来,寄主细胞在双生病毒转录调控过程中可能起重要的作用。
5.4 寄主细胞因子的作用
瞬时表达和转基因植物研究表明,ACMV B组份的启动子活性明显低于组份A启动子的活性。两者核苷酸序列几乎相同,而其活性相差很大,很可能是由于B基因组的表达还需要寄主细胞提供的转录因子[11]。
, 百拇医药
MSV的UAS(122bp)对转录活性是非常重要的,其中包括两个GC盒,位于发夹环上游。凝胶阻滞分析表明,玉米核因子与MSV的UAS结合可产生快慢两条阻滞带,分别代表该因子与一个或两个GC盒结合的产物,甲基化干扰实验表明,核因子与GC盒的结合不是以协同方式进行的。两个GC盒分别位于相对的两个DNA螺旋大沟中,因此核因子可分别与两个GC盒结合[13]。发夹环中的保守序列TAATATTAC可被寄主细胞的核因子识别,并增强启动子的转录活性[13]。
6 结语
双生病毒的基因组结构较为简单,但其复制及转录调控却相当复杂。该过程不仅涉及病毒自身编码蛋白的调控作用,还与寄主细胞密切相关。双生病毒往往采用较经济的方式调控基因表达,这反映在其编码蛋白具有多种功能。如AC1不仅参与病毒DNA的复制,而且还参与自身转录的调控过程。此外,AC1还能诱导寄主植物PCNA的表达,从而调控寄主的细胞周期。与病状表现有关的C4蛋白也可诱导寄主细胞的分裂[35]。这些均为研究植物细胞周期调控过程以及植物与病毒间相互作用的机理提供了新的线索,也为防治双生病毒引起的病害提供了理论基础。
, http://www.100md.com
研究双生病毒复制及转录调控机制,不仅具有重要的理论意义,还具有潜在的应用价值。双生病毒可以直接作为基因的表达载体,在植物细胞内大量表达外源基因产物[36]。同时,双生病毒基因组的某些特殊的DNA序列也可作为植物基因表达载体的调控元件。Hong等使用ACMV毒粒链启动子控制核糖体失活蛋白基因的表达,获得了抗双生病毒的转基因烟草[37];并利用AC2蛋白激活毒粒链启动子的特点,使毒粒链启动子控制下的核糖体失活蛋白基因在病毒侵染的情况下高效表达[38],起到了抗病的作用。对双生病毒分子生物学的深入了解,有助于我们采取多种策略进行遗传操作,为植物基因工程开辟新的途径。
基金项目:中国科学院重大项目基金(KY951-A1-302-12-08);国家“863”计划基金(863-BH-02-01-01、863-101-01-01-01)。
作者简介:谢迎秋,男,博士,研究方向为基因表达调控。
, http://www.100md.com
联系作者:朱祯
参考文献
1 Murphy F A, Fauquet C M, Bishop D H L, et al. Geminiviridae, virus taxonomy[A]. Sixth Report of the International Committee on Taxonomy of Virus[C], New York:Spring-Verlag Wein, 1995, 158-165.
2 Lazarowitz S G. The molecular characterization of geminiviruses[J]. Plant Mol Biol Rep, 1987,4: 177-192.
3 Zhou X, Liu Y, Robinson D J, et al. Four DNA-A variants among Pakistani isolates of cotton leaf curl virus and their affinities to DNA-A of geminivirus isolates from Okra[J]. J Gen Virol, 1998, 79: 915-923.
, http://www.100md.com
4 Liu Y, Robinson D J, Harrison B D. Defective forms of cotton leaf curl virus DNA-A that have different combinations of sequence deletion, duplication, inversion and rearrangement[J]. J Gen Virol, 1998, 79(In press).
5 Michael T, Wilson A, Davies J W. Genetic engineering with plant viruses[M].London: CRC Press, 1994, 193-194.
6 Hofer J M I, Dekker E L, Reynolds H V, et al. Coordinate regulation of replication and virion sense gene expression in wheat dwarf virus[J]. Plant Cell, 1992, 4: 213-223.
, 百拇医药
7 Hamilton W O O, Stein V E, Coutts R H A, et al. Complete nucleotide sequence of the infectious cloned DNA components of tomato golden mosaic virus: potential coding regions and regulatory sequences[J]. EMBOJ, 1984, 3: 2197-2205.
8 ArgUello-Astorga G, Herrera-Estrella L, Rivera-Bustamante R. Experimental and theoretical definition of geminivirus origin of replication[J]. Plant Mol Biol, 1994, 26: 553-556.
9 Fenoll C, Black D, Howell S H. The intergenic region of maize streak virus contains promoter involved in rightward transcription of viral genome[J]. EMBO J, 1988, 7:1589-1596.
, http://www.100md.com
10 Eagle P A, Hanley-Bowdoin L. cis elements that contribute to geminivirus transcriptional regulation and the efficiency of DNA replication[J]. J Virol, 1997, 71: 6947-6955.
11 Zhan X, Haley A, Richardson K, et al. Analysis of the potential promoter sequence of African cassava mosaic virus by transient expression of the β-glucuronidase gene[J]. J Gen Virol, 1994, 72: 2849-2852.
12 Brough C, Sunter G, Gardiner W E, et al. Kinetics of tomato golden mosaic virus DNA replication and coat protein promoter activity in Nicotiana tabacum protoplast[J]. Virology, 1992, 187:1-9.
, 百拇医药
13 Fenoll C, Schwarz J J, Black D M, et al. The intergenic region of maize streak virus contains a GC-rich element that activates rightward transcription and binds maize nuclear factors[J]. Plant Mol Biol, 1990, 15: 865-877.
14 Eagle P A, Orozco B M, Hanley-Bowdoin L A. A DNA sequence required for geminivirus replication also mediate transcription regulation[J]. Plant Cell, 1994, 6: 1157-1170.
15 Negar S, Pedersen T J, Carrick K M, et al. A geminivirus induces expression of a host DNA synthesis protein in terminally differentiated plant cells[J]. Plant Cell, 1995, 7: 705-719.
, 百拇医药
16 Xie Q, Suarezlopez P, Gutierrez C. Identification and analysis of a retinoblastoma binding motif in the replication protein of a plant DNA virus-requirement for efficient viral DNA replication[J]. EMBO J, 1995, 14: 4073-4083.
17 Hayes R J, MacDonald H, Coutts R H A, et al. Primering of complementary DNA synthesis in virto by small DNA molecules tightly bound to virion DNA of wheat dwarf virus[J]. J Gen Virol, 1988, 69: 1345-1350
, 百拇医药
18 Donson J, Morris-Krsinich B A M, Mullineaux P M,et al. A putative primer for second strand DNA synthesis of maize streak virus is virion associated[J]. EMBO J, 1984, 3: 3069-3073.
19 Saunders K, Lucy A, Stanley J. RNA-primed complementary-sense DNA synthesis of the geminivirus African cassava mosaic virus[J]. Nucleic Acids Res, 1992, 20: 6311-6315.
20 Stenger D C, Revington G N, Stevenson M C, et al. Replicational release of geminivirus genomes from tandemly repeated copies: evidence for rolling-circle replication of a plant viral DNA[J]. Proc Natl Acad Sci USA, 1991, 88: 8029-8033.
, 百拇医药
21 Dhar A K, Singh R P. Geminiviruses, pathologenesis and host specificity in plant diseases[A], VolⅢ: Viruses & Viroids[M], Published by Elsevier Science Ltd, 1995, 289-309.
22 Orozco B M, Hanley-bowdain L. A DNA structure is required for geminivirus replication origin function[J]. J Virol, 1996, 70: 148-158.
23 Heyraudnitschke F, Schumacher S, Laufs J, et al. Determination of the origin cleavage and joining domain of geminivirus rep proteins[J]. Nucleic Acids Res, 1995, 23: 910-916.
, 百拇医药
24 Settlage S B, Miller A B, Hanley-Bowdoin L. Interactions between geminivirus replication proteins[J]. J Virol, 1996, 70: 6790-6795.
25 Laufs J, Traut W, Heyraud F, et al. In virto cleavage and joining at the viral origin of replication by the replication initiator protein of tomato yellow leaf curl virus[J]. Proc Natl Acad Sci USA, 1995, 92: 3879-3883.
26 Sunter G, Hartitz M D, Hormuzdi S G, et al. Genetic analysis of tomato golden mosaic virus: ORF AL2 is required for coat protein accumulation while ORF AL3 is necessary for efficient DNA replication[J]. Virology, 1990, 179: 69-77.
, http://www.100md.com
27 Sunter G, Hartitz M D, Bisaro D M. Tomato golden mosaic virus leftward gene expression: autoregulation of geminivirus replication protein[J]. Virology, 1993, 185: 2275-2280.
28 Fontes E P B, Eagle P A, Sipe P A, et al. Interaction between a geminivirus replication protein and origin DNA is essential for viral replication[J]. J Biol Chem, 1994, 269: 8459-8465.
29 Groning B R, Hages R J, Buck K W. Simultaneous regulation of tomato golden mosaic virus coat protein and AL1 gene expression: expression of the AL4 gene may contribute to suppression of the AL1 gene[J]. J Gen Virol, 1994, 75: 721-726.
, 百拇医药
30 Sunter G, Bisaro D M. Transactivation in a geminivirus: AL2 gene product is needed for coat protein expression[J]. Virology, 1991, 180: 416-419.
31 Sunter G, Bisaro D M. Transactivation of geminivirus AR1 and BR1 gene expression by the viral AL2 gene product occurs at the level of transcription[J]. Plant Cell, 1992, 4: 1321-1331.
32 Haley A, Zhan X, Richardson K, et al. Regulation of the activities of African cassava mosaic virus promoters by the AC1, AC2, and AC3 gene products[J]. Virology, 1992, 188: 905-909.
, http://www.100md.com
33 Berg J M. Zinc fingers and other metal binding domains[J]. J Biol Chem, 1990, 265: 6513-6516.
34 Luscher B, Christenson E, Litchfield D W, et al. Myb DNA binding inhibited at a site deleted during oncogenic by phosphorylation activation[J]. Nature, 1990, 344: 517-522.
35 Chasan R. Geminivirus: a twin approach to replication[J]. Plant Cell, 1995, 7: 659-660.
36 Ward A, Etessami P, Stanley J. Expression of a bacterial gene in plants mediated by infectious geminivirus DNA[J]. EMBO J, 1988, 7: 1583-1587.
, 百拇医药
37 Hong Y, Saunders K, Stanley J. Transactivation of dianthin transgene expression by African mosaic virus AC2[J]. Virology, 1997, 228: 383-387.
38 Hong Y, Saunder K, Hartley M R, et al. Resistance to geminivirus infection by virus induced expression of dianthin in transgenic plants[J]. Virology, 1996, 220: 119-127.
收稿日期:1998-04-14;修回日期:1998-06-15, 百拇医药