肥大细胞与肺成纤维细胞共育的形态学观察*
作者:尹红玲 钱仲棐
单位:湖南医科大学病理学教研室,长沙 410078
关键词:肥大细胞;成纤维细胞;形态学;形态计量;共育
解剖学报980117
摘 要 用分离纯化的大鼠腹腔肥大细胞(PMC)与同源胎鼠肺成纤维细胞(LFb)共育,对LFb进行形态学观察和形态计量分析。结果表明:与PMC共育的 LFb 呈复层生长,单
位面积内细胞计数明显增加,粗面内质网(RER)增生。电镜见PMC与LFb紧密接触和部
分PMC有脱颗粒现象。提示PMC可促进LFb增值,并使其功能活跃。
近年来,肥大细胞(mast cell,MC)促进成纤维细胞增生以及MC在纤维化病变发生发
, http://www.100md.com
展中的作用,已引起人们的重视[1],但国内很少有研究报道[2]。本实验采用正常大鼠
腹腔肥大细胞(peritonealmast cell,PMC)与同源胎鼠肺成纤维细胞(lung fibroblast,LFb)共
育,观察PMC与LFb的形态学变化,为探讨MC在肺纤维化过程中的作用提供形态学依
据。
材料和方法
1.实验动物
Wistar 大鼠,体重约 200g,雌雄不限,供采集PMC。取妊娠13~15dWistar 胎鼠
用作分离 LFb。以上动物均由本校实验动物学部提供。
, 百拇医药
2.PMC 采集分离
2.1 PMC分离液的配制:取比重1.120的40%Ficoll溶液50ml,用比重1.077的淋巴细胞
分离液调整比重至1.085,用于分离PMC。(Ficoll溶液和淋巴细胞分离液均为上海试剂二
厂产品)
2.2 PMC采集分离:参照本室使用的梯度密度分离PMC 方法[3],于无菌条件下收集
大鼠(6只)腹腔冲洗液,离心后取其细胞悬液,沿管壁缓慢加入盛有PMC分离液的离心
管中,使两液形成界面,4℃、2500r/min离心15min,PMC沉于管底,倾去上层液体,取
, http://www.100md.com
底部PMC用冷无 Ca2+、Mg2+的PBS 清洗 2次(4℃,1000r/min离心10min)后,于RPMI-
1640 培养液悬浮备用(甲苯胺蓝染色,光镜下计数PMC纯度达95%以上)。
3.LFb分离培养
按本室建立的方法分离培养LFb[3]。
3.1 试剂与培养液:(1)胰蛋白酶1∶250,Sigma公司)用PBS液配制成0.1%溶液供原
代和传代消化用;(2)无Ca2+、Mg2+PBS液;(3)完全培养基:RPMI-1640(日本日水制药
, 百拇医药
株式会社)加15%小牛血清(杭州四季青生物制品公司)和青霉素(1×105U/L)、链霉素
(100mg/L),用7.4%NaHCO3调整pH至 7.4±0.1。
3.2 分离培养 LFb:胎鼠 20只,无菌条件下取肺,生理盐水清洗后剪成约0.2cm3
碎块,胰蛋白酶室温下消化10min,以完全培养基中止消化后离心,取组织块接种于培
养瓶内,24h后组织块边缘长出贴壁细胞并逐渐展开连接成片,呈辐射状排列,待长满
瓶底时传代(约5d),然后每2d传代1次,经6~7次传代后取得自然纯化的LFb,供实验
用。
, http://www.100md.com
4.PMC 与LFb共育
消化收集纯化的 LFb,以3×105/ml细胞数分别接种于25ml 培养瓶内,或置有盖玻片
的培养皿内。于第3d换液后,共育组加入PMC悬液1ml(含105个PMC);对照组不加PMC
(至第3d换液1次,换液后不加PMC),共育5d中止培养,取培养细胞进行下述形态学观
察和形态计量分析。
5.观察方法
5.1 光镜:取盖玻片培养细胞分别作苏木素-伊红(HE)染色和甲苯胺蓝染色,光镜观
, http://www.100md.com
察。
5.2 透射电镜:共育组和对照组各取8瓶培养细胞,分别用2.5%戊二醛固定1h,刮取
贴壁细胞,制成悬液,1 000r/min离心15min,PBS清洗2次,再离心取沉淀细胞加入5滴
血浆,混匀后4000r/min 离心 30min,弃上清液,沉淀物为凝结的细胞团块,再加2.5%戊
二醛固定1h,锇酸后固定1h,取出细胞团块沿中线对半切成两份,常规制成两个Epon包
埋块,每个包埋块超薄切片制成两个铜网样品(每瓶细胞制成4个铜网样品,每组8瓶细
胞共32个铜网样品),H-600透射电镜观察并摄片。
, 百拇医药 5.3扫描电镜:共育组和对照组各取5张载有贴壁细胞的盖玻片常规扫描电镜制样,S-100扫描电镜观察、摄片。
5.4 LFb 定量分析:(1)单位面积LFb 计数:每组各取10张HE染色的盖玻片培养细
胞,光镜下随机取每张染片5个低倍视野(×100,单位面积为0.196mm2),用图像分析仪
(PC Vision Plus85型)进行细胞计数。10张染片共50个视野的细胞均数(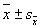 )作为该组单
)作为该组单
位面积细胞数。(2)粗面内质网(RER)的定量分析:透射电镜下每个铜网样品随机拍取4
个LFb(×15 000),两组各取120LFb输入图像分析仪,计量分析LFb 的体密度(Vv)、面
, http://www.100md.com
密度(Sv)和平均截面积( )。
)。
实验结果以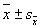 表示,组间比较采用t检验。
表示,组间比较采用t检验。
结 果
1.光镜
倒置显微镜观察发现,共育组第1~2d LFb 呈单层生长,第3d开始逐渐呈多层交错
重叠生长。对照组实验全程均呈单层生长。盖玻片细胞HE染色,共育组LFb 第5d亦呈
多层交错重叠生长,有丝分裂像多见。对照组呈单层生长,有极性,有丝分裂像少(图
, 百拇医药
1a,b)。甲苯胺蓝染色可见LFb表面和细胞间散在PMC,染成紫红色(异染性)。一些PMC
质膜完整,细胞内颗粒较稀疏清晰(图2),细胞周围(胞膜外)有数量不等的异染颗粒。
2.透射电镜
共育组与对照组LFb形态基本相同。细胞呈梭形或星形,核多为卵圆形,或有凹
陷,1~3个核仁,胞质含丰富的RER,部分RER 扩张,甚至呈池状,其内容物为均匀
低电子密度,呈细颗粒状(图3)。对照组LFb形态与共育组LFb相似。
未经培养的PMC呈圆形或卵圆形,表面有丝状微绒毛,胞质充满分泌颗粒,颗粒圆
, http://www.100md.com
形,表面为颗粒界膜(perigranular membrance)包被,内为电子密度高的均质或细颗粒状
的致密物(图4)。与LFb共育的PMC形态与培养前大致相同,只是部分细胞表现出明显的
脱颗粒现象,颗粒内致密物电子密度降低,颗粒界膜相互融合,似形成排放颗粒内容物
的“管道”(图5)。
3.扫描电镜
多数 PMC 为圆形或椭圆形,表面为典型的片状伪足(lamellipodia)。部分细胞形态
比较特殊,呈橄榄形或贝壳形,细胞表面为“桑椹样”(mulberry-like),细胞周围散在
, 百拇医药
大小不一,数量不等的颗粒样物质(图6)。有的细胞表面可见少量小“孔洞”,可能是
胞吐后遗留的痕迹。未经培养的 PMC 呈圆形,表面有片层状伪足,周围无颗粒。LFb
呈复层,胞体梭形,细胞两端有一个或多个较长的树枝状突起,突起间可有短的分支
彼此连接。偶见PMC一端与LFb的突起呈相嵌状(图7)。对照组LFb呈单层生长,形态与
共育组基本相似。
4.形态计量
单位面积(0.196mm2)LFb数量:对照组 171.04±49(个),共育组380.71±80.49
, http://www.100md.com
(个),共育组为对照组的2.2倍。两组比较P<0.01,有显著性差异。LFb的RER 形态计
量结果见附表。
附表 LFb的RER 形态计量()
Table Morphometry of LFb RER
体密度
volume density(Vv)
面密度
surface density(Sv)
平均截面积
, 百拇医药
mean profile area( )
)
共育组
Co-cultured group
15.22±5.32
6.43±2.07
0.11±0.03
对照组
control group
7.38±3.03
3.26±1.24
, http://www.100md.com
0.08±0.02
P
<0.01
<0.01
<0.01
讨 论
肥大细胞在体外与成纤维细胞(3T3)共育可长期保持其表型和活力[4],这种方法一
直作为体外研究MC的重要手段。近年来,人们注意到MC释放物质可促进Fb增生,又
给这一方法带来新的研究内容。目前国内尚未见从MC促进Fb增生的角度观察MC 和
Fb 形态学变化的文献报道。
, 百拇医药
IL-3 激活的骨髓源性MC(BMMC)与3T3 共育,2周时 Fb 数增至原来的4倍,第4周
增至6倍,Fb 重叠生长达11层[5]。在人工划痕(人工创伤)的单层3T3中加入PMC,42h
后,远离“伤口”250μm处,单位面积Fb 数为未加PMC组的1.4倍[6]。本实验PMC与
LFb共育第5d,LFb 呈复层生长,单位面积LFb数为对照组的2.2倍。结果与上述文献报
道基本一致,表明PMC也有促进 LFb 增生的作用。
胶原纤维的前身胶原蛋白在成纤维细胞的RER 内合成。RER 的形态和数量可以间
接地反映成纤维细胞合成前胶原蛋白的功能状态。本研究透射电镜下见RER数量增加,囊状扩张,形态计量结果共育组 RER 体密度、面密度和平均截面积均大于对照组
, 百拇医药
(P<0.01),反映其功能活跃,提示 PMC 可促进LFb合成前胶原蛋白。Doyton等[5]在
BMMC 与3T3共育的研究中发现,胶原mRNA 的转录及生物合成增强,本研究形态学
所见与之相吻合。
MC 生物学功能是通过脱颗粒实现的。MC脱颗粒有三种途径:(1)通过胞吐作用将
颗粒完整地释放到胞外[7];(2)微绒毛内的颗粒随微绒毛断裂脱离胞体[7];(3)浅层颗粒
界膜与胞膜融合,深层颗粒彼此融合,形成“管道”,活性物质通过“管道”排至胞
外[8]。本实验光镜见当与LFb共育后,部分PMC颗粒稀疏清晰,细胞周围有异染颗粒出
, 百拇医药
现。透射电镜可见部分颗粒内致密物电子密度降低,颗粒界膜相互融合似形成排放内
容物的“管道”。这与我们已报道的结果相同[9]。扫描电镜见部分PMC表面呈“桑椹
样”,周围散落颗粒样物质,也与文献报道的扫描电镜下脱颗粒的形态特点相似[10]。
本研究透射电镜所见的脱颗粒现象符合第(3)种途径。光镜与扫描电镜所见的胞外颗粒
或许是第(1)或第(2)种途径脱颗粒的结果。
关于MC促进Fb增生及胶原合成增强的机制尚未完全明了。MC颗粒中含有40余种
活性物质,其中组织胺、肝素糖蛋白、胃促胰酶和肥大细胞源性的生长因子等均可刺
, http://www.100md.com
激Fb增生及胶原合成[11~13]。本研究从形态学上反映了脱颗粒的作用,有关释放介质
促LFb增生的作用机理有待于进一步探讨。
收稿1995-10 修回 1997-05
本文图1~6见插图第14页
* 国家自然科学基金资助课题(No.39170649),CMB基金资助课题(No.900111)
图 版 说 明
图1a共育组:LFb 与PMC共育5d,LFb呈复层生长.HE染色×100
, 百拇医药
图1b 对照组:培养5d,LFb单层生长,有极性.HE染色×100
图2 共育组:共育5d,LFb 表面散在分布着PMC(紫红色).图示一个PMC质膜完整,细
胞内颗粒稀疏(↑).甲苯胺蓝染色×400
图3 共育5d,LFb 胞质中含丰富的粗面内质网(RER),部分RER 扩张,甚至呈池状,其内含低电子密度物质,呈细颗粒状.TEM ×15 000
图4 未经培养的PMC呈卵圆形,表面有丝状突起,胞质内充满圆形颗粒,表面为颗粒
界膜包被(↑),内为高电子密度物质.TEM ×25 000
图5 共育组:共育5d,PMC 与LFb 紧密接触,LFb 胞质中RER 与线粒体丰富.PMC 显
, 百拇医药
示脱颗粒改变:颗粒的界膜相互融合(↑-↑-↑),似形成排放颗粒内容物的“管
道”,部分颗粒电子密度降低(↑).TEM ×50 000
图6 LFb 呈复层生长,表面附着PMC,PMC 表面呈“桑椹样”.有的PMC 呈“贝壳”
形,其周围散在PMC 颗粒(↑).SEM ×6 000
Fig.1a Co-cultured group.LFb co-cultured with PMC for 5 daysgrowed into many layers.
HE ×100
Fig.1b Control group.LFb appeared a single layer with polarityafter 5 days culturing.HE ×100
, 百拇医药
Fig.2 Co-cultured group.Some of the PMC which co-cultured withLFb had intact cell mem-
brane with scattered cytoplasm granules(↑).Toluidineblue stain.×400
Fig.3 Co-cultured LFb for 5 days.Containded abundant roughsurfaced endoplasmic reticulum
(RER).Some of them showed extension shapeeven pooled-shape containing low electron
density particles with small-granularshape.TEM×15 000
, 百拇医药
Fig.4 Non-cultured PMC appeared avoid with filiform processes onthe surface.Its cytoplasm
is full of rounded granules covered byperigranular membrane(↑),containing high
electron density particles.TEM ×25 000
Fig.5 Co-cultured group.A PMC was in close contact with LFb.Therewere abundant RER
and mitochondria in LFb cytoplasm.PMCshowed degranulation,the perigranular memb-
, 百拇医药
ranes of granules fused with each other(↑-↑-↑),formingchannel-like,something like
eliminating granule content.Some granulesshowed electron lucent(↑),TEM×50 000
Fig.6 LFb growed into many layers with PMC adhering to itssurfaces.The surface of a PMC
appeared mulberry like withshell\|shape,at bottom of it scattered PMC granules(↑)
were seen.SEM ×6 000
, http://www.100md.com
参 考 文 献
[1] Choi KL,ClamanHN:Mast cells,Fibroblast and Fibrosis.Immunol Res,1987,6:145
[2] 钱钟FDA3,尹红玲,肥大细胞与肺成纤维细胞生长的影响.中华劳动卫生职业病杂
志,1995,13(3):149
[3] 郑晖,钱仲FDA3,肥大细胞与肺成纤维细胞共育方法.细胞生物学杂志,1993,15(4):186
[4] Levi-Schaffer F,Austen RF,Caulfield JP,et al.Fibroblastsmaintain the phenotype and
, 百拇医药
viability of the rat heparin-containingmast cell in vitro.J Immunol,1985,135(5):3454
[5] Doyton ET,Caulfield JP,Hein A,et al.Regulation of the growthrate of mouse fibroblasts by
IL-3-actived mouse bone marrow derivedmast cells.J Immunol,1989,142(12):4307
[6] Levi-Schaffer F.Mast cells enhance migration andproliferation of fibroblasts into an in
vitro wound.Exp Cell Res,1990,188(1):42
, 百拇医药
[7] Kruger PG.Morphology of normal and secreting mast cell.ActaOtolaryngol,1984,414(Suppl):118
[8] 成令忠主编:组织学.第2版.北京:人民卫生出版社.1993,234~242
[9] 钱仲 FDA3,戚以谟.实验性矽尘沉着病肥大细胞的研究.中华病理学杂志,1992,21(6):246
[10] Ginsburg H,Amira M,Padawer J,et al.Structural alterations infibroblast monolayers
caused by mast cell degranulation.J LeukocBiol,1985,45(6):491
, 百拇医药
[11] Yamashita Y,Nakagomi K,Takeda T,et al.Effect of heparin onpulmonary fibroblasts
and vascular cells.Thorax 1992,47(8):624
[12] Rouss SJ,Hartmann T,Caughey GH.Mast cell tryptase is amitogen for cultured fibro-
blasts.J Clin Invest,1991,88(2):493
[13] Stevens RL,Austen KF.Recent advences in the cellular andmolecular biology of mast
, 百拇医药
cells.Immunol Today,1989,10(11):381
MORPHOLOGICSTUDY OF MAST CELL AND LUNG
FIBROBLASTS IN CO-CULTURE
YinHongling,Qian Zhongfei△
(Department ofPathology,Human Medical University,Changsha)
Mast cells(PMC)collected from peritonealcavities of normal adult rats were co-cultured
, 百拇医药
with lung fibroblasts(LFb)of fetal rats.On the 5th day ofco-cultured,the LFb were observed by
light microscope,electron microscope,and the morphometry for themwas performed by com-
puter image analysis system.The results showed:(1)Theco-culturing LFb growed into many
layers,and the number of LFb per unit area(0.196mm2)were2.2 times more than that of contr-
, http://www.100md.com
ols(P<0.01).(2)The volume density(Vv),surfacedensity(Sv),mean profile area( )of rough
)of rough
surfaced endoplasmic reticula(RER)were larger than that ofcontrols(P<0.01).(3)It was
usually found that the PMC contact closely with LFb and some PMCshowed the degranulat-
ion.It suggested that PMC might promote proliferation of LFbwhose function became active. KEY WORDS Mastcell;Fibroblast;Morphology;Morphometry;Co-culture
______________________
△Department of Pathology,Human MedicalUniversity,Changsha 410078,China, 百拇医药
单位:湖南医科大学病理学教研室,长沙 410078
关键词:肥大细胞;成纤维细胞;形态学;形态计量;共育
解剖学报980117
摘 要 用分离纯化的大鼠腹腔肥大细胞(PMC)与同源胎鼠肺成纤维细胞(LFb)共育,对LFb进行形态学观察和形态计量分析。结果表明:与PMC共育的 LFb 呈复层生长,单
位面积内细胞计数明显增加,粗面内质网(RER)增生。电镜见PMC与LFb紧密接触和部
分PMC有脱颗粒现象。提示PMC可促进LFb增值,并使其功能活跃。
近年来,肥大细胞(mast cell,MC)促进成纤维细胞增生以及MC在纤维化病变发生发
, http://www.100md.com
展中的作用,已引起人们的重视[1],但国内很少有研究报道[2]。本实验采用正常大鼠
腹腔肥大细胞(peritonealmast cell,PMC)与同源胎鼠肺成纤维细胞(lung fibroblast,LFb)共
育,观察PMC与LFb的形态学变化,为探讨MC在肺纤维化过程中的作用提供形态学依
据。
材料和方法
1.实验动物
Wistar 大鼠,体重约 200g,雌雄不限,供采集PMC。取妊娠13~15dWistar 胎鼠
用作分离 LFb。以上动物均由本校实验动物学部提供。
, 百拇医药
2.PMC 采集分离
2.1 PMC分离液的配制:取比重1.120的40%Ficoll溶液50ml,用比重1.077的淋巴细胞
分离液调整比重至1.085,用于分离PMC。(Ficoll溶液和淋巴细胞分离液均为上海试剂二
厂产品)
2.2 PMC采集分离:参照本室使用的梯度密度分离PMC 方法[3],于无菌条件下收集
大鼠(6只)腹腔冲洗液,离心后取其细胞悬液,沿管壁缓慢加入盛有PMC分离液的离心
管中,使两液形成界面,4℃、2500r/min离心15min,PMC沉于管底,倾去上层液体,取
, http://www.100md.com
底部PMC用冷无 Ca2+、Mg2+的PBS 清洗 2次(4℃,1000r/min离心10min)后,于RPMI-
1640 培养液悬浮备用(甲苯胺蓝染色,光镜下计数PMC纯度达95%以上)。
3.LFb分离培养
按本室建立的方法分离培养LFb[3]。
3.1 试剂与培养液:(1)胰蛋白酶1∶250,Sigma公司)用PBS液配制成0.1%溶液供原
代和传代消化用;(2)无Ca2+、Mg2+PBS液;(3)完全培养基:RPMI-1640(日本日水制药
, 百拇医药
株式会社)加15%小牛血清(杭州四季青生物制品公司)和青霉素(1×105U/L)、链霉素
(100mg/L),用7.4%NaHCO3调整pH至 7.4±0.1。
3.2 分离培养 LFb:胎鼠 20只,无菌条件下取肺,生理盐水清洗后剪成约0.2cm3
碎块,胰蛋白酶室温下消化10min,以完全培养基中止消化后离心,取组织块接种于培
养瓶内,24h后组织块边缘长出贴壁细胞并逐渐展开连接成片,呈辐射状排列,待长满
瓶底时传代(约5d),然后每2d传代1次,经6~7次传代后取得自然纯化的LFb,供实验
用。
, http://www.100md.com
4.PMC 与LFb共育
消化收集纯化的 LFb,以3×105/ml细胞数分别接种于25ml 培养瓶内,或置有盖玻片
的培养皿内。于第3d换液后,共育组加入PMC悬液1ml(含105个PMC);对照组不加PMC
(至第3d换液1次,换液后不加PMC),共育5d中止培养,取培养细胞进行下述形态学观
察和形态计量分析。
5.观察方法
5.1 光镜:取盖玻片培养细胞分别作苏木素-伊红(HE)染色和甲苯胺蓝染色,光镜观
, http://www.100md.com
察。
5.2 透射电镜:共育组和对照组各取8瓶培养细胞,分别用2.5%戊二醛固定1h,刮取
贴壁细胞,制成悬液,1 000r/min离心15min,PBS清洗2次,再离心取沉淀细胞加入5滴
血浆,混匀后4000r/min 离心 30min,弃上清液,沉淀物为凝结的细胞团块,再加2.5%戊
二醛固定1h,锇酸后固定1h,取出细胞团块沿中线对半切成两份,常规制成两个Epon包
埋块,每个包埋块超薄切片制成两个铜网样品(每瓶细胞制成4个铜网样品,每组8瓶细
胞共32个铜网样品),H-600透射电镜观察并摄片。
, 百拇医药 5.3扫描电镜:共育组和对照组各取5张载有贴壁细胞的盖玻片常规扫描电镜制样,S-100扫描电镜观察、摄片。
5.4 LFb 定量分析:(1)单位面积LFb 计数:每组各取10张HE染色的盖玻片培养细
胞,光镜下随机取每张染片5个低倍视野(×100,单位面积为0.196mm2),用图像分析仪
(PC Vision Plus85型)进行细胞计数。10张染片共50个视野的细胞均数(
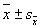 )作为该组单
)作为该组单位面积细胞数。(2)粗面内质网(RER)的定量分析:透射电镜下每个铜网样品随机拍取4
个LFb(×15 000),两组各取120LFb输入图像分析仪,计量分析LFb 的体密度(Vv)、面
, http://www.100md.com
密度(Sv)和平均截面积(
 )。
)。实验结果以
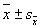 表示,组间比较采用t检验。
表示,组间比较采用t检验。结 果
1.光镜
倒置显微镜观察发现,共育组第1~2d LFb 呈单层生长,第3d开始逐渐呈多层交错
重叠生长。对照组实验全程均呈单层生长。盖玻片细胞HE染色,共育组LFb 第5d亦呈
多层交错重叠生长,有丝分裂像多见。对照组呈单层生长,有极性,有丝分裂像少(图
, 百拇医药
1a,b)。甲苯胺蓝染色可见LFb表面和细胞间散在PMC,染成紫红色(异染性)。一些PMC
质膜完整,细胞内颗粒较稀疏清晰(图2),细胞周围(胞膜外)有数量不等的异染颗粒。
2.透射电镜
共育组与对照组LFb形态基本相同。细胞呈梭形或星形,核多为卵圆形,或有凹
陷,1~3个核仁,胞质含丰富的RER,部分RER 扩张,甚至呈池状,其内容物为均匀
低电子密度,呈细颗粒状(图3)。对照组LFb形态与共育组LFb相似。
未经培养的PMC呈圆形或卵圆形,表面有丝状微绒毛,胞质充满分泌颗粒,颗粒圆
, http://www.100md.com
形,表面为颗粒界膜(perigranular membrance)包被,内为电子密度高的均质或细颗粒状
的致密物(图4)。与LFb共育的PMC形态与培养前大致相同,只是部分细胞表现出明显的
脱颗粒现象,颗粒内致密物电子密度降低,颗粒界膜相互融合,似形成排放颗粒内容物
的“管道”(图5)。
3.扫描电镜
多数 PMC 为圆形或椭圆形,表面为典型的片状伪足(lamellipodia)。部分细胞形态
比较特殊,呈橄榄形或贝壳形,细胞表面为“桑椹样”(mulberry-like),细胞周围散在
, 百拇医药
大小不一,数量不等的颗粒样物质(图6)。有的细胞表面可见少量小“孔洞”,可能是
胞吐后遗留的痕迹。未经培养的 PMC 呈圆形,表面有片层状伪足,周围无颗粒。LFb
呈复层,胞体梭形,细胞两端有一个或多个较长的树枝状突起,突起间可有短的分支
彼此连接。偶见PMC一端与LFb的突起呈相嵌状(图7)。对照组LFb呈单层生长,形态与
共育组基本相似。
4.形态计量
单位面积(0.196mm2)LFb数量:对照组 171.04±49(个),共育组380.71±80.49
, http://www.100md.com
(个),共育组为对照组的2.2倍。两组比较P<0.01,有显著性差异。LFb的RER 形态计
量结果见附表。
附表 LFb的RER 形态计量(
Table Morphometry of LFb RER
体密度
volume density(Vv)
面密度
surface density(Sv)
平均截面积
, 百拇医药
mean profile area(
 )
)共育组
Co-cultured group
15.22±5.32
6.43±2.07
0.11±0.03
对照组
control group
7.38±3.03
3.26±1.24
, http://www.100md.com
0.08±0.02
P
<0.01
<0.01
<0.01
讨 论
肥大细胞在体外与成纤维细胞(3T3)共育可长期保持其表型和活力[4],这种方法一
直作为体外研究MC的重要手段。近年来,人们注意到MC释放物质可促进Fb增生,又
给这一方法带来新的研究内容。目前国内尚未见从MC促进Fb增生的角度观察MC 和
Fb 形态学变化的文献报道。
, 百拇医药
IL-3 激活的骨髓源性MC(BMMC)与3T3 共育,2周时 Fb 数增至原来的4倍,第4周
增至6倍,Fb 重叠生长达11层[5]。在人工划痕(人工创伤)的单层3T3中加入PMC,42h
后,远离“伤口”250μm处,单位面积Fb 数为未加PMC组的1.4倍[6]。本实验PMC与
LFb共育第5d,LFb 呈复层生长,单位面积LFb数为对照组的2.2倍。结果与上述文献报
道基本一致,表明PMC也有促进 LFb 增生的作用。
胶原纤维的前身胶原蛋白在成纤维细胞的RER 内合成。RER 的形态和数量可以间
接地反映成纤维细胞合成前胶原蛋白的功能状态。本研究透射电镜下见RER数量增加,囊状扩张,形态计量结果共育组 RER 体密度、面密度和平均截面积均大于对照组
, 百拇医药
(P<0.01),反映其功能活跃,提示 PMC 可促进LFb合成前胶原蛋白。Doyton等[5]在
BMMC 与3T3共育的研究中发现,胶原mRNA 的转录及生物合成增强,本研究形态学
所见与之相吻合。
MC 生物学功能是通过脱颗粒实现的。MC脱颗粒有三种途径:(1)通过胞吐作用将
颗粒完整地释放到胞外[7];(2)微绒毛内的颗粒随微绒毛断裂脱离胞体[7];(3)浅层颗粒
界膜与胞膜融合,深层颗粒彼此融合,形成“管道”,活性物质通过“管道”排至胞
外[8]。本实验光镜见当与LFb共育后,部分PMC颗粒稀疏清晰,细胞周围有异染颗粒出
, 百拇医药
现。透射电镜可见部分颗粒内致密物电子密度降低,颗粒界膜相互融合似形成排放内
容物的“管道”。这与我们已报道的结果相同[9]。扫描电镜见部分PMC表面呈“桑椹
样”,周围散落颗粒样物质,也与文献报道的扫描电镜下脱颗粒的形态特点相似[10]。
本研究透射电镜所见的脱颗粒现象符合第(3)种途径。光镜与扫描电镜所见的胞外颗粒
或许是第(1)或第(2)种途径脱颗粒的结果。
关于MC促进Fb增生及胶原合成增强的机制尚未完全明了。MC颗粒中含有40余种
活性物质,其中组织胺、肝素糖蛋白、胃促胰酶和肥大细胞源性的生长因子等均可刺
, http://www.100md.com
激Fb增生及胶原合成[11~13]。本研究从形态学上反映了脱颗粒的作用,有关释放介质
促LFb增生的作用机理有待于进一步探讨。
收稿1995-10 修回 1997-05
本文图1~6见插图第14页
* 国家自然科学基金资助课题(No.39170649),CMB基金资助课题(No.900111)

图 版 说 明
图1a共育组:LFb 与PMC共育5d,LFb呈复层生长.HE染色×100
, 百拇医药
图1b 对照组:培养5d,LFb单层生长,有极性.HE染色×100
图2 共育组:共育5d,LFb 表面散在分布着PMC(紫红色).图示一个PMC质膜完整,细
胞内颗粒稀疏(↑).甲苯胺蓝染色×400
图3 共育5d,LFb 胞质中含丰富的粗面内质网(RER),部分RER 扩张,甚至呈池状,其内含低电子密度物质,呈细颗粒状.TEM ×15 000
图4 未经培养的PMC呈卵圆形,表面有丝状突起,胞质内充满圆形颗粒,表面为颗粒
界膜包被(↑),内为高电子密度物质.TEM ×25 000
图5 共育组:共育5d,PMC 与LFb 紧密接触,LFb 胞质中RER 与线粒体丰富.PMC 显
, 百拇医药
示脱颗粒改变:颗粒的界膜相互融合(↑-↑-↑),似形成排放颗粒内容物的“管
道”,部分颗粒电子密度降低(↑).TEM ×50 000
图6 LFb 呈复层生长,表面附着PMC,PMC 表面呈“桑椹样”.有的PMC 呈“贝壳”
形,其周围散在PMC 颗粒(↑).SEM ×6 000
Fig.1a Co-cultured group.LFb co-cultured with PMC for 5 daysgrowed into many layers.
HE ×100
Fig.1b Control group.LFb appeared a single layer with polarityafter 5 days culturing.HE ×100
, 百拇医药
Fig.2 Co-cultured group.Some of the PMC which co-cultured withLFb had intact cell mem-
brane with scattered cytoplasm granules(↑).Toluidineblue stain.×400
Fig.3 Co-cultured LFb for 5 days.Containded abundant roughsurfaced endoplasmic reticulum
(RER).Some of them showed extension shapeeven pooled-shape containing low electron
density particles with small-granularshape.TEM×15 000
, 百拇医药
Fig.4 Non-cultured PMC appeared avoid with filiform processes onthe surface.Its cytoplasm
is full of rounded granules covered byperigranular membrane(↑),containing high
electron density particles.TEM ×25 000
Fig.5 Co-cultured group.A PMC was in close contact with LFb.Therewere abundant RER
and mitochondria in LFb cytoplasm.PMCshowed degranulation,the perigranular memb-
, 百拇医药
ranes of granules fused with each other(↑-↑-↑),formingchannel-like,something like
eliminating granule content.Some granulesshowed electron lucent(↑),TEM×50 000
Fig.6 LFb growed into many layers with PMC adhering to itssurfaces.The surface of a PMC
appeared mulberry like withshell\|shape,at bottom of it scattered PMC granules(↑)
were seen.SEM ×6 000
, http://www.100md.com
参 考 文 献
[1] Choi KL,ClamanHN:Mast cells,Fibroblast and Fibrosis.Immunol Res,1987,6:145
[2] 钱钟FDA3,尹红玲,肥大细胞与肺成纤维细胞生长的影响.中华劳动卫生职业病杂
志,1995,13(3):149
[3] 郑晖,钱仲FDA3,肥大细胞与肺成纤维细胞共育方法.细胞生物学杂志,1993,15(4):186
[4] Levi-Schaffer F,Austen RF,Caulfield JP,et al.Fibroblastsmaintain the phenotype and
, 百拇医药
viability of the rat heparin-containingmast cell in vitro.J Immunol,1985,135(5):3454
[5] Doyton ET,Caulfield JP,Hein A,et al.Regulation of the growthrate of mouse fibroblasts by
IL-3-actived mouse bone marrow derivedmast cells.J Immunol,1989,142(12):4307
[6] Levi-Schaffer F.Mast cells enhance migration andproliferation of fibroblasts into an in
vitro wound.Exp Cell Res,1990,188(1):42
, 百拇医药
[7] Kruger PG.Morphology of normal and secreting mast cell.ActaOtolaryngol,1984,414(Suppl):118
[8] 成令忠主编:组织学.第2版.北京:人民卫生出版社.1993,234~242
[9] 钱仲 FDA3,戚以谟.实验性矽尘沉着病肥大细胞的研究.中华病理学杂志,1992,21(6):246
[10] Ginsburg H,Amira M,Padawer J,et al.Structural alterations infibroblast monolayers
caused by mast cell degranulation.J LeukocBiol,1985,45(6):491
, 百拇医药
[11] Yamashita Y,Nakagomi K,Takeda T,et al.Effect of heparin onpulmonary fibroblasts
and vascular cells.Thorax 1992,47(8):624
[12] Rouss SJ,Hartmann T,Caughey GH.Mast cell tryptase is amitogen for cultured fibro-
blasts.J Clin Invest,1991,88(2):493
[13] Stevens RL,Austen KF.Recent advences in the cellular andmolecular biology of mast
, 百拇医药
cells.Immunol Today,1989,10(11):381
MORPHOLOGICSTUDY OF MAST CELL AND LUNG
FIBROBLASTS IN CO-CULTURE
YinHongling,Qian Zhongfei△
(Department ofPathology,Human Medical University,Changsha)
Mast cells(PMC)collected from peritonealcavities of normal adult rats were co-cultured
, 百拇医药
with lung fibroblasts(LFb)of fetal rats.On the 5th day ofco-cultured,the LFb were observed by
light microscope,electron microscope,and the morphometry for themwas performed by com-
puter image analysis system.The results showed:(1)Theco-culturing LFb growed into many
layers,and the number of LFb per unit area(0.196mm2)were2.2 times more than that of contr-
, http://www.100md.com
ols(P<0.01).(2)The volume density(Vv),surfacedensity(Sv),mean profile area(
 )of rough
)of roughsurfaced endoplasmic reticula(RER)were larger than that ofcontrols(P<0.01).(3)It was
usually found that the PMC contact closely with LFb and some PMCshowed the degranulat-
ion.It suggested that PMC might promote proliferation of LFbwhose function became active. KEY WORDS Mastcell;Fibroblast;Morphology;Morphometry;Co-culture
______________________
△Department of Pathology,Human MedicalUniversity,Changsha 410078,China, 百拇医药