反义周期蛋白B1基因抑制HT29细胞的增殖*
作者:邢录洲 王永潮
单位:北京师范大学生物系细胞增殖及调控生物学开放实验室,北京 100875
关键词:DNA重组;反义RNA;周期蛋白B1;基因转染
解剖学报980101
摘 要 用DNA重组技术将人类cyclin B1基因的全长cDNA,反向插入到真核表达
载体pXJ41-neo的BamH1位点,得到cyclin B1基因的反义RNA表达载体pAS-B1。利用
DNA磷酸钙共沉淀方法,将pAS-B1转染进HT29细胞。在含有G418的培养基中,挑
, 百拇医药
选出独立的细胞克隆。利用cyclin B1 cDNA作探针,Northern blot杂交鉴定出一株内源
性cyclin B1 mRNA受到抑制的细胞株HTB1。比较HTB1与对照细胞HT29发现,cyclin
B1的反义RNA明显抑制HT29细胞的增殖,细胞内3H-TdR参入量减少。流式细胞光度
术分析,处于G1期细胞比率的升高与S期、G2+M期细胞数量的下降都十分显著。
周期蛋白(cyclin)是Evans等[1]在1983年研究海胆(sea urchin)早期胚胎同步化细胞
分裂过程中发现的。它在间期合成,含量持续积累升高,在有丝分裂向后期转换时,突然降解,G1期又开始合成,由此得名cyclin。首先在海蛤(clam)中鉴定出两种cyclin
, 百拇医药
蛋白:cyclin A和cyclin B[2,3],它们的序列存在差异。由于cyclin B是M期促进因子
(M-phase promotingfactor, MPF)[4]的组成成分,它引起了人们的极大关注。MPF主
要是由催化亚基p34cdc2和调节亚基cyclin B组成的激酶复合体(cyclin B/cdc2)[5]。真核
细胞M期的诱导由MPF来完成。cyclin B1是Hunter等[6]在1989年从HeLa细胞cDNA文
库中分离获得,它是在人类体细胞中发现的第一个cyclin。
反义RNA(antisenseRNA)是一类天然的广泛存在于生物体内的基因调控分子。这
, http://www.100md.com
类小分子RNA不能编码蛋白质,主要通过碱基互补方式,与特定的mRNA形成双链
RNA杂交体调控基因表达。现在,随着天然反义RNA的普遍发现,以及对它们的结
构特征、作用机理和功能效应的深入研究,启发了人们利用反义RNA抑制特定基因
表达的特征,发展了多项反义RNA技术,特别是利用基因重组技术,在适宜的启动
子和转录终止子之间反向插入一段靶基因,构建反义RNA表达载体,将其转染进细
胞,在体内表达出反义RNA,从而对靶基因表达进行抑制,这是技术上的一大进步。
反义RNA技术在研究基因负调控作用机理中显示巨大潜力,同时为肿瘤等疾病的基
, http://www.100md.com
因治疗带来了希望。
材料和方法
1.材料
1.1 菌种:大肠杆菌菌株HB101,为本实验室保存。
1.2 质粒:pCycB1由TonyHunter教授(The Salk Institute for BiologicalStudies, San
Diego, California)惠赠,其内部含有人类cyclin B1基因的全长cDNA,1.45kb,克隆于
质粒载体pGEM-4的BamH I酶切位点。pXJ41-neo[7]由王跃博士(国立新加坡大学分
, 百拇医药
子及细胞生物学研究所)惠赠。1.3 试剂:限制性内切酶、碱性磷酸酶、T4 DNA连
接酶、同位素标记试剂盒prime-a-gene Labelling system购自Promega公司;G418、琼
脂糖、低熔点琼脂糖、DEPC、HEPES、MOPS、gunidinium isothiocyanate购自Gibco
公司;sodiumlauryl sarcocinate、sodium citrate购自Sigma公司;2-mercaptoethanol,formamid、Formaldehyde购自Fluka公司;α-32P-dCTP(3 000Ci/mmol, 10Ci/L)购自北
京亚辉公司;3H-TdR(1Ci/L)购自中国原子能研究所(北京);其他试剂为国产分析
, http://www.100md.com
纯。
1.4 细胞株:人结肠腺癌HT29细胞系本实验室保存。
2.方法[8]
2.1 质粒DNA的制备:细菌生长在含氨苄青霉素的LB培养基中。在氯霉素存在下
扩增。采取碱法裂解,用聚乙二醇沉淀法纯化质粒DNA。
2.2 质粒DNA的限制性酶切和凝胶电泳:参考文献[8]。
2.3 DNA片段回收:利用低熔点琼脂糖凝胶电泳回收DNA片段。
2.4 外源DNA和质粒载体的连接:(1) 线状质粒DNA的去磷酸化参照文献[8]。(2)
, http://www.100md.com
连接反应依次按载体DNA∶外源DNA=1∶1、1∶3或3∶1摩尔比设计连接反应。在
T4 DNA ligase作用下于4℃中反应过夜,取1μl转化大肠杆菌感受态细胞。
2.5 含重组质粒的细菌菌落的鉴定:随机挑取一些独立的转化菌落进行小规模培
养,制备质粒DNA,然后用限制酶进行消化,通过凝胶电泳进行分析。确定单一插
入片段的重组子,在插入片段的非中央位置选取单酶切位点,结合载体上的酶切位
点,限制酶切分析,判断插入片段的方向。
2.6 重组质粒转染HT29细胞[8,9]:(1) 细胞培养:HT29细胞培养在含10%小牛血清
, http://www.100md.com
的Mc Coy′5A培养基中,于37℃含5%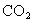 孵箱培养。使细胞分散充分,散布均匀。
孵箱培养。使细胞分散充分,散布均匀。
(2) 按参考文献[7]制备磷酸钙DNA共沉淀物。(3) 转染细胞:用吸液管将混合液吹打
1次,转移至细胞培养皿内培养液中,培养6h后,吸出培养液和沉淀物用培养液将细
胞洗2次。加入含10% DMSO的37℃培养液,放回孵箱,作用2.5min。吸出含DMSO
的培养液,洗细胞2次,然后换为含G418(400mg/L)的培养基培养。每2~4d换液1次。
(4) 克隆细胞的扩大培养:细胞克隆长出后,让其在含G418培养基中继续生长2周。
, 百拇医药
吸取少量胰酶对准克隆消化适当时间,吸取细胞转入24孔培养板中,在G418培养基
中继续培养。
2.7 细胞总体RNA的制备及Northernblot:(1) RNA的制备详见文献[10]。(2) 用常规方
法进行Northernblot。
2.8 DNA探针的制备及预杂交、杂交和放射自显影:详见文献[11]。
2.9 细胞生长曲线:用胰酶消化对数生长期的HeLa细胞及其转染细胞,计数,接种
于小方瓶培养。每24h,平行取3份消化,细胞计数仪计数,求平均值, 绘制细胞生
长曲线。
, http://www.100md.com
2.10 3H-TdR参入试验[12]:用胰酶消化对数期生长的HT29及其转染细胞,计数,接种,24h后,加入3H-TdR(1mCi/L)于培养液脉冲标记6h。弃去培养液,收集细胞,制备样品。利用抽滤器将细胞样品裂解液点到硝酸纤维素滤膜上,三氯乙酸冲洗,干燥。在BeckmanLS-9000型液体闪烁计数器中测量。记录样品脉冲数/分(CPM)。
2.11 流式细胞光度术(FCM):收集对数期生长的转染细胞及其对照细胞,PBS洗1
次,将细胞快速吹散于70%冷酒精中,4℃固定24h。离心,洗涤,加入RNase A,37℃温育1h,冰水冷却。加入碘化丙啶,放置冰上避光染色20min。流式细胞仪测
量绘制DNA分布直方图。
结 果
, 百拇医药
1. 反义cyclin B1重组质粒pAS-B1的构建与鉴定
BamH I酶切消化质粒pCycB1和pXJ41-neo,低熔点胶回收pCycB1质粒中1.45kb
cyclin B1 cDNA片段。去磷酸化的线性pXJ41-neo载体与cyclin B1 cDNA进行连接。
产物转化受体菌HB101。随机挑取转化菌落,制备质粒DNA。
Xhol I酶切分析转化菌落的质粒DNA,当载体(6.89kb)内有一个片段(1.45kb)插
入时,线性重组质粒DNA大小为8.34kb,它介于DNA marker (λDNA/HINDⅢ)第
, 百拇医药
2条带(9.4kb)和第3条带(6.6kb)之间。反向插入时,EcoRI酶切消化,在高分子量位
置切出1条大于载体DNA而与重组DNA大小接近的8.22kb的DNA带,该质粒命名
为pAS-B1(AS:antisense)。质粒构建如图1,鉴定结果如图2。
图1 重组质粒pAS-B1的图谱
人巨细胞病毒启动子、内含子Ⅱ、周期蛋白B1位点
Fig.1 Map ofrecombinant plasmid of pAS-B1
HCMV promotor, intron Ⅱ, cyclin B1, sit
, http://www.100md.com
图2 质粒pAS-B1、pXJ41-neo和pcycB1的限制酶切分析
Fig.2 Restrictionenzyme analysis of pAS-B1, pXJ41-neo and pcycB1
a: pAS-B1/EcoRI,b:pAS-B1/XholI,c:Marker (λ DNA/HindⅢ)
d:pXJ41-neo/BamHI,e:pCycB1/BamHI,2. pAS-B1转染HT29细胞及转染克隆的鉴定
利用DNA磷酸钙共沉淀方法,将pAS-B1转染HT29细胞,转染细胞在含G418培
养基中筛选培养。2周时,培养皿中长出抗性细胞集落。利用24孔培养板分离扩大细
, 百拇医药
胞克隆,得到一株抗G418细胞株,命名为HTB1。以未转染质粒的HT29作对照细胞。
用α-32P-dCTP标记的cyclin B1 cDNA作探针对HTB1和HT29的RNA进行Northernblot
杂交分析,结果如图3。
结果显示转染细胞HTB1中cyclin B1 RNA的表达水平有大幅度下降,明显低于对
照细胞HT29中的表达,是对照的54%。
3. 细胞形态的变化
转染细胞与对照细胞相比,其形态仍然呈圆形,没有大的变化,但细胞间界限
, 百拇医药
相对清楚(图4)。
4. 细胞增殖速度的变化
以1.85×105细胞/培养瓶(11cm32)接种HTB1和HT29于小方瓶中,每隔24h,平行
取出3瓶,细胞计数,绘制生长曲线(图5)。
结果表明转染细胞的增殖速度明显低于对照细胞,而且转染细胞的密度抑制强
于对照HT29细胞。
5. 细胞DNA合成速度的变化
, 百拇医药
以8×104细胞/孔接种HTB1和HT29细胞于24孔板,每种细胞平行接种3孔,24h
后,加入3H-TdR,脉冲标记6h,收集细胞,液体闪烁计数仪测定各样品CPM,相
对合成率(图6)。
3H-TdR在HTB1中的参入量比HT29细胞中低16.5%,说明反义cyclin B1转染使
HT29细胞DNA合成速度减慢。
6. 细胞周期分布的变化
收集对数期生长的HTB1和HT29细胞,利用流式细胞光度仪进行分析。反义cyclin
, http://www.100md.com
B1转染HT29细胞后,G1期细胞由26.8%上升到43.8%,G2+M期细胞数由25.7%下降到
16.3%,S期细胞数由47.5%下降到39.9%(图7)。
图3 Northern blot 分析 HTB1和 HT29细胞内的cyclin B1 RNA
Fig.3 Northern blot analysis of cyclin B1 RNA in HTB1 and HT29cells
图4 HTB1和HT29细胞的形态
Fig.4 Morphology ofHTB1 and HT29 cells
, 百拇医药
A:HT29 B:HTB1
图5 HTB1和HT29细胞的生长曲线
Fig.5 Cell growthcurves of HTB1 and HT29 cells
图6 3H-TdR参入的每分钟计数
Fig.6 CPM in 3H-TdRincorporation test
图7 HTB1和HT29细胞的周期时相分布
, 百拇医药
Fig.7 Cell cyclephase distribution of HTB1 and HT29 cells
A(HTB1), B(HT29)
G1: 43.8 26.8
S: 39.9 47.5
G2+M: 16.3 25.7
total: 100.0 100.0
Relative RNA expression
讨 论
根据反义RNA能抑制特定基因功能的特性,利用反义战略揭示许多基因的正常
, 百拇医药
功能,Neiman等运用反义技术抑制了劳氏肉瘤病毒转化基因src对细胞的转化作用。
他们选择了一种无致病力的病毒,用它携带劳氏肉瘤病毒反义src基因,细胞被这种
特殊病毒感染后,再用劳氏肉瘤病毒处理,就不会被转化,证明反义src基因的表达
抑制了劳氏肉瘤病毒的转化作用。Prochownik等[12]将鼠的全长c-myc cDNA反向克隆
于一种真核表达载体中,用它转染F-MEL细胞。结果显示c-myc的反义转录体加速细
胞分化,抑制了G1期进程。我们对6例结肠癌病人的癌组织RNA进行dot blot杂交分
析,发现cyclinB1基因在其中有过表达现象(结果未发表)。现在细胞周期调控因子与
, 百拇医药
癌发生的关系引起人们高度重视,G1 cyclins的过表达与癌发生基本已被肯定,如cyc-
lin D1认为是癌基因,cyclin E的表达失控认为是乳腺上皮细胞恶性转化的最突出的分
子标志(malecularmarker),cyclin D2、cyclin D3和cyclin A均与一定的癌发生有关。有丝
分裂cyclin在这一过程中发挥什么作用?在最近的报告中,人们已经怀疑cyclin B与乳
癌有关[14]。我们的结果提示,cyclin B1的过表达与结肠癌中细胞增殖失控可能存在
某种联系。于是我们构建了人类cyclin B1基因的反义RNA表达载体pAS-B1,转染人
, 百拇医药
结肠腺癌细胞系HT29。
cyclin B1全长cDNA反向插入于pXJ41-neo载体的BamH I位点,在上游HCMV启动
子驱动下,能够转录出cyclin B1的反义RNA。将pAS-B1质粒转染HT29细胞,筛选分
离出一株G418抗性细胞株HTB1。Northern blot杂交显示转染细胞内cyclin B1的mRNA
含量下降,仅占对照细胞的一半。说明cyclin B1的反义RNA对于降低细胞内源性cyclin
B1 mRNA是十分有效的。
转染细胞的形态仍然呈圆形,贴壁生长。单层生长时,细胞间界限比较分明,多
, http://www.100md.com
层局部集聚生长能力下降。其增殖速度明显低于对照细胞,并且转染细胞的最大密度
低于对照细胞。我们知道,接触抑制是正常细胞和转化细胞的区别之一。上述结果反
映出,反义cyclinB1的转染对HT29细胞的增殖有明显抑制作用。流式细胞光度术结果
及3H-TdR参入DNA试验与此相一致。
收稿 1996-09 修回 1997-04
* 国家自然科学基金资助课题(No.39430080)
参考文献
[1]Evans T,Rosenthal E T, Youngblom J. Cyclin: A protein specified bymaternal mRNA in
, 百拇医药
sea urchin eggs that is destroyed at eachcleavage division. Cell, 1983, 33(6): 389
[2] Swenson K I, Farrell K M, Ruderman J V. The clam embryoprotein cyclin A induces entry
into M-phase and the resumption of meiosisin Xenopus oocytes. Cell, 1986(9),47:861
[3] Westendorf J M, Swenson K I, Ruderman J V. The role of cyclinB in meiosis I. J Cell
Biol, 1989, 108(4):1431
, 百拇医药
[4] Genhart J, Wu M, Kirschner M. Cell cycle dynamics of anM-phase-specific cytoplasmic
factor in Xenopus laevis occytes and eggs.J Cell Biol, 1984, 98(4):1247
[5] Lohka M J, Hayes M K, Maller JL. Purification ofmaturation-promoting factor, an intrac-
ellularregulator of early mitotic events. PNAS(USA), 1988, 85(5):3009
[6] Pines J, Hunter T. Isolation of a human cyclin cDNA: evidencefor cyclin mRNA and pro-
, 百拇医药
tein regulation in the cell cycle and forinteraction with P34cdc2.Cell, 1989, 58(9):833
[7] Zheng X M, Wang Y, Pallen C P. Cell transformation andactivation of pp60c-src by over-
expression of a protein tyrosinephosphatase. Nature, 1992, 359(9):336
[8] Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning. ed 2,New York:Cold Spring
Harbor Laboratory Press, 1989:5.72-5.72,6.3-6.20
, 百拇医药
[9] 鄂 征.组织培养技术:细胞培养在癌基因研究中的应用.北京:人民卫生出版社,1993:287~289
[10] Chomczynski P, Sacchi N. Single -step method of RNAisolation by acid guanidinium
thiocyanate-phenol-chloroform extraction.Analytical Biochemistry, 1987,162(4):156
[11] 邢录洲,王永潮.反义周期蛋白B1基因转染HT29细胞后若干细胞增殖调控相关基
因表达的变化.解剖学报,1998,29(1):8
[12] Prochownik E V, Kukowska J, Rodgers C. c-myc antisensetranscripts accelerate
, 百拇医药
differentiation and inhibit G1 progressionin murine erythroleukemia cells. Molecular
Cellular Biology, 1988, 8(9):3683
[13] Karp J E, Broder S. Molecular foundations of cancer :newtargets for intervention. Nature
Medicine, 1995,1(2):309
ANTISENSECYCLIN B1 GENE INHIBITS THE
PROLIFERATION OF HT29 CELLS
, http://www.100md.com
XingLuzhou, Wang Yongchao△(KeyLaboratory of Cell Proliferation and Regulation Biology, BeijingNormal University, Beijing)
The full-length cDNA of human cyclin B1gene was inserted into the eukaryotic
expression vector pXJ41-neo in its antisense orientation at theBamH I site to produce
the plasmid pAS-B1 which expressed antisense RNA of cyclin B1gene by DNA rec-
, 百拇医药
ombinant technique. The plasmid pAS-B1 was transfected into HT29cells by DNA- co-precipitation. Individual cell clones were selected in themedium
co-precipitation. Individual cell clones were selected in themedium
supplemented with G418. The expresison of endogenous cyclin B1mRNA was inhibited
and was measured by Northern blot with cyclin B1 cDNA probe.Compared with HT29
cells, we found that antisense RNA of cyclin B1 could obviouslyinhibit the proliferation
, 百拇医药
and 3H-thymidine incorporation of HTB1 cells.By flow cytometry analysis we found that
the cell number of G1 phase increased obviously and the cellnumber of S phase and G2+M
phases decreased markedly in HTB1 cells. KEY WORDS DNA recombinant;Antisense RNA; Cyclin B1; Gene transfection
___________________
△Key Laboratory of Cell Proliferation andRegulation Biology,Beijing Normal University, Beijing 100875,China, 百拇医药
单位:北京师范大学生物系细胞增殖及调控生物学开放实验室,北京 100875
关键词:DNA重组;反义RNA;周期蛋白B1;基因转染
解剖学报980101
摘 要 用DNA重组技术将人类cyclin B1基因的全长cDNA,反向插入到真核表达
载体pXJ41-neo的BamH1位点,得到cyclin B1基因的反义RNA表达载体pAS-B1。利用
DNA磷酸钙共沉淀方法,将pAS-B1转染进HT29细胞。在含有G418的培养基中,挑
, 百拇医药
选出独立的细胞克隆。利用cyclin B1 cDNA作探针,Northern blot杂交鉴定出一株内源
性cyclin B1 mRNA受到抑制的细胞株HTB1。比较HTB1与对照细胞HT29发现,cyclin
B1的反义RNA明显抑制HT29细胞的增殖,细胞内3H-TdR参入量减少。流式细胞光度
术分析,处于G1期细胞比率的升高与S期、G2+M期细胞数量的下降都十分显著。
周期蛋白(cyclin)是Evans等[1]在1983年研究海胆(sea urchin)早期胚胎同步化细胞
分裂过程中发现的。它在间期合成,含量持续积累升高,在有丝分裂向后期转换时,突然降解,G1期又开始合成,由此得名cyclin。首先在海蛤(clam)中鉴定出两种cyclin
, 百拇医药
蛋白:cyclin A和cyclin B[2,3],它们的序列存在差异。由于cyclin B是M期促进因子
(M-phase promotingfactor, MPF)[4]的组成成分,它引起了人们的极大关注。MPF主
要是由催化亚基p34cdc2和调节亚基cyclin B组成的激酶复合体(cyclin B/cdc2)[5]。真核
细胞M期的诱导由MPF来完成。cyclin B1是Hunter等[6]在1989年从HeLa细胞cDNA文
库中分离获得,它是在人类体细胞中发现的第一个cyclin。
反义RNA(antisenseRNA)是一类天然的广泛存在于生物体内的基因调控分子。这
, http://www.100md.com
类小分子RNA不能编码蛋白质,主要通过碱基互补方式,与特定的mRNA形成双链
RNA杂交体调控基因表达。现在,随着天然反义RNA的普遍发现,以及对它们的结
构特征、作用机理和功能效应的深入研究,启发了人们利用反义RNA抑制特定基因
表达的特征,发展了多项反义RNA技术,特别是利用基因重组技术,在适宜的启动
子和转录终止子之间反向插入一段靶基因,构建反义RNA表达载体,将其转染进细
胞,在体内表达出反义RNA,从而对靶基因表达进行抑制,这是技术上的一大进步。
反义RNA技术在研究基因负调控作用机理中显示巨大潜力,同时为肿瘤等疾病的基
, http://www.100md.com
因治疗带来了希望。
材料和方法
1.材料
1.1 菌种:大肠杆菌菌株HB101,为本实验室保存。
1.2 质粒:pCycB1由TonyHunter教授(The Salk Institute for BiologicalStudies, San
Diego, California)惠赠,其内部含有人类cyclin B1基因的全长cDNA,1.45kb,克隆于
质粒载体pGEM-4的BamH I酶切位点。pXJ41-neo[7]由王跃博士(国立新加坡大学分
, 百拇医药
子及细胞生物学研究所)惠赠。1.3 试剂:限制性内切酶、碱性磷酸酶、T4 DNA连
接酶、同位素标记试剂盒prime-a-gene Labelling system购自Promega公司;G418、琼
脂糖、低熔点琼脂糖、DEPC、HEPES、MOPS、gunidinium isothiocyanate购自Gibco
公司;sodiumlauryl sarcocinate、sodium citrate购自Sigma公司;2-mercaptoethanol,formamid、Formaldehyde购自Fluka公司;α-32P-dCTP(3 000Ci/mmol, 10Ci/L)购自北
京亚辉公司;3H-TdR(1Ci/L)购自中国原子能研究所(北京);其他试剂为国产分析
, http://www.100md.com
纯。
1.4 细胞株:人结肠腺癌HT29细胞系本实验室保存。
2.方法[8]
2.1 质粒DNA的制备:细菌生长在含氨苄青霉素的LB培养基中。在氯霉素存在下
扩增。采取碱法裂解,用聚乙二醇沉淀法纯化质粒DNA。
2.2 质粒DNA的限制性酶切和凝胶电泳:参考文献[8]。
2.3 DNA片段回收:利用低熔点琼脂糖凝胶电泳回收DNA片段。
2.4 外源DNA和质粒载体的连接:(1) 线状质粒DNA的去磷酸化参照文献[8]。(2)
, http://www.100md.com
连接反应依次按载体DNA∶外源DNA=1∶1、1∶3或3∶1摩尔比设计连接反应。在
T4 DNA ligase作用下于4℃中反应过夜,取1μl转化大肠杆菌感受态细胞。
2.5 含重组质粒的细菌菌落的鉴定:随机挑取一些独立的转化菌落进行小规模培
养,制备质粒DNA,然后用限制酶进行消化,通过凝胶电泳进行分析。确定单一插
入片段的重组子,在插入片段的非中央位置选取单酶切位点,结合载体上的酶切位
点,限制酶切分析,判断插入片段的方向。
2.6 重组质粒转染HT29细胞[8,9]:(1) 细胞培养:HT29细胞培养在含10%小牛血清
, http://www.100md.com
的Mc Coy′5A培养基中,于37℃含5%
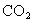 孵箱培养。使细胞分散充分,散布均匀。
孵箱培养。使细胞分散充分,散布均匀。(2) 按参考文献[7]制备磷酸钙DNA共沉淀物。(3) 转染细胞:用吸液管将混合液吹打
1次,转移至细胞培养皿内培养液中,培养6h后,吸出培养液和沉淀物用培养液将细
胞洗2次。加入含10% DMSO的37℃培养液,放回孵箱,作用2.5min。吸出含DMSO
的培养液,洗细胞2次,然后换为含G418(400mg/L)的培养基培养。每2~4d换液1次。
(4) 克隆细胞的扩大培养:细胞克隆长出后,让其在含G418培养基中继续生长2周。
, 百拇医药
吸取少量胰酶对准克隆消化适当时间,吸取细胞转入24孔培养板中,在G418培养基
中继续培养。
2.7 细胞总体RNA的制备及Northernblot:(1) RNA的制备详见文献[10]。(2) 用常规方
法进行Northernblot。
2.8 DNA探针的制备及预杂交、杂交和放射自显影:详见文献[11]。
2.9 细胞生长曲线:用胰酶消化对数生长期的HeLa细胞及其转染细胞,计数,接种
于小方瓶培养。每24h,平行取3份消化,细胞计数仪计数,求平均值, 绘制细胞生
长曲线。
, http://www.100md.com
2.10 3H-TdR参入试验[12]:用胰酶消化对数期生长的HT29及其转染细胞,计数,接种,24h后,加入3H-TdR(1mCi/L)于培养液脉冲标记6h。弃去培养液,收集细胞,制备样品。利用抽滤器将细胞样品裂解液点到硝酸纤维素滤膜上,三氯乙酸冲洗,干燥。在BeckmanLS-9000型液体闪烁计数器中测量。记录样品脉冲数/分(CPM)。
2.11 流式细胞光度术(FCM):收集对数期生长的转染细胞及其对照细胞,PBS洗1
次,将细胞快速吹散于70%冷酒精中,4℃固定24h。离心,洗涤,加入RNase A,37℃温育1h,冰水冷却。加入碘化丙啶,放置冰上避光染色20min。流式细胞仪测
量绘制DNA分布直方图。
结 果
, 百拇医药
1. 反义cyclin B1重组质粒pAS-B1的构建与鉴定
BamH I酶切消化质粒pCycB1和pXJ41-neo,低熔点胶回收pCycB1质粒中1.45kb
cyclin B1 cDNA片段。去磷酸化的线性pXJ41-neo载体与cyclin B1 cDNA进行连接。
产物转化受体菌HB101。随机挑取转化菌落,制备质粒DNA。
Xhol I酶切分析转化菌落的质粒DNA,当载体(6.89kb)内有一个片段(1.45kb)插
入时,线性重组质粒DNA大小为8.34kb,它介于DNA marker (λDNA/HINDⅢ)第
, 百拇医药
2条带(9.4kb)和第3条带(6.6kb)之间。反向插入时,EcoRI酶切消化,在高分子量位
置切出1条大于载体DNA而与重组DNA大小接近的8.22kb的DNA带,该质粒命名
为pAS-B1(AS:antisense)。质粒构建如图1,鉴定结果如图2。

图1 重组质粒pAS-B1的图谱
人巨细胞病毒启动子、内含子Ⅱ、周期蛋白B1位点
Fig.1 Map ofrecombinant plasmid of pAS-B1
HCMV promotor, intron Ⅱ, cyclin B1, sit

, http://www.100md.com
图2 质粒pAS-B1、pXJ41-neo和pcycB1的限制酶切分析
Fig.2 Restrictionenzyme analysis of pAS-B1, pXJ41-neo and pcycB1
a: pAS-B1/EcoRI,b:pAS-B1/XholI,c:Marker (λ DNA/HindⅢ)
d:pXJ41-neo/BamHI,e:pCycB1/BamHI,2. pAS-B1转染HT29细胞及转染克隆的鉴定
利用DNA磷酸钙共沉淀方法,将pAS-B1转染HT29细胞,转染细胞在含G418培
养基中筛选培养。2周时,培养皿中长出抗性细胞集落。利用24孔培养板分离扩大细
, 百拇医药
胞克隆,得到一株抗G418细胞株,命名为HTB1。以未转染质粒的HT29作对照细胞。
用α-32P-dCTP标记的cyclin B1 cDNA作探针对HTB1和HT29的RNA进行Northernblot
杂交分析,结果如图3。
结果显示转染细胞HTB1中cyclin B1 RNA的表达水平有大幅度下降,明显低于对
照细胞HT29中的表达,是对照的54%。
3. 细胞形态的变化
转染细胞与对照细胞相比,其形态仍然呈圆形,没有大的变化,但细胞间界限
, 百拇医药
相对清楚(图4)。
4. 细胞增殖速度的变化
以1.85×105细胞/培养瓶(11cm32)接种HTB1和HT29于小方瓶中,每隔24h,平行
取出3瓶,细胞计数,绘制生长曲线(图5)。
结果表明转染细胞的增殖速度明显低于对照细胞,而且转染细胞的密度抑制强
于对照HT29细胞。
5. 细胞DNA合成速度的变化
, 百拇医药
以8×104细胞/孔接种HTB1和HT29细胞于24孔板,每种细胞平行接种3孔,24h
后,加入3H-TdR,脉冲标记6h,收集细胞,液体闪烁计数仪测定各样品CPM,相
对合成率(图6)。
3H-TdR在HTB1中的参入量比HT29细胞中低16.5%,说明反义cyclin B1转染使
HT29细胞DNA合成速度减慢。
6. 细胞周期分布的变化
收集对数期生长的HTB1和HT29细胞,利用流式细胞光度仪进行分析。反义cyclin
, http://www.100md.com
B1转染HT29细胞后,G1期细胞由26.8%上升到43.8%,G2+M期细胞数由25.7%下降到
16.3%,S期细胞数由47.5%下降到39.9%(图7)。

图3 Northern blot 分析 HTB1和 HT29细胞内的cyclin B1 RNA
Fig.3 Northern blot analysis of cyclin B1 RNA in HTB1 and HT29cells

图4 HTB1和HT29细胞的形态
Fig.4 Morphology ofHTB1 and HT29 cells
, 百拇医药
A:HT29 B:HTB1

图5 HTB1和HT29细胞的生长曲线
Fig.5 Cell growthcurves of HTB1 and HT29 cells

图6 3H-TdR参入的每分钟计数
Fig.6 CPM in 3H-TdRincorporation test

图7 HTB1和HT29细胞的周期时相分布
, 百拇医药
Fig.7 Cell cyclephase distribution of HTB1 and HT29 cells
A(HTB1), B(HT29)
G1: 43.8 26.8
S: 39.9 47.5
G2+M: 16.3 25.7
total: 100.0 100.0
Relative RNA expression
讨 论
根据反义RNA能抑制特定基因功能的特性,利用反义战略揭示许多基因的正常
, 百拇医药
功能,Neiman等运用反义技术抑制了劳氏肉瘤病毒转化基因src对细胞的转化作用。
他们选择了一种无致病力的病毒,用它携带劳氏肉瘤病毒反义src基因,细胞被这种
特殊病毒感染后,再用劳氏肉瘤病毒处理,就不会被转化,证明反义src基因的表达
抑制了劳氏肉瘤病毒的转化作用。Prochownik等[12]将鼠的全长c-myc cDNA反向克隆
于一种真核表达载体中,用它转染F-MEL细胞。结果显示c-myc的反义转录体加速细
胞分化,抑制了G1期进程。我们对6例结肠癌病人的癌组织RNA进行dot blot杂交分
析,发现cyclinB1基因在其中有过表达现象(结果未发表)。现在细胞周期调控因子与
, 百拇医药
癌发生的关系引起人们高度重视,G1 cyclins的过表达与癌发生基本已被肯定,如cyc-
lin D1认为是癌基因,cyclin E的表达失控认为是乳腺上皮细胞恶性转化的最突出的分
子标志(malecularmarker),cyclin D2、cyclin D3和cyclin A均与一定的癌发生有关。有丝
分裂cyclin在这一过程中发挥什么作用?在最近的报告中,人们已经怀疑cyclin B与乳
癌有关[14]。我们的结果提示,cyclin B1的过表达与结肠癌中细胞增殖失控可能存在
某种联系。于是我们构建了人类cyclin B1基因的反义RNA表达载体pAS-B1,转染人
, 百拇医药
结肠腺癌细胞系HT29。
cyclin B1全长cDNA反向插入于pXJ41-neo载体的BamH I位点,在上游HCMV启动
子驱动下,能够转录出cyclin B1的反义RNA。将pAS-B1质粒转染HT29细胞,筛选分
离出一株G418抗性细胞株HTB1。Northern blot杂交显示转染细胞内cyclin B1的mRNA
含量下降,仅占对照细胞的一半。说明cyclin B1的反义RNA对于降低细胞内源性cyclin
B1 mRNA是十分有效的。
转染细胞的形态仍然呈圆形,贴壁生长。单层生长时,细胞间界限比较分明,多
, http://www.100md.com
层局部集聚生长能力下降。其增殖速度明显低于对照细胞,并且转染细胞的最大密度
低于对照细胞。我们知道,接触抑制是正常细胞和转化细胞的区别之一。上述结果反
映出,反义cyclinB1的转染对HT29细胞的增殖有明显抑制作用。流式细胞光度术结果
及3H-TdR参入DNA试验与此相一致。
收稿 1996-09 修回 1997-04
* 国家自然科学基金资助课题(No.39430080)
参考文献
[1]Evans T,Rosenthal E T, Youngblom J. Cyclin: A protein specified bymaternal mRNA in
, 百拇医药
sea urchin eggs that is destroyed at eachcleavage division. Cell, 1983, 33(6): 389
[2] Swenson K I, Farrell K M, Ruderman J V. The clam embryoprotein cyclin A induces entry
into M-phase and the resumption of meiosisin Xenopus oocytes. Cell, 1986(9),47:861
[3] Westendorf J M, Swenson K I, Ruderman J V. The role of cyclinB in meiosis I. J Cell
Biol, 1989, 108(4):1431
, 百拇医药
[4] Genhart J, Wu M, Kirschner M. Cell cycle dynamics of anM-phase-specific cytoplasmic
factor in Xenopus laevis occytes and eggs.J Cell Biol, 1984, 98(4):1247
[5] Lohka M J, Hayes M K, Maller JL. Purification ofmaturation-promoting factor, an intrac-
ellularregulator of early mitotic events. PNAS(USA), 1988, 85(5):3009
[6] Pines J, Hunter T. Isolation of a human cyclin cDNA: evidencefor cyclin mRNA and pro-
, 百拇医药
tein regulation in the cell cycle and forinteraction with P34cdc2.Cell, 1989, 58(9):833
[7] Zheng X M, Wang Y, Pallen C P. Cell transformation andactivation of pp60c-src by over-
expression of a protein tyrosinephosphatase. Nature, 1992, 359(9):336
[8] Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning. ed 2,New York:Cold Spring
Harbor Laboratory Press, 1989:5.72-5.72,6.3-6.20
, 百拇医药
[9] 鄂 征.组织培养技术:细胞培养在癌基因研究中的应用.北京:人民卫生出版社,1993:287~289
[10] Chomczynski P, Sacchi N. Single -step method of RNAisolation by acid guanidinium
thiocyanate-phenol-chloroform extraction.Analytical Biochemistry, 1987,162(4):156
[11] 邢录洲,王永潮.反义周期蛋白B1基因转染HT29细胞后若干细胞增殖调控相关基
因表达的变化.解剖学报,1998,29(1):8
[12] Prochownik E V, Kukowska J, Rodgers C. c-myc antisensetranscripts accelerate
, 百拇医药
differentiation and inhibit G1 progressionin murine erythroleukemia cells. Molecular
Cellular Biology, 1988, 8(9):3683
[13] Karp J E, Broder S. Molecular foundations of cancer :newtargets for intervention. Nature
Medicine, 1995,1(2):309
ANTISENSECYCLIN B1 GENE INHIBITS THE
PROLIFERATION OF HT29 CELLS
, http://www.100md.com
XingLuzhou, Wang Yongchao△(KeyLaboratory of Cell Proliferation and Regulation Biology, BeijingNormal University, Beijing)
The full-length cDNA of human cyclin B1gene was inserted into the eukaryotic
expression vector pXJ41-neo in its antisense orientation at theBamH I site to produce
the plasmid pAS-B1 which expressed antisense RNA of cyclin B1gene by DNA rec-
, 百拇医药
ombinant technique. The plasmid pAS-B1 was transfected into HT29cells by DNA-
 co-precipitation. Individual cell clones were selected in themedium
co-precipitation. Individual cell clones were selected in themediumsupplemented with G418. The expresison of endogenous cyclin B1mRNA was inhibited
and was measured by Northern blot with cyclin B1 cDNA probe.Compared with HT29
cells, we found that antisense RNA of cyclin B1 could obviouslyinhibit the proliferation
, 百拇医药
and 3H-thymidine incorporation of HTB1 cells.By flow cytometry analysis we found that
the cell number of G1 phase increased obviously and the cellnumber of S phase and G2+M
phases decreased markedly in HTB1 cells. KEY WORDS DNA recombinant;Antisense RNA; Cyclin B1; Gene transfection
___________________
△Key Laboratory of Cell Proliferation andRegulation Biology,Beijing Normal University, Beijing 100875,China, 百拇医药