热力对IgG分子构象影响的研究
作者:许金波 刘育京 李成文 张文福 尤洪涛
单位:军事医学科学院微生物流行病研究所, 北京 100071
关键词:热力消毒;IgG分子结构;光谱分析;CD光谱;紫外差光谱
中国消毒学杂志980101 提要 经圆二色光谱和紫外差光谱分析,冻干IgG经80℃作用2 h后,其β-折叠构象及侧链氨基酸生色基团和肽键未见明显变化。作用时间延长至72 h,β-折叠含量则明显减少,氨基酸生色基团和肽键的紫外最大吸收波长蓝移,分子变构。溶液中的IgG经60℃处理10 h后也有一定程度的变构。
生物大分子的特定构象是其重要特征之一,亦为其生物功能的结构基础。构象改变可导致蛋白质生物活性的丧失 〔1〕 。消毒因子在灭活血浆蛋白制剂中的病毒时,对其蛋白质分子空间结构的影响尚未见报导。本研究采用圆二色光谱(CD光谱)和紫外差光谱方法观察了热力对IgG β-折叠构象、氨基酸生色基团和肽键的影响。
, http://www.100md.com
1 方法
1.1 IgG 的制备
采用饱和硫酸铵盐析法从正常人血清中提取IgG,其含量用7520分光光度计(上海分析仪器厂产)测定〔2〕。
1.2 IgG 的鉴定
1.2.1 聚丙烯酰胺凝胶电泳(PAGE)法 将提取的IgG样本经快速盘状PAGE法(凝胶浓度为6.06%,pH 8.8)分离后,用0.01%考马斯亮蓝G-250染色。经7%乙酸脱色后,再用CS-920型高速深层扫描仪(日本岛津产)做蛋白质胶带紫外深层扫描。
1.2.2 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)法 取100 μl IgG提取物样本(2 mg/ml)与120 μl SDS-PAGE蛋白质处理液相混合。经100 ℃煮沸5 min后,取样在含0.1% SDS的Tris-甘氨酸缓冲系统(pH 8.3)中进行电泳(胶浓度为6.06%)。用Weber公式计算蛋白质胶带的相对迁移率(Rf),根据Rf值从蛋白质分子量标准曲线上查出相应分子量范围。
, 百拇医药
1.2.3 免疫电泳法 用1%离子琼脂糖胶制板,并在胶板上下孔中分别加入10 μl检测样本。以5 V/cm端电压电泳2 h后,在琼脂板中间挖槽,加入50 μl羊抗人IgG或羊抗人全血清。于37℃放置24 h,待沉淀弧出现后,进行蛋白质洗脱、染色、脱色和显影等处理。
1.3 IgG 的热处理
在试验中,IgG分为2组,一组为经冷冻干燥的IgG,一组为未经冷冻干燥的IgG溶液。前者以浓度为50 mg/ml的IgG,经LGL-冷冻干燥机(军事医学科学院实验仪器厂产)冻干制备。试验时,用102A远红外线快速干燥箱(1400 W,200±0.5℃,北京振兴实验仪器厂生产)进行热处理。IgG溶液(50 mg/ml)则用恒温水浴箱(37~100℃)进行热处理。
1.4 圆二色光谱( CD 光谱)分析
以CD 7-720圆二色光谱仪(Jasco-720,日本制)分析IgG的二级空间结构变化。具体试验条件如下:光径为1 mm;结果为4次扫描的平均值;扫描速度为100 nm/min;扫描范围为250~190 nm;时间常数为1 s;分辨力为0.2 nm;检测样品蛋白质浓度为1 mg/ml。
, 百拇医药
1.5 紫外光谱分析
将受试蛋白质以0.01 mol/L磷酸盐缓冲液(PBS)配制成1 mg/ml溶液。用日立-577型紫外-可见分光光度计分析其氨基酸生色基团及肽键吸收峰的变化,并以PBS为参考对照。测试条件如下:双光束;标度为0-2;扫描速度为120 nm/min;λ Exp为×1;狭缝为2 nm;自动反应;扫描范围为400~190 nm。
2 结果
2.1 IgG 的分析鉴定
所提取IgG的PAGE胶带,经紫外深层扫描,主带面积占95%以上。通过SDS-PAGE不连续系统分析并从蛋白质分子量标准曲线上得出,所提取IgG的分子量约为160 000,符合人IgG分子量标准范围。.2 免疫电泳结果 图1胶板中沉淀线的位置与形状表明,所提取的IgG与对照IgG及人血清IgG具有相同的抗原性和免疫纯度,以及仅与抗人IgG反应的特异性。
, 百拇医药
2.3 热力对 IgG β-折叠构象的影响
IgG是一种高β-折叠含量蛋白质,这种结构蛋白质的CD光谱最大特点是在-217.5 nm处有一负峰 〔3〕 。冻干IgG经80℃热处理不同时间,其峰位值均在-217.4 nm处,截距值变化也很小(表1),但峰的吸收强度则随处理时间的延长而有所减弱,以80℃ 48 h和72 h剂量组的吸收减弱较明显(图2 b)。而溶液中的IgG经不同热剂量处理后,峰位值和截距值均向短波区移动(蓝移,表1),根据峰型判断,60℃ 10 h处理后的IgG基本保持了β-折叠构象(图2 c),而80℃ 5 min剂量组的IgG则变构明显(图2 d)。
图 1 所提取的IgG免疫电泳结果Fig 1 Results of immunoelectrophoresis of IgG extracted
, 百拇医药
A: 提取的IgG; B:对照IgG; C:提取的IgG;D:人血清。 A: IgG extracted; B: Control IgG; C: IgG extrac- ted; D: Human serum.
表 1 热处理前后IgG的CD光谱峰位及截距值 变化
Table 1 Changes in values of peak position and length of CD spectra of IgG before and after heat treatment 处理剂量Dosage of heat
峰 位Peak position (nm)
截 距Length(nm)
冻干样本
, 百拇医药
Lyophilized sample
80℃, 2 h
-217.4
206.1
80℃, 4 h
-217.4
206.3
80℃, 6 h
-217.4
205.9
80℃, 24 h
-217.4
, http://www.100md.com
205.7
80℃, 48 h
-217.4
206.5
80℃, 72 h
-217.4
206.9
溶液样本
Solution sample
60℃, 10 h
-216.6
205.3
, http://www.100md.com
80℃, 5 min
-210.8
197.3
80℃, 10 min
-208.8
194.3
注: 未处理对照组,峰位值为-217.4 nm,截距为206.5 nm。
Note: The peak position was -217.4 nm and the length was 206.5 nm in untreated control group.
, 百拇医药
Wave length(nm)
(a)
1. IgG 正常对照; 2. 80℃,2 h(冻干品)。 1. Normal control of IgG; 2. 80℃,2 hr (lyophilized sample).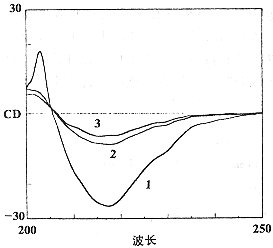
Wave length(n,m)
(b)
1. IgG 正常对照; 2. 80℃,48 h(冻干品); 3. 80℃,72 h(冻干品)。 1. Normal control of IgG; 2. 80℃,48 hr(lyophi- lized sample);3. 80℃,72 hr(lyophilized sample).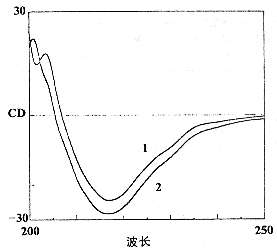
, http://www.100md.com
Wave Length(nm)
(c)
1. IgG 正常对照; 2. 60℃,10 h(液体)。 1. Normal control of IgG; 2. 60℃,10 hr(solution).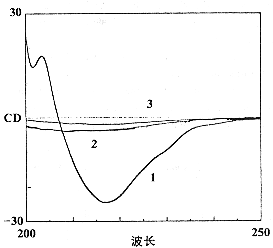
Wave length(nm) (d) 1. IgG 正常对照; 2. 80℃,5 min(液体); 3. 80℃,10 min(液体)。 1. Normal control of IgG; 2. 80℃,5 min (solution); 3. 80℃,10 min(solution).
图 2 热处理前后IgG的CD谱图
Fig 2 CD spectrogram of IgG before and after heat treatment
, 百拇医药
2.4 热力对 IgG 氨基酸和肽键的影响
IgG紫外光谱主要有2个较强吸收峰,一是在230 nm附近的肽键吸收峰,另一个为280 nm附近的氨基酸生色基团吸收 峰〔1〕。冻干IgG组经80℃热力处理不同时间后,48 h以上剂量组的结果变化明显,肽键和氨基酸的吸光度值降低,最大吸收发生蓝移,这表明该处理剂量对IgG的
表 2 热处理前后IgG的紫外线吸收结果 Table 2 Results of ultraviolet absorption of IgG before and after heat treatment 处理剂量 Dosage of heat
吸光度Spectralabsorption
最大吸收波长Maximal absorption wavelength (nm)
, 百拇医药
氨基酸峰Aminoacid peak
肽键峰Peptidebond peak
氨基酸峰 Aminoacid peak
肽键峰 Peptidebond peak
冻干组
Lyophilized group
80℃, 2 h
0.669
2.803
276
218
, 百拇医药
80℃, 24 h
0.628
2.660
276
220
80℃, 48 h
0.587
2.795
276
216
80℃, 72 h
0.534
1.995
, 百拇医药
274
214
溶液组
Solution group
60℃, 10 h
0.689
2.478
272
212
80℃, 5 min
0.201
1.286
, 百拇医药 280
209
注: 未处理对照组的吸光度,其氨基酸峰为0.662,肽键 峰为2.783;最大吸收波长,氨基酸峰为276 nm,肽 键峰为218 nm。 Note: In untreated control group, the spectral absorption of amino acid peak was 0.662 and that of peptide bond peak was 2.783, the maximal absorption wavelength of amino acid peak was 276 nm and that of peptide bond peak was 218 nm.
肽键和氨基酸侧链可能有一定影响。IgG溶液组经60℃作用10 h后,氨基酸和肽键峰最大吸收也发生蓝移,而80℃ 5 min剂量组对氨基酸残基侧链和肽键影响非常明显(表2,图3)。
, 百拇医药
3 讨论
3.1 CD光谱是近年来研究溶液中蛋白质构象变化的常用方法之一。由于其圆二色性与吸收峰之间有对应关系,同时又不出现氨基酸侧链影响本底问题,故有利于解释蛋白质的构象〔3〕。IgG在溶液中的构象主要呈β-折叠状态,即一种肽链相当伸展的结构,两条肽链以相同或相反方向形成氢键。这种构象利于其与多种多样的抗原相结合。IgG的β-折叠片在CD光谱吸收曲线上的最大特性是在远紫外区217.5 nm处有一负峰,其它蛋白质则不多见。在理论上,这一区域的吸收如发生变化,可说明蛋白质主肽链发生了变构〔4〕。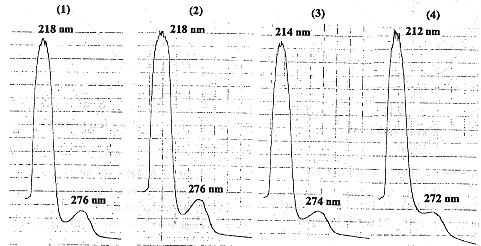
图 3 热力对IgG肽键和氨基酸侧链的影响(紫外光谱)
Fig 3 Influence of heat on peptide bonds and side chain of amino acid of IgG (ultraviolet spectra)
, 百拇医药
1. 未处理对照; 2. 80℃,2 h; 3. 80℃,72 h; 4. 60℃(湿热),10 h。 1. Untreated control; 2. 80℃,2 hr; 3. 80℃,72 hr; 4. 60℃(wet heat),10 hr.
冻干IgG组经80℃热力处理后,其CD光谱吸收峰的顶极处波长均在-217.4 nm处,截距变化范围也较小,谱型相似,说明经热力处理后的IgG仍保持β-折叠的基本构象,但负峰的高度随处理时间的延长有所下降。因通常峰高与特征性结构的蛋白质含量多少有关〔3〕,提示其β-折叠片含量减少。但目前还没有理想的计算CD曲线中β-折叠含量的方法,故难以得出β-折叠含量减少的具体数值。从CD谱型上推断,80℃ 2 h剂量组对IgG β-折叠片影响较小,而80℃ 72 h剂量组的影响较明显。这可能是热处理后的蛋白质有部分变性发生,蛋白质溶解度降低所致。IgG溶液组经热处理后,其CD光谱出现不同程度的变化,负峰极顶处波长发生蓝移。根据β-折叠的CD光谱吸收范围,尽管经60℃湿热处理10 h后的IgG仍属β-折叠构象,但最大峰值发生蓝移,这可能与部分蛋白质变构有关。而经80℃ 5 min处理后的IgG已完全失去了β-折叠构象的特征。3.2 变性紫外差光谱分析表明,加热80℃ 2 h,对冻干IgG组的肽键和氨基酸侧链生色基团未产生明显的变性影响,而经72 h和两 组湿热法处理后,峰型发生变化,最大吸收蓝移,吸收强度减弱。这可能是蛋白质热变性后肽键伸展,将藏在分子 内部疏水区中的生色基团暴露出来。一般认为,最大吸收蓝移意味着蛋白质发生变 性 〔3,5〕。由此可见,80℃ 2 h剂量组对冻干IgG的二级结构未产生明显影响,而目前常用的干热80℃ 72 h和湿热60℃ 10 h剂量组对IgG均有不同程度的变构作用。
, 百拇医药
(本研究得到中国科学院生物物理研究所童俊超博士的大力协助,特此致谢。)
参 考 文 献
〔1〕 鲁子贤编著. 蛋白质化学. 北京:科学出版社, 1984: 94~125.
〔2〕 李成文编著. 现代免疫化学技术. 上海: 上海科学技术出版社崐,1992: 63~70. 〔3〕 鲁子贤编著. 圆二色和旋光色散在分子生物学中的应用. 北京: 科学出版社,1987: 92~115.
〔4〕 张世馥(译). 抗体的结构与功能. 北京: 科学出版社, 1987: 18~30.
〔5〕 孙志贤主编. 现代生物化学理论与研究技术. 北京: 军事医学科学院出版社, 1995: 408~413.
, http://www.100md.com STUDY ON INFLUENCE OF HEAT ON MOLECULAR CONFIGURATION OF IgG
Xu Jinbo Liu Yujing Li Chengwen Zhang Wenfu You Hongtao ( Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071 )
Abstract
Influences of heat on β-folding configurations, chromophores and peptide bondsof amino acids of IgG were observed experimentally using circular dichroism(CD) spectrometry and ultraviolet differential spectrometry. The resultsindicated that when lyophilized IgG was exposed to 80℃ heat for 2 hr, nosignificant change in β-folding configuration, chromophores and peptidebonds of side-chain amino acids of IgG was observed. Only when the exposuretime was prolonged to 72 hr, could significant decrease in content ofβ-folding, blue shift of maximal absorption wave length of chromophoresand peptide bonds of amino acids and change in molecular configurationbe seen. When IgG in solution was exposed to 60℃ heat for 10 hr or 80℃ heat for 5 min, certain change in configuration of IgG occurred.
Key words heat disinfection molecular structure of IgG spectrometryCD spectra ultraviolet differential spectra
(1996-11-25收稿 1997-03-01修回), 百拇医药
单位:军事医学科学院微生物流行病研究所, 北京 100071
关键词:热力消毒;IgG分子结构;光谱分析;CD光谱;紫外差光谱
中国消毒学杂志980101 提要 经圆二色光谱和紫外差光谱分析,冻干IgG经80℃作用2 h后,其β-折叠构象及侧链氨基酸生色基团和肽键未见明显变化。作用时间延长至72 h,β-折叠含量则明显减少,氨基酸生色基团和肽键的紫外最大吸收波长蓝移,分子变构。溶液中的IgG经60℃处理10 h后也有一定程度的变构。
生物大分子的特定构象是其重要特征之一,亦为其生物功能的结构基础。构象改变可导致蛋白质生物活性的丧失 〔1〕 。消毒因子在灭活血浆蛋白制剂中的病毒时,对其蛋白质分子空间结构的影响尚未见报导。本研究采用圆二色光谱(CD光谱)和紫外差光谱方法观察了热力对IgG β-折叠构象、氨基酸生色基团和肽键的影响。
, http://www.100md.com
1 方法
1.1 IgG 的制备
采用饱和硫酸铵盐析法从正常人血清中提取IgG,其含量用7520分光光度计(上海分析仪器厂产)测定〔2〕。
1.2 IgG 的鉴定
1.2.1 聚丙烯酰胺凝胶电泳(PAGE)法 将提取的IgG样本经快速盘状PAGE法(凝胶浓度为6.06%,pH 8.8)分离后,用0.01%考马斯亮蓝G-250染色。经7%乙酸脱色后,再用CS-920型高速深层扫描仪(日本岛津产)做蛋白质胶带紫外深层扫描。
1.2.2 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)法 取100 μl IgG提取物样本(2 mg/ml)与120 μl SDS-PAGE蛋白质处理液相混合。经100 ℃煮沸5 min后,取样在含0.1% SDS的Tris-甘氨酸缓冲系统(pH 8.3)中进行电泳(胶浓度为6.06%)。用Weber公式计算蛋白质胶带的相对迁移率(Rf),根据Rf值从蛋白质分子量标准曲线上查出相应分子量范围。
, 百拇医药
1.2.3 免疫电泳法 用1%离子琼脂糖胶制板,并在胶板上下孔中分别加入10 μl检测样本。以5 V/cm端电压电泳2 h后,在琼脂板中间挖槽,加入50 μl羊抗人IgG或羊抗人全血清。于37℃放置24 h,待沉淀弧出现后,进行蛋白质洗脱、染色、脱色和显影等处理。
1.3 IgG 的热处理
在试验中,IgG分为2组,一组为经冷冻干燥的IgG,一组为未经冷冻干燥的IgG溶液。前者以浓度为50 mg/ml的IgG,经LGL-冷冻干燥机(军事医学科学院实验仪器厂产)冻干制备。试验时,用102A远红外线快速干燥箱(1400 W,200±0.5℃,北京振兴实验仪器厂生产)进行热处理。IgG溶液(50 mg/ml)则用恒温水浴箱(37~100℃)进行热处理。
1.4 圆二色光谱( CD 光谱)分析
以CD 7-720圆二色光谱仪(Jasco-720,日本制)分析IgG的二级空间结构变化。具体试验条件如下:光径为1 mm;结果为4次扫描的平均值;扫描速度为100 nm/min;扫描范围为250~190 nm;时间常数为1 s;分辨力为0.2 nm;检测样品蛋白质浓度为1 mg/ml。
, 百拇医药
1.5 紫外光谱分析
将受试蛋白质以0.01 mol/L磷酸盐缓冲液(PBS)配制成1 mg/ml溶液。用日立-577型紫外-可见分光光度计分析其氨基酸生色基团及肽键吸收峰的变化,并以PBS为参考对照。测试条件如下:双光束;标度为0-2;扫描速度为120 nm/min;λ Exp为×1;狭缝为2 nm;自动反应;扫描范围为400~190 nm。
2 结果
2.1 IgG 的分析鉴定
所提取IgG的PAGE胶带,经紫外深层扫描,主带面积占95%以上。通过SDS-PAGE不连续系统分析并从蛋白质分子量标准曲线上得出,所提取IgG的分子量约为160 000,符合人IgG分子量标准范围。.2 免疫电泳结果 图1胶板中沉淀线的位置与形状表明,所提取的IgG与对照IgG及人血清IgG具有相同的抗原性和免疫纯度,以及仅与抗人IgG反应的特异性。
, 百拇医药
2.3 热力对 IgG β-折叠构象的影响
IgG是一种高β-折叠含量蛋白质,这种结构蛋白质的CD光谱最大特点是在-217.5 nm处有一负峰 〔3〕 。冻干IgG经80℃热处理不同时间,其峰位值均在-217.4 nm处,截距值变化也很小(表1),但峰的吸收强度则随处理时间的延长而有所减弱,以80℃ 48 h和72 h剂量组的吸收减弱较明显(图2 b)。而溶液中的IgG经不同热剂量处理后,峰位值和截距值均向短波区移动(蓝移,表1),根据峰型判断,60℃ 10 h处理后的IgG基本保持了β-折叠构象(图2 c),而80℃ 5 min剂量组的IgG则变构明显(图2 d)。

图 1 所提取的IgG免疫电泳结果Fig 1 Results of immunoelectrophoresis of IgG extracted
, 百拇医药
A: 提取的IgG; B:对照IgG; C:提取的IgG;D:人血清。 A: IgG extracted; B: Control IgG; C: IgG extrac- ted; D: Human serum.
表 1 热处理前后IgG的CD光谱峰位及截距值 变化
Table 1 Changes in values of peak position and length of CD spectra of IgG before and after heat treatment 处理剂量Dosage of heat
峰 位Peak position (nm)
截 距Length(nm)
冻干样本
, 百拇医药
Lyophilized sample
80℃, 2 h
-217.4
206.1
80℃, 4 h
-217.4
206.3
80℃, 6 h
-217.4
205.9
80℃, 24 h
-217.4
, http://www.100md.com
205.7
80℃, 48 h
-217.4
206.5
80℃, 72 h
-217.4
206.9
溶液样本
Solution sample
60℃, 10 h
-216.6
205.3
, http://www.100md.com
80℃, 5 min
-210.8
197.3
80℃, 10 min
-208.8
194.3
注: 未处理对照组,峰位值为-217.4 nm,截距为206.5 nm。
Note: The peak position was -217.4 nm and the length was 206.5 nm in untreated control group.

, 百拇医药
Wave length(nm)
(a)
1. IgG 正常对照; 2. 80℃,2 h(冻干品)。 1. Normal control of IgG; 2. 80℃,2 hr (lyophilized sample).

Wave length(n,m)
(b)
1. IgG 正常对照; 2. 80℃,48 h(冻干品); 3. 80℃,72 h(冻干品)。 1. Normal control of IgG; 2. 80℃,48 hr(lyophi- lized sample);3. 80℃,72 hr(lyophilized sample).

, http://www.100md.com
Wave Length(nm)
(c)
1. IgG 正常对照; 2. 60℃,10 h(液体)。 1. Normal control of IgG; 2. 60℃,10 hr(solution).

Wave length(nm) (d) 1. IgG 正常对照; 2. 80℃,5 min(液体); 3. 80℃,10 min(液体)。 1. Normal control of IgG; 2. 80℃,5 min (solution); 3. 80℃,10 min(solution).
图 2 热处理前后IgG的CD谱图
Fig 2 CD spectrogram of IgG before and after heat treatment
, 百拇医药
2.4 热力对 IgG 氨基酸和肽键的影响
IgG紫外光谱主要有2个较强吸收峰,一是在230 nm附近的肽键吸收峰,另一个为280 nm附近的氨基酸生色基团吸收 峰〔1〕。冻干IgG组经80℃热力处理不同时间后,48 h以上剂量组的结果变化明显,肽键和氨基酸的吸光度值降低,最大吸收发生蓝移,这表明该处理剂量对IgG的
表 2 热处理前后IgG的紫外线吸收结果 Table 2 Results of ultraviolet absorption of IgG before and after heat treatment 处理剂量 Dosage of heat
吸光度Spectralabsorption
最大吸收波长Maximal absorption wavelength (nm)
, 百拇医药
氨基酸峰Aminoacid peak
肽键峰Peptidebond peak
氨基酸峰 Aminoacid peak
肽键峰 Peptidebond peak
冻干组
Lyophilized group
80℃, 2 h
0.669
2.803
276
218
, 百拇医药
80℃, 24 h
0.628
2.660
276
220
80℃, 48 h
0.587
2.795
276
216
80℃, 72 h
0.534
1.995
, 百拇医药
274
214
溶液组
Solution group
60℃, 10 h
0.689
2.478
272
212
80℃, 5 min
0.201
1.286
, 百拇医药 280
209
注: 未处理对照组的吸光度,其氨基酸峰为0.662,肽键 峰为2.783;最大吸收波长,氨基酸峰为276 nm,肽 键峰为218 nm。 Note: In untreated control group, the spectral absorption of amino acid peak was 0.662 and that of peptide bond peak was 2.783, the maximal absorption wavelength of amino acid peak was 276 nm and that of peptide bond peak was 218 nm.
肽键和氨基酸侧链可能有一定影响。IgG溶液组经60℃作用10 h后,氨基酸和肽键峰最大吸收也发生蓝移,而80℃ 5 min剂量组对氨基酸残基侧链和肽键影响非常明显(表2,图3)。
, 百拇医药
3 讨论
3.1 CD光谱是近年来研究溶液中蛋白质构象变化的常用方法之一。由于其圆二色性与吸收峰之间有对应关系,同时又不出现氨基酸侧链影响本底问题,故有利于解释蛋白质的构象〔3〕。IgG在溶液中的构象主要呈β-折叠状态,即一种肽链相当伸展的结构,两条肽链以相同或相反方向形成氢键。这种构象利于其与多种多样的抗原相结合。IgG的β-折叠片在CD光谱吸收曲线上的最大特性是在远紫外区217.5 nm处有一负峰,其它蛋白质则不多见。在理论上,这一区域的吸收如发生变化,可说明蛋白质主肽链发生了变构〔4〕。

图 3 热力对IgG肽键和氨基酸侧链的影响(紫外光谱)
Fig 3 Influence of heat on peptide bonds and side chain of amino acid of IgG (ultraviolet spectra)
, 百拇医药
1. 未处理对照; 2. 80℃,2 h; 3. 80℃,72 h; 4. 60℃(湿热),10 h。 1. Untreated control; 2. 80℃,2 hr; 3. 80℃,72 hr; 4. 60℃(wet heat),10 hr.
冻干IgG组经80℃热力处理后,其CD光谱吸收峰的顶极处波长均在-217.4 nm处,截距变化范围也较小,谱型相似,说明经热力处理后的IgG仍保持β-折叠的基本构象,但负峰的高度随处理时间的延长有所下降。因通常峰高与特征性结构的蛋白质含量多少有关〔3〕,提示其β-折叠片含量减少。但目前还没有理想的计算CD曲线中β-折叠含量的方法,故难以得出β-折叠含量减少的具体数值。从CD谱型上推断,80℃ 2 h剂量组对IgG β-折叠片影响较小,而80℃ 72 h剂量组的影响较明显。这可能是热处理后的蛋白质有部分变性发生,蛋白质溶解度降低所致。IgG溶液组经热处理后,其CD光谱出现不同程度的变化,负峰极顶处波长发生蓝移。根据β-折叠的CD光谱吸收范围,尽管经60℃湿热处理10 h后的IgG仍属β-折叠构象,但最大峰值发生蓝移,这可能与部分蛋白质变构有关。而经80℃ 5 min处理后的IgG已完全失去了β-折叠构象的特征。3.2 变性紫外差光谱分析表明,加热80℃ 2 h,对冻干IgG组的肽键和氨基酸侧链生色基团未产生明显的变性影响,而经72 h和两 组湿热法处理后,峰型发生变化,最大吸收蓝移,吸收强度减弱。这可能是蛋白质热变性后肽键伸展,将藏在分子 内部疏水区中的生色基团暴露出来。一般认为,最大吸收蓝移意味着蛋白质发生变 性 〔3,5〕。由此可见,80℃ 2 h剂量组对冻干IgG的二级结构未产生明显影响,而目前常用的干热80℃ 72 h和湿热60℃ 10 h剂量组对IgG均有不同程度的变构作用。
, 百拇医药
(本研究得到中国科学院生物物理研究所童俊超博士的大力协助,特此致谢。)
参 考 文 献
〔1〕 鲁子贤编著. 蛋白质化学. 北京:科学出版社, 1984: 94~125.
〔2〕 李成文编著. 现代免疫化学技术. 上海: 上海科学技术出版社崐,1992: 63~70. 〔3〕 鲁子贤编著. 圆二色和旋光色散在分子生物学中的应用. 北京: 科学出版社,1987: 92~115.
〔4〕 张世馥(译). 抗体的结构与功能. 北京: 科学出版社, 1987: 18~30.
〔5〕 孙志贤主编. 现代生物化学理论与研究技术. 北京: 军事医学科学院出版社, 1995: 408~413.
, http://www.100md.com STUDY ON INFLUENCE OF HEAT ON MOLECULAR CONFIGURATION OF IgG
Xu Jinbo Liu Yujing Li Chengwen Zhang Wenfu You Hongtao ( Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071 )
Abstract
Influences of heat on β-folding configurations, chromophores and peptide bondsof amino acids of IgG were observed experimentally using circular dichroism(CD) spectrometry and ultraviolet differential spectrometry. The resultsindicated that when lyophilized IgG was exposed to 80℃ heat for 2 hr, nosignificant change in β-folding configuration, chromophores and peptidebonds of side-chain amino acids of IgG was observed. Only when the exposuretime was prolonged to 72 hr, could significant decrease in content ofβ-folding, blue shift of maximal absorption wave length of chromophoresand peptide bonds of amino acids and change in molecular configurationbe seen. When IgG in solution was exposed to 60℃ heat for 10 hr or 80℃ heat for 5 min, certain change in configuration of IgG occurred.
Key words heat disinfection molecular structure of IgG spectrometryCD spectra ultraviolet differential spectra
(1996-11-25收稿 1997-03-01修回), 百拇医药