人类端粒酶分离纯化的研究
作者:周俊宜 罗超权
单位:中山医科大学生化教研室; 广州,510080
关键词:端粒酶;寡核苷酸
中山医科大学学报990420
中图号 Q 756
近年来,端粒酶与恶性肿瘤的发生以及衰老的密切关系是人们所关注的一个热点[1~3]。现在人们试图从端粒酶方面寻找抗肿瘤或抗衰老的新途径,要达到这一目的,阐明人类端粒酶的基本组成结构和生化特性是其前提和基础[4~5]。到目前为止,为人类端粒酶RNA组分已研究得比较清楚,但人类端粒酶的分离纯化和对其蛋白质成分的分析一直是该研究领域中的一大难题,国内外还未有成功分离的报道。本研究从人类端粒酶的组成特点和功能出发,以其含有蛋白质成分和RNA成分这一重要特点和它在延伸端粒时的作用过程为依据,自行设计了一套高灵敏、高特异的寡核苷酸亲和纯化法对Hela细胞端粒酶进行分离纯化,并对其蛋白质组分进行分析。
, http://www.100md.com
1 材料和方法
寡核苷酸亲和纯化分离Hela细胞端粒酶的基本思路和过程如下:根据人端粒酶RNA组分的模板序列及人的端粒序列以及端粒酶催化合成端粒时“爬行模式’,设计合成长短不一的两条互补寡核苷酸链,通过T4DNA连接酶的作用把它们连接到一种带有双链寡核苷酸尾的层析磁珠上,通过模拟端粒的延伸过程使其RNA组分模板序列与寡核苷酸长链碱基互补,从而达到对人端粒酶高特异、高灵敏的亲和纯化的目的。具体方法是首先把寡核苷酸链连接到带有一段双链寡核酸的纯化磁珠上,然后加入Hela细胞粗提物进行蛋白质结合反应,端粒酶通过其RNA组分中的模板序列与寡核苷酸中的人端粒重复序列互补而结合到纯化磁珠上从而与上清液相分离,最后通过洗脱过程使结合在微珠寡核苷酸链上端粒酶洗脱下来。纯化产物以TRAP法检测其端粒酶活性,用RNase处理后进行PAGE分析。
2 结 果
洗脱产物用TRAP法检测具有端粒酶活性,对其进行SDS-PAGE分析可见到4条蛋白质条带;与标准蛋白质分子质量比较:有两条位置接近212.0 ku,一条接近97.4 ku,一条接近42.7 ku。同时,设立了两组阴性对照:一组是无关的寡核苷酸片段对端粒酶粗提物的纯化,一组是用端粒酶阴性的非肿瘤细胞蛋白提取物进行亲和纯化。实验结果表明,两者都没有得到相应的纯化片段(图1)。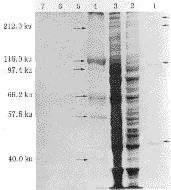
, 百拇医药
图1 蛋白质成分的SDS-PAGE分析
Fig.1 SDS-PAGE of protein components
1. Elute.2.Supernatant of purification procedure. 3. Crude from HeLa cells. 4. Molecular Weight Mark of protein. 5. Fractioin of last washing step. 6. Negative control using non-target sequence. 7. Control from normal cells
3 讨 论
端粒酶作为一种核糖核酸逆转录酶在组成结构上有其特点。而人端粒酶又由于在细胞内含量甚低(其活性比四膜虫等低等生物低很多)而使其分离纯化工作一直难以取得突破性进展。要从含有种类繁多的蛋白质成分的细胞粗提物中分离到含量极微的端粒酶成分,关键所在是必须抓住该酶在组成、结构和功能上的特点并针对这些特点来进行操作,才能有效地提高其特异性和灵敏性。本研究经过两年多的摸索,在历经了多次失败的经验教训以后,把实验设计的重点放在了端粒酶包含了蛋白质组分和RNA组分,而它的RNA组分又是作为染色体端粒合成时的模板这一重要特点上,参照生物体内端粒酶催化端粒合成时的所谓“爬行模式”,根据人端粒酶RNA组分的模板序列以及人染色体端粒重复序列,设计长短不一的两段寡核苷酸,并把它们连接到一纯化磁珠上,然后通过模拟端粒延伸的过程使细胞粗提物中的端粒酶结合到寡核苷酸上,这样就特异性地把端粒酶从粗提物中分离出来,再通过洗脱过程得到了具有端粒酶活性的纯化产物。
, 百拇医药
在实验过程中,我们还同时设立了两组阴性对照,一组是无关的寡核苷酸片段对端粒酶粗提物的纯化,一组是用端粒酶阴性的非肿瘤细胞蛋白提取物进行亲和纯化。实验结果表明,两者都没有得到相应的纯化片段。对纯化产物进行蛋白质的SDS-PAGE分析可见大小不同的4条蛋白条带。由于国内外人端粒酶蛋白组分的研究至今尚处于探讨阶段,没有成功分离的资料[6],无从比较,与标准蛋白质分子相比较,有两条相距很近的条带其分子质量与212.0 ku条带接近,中间的一条与97.4 ku条带接近,最小的一条在40.0 ku和57.5 ku之间。进一步的工作正在进行中。
参考文献
1 Collins K,Ryuji Kobayashi, Greider W. Purification of tetrahymena telomerase and clonineg of genes econding the two protein components of the enzyme. Cell, 1995,81(8):677
, 百拇医药
2 Autexier C, Pruzan R, Funk W D, et al. Reconstitution of the human telomerase activity and identification of a minimal fuctional region of the human telomerase RNA. EMBO J, 1996,15(6):5928~5938
3 Kim N W, Piatyszek M A, Prowse K P, et al. Specific sociation of human elomerase activity with immortal cells and cancer. Science, 1994,266(9):2011
4 Junli F, Walter D F, Sy-Shi W, Bryant V, et al. The RNA component of Human telomerase. Science, 1995,269(4):1236
5 Harrington L, McPhail T, Mar V, et al. A Mammalian Telomerase-associated protein. Science. Vol, 275(4):973
6 Kanaya T, Kyo S, Takakura M, et al. HTERT is acritical determinant of telomerase activity in renal-cell carcinoma. Int J Cancer, 1998,78(5):529
(1999 - 07 - 02收稿 1999 - 10 - 07修回), 百拇医药
单位:中山医科大学生化教研室; 广州,510080
关键词:端粒酶;寡核苷酸
中山医科大学学报990420
中图号 Q 756
近年来,端粒酶与恶性肿瘤的发生以及衰老的密切关系是人们所关注的一个热点[1~3]。现在人们试图从端粒酶方面寻找抗肿瘤或抗衰老的新途径,要达到这一目的,阐明人类端粒酶的基本组成结构和生化特性是其前提和基础[4~5]。到目前为止,为人类端粒酶RNA组分已研究得比较清楚,但人类端粒酶的分离纯化和对其蛋白质成分的分析一直是该研究领域中的一大难题,国内外还未有成功分离的报道。本研究从人类端粒酶的组成特点和功能出发,以其含有蛋白质成分和RNA成分这一重要特点和它在延伸端粒时的作用过程为依据,自行设计了一套高灵敏、高特异的寡核苷酸亲和纯化法对Hela细胞端粒酶进行分离纯化,并对其蛋白质组分进行分析。
, http://www.100md.com
1 材料和方法
寡核苷酸亲和纯化分离Hela细胞端粒酶的基本思路和过程如下:根据人端粒酶RNA组分的模板序列及人的端粒序列以及端粒酶催化合成端粒时“爬行模式’,设计合成长短不一的两条互补寡核苷酸链,通过T4DNA连接酶的作用把它们连接到一种带有双链寡核苷酸尾的层析磁珠上,通过模拟端粒的延伸过程使其RNA组分模板序列与寡核苷酸长链碱基互补,从而达到对人端粒酶高特异、高灵敏的亲和纯化的目的。具体方法是首先把寡核苷酸链连接到带有一段双链寡核酸的纯化磁珠上,然后加入Hela细胞粗提物进行蛋白质结合反应,端粒酶通过其RNA组分中的模板序列与寡核苷酸中的人端粒重复序列互补而结合到纯化磁珠上从而与上清液相分离,最后通过洗脱过程使结合在微珠寡核苷酸链上端粒酶洗脱下来。纯化产物以TRAP法检测其端粒酶活性,用RNase处理后进行PAGE分析。
2 结 果
洗脱产物用TRAP法检测具有端粒酶活性,对其进行SDS-PAGE分析可见到4条蛋白质条带;与标准蛋白质分子质量比较:有两条位置接近212.0 ku,一条接近97.4 ku,一条接近42.7 ku。同时,设立了两组阴性对照:一组是无关的寡核苷酸片段对端粒酶粗提物的纯化,一组是用端粒酶阴性的非肿瘤细胞蛋白提取物进行亲和纯化。实验结果表明,两者都没有得到相应的纯化片段(图1)。

, 百拇医药
图1 蛋白质成分的SDS-PAGE分析
Fig.1 SDS-PAGE of protein components
1. Elute.2.Supernatant of purification procedure. 3. Crude from HeLa cells. 4. Molecular Weight Mark of protein. 5. Fractioin of last washing step. 6. Negative control using non-target sequence. 7. Control from normal cells
3 讨 论
端粒酶作为一种核糖核酸逆转录酶在组成结构上有其特点。而人端粒酶又由于在细胞内含量甚低(其活性比四膜虫等低等生物低很多)而使其分离纯化工作一直难以取得突破性进展。要从含有种类繁多的蛋白质成分的细胞粗提物中分离到含量极微的端粒酶成分,关键所在是必须抓住该酶在组成、结构和功能上的特点并针对这些特点来进行操作,才能有效地提高其特异性和灵敏性。本研究经过两年多的摸索,在历经了多次失败的经验教训以后,把实验设计的重点放在了端粒酶包含了蛋白质组分和RNA组分,而它的RNA组分又是作为染色体端粒合成时的模板这一重要特点上,参照生物体内端粒酶催化端粒合成时的所谓“爬行模式”,根据人端粒酶RNA组分的模板序列以及人染色体端粒重复序列,设计长短不一的两段寡核苷酸,并把它们连接到一纯化磁珠上,然后通过模拟端粒延伸的过程使细胞粗提物中的端粒酶结合到寡核苷酸上,这样就特异性地把端粒酶从粗提物中分离出来,再通过洗脱过程得到了具有端粒酶活性的纯化产物。
, 百拇医药
在实验过程中,我们还同时设立了两组阴性对照,一组是无关的寡核苷酸片段对端粒酶粗提物的纯化,一组是用端粒酶阴性的非肿瘤细胞蛋白提取物进行亲和纯化。实验结果表明,两者都没有得到相应的纯化片段。对纯化产物进行蛋白质的SDS-PAGE分析可见大小不同的4条蛋白条带。由于国内外人端粒酶蛋白组分的研究至今尚处于探讨阶段,没有成功分离的资料[6],无从比较,与标准蛋白质分子相比较,有两条相距很近的条带其分子质量与212.0 ku条带接近,中间的一条与97.4 ku条带接近,最小的一条在40.0 ku和57.5 ku之间。进一步的工作正在进行中。
参考文献
1 Collins K,Ryuji Kobayashi, Greider W. Purification of tetrahymena telomerase and clonineg of genes econding the two protein components of the enzyme. Cell, 1995,81(8):677
, 百拇医药
2 Autexier C, Pruzan R, Funk W D, et al. Reconstitution of the human telomerase activity and identification of a minimal fuctional region of the human telomerase RNA. EMBO J, 1996,15(6):5928~5938
3 Kim N W, Piatyszek M A, Prowse K P, et al. Specific sociation of human elomerase activity with immortal cells and cancer. Science, 1994,266(9):2011
4 Junli F, Walter D F, Sy-Shi W, Bryant V, et al. The RNA component of Human telomerase. Science, 1995,269(4):1236
5 Harrington L, McPhail T, Mar V, et al. A Mammalian Telomerase-associated protein. Science. Vol, 275(4):973
6 Kanaya T, Kyo S, Takakura M, et al. HTERT is acritical determinant of telomerase activity in renal-cell carcinoma. Int J Cancer, 1998,78(5):529
(1999 - 07 - 02收稿 1999 - 10 - 07修回), 百拇医药