胸腺内接种同种脾细胞诱导新生期大鼠免疫耐受的研究
作者:范太兵 丁文祥 黄惠民 蒋祖明
单位:范太兵(河南医科大学第三附属医院小儿胸心外科 郑州 450052);丁文祥 黄惠民 蒋祖明(上海第二医科大学附属新华医院小儿胸心外科 上海200092)
关键词:胸腺;脾淋巴细胞;新生免疫耐受
河南医科大学学报990220 摘要 目的:为了诱导新生大鼠免疫耐受。方法:将2.5×107个Wistar大鼠脾淋巴细胞通过胸腺途径注射给新生SD大鼠,4~6周龄时取其脾淋巴细胞与Wistar大鼠脾淋巴细胞(20Gy照射)进行混合培养,作氚标记并测定放射强度。结果:实验组放射强度平均为(10.85±2.56)Bq;对照组为(24.82±5.44)Bq,2组比较差异显著(P<0.001)。结论:新生期大鼠胸腺内接种同种脾淋巴细胞可以诱导其免疫耐受。
中图分类号 R654
, 百拇医药
Immunologic tolerance induced by neonatal intrathymic injection of allogeneic spleen cells
Fan Taibing1),Ding Wenxiang2),Huang Huimin 2),Jiang Zuming2)
1)Department of Pediatric Thoracic and Cardiac Surgery,the Third Affiliated Hospital,Henan Medical University,Zhengzhou 450052 2)Department of Pediatric Thoracic and Cardiac Surgery,Xinhua Hospital,Shanghai Second Medical University,Shanghai 200092
, 百拇医药
Abstract Aim:To induce immunologic tolerance in neonatal SD rat. Methods:Intrathymic injection of 2.5×107 Wistar rat spleen cells in neonates was followed by mixed lymphocyte culture(MLC) with Wistar rat spleen cells(20Gy)at 4~6 weeks of age.Results:The value of Bq in neonatal primed rats is Signif icantly lower than that in control rats (10.85±2.56)Bq and(24.82±5.44)Bq respectively (P<0.001).conclusion:Intrathymic inoculation of allogeneic cells in neonatal rats with immature immune system can produce immunologic tolerance in vitro.
, http://www.100md.com
Key words thymus;spleen cells;neonatal immunologic tolerance
近年来,小儿器官移植发展迅速,前景乐观,但由于术后应用免疫抑制剂所致的毒副作用,不仅影响小儿生长发育,而且会导致巨细胞病毒感染、肿瘤等严重并发症。同时,免疫抑制剂只能暂时抑制而不能消除排斥反应,尤其是慢性排斥反应。诱导受体免疫耐受可能是解决这一问题的有效途径。在1953年,Billingham等[1]发现,机体在其免疫系统未发育成熟之前,对外来抗原较易产生免疫耐受。近年来,随着对胸腺结构和功能研究的深入,认识到T细胞是在胸腺内分化发育成熟,胸腺在整个免疫系统中起着中枢性的作用,可能是致耐的特惠器官。作者拟通过新生期大鼠胸腺内接种同种供体脾细胞诱导其特异性免疫耐受,以便为进一步同种动物心脏移植研究提供实验依据。
1 材料与方法
1.1 实验动物 SD孕母鼠和Wistar大鼠雌雄、体重不限,均由中国医学科学院上海实验动物中心提供,上海新华医院实验动物中心饲养。
, 百拇医药
1.2 脾淋巴细胞分离 Wistar大鼠麻醉后,无菌条件下取脾,在玻璃皿中剪碎,轻轻研磨并经200目钢丝网过滤,RPMI-1640冲洗,应用鼠脾淋巴细胞分层液分离脾淋巴细胞,台盼兰染色判定细胞活力。并制成所需浓度的细胞悬液。
1.3 受体胸腺内脾淋巴细胞接种 新生期SD大鼠(生后24h内)麻醉后,在胸骨切开直视下用特制微量注射器(针头直径0.32mm)将制备待用的Wistar大鼠脾淋巴细胞悬液10μl(含2.5×107个脾细胞)均匀注入两叶胸腺内,稍后慢慢拨出针头。用8-0锦纶线缝合胸骨及皮肤,然后放回母鼠身边饲养,养至21~28 d断奶,并观察其生长发育情况。
1.4 细胞培养液配制 参照Chen等[2]所报道的方法。RPMI-1640培养液中含100g/L的灭活小牛血清,谷氨酰胺2mol/L,Hepes10mol/L,青霉素1.0×105U/L,链霉素1.0×105ng/L,NaHCO3调节pH至7.2(以上试剂均由上海实生公司提供)。
, 百拇医药
1.5 混合淋巴细胞培养 ①实验组:取4~6周龄在新生期胸腺内注射过Wistar大鼠脾淋巴细胞的SD大鼠,按上述方法分离的脾淋巴细胞作为反应细胞,Wistar大鼠脾淋巴细胞经20GyX线照射后作为刺激细胞。用24孔培养板,每孔加SD和Wistar大鼠脾淋巴细胞各1.0×105个/ml,并设置3个复孔。在体积分数为5%的CO2、37℃的培养箱中培养72h后,每孔加甲基-H3TDR 7.4×105Bq,再培养18h,应用细胞收集装置收集细胞于F49型玻璃纤维滤纸上,依次用生理盐水冲洗,三氯乙酸固定,无水乙醇脱水、脱色。80℃烘烤箱中烘干,置于含4ml闪烁液的闪烁杯中,在YSJ-75型液闪计数仪上测定样本的放射强度(min-1)。同时,用未经X线照射的SD大鼠脾淋巴细胞与经20GyX线照射的自身脾淋巴细胞进行混合培养,作为自身对照,并设置3个复孔。细胞数量、培养方法、氚标记及细胞收集均同上。②对照组:取4~6周龄并在新生期胸腺内注射RPMI-1640的SD大鼠,分离其脾淋巴细胞作为反应细胞,成年Wistar大鼠脾淋巴细胞经20GyX线照射后作为刺激细胞,按与实验组同样的方法进行设置和细胞培养,经甲基-H3TDR掺入后收集细胞,测样本放射强度值。同时设置自身对照。
, http://www.100md.com
1.6 统计学处理 数据采用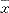 ±s表达,方差分析,组间数据比较采用方差不齐性t检验。
±s表达,方差分析,组间数据比较采用方差不齐性t检验。
2 结果
9只在新生期接受Wistar大鼠脾淋巴细胞接种的SD大鼠,在4~6周龄时与成年Wistar大鼠脾淋巴细胞混合培养,平均放射强度值为(10.85±2.56)Bq,自身对照为(8.35±1.75)Bq。而对照组6只SD大鼠在4~6周龄时分离其脾淋巴细胞与Wistar大鼠脾淋巴细胞(经20Gy照射)混合培养,测得平均放射强度值为(24.82±5.44)Bq,自身对照为(6.9±1.63) Bq,2组比较差异有显著性(P<0.001)。
3 讨论
免疫耐受是机体免疫系统受到某种异型抗原刺激后产生的特异性针对该抗原的免疫无反应状态。免疫耐受诱导首先要向受体注入供体特异MHC抗原。若受体在胚胎或新生期接触异体抗原,由于免疫系统尚未发育成熟,异体抗原会被认为属于“自己”,从而对其产生免疫耐受。许多学者[3,4]通过静脉注射供体脾细胞成功地诱导出新生小鼠的特异性免疫耐受,使移植心存活时间显著延长。近年来,胸腺作为重要的中枢免疫器官,其结构和功能日渐被人们所认识[5]。胸腺为T细胞分化发育提供了最适宜的微环境,该微环境的作用在于诱导骨髓来源的前T细胞发育成熟。胸腺上皮细胞表达MHC-Ⅰ和MHC-Ⅱ抗原,从骨髓来到胸腺的前T细胞只有与MHC-Ⅰ和MHC-Ⅱ抗原结合后才能存活和增殖,并发育成熟为CD4+和CD8+细胞而后进入髓质,在髓质内那些带有自身抗原反应性受体的T细胞与提呈自身抗原的巨噬细胞或树突细胞结合而凋亡。由此,胸腺是自身耐受形成的重要器官。作者设想,在个体发育早期,机体免疫系统未发育成熟之前,如若在胸腺内直接接种脾细胞抗原,就会更易产生免疫耐受。
, http://www.100md.com
作者将Wistar大鼠脾淋巴细胞注射到新生大鼠胸腺内,4~6周龄时经混合淋巴细胞培养,发现经同样数量的Wistar大鼠脾淋巴细胞刺激后,其淋巴细胞反应增殖程度远较对照组为弱。结果表明,新生期SD大鼠胸腺内接种同种脾淋巴细胞抗原后,确能诱导出对该抗原的免疫耐受。这可能有利于减轻同种器官移植后的排异反应,最终达到长期存活的目标。
参考文献
[1] Billingham RE,Brent L,Medawar PB. Actively acquired tolerance to foreign cells. Nature,1953,172:603
[2] Chen Naxi,Gao QingLin,Field EH. Expansion of memory TH2 cells over TH1 cells in neonatal primed mice. Transplantation,1995,60(11):1187
, http://www.100md.com
[3] West LJ,Wood KJ. Neonatal induction of tolerance to Cardiac allografts. Transplant proc,1994,26(1):207
[4] West LJ,Peter JW,Wood KJ. Fetal Liver Haematopoietic Cells and tolerance to organ Allografts. Lancet,1994,343:148
[5] Boyd RJ,Tucek CL,Godrfrey DC,et al. The thymus microenvironment. Immunology Today,1993,14:445
(1998-09-18收稿), http://www.100md.com
单位:范太兵(河南医科大学第三附属医院小儿胸心外科 郑州 450052);丁文祥 黄惠民 蒋祖明(上海第二医科大学附属新华医院小儿胸心外科 上海200092)
关键词:胸腺;脾淋巴细胞;新生免疫耐受
河南医科大学学报990220 摘要 目的:为了诱导新生大鼠免疫耐受。方法:将2.5×107个Wistar大鼠脾淋巴细胞通过胸腺途径注射给新生SD大鼠,4~6周龄时取其脾淋巴细胞与Wistar大鼠脾淋巴细胞(20Gy照射)进行混合培养,作氚标记并测定放射强度。结果:实验组放射强度平均为(10.85±2.56)Bq;对照组为(24.82±5.44)Bq,2组比较差异显著(P<0.001)。结论:新生期大鼠胸腺内接种同种脾淋巴细胞可以诱导其免疫耐受。
中图分类号 R654
, 百拇医药
Immunologic tolerance induced by neonatal intrathymic injection of allogeneic spleen cells
Fan Taibing1),Ding Wenxiang2),Huang Huimin 2),Jiang Zuming2)
1)Department of Pediatric Thoracic and Cardiac Surgery,the Third Affiliated Hospital,Henan Medical University,Zhengzhou 450052 2)Department of Pediatric Thoracic and Cardiac Surgery,Xinhua Hospital,Shanghai Second Medical University,Shanghai 200092
, 百拇医药
Abstract Aim:To induce immunologic tolerance in neonatal SD rat. Methods:Intrathymic injection of 2.5×107 Wistar rat spleen cells in neonates was followed by mixed lymphocyte culture(MLC) with Wistar rat spleen cells(20Gy)at 4~6 weeks of age.Results:The value of Bq in neonatal primed rats is Signif icantly lower than that in control rats (10.85±2.56)Bq and(24.82±5.44)Bq respectively (P<0.001).conclusion:Intrathymic inoculation of allogeneic cells in neonatal rats with immature immune system can produce immunologic tolerance in vitro.
, http://www.100md.com
Key words thymus;spleen cells;neonatal immunologic tolerance
近年来,小儿器官移植发展迅速,前景乐观,但由于术后应用免疫抑制剂所致的毒副作用,不仅影响小儿生长发育,而且会导致巨细胞病毒感染、肿瘤等严重并发症。同时,免疫抑制剂只能暂时抑制而不能消除排斥反应,尤其是慢性排斥反应。诱导受体免疫耐受可能是解决这一问题的有效途径。在1953年,Billingham等[1]发现,机体在其免疫系统未发育成熟之前,对外来抗原较易产生免疫耐受。近年来,随着对胸腺结构和功能研究的深入,认识到T细胞是在胸腺内分化发育成熟,胸腺在整个免疫系统中起着中枢性的作用,可能是致耐的特惠器官。作者拟通过新生期大鼠胸腺内接种同种供体脾细胞诱导其特异性免疫耐受,以便为进一步同种动物心脏移植研究提供实验依据。
1 材料与方法
1.1 实验动物 SD孕母鼠和Wistar大鼠雌雄、体重不限,均由中国医学科学院上海实验动物中心提供,上海新华医院实验动物中心饲养。
, 百拇医药
1.2 脾淋巴细胞分离 Wistar大鼠麻醉后,无菌条件下取脾,在玻璃皿中剪碎,轻轻研磨并经200目钢丝网过滤,RPMI-1640冲洗,应用鼠脾淋巴细胞分层液分离脾淋巴细胞,台盼兰染色判定细胞活力。并制成所需浓度的细胞悬液。
1.3 受体胸腺内脾淋巴细胞接种 新生期SD大鼠(生后24h内)麻醉后,在胸骨切开直视下用特制微量注射器(针头直径0.32mm)将制备待用的Wistar大鼠脾淋巴细胞悬液10μl(含2.5×107个脾细胞)均匀注入两叶胸腺内,稍后慢慢拨出针头。用8-0锦纶线缝合胸骨及皮肤,然后放回母鼠身边饲养,养至21~28 d断奶,并观察其生长发育情况。
1.4 细胞培养液配制 参照Chen等[2]所报道的方法。RPMI-1640培养液中含100g/L的灭活小牛血清,谷氨酰胺2mol/L,Hepes10mol/L,青霉素1.0×105U/L,链霉素1.0×105ng/L,NaHCO3调节pH至7.2(以上试剂均由上海实生公司提供)。
, 百拇医药
1.5 混合淋巴细胞培养 ①实验组:取4~6周龄在新生期胸腺内注射过Wistar大鼠脾淋巴细胞的SD大鼠,按上述方法分离的脾淋巴细胞作为反应细胞,Wistar大鼠脾淋巴细胞经20GyX线照射后作为刺激细胞。用24孔培养板,每孔加SD和Wistar大鼠脾淋巴细胞各1.0×105个/ml,并设置3个复孔。在体积分数为5%的CO2、37℃的培养箱中培养72h后,每孔加甲基-H3TDR 7.4×105Bq,再培养18h,应用细胞收集装置收集细胞于F49型玻璃纤维滤纸上,依次用生理盐水冲洗,三氯乙酸固定,无水乙醇脱水、脱色。80℃烘烤箱中烘干,置于含4ml闪烁液的闪烁杯中,在YSJ-75型液闪计数仪上测定样本的放射强度(min-1)。同时,用未经X线照射的SD大鼠脾淋巴细胞与经20GyX线照射的自身脾淋巴细胞进行混合培养,作为自身对照,并设置3个复孔。细胞数量、培养方法、氚标记及细胞收集均同上。②对照组:取4~6周龄并在新生期胸腺内注射RPMI-1640的SD大鼠,分离其脾淋巴细胞作为反应细胞,成年Wistar大鼠脾淋巴细胞经20GyX线照射后作为刺激细胞,按与实验组同样的方法进行设置和细胞培养,经甲基-H3TDR掺入后收集细胞,测样本放射强度值。同时设置自身对照。
, http://www.100md.com
1.6 统计学处理 数据采用
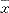 ±s表达,方差分析,组间数据比较采用方差不齐性t检验。
±s表达,方差分析,组间数据比较采用方差不齐性t检验。2 结果
9只在新生期接受Wistar大鼠脾淋巴细胞接种的SD大鼠,在4~6周龄时与成年Wistar大鼠脾淋巴细胞混合培养,平均放射强度值为(10.85±2.56)Bq,自身对照为(8.35±1.75)Bq。而对照组6只SD大鼠在4~6周龄时分离其脾淋巴细胞与Wistar大鼠脾淋巴细胞(经20Gy照射)混合培养,测得平均放射强度值为(24.82±5.44)Bq,自身对照为(6.9±1.63) Bq,2组比较差异有显著性(P<0.001)。
3 讨论
免疫耐受是机体免疫系统受到某种异型抗原刺激后产生的特异性针对该抗原的免疫无反应状态。免疫耐受诱导首先要向受体注入供体特异MHC抗原。若受体在胚胎或新生期接触异体抗原,由于免疫系统尚未发育成熟,异体抗原会被认为属于“自己”,从而对其产生免疫耐受。许多学者[3,4]通过静脉注射供体脾细胞成功地诱导出新生小鼠的特异性免疫耐受,使移植心存活时间显著延长。近年来,胸腺作为重要的中枢免疫器官,其结构和功能日渐被人们所认识[5]。胸腺为T细胞分化发育提供了最适宜的微环境,该微环境的作用在于诱导骨髓来源的前T细胞发育成熟。胸腺上皮细胞表达MHC-Ⅰ和MHC-Ⅱ抗原,从骨髓来到胸腺的前T细胞只有与MHC-Ⅰ和MHC-Ⅱ抗原结合后才能存活和增殖,并发育成熟为CD4+和CD8+细胞而后进入髓质,在髓质内那些带有自身抗原反应性受体的T细胞与提呈自身抗原的巨噬细胞或树突细胞结合而凋亡。由此,胸腺是自身耐受形成的重要器官。作者设想,在个体发育早期,机体免疫系统未发育成熟之前,如若在胸腺内直接接种脾细胞抗原,就会更易产生免疫耐受。
, http://www.100md.com
作者将Wistar大鼠脾淋巴细胞注射到新生大鼠胸腺内,4~6周龄时经混合淋巴细胞培养,发现经同样数量的Wistar大鼠脾淋巴细胞刺激后,其淋巴细胞反应增殖程度远较对照组为弱。结果表明,新生期SD大鼠胸腺内接种同种脾淋巴细胞抗原后,确能诱导出对该抗原的免疫耐受。这可能有利于减轻同种器官移植后的排异反应,最终达到长期存活的目标。
参考文献
[1] Billingham RE,Brent L,Medawar PB. Actively acquired tolerance to foreign cells. Nature,1953,172:603
[2] Chen Naxi,Gao QingLin,Field EH. Expansion of memory TH2 cells over TH1 cells in neonatal primed mice. Transplantation,1995,60(11):1187
, http://www.100md.com
[3] West LJ,Wood KJ. Neonatal induction of tolerance to Cardiac allografts. Transplant proc,1994,26(1):207
[4] West LJ,Peter JW,Wood KJ. Fetal Liver Haematopoietic Cells and tolerance to organ Allografts. Lancet,1994,343:148
[5] Boyd RJ,Tucek CL,Godrfrey DC,et al. The thymus microenvironment. Immunology Today,1993,14:445
(1998-09-18收稿), http://www.100md.com