内源性一氧化碳对大鼠主动脉球囊损伤后新生内膜形成及丝裂素活化蛋白激酶活性的影响
作者:欧和生 严丽梅 杨军 王培勇 庞永正 苏静怡 唐朝枢
单位:北京医科大学第一医院心血管研究所,北京 100034
关键词:血红素氧化酶;药理学;一氧化碳;药理学;丝裂素活化蛋白激酶☆;血管内膜;药物作用
北京医科大学学报990506 摘 要 目的:探讨内源性血红素加氧酶(heme oxygenase, HO)/一氧化碳(carbon monoxide, CO)系统对大鼠主动脉球囊损伤后新生内膜形成及丝裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)激活的调节作用。方法:采用大鼠主动脉内膜球囊拉伤模型,观察HO抑制剂锌卟啉-9(zinc protoporphyrin IX, ZnPP-9)或其底物血红素-左旋-赖氨酸盐(heme-L-lysinate, HLL)对血管壁细胞3H-TdR掺入和MAPK活性的影响,同时观察血管平滑肌HO活性和CO生成的变化。结果:内膜拉伤后2周血管3H-TdR掺入和MAPK活性明显增加,同时HO活性和CO的产生增加;ZnPP-9使血管的3H-TdR掺入和MAPK活性增加更为明显(分别比单独拉伤组增加34.6%和39.2%,均为P<0.01);而HLL使血管的3H-TdR掺入和MAPK活性则明显降低(比单独拉伤组分别减少29.45%和33.6%,均为P<0.01)。结论:HO活性上调或CO产生增加是血管对机械拉伤的一种保护性应激反应;内源性HO/CO系统直接参与新内膜形成中血管壁细胞的增殖调节,HO活性诱导有可能成为临床上防治血管增殖性疾病的一种新途径。
, http://www.100md.com
中国图书资料分类法分类号 R654.3-332
The role of endogenous carbon monoxide on neointimal formation and mitogen-activated protein kinase activity in aortic artery of rats after balloon-injury
OU He-Sheng#, YAN Li-Mei, YANG Jun, WANG Pei-Yong, PANG Yong-Zheng, SU Jing-Yi, TANG Chao-Shu
(#Institute of Cardiovascular Disease, the First Hospital, Beijing Medical University, Beijing 100034)
, http://www.100md.com
MeSH Heme oxygenase/pharmacol Carbon monoxide/pharmacol Mitogen-activated protein kinase☆ Tunica intima/drug off
ABSTRACT Objective: The purpose of this study was to investigate the role of endogenous carbon monoxide (CO) on neointimal formation and mitogen-activated protein kinase (MAPK) activity. Methods: On a rat model of aortic endothelium balloon-injury. Vascular 3H-TdR incorporation, MAPK activity, heme oxygenase (HO) activity and CO release were measured after treatment of ZnPP-9, an HO inhibitor, or heme-L-lysinate (HLL), an HO substrate. Results: Vascular 3H-TdR incorporation and MAPK activity were significantly increased on day 14 after endothelium balloon-injury while HO activity and CO release were up-regulated. The increased vascular 3H-TdR incorporation and MAPK activity after balloon-injury could be enhanced by pretreatment of ZnPP-9, whereas they could be inhibited by pretreatment of HLL. Conclusion: HO activity up-regulation in aorta was a protective response to balloon-injury; endogenous HO/CO system is involved in the regulation of cell proliferation during neointimal formation , and HO induction may become a new clinical approach to prevent cell proliferation in some vascular disease.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:404-407)
再狭窄的主要病变是血管内膜受损部位出现内皮剥脱、内皮细胞再生、平滑肌细胞(smooth muscle cell, SMC)增殖和迁移并形成新内膜。细胞增殖和迁移的机制有待阐明。内源性一氧化碳(carbon monoxide, CO)是由血红素在加氧酶(hemeoxygen-
ase, HO)作用下降解产生的小分子气体,新近发现内源性CO在心血管系统有重要的生理和病理调节作用[1]。我们最近的工作表明,内源性HO/CO系统参与了血管内膜剥脱后血管壁增厚和新内膜形成[2]。然而内源性CO对新内膜中细胞增殖有无影响,以及对丝裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号传递系统的影响,目前尚未见报道。本工作在大鼠主动脉内膜球囊剥脱模型上,观察血管3H-TdR掺入和MAPK活性改变以及与平滑肌HO活性和CO生成之间的相互关系,以探讨内源性HO/CO系统对血管壁细胞增殖及其MAPK活性调节的影响。
, http://www.100md.com
1 材料与方法
大鼠主动脉内膜球囊剥脱术[3]:选350~400 g雄性Wistar大鼠(北京医科大学动物中心提供)随机分为4组:对照组、剥脱组、HO抑制组、HO底物组。对照组为10只,其余3组为8只。剥脱组大鼠分离左颈总动脉,将改良的Forgarty球囊导管(2F)经此插入腹主动脉,充盈球囊后反复抽拉3次以剥脱主动脉内膜。后两组分别在剥脱术前给予ZnPP-9和HLL (均为45 μmol.kg-1.d-1, ip),1周后行剥脱术, 术后给药持续2周。对照组除不插入导管外,其余操作同剥脱组。
血管条3H-TdR掺入[4]:动物术后14 d,摘取胸主动脉约1 cm纵行切开后,置于1.5 ml RPMI 1640培养液中,加入5.6×104 Bq的3H-TdR,在通气条件O2与CO2体积比为9∶1, 37 ℃的恒温水浴振荡器上孵育24 h,冷PBS冲洗3次,甲酸消化后用液闪仪测定其放射强度。
, 百拇医药
MAPK活性测定[5]:将主动脉剪成碎块,加入冷提取液后匀浆,离心后取上清0.5 ml与5 μg特异性MAPK抗体于4 ℃共同孵育4 h,收集免疫复合物与预先吸附有抗鼠IgG的Agarose deads孵育30 min,沉淀下的蛋白再加入溶解液0.5 ml混匀,取其中150 μl与20 μl激酶缓冲液在25 ℃孵育25 min,取100 μl点于P81 Phosphocellulose滤纸(Whatman)上,在液闪仪上测定髓磷脂碱性蛋白中32P的掺入量,结果以每分每毫克蛋白掺入32P的pmol数表示。
主动脉平滑肌HO活性和CO释放量测定:主动脉去掉内膜和外层组织,平滑肌层用于以下HO活性和HbCO形成的测定。
HO活性测定采用Morita等[6]的方法稍加改良。主要步骤有,血管组织用5体积冷Tris/HCl(pH7.4)缓冲液匀浆,匀浆液过滤后离心两次(分别2 000 r.min-1, 20 min)以沉淀线粒体。上清液再离心(120 000 r.min-1, 90 min)分离微粒体。用100 mmol.L-1,pH7.4的焦磷酸钠去除血红蛋白后,用磷酸钾缓冲液制成微粒体悬浮液,其蛋白终浓度为40 g.L-1。取0.5 mg微粒体加于0.4 ml反应液中(含肝实质0.6 mg,NADP 0.8 mmol.L-1,6-磷酸葡萄糖,6-磷酸葡萄糖脱氢酶0.2 u),最后加入50 μl 0.25 mmol.L-1的血红素作底物。混匀后置暗室37 ℃孵育10 min, 用50 μl 100 g.L-1 HgCl2终止反应。在分光光度仪上(λ/464~530 nm)比色。HO活性用胆红素形成速率来表示。蛋白含量测定用考马斯亮蓝法。
, http://www.100md.com
HbCO生成测定采用Morita[7]等的方法加以改良。主动脉平滑肌剪成3 mm大小组织块在DMEM培养液中(每15 mg 组织加纯Hb 1 mg)孵育1 h (37 ℃, O2与 CO2体积比为9∶1)。用双波长分光光度仪比色测定培养液中HbCO生成量,单位以μmol.L-1表示。
统计学处理:结果用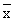 ±s表示。组间差异用方差分析q检验。
±s表示。组间差异用方差分析q检验。
2 结果
2.1 ZnPP-9对大鼠主动脉内膜剥脱后血管壁细胞3H-TdR掺入和MAPK活性的影响(表1)
表1 各实验组血管3H-TdR掺入值和MAPK活性的变化(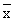 ±s)
±s)
, http://www.100md.com
Table 1 Changes of vascular 3H-TdR incorporation and MAPK activity in various experimental groups (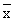 ±s) Group
±s) Group
n
f(3H-TdR incoor)
/min-1☆
MAPK activity
(pmol.min-1)☆
Control
, 百拇医药
10
2 089±265
2 295±564
Balloon alone
8
4 894±386**
5 492±378**
Balloon +ZnPP-9
8
6 589±478**##
7 643±498**##
, 百拇医药
Balloon+HLL
8
3 452±465**##
3 647±509**##
**P<0.01,compared with control; ##P<0.01,compared with balloon alone group; ☆ per mg protein. 无论是否加入ZnPP-9或HLL,球囊拉伤后血管3H-TdR掺入和MAPK活性均明显增加。拉伤加ZnPP-9组3H-TdR掺入值和MAPK活性分别比单独拉伤组增加34.6%和39.2%; 而拉伤加HLL组3H-TdR掺入值和MAPK活性比单独拉伤组分别减少29.45%和33.6%。
, 百拇医药
2.2 ZnPP-9和HLL对大鼠球囊拉伤主动脉平滑肌HO活性和HbCO生成的影响
与对照组比,单独拉伤组HO活性和HbCO生成分别增加2.1倍和2.6倍(均为P<0.01), 拉伤加ZnPP-9组HO活性和HbCO生成分别减少3.9倍和4.9倍, 而拉伤加HLL组HO活性和HbCO生成分别增加5.3倍和5.4倍。有趣的是,拉伤加ZnPP-9组的HO活性和HbCO生成比单独拉伤组分别减少11.7倍和20.4倍(均为P<0.01);而拉伤加HLL组的HO活性和HbCO生成分别比单独拉伤组增加143%和77%(均为P<0.01)。见表2所示。
表2 各实验组中血管平滑肌的HO活性和HbCO浓度(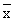 ±s)
±s)
Table 2 HO activity and HbCO formation in aortic smooth muscle in experimental groups(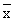 ±s) Group
±s) Group
, http://www.100md.com
n
HO activity
(pmol. h-1)☆
c([HbCO])/
μmol.L-1
Control
10
408±26
6.05±0.43
Balloon alone
8
, http://www.100md.com
1 065±127**
21.78±3.86**
Balloon+ZnPP-9
8
84±12**##
1.02±0.23**##
Balloon+HLL
8
2 587±346**##
38.56±5.49**##
, 百拇医药
**P<0.01, compared with control; ##P<0.01, compared with balloon alone group; ☆ per mg protein.
3 讨论
在球囊拉伤大鼠主动脉内膜后,内皮细胞再生/平滑肌细胞的增殖和迁移可在内膜受损后24 h开始出现,以后逐渐加快,第2周可达到高峰,并形成明显增厚的新生内膜。本实验观察到,拉伤后2周血管壁细胞3H-TdR掺入明显增加,MAPK活性亦明显上调,同时发现内源性血管平滑肌HO活性和CO的生成释放明显增加。更另人感兴趣的是,应用HO抑制剂ZnPP-9抑制HO活性,继而减少CO的生成,能使血管壁细胞3H-TdR掺入和MAPK活性的增加比单独拉伤组更明显,表明ZnPP-9加重了血管壁细胞的增殖;而应用HO底物HLL则使内源性CO的生成释放明显增加,此时血管壁细胞的3H-TdR掺入和MAPK活性明显降低,即HO活性上调和CO产生增加可有效地抑制球囊拉伤所引起的细胞增殖。实验结果表明内源性HO/CO系统参与血管拉伤后细胞增殖的调节。
, 百拇医药
HO是一种蛋白酶,广泛存在于哺乳动物组织细胞微粒体中,它是血红素代谢过程中的限速酶,能降解胞浆中的血红素产生胆绿素(迅速还原成胆红素)、自由离子和CO。近来研究发现,细胞内源性CO在血管生物学功能调节中起着很重要的作用[8]。CO与另一个人们已熟知的血管功能调节分子——NO有许多相似之处,如两者都是小分子气体,都可由血管壁细胞浆中的相应底物在酶的作用下产生和释放,都能在胞浆中与可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC)结合并使之激活,继而使细胞浆cGMP水平上升[9]。目前已确定HO有两种形式:HO-1(诱导型)和HO-2(固有型),许多刺激因素均可使细胞内HO-1的活性上调,如血红素、细菌脂多糖等。ZnPP-9和ZnDPBG等重金属卟啉类化合物是HO的强抑制剂,这些抑制剂已被证实对HO-1和HO-2均有效。本实验用ZnPP-9能加重大鼠主动脉球囊剥脱术后血管新生内膜增厚的程度,这一效应与HO活性的抑制和CO的生成减少密切相关,推测内源性HO/CO系统可能直接参与血管壁细胞的增殖调节。
, http://www.100md.com
在本实验中,HO活性上调,继而CO的产生释放增加,可能是血管壁细胞对机械拉伤的一种应激性保护反应。一旦HO被抑制剂所阻断,CO的产生减少,则细胞的增殖反应加重;相反,应用HO底物增加内源性CO的产生,则细胞增殖受到抑制。这表明内源性CO的产生对细胞的增殖有明显的抑制作用,一旦这种抑制被阻断,细胞的增殖反应就加重。实验还发现,MAPK的活性变化与细胞的增殖反应相平行,提示这种作用通过细胞内MAPK信号传递途径所介导。已有报道内皮素和溶血磷脂等对平滑肌细胞的促增殖作用是通过MAPK途径介导的[10]。MAPK活性受许多因素的调节,包括其上游成分如MAP3K,MAP2K以及PKC和PKA等;内源性HO/CO系统引起MAPK活性改变的主要环节值得进一步研究。
注:国家自然科学基金(39730220)资助课题;
严丽梅 现在衡阳医学院;
☆ 自由词。
, 百拇医药
参考文献
1 Johnson RA, Lavesa M, Deseyn K, et al. Heme oxygenase substrates acutely lower blood pressure in hypertensive rats. Am J Physiol, 1996,271:H1132-H1138
2 Hesheng O, Lijia T, Jun Y, et al. Role of endogenous carbon monxide in neointimal formation induced by balloon-injury in rat aortic artery. Chin Med Sci J, 1999,14(1):41-45
3 Haudenschild CC, Schwartzman SM. Endothelial regeneration.II. Restituting of endothelial continuity. Lab Invest, 1979,41:407-418
, 百拇医药
4 Mcmurry HF, Parrot DP, Dowyer DE. A standard method of culturing aortic explants, suitable for the study of factors affecting the phenotype modulation, migration and proliferation of aortic smooth muscle cells. Atherosclerosis, 1991,86:227-236
5 李田昌,庞永政,苏静怡,等.丝裂素活化蛋白激酶活性测定.基础医学与临床, 1996,16(2):158-160
6 Morita T, Perrella MA, Lee ME, et al. Smooth muscle cell-derived carbon monoxide is a regulator of vascular cGMP. Proc Natl Acad Sci USA, 1995,92:1475-1479
, 百拇医药
7 Morita T, Kourembanas S. Endothelial cell expression of vasoconstrictors and growth factors is regulated by smooth muscle cell-derived carbon monoxide. J Clin Invest, 1995,96:2676-2682
8 Durante W, Christodoulides N, Cheng K, et al. cAMP induces heme oxygenase-1 gene expression and carbon monoxide production in vascular smooth muscle. Am J Physiol, 1997,273(1 Pt 2):H317-H323
9 Maines MD. Carbon monoxide and nitric oxide homology:differential modulation of heme oxygenases in brain and detection of protein and activity. Methods In Enzymology, 1996,268:473-488
10 Yamakawa T, Eguchi S, Yamakawa Y, et al. Lysophosphatidy-
line stimulates MAP kinase activity in rat vascular smooth muscle cells. Hypertension, 1998 ,31:248-253
(1998-08-27收稿), http://www.100md.com
单位:北京医科大学第一医院心血管研究所,北京 100034
关键词:血红素氧化酶;药理学;一氧化碳;药理学;丝裂素活化蛋白激酶☆;血管内膜;药物作用
北京医科大学学报990506 摘 要 目的:探讨内源性血红素加氧酶(heme oxygenase, HO)/一氧化碳(carbon monoxide, CO)系统对大鼠主动脉球囊损伤后新生内膜形成及丝裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)激活的调节作用。方法:采用大鼠主动脉内膜球囊拉伤模型,观察HO抑制剂锌卟啉-9(zinc protoporphyrin IX, ZnPP-9)或其底物血红素-左旋-赖氨酸盐(heme-L-lysinate, HLL)对血管壁细胞3H-TdR掺入和MAPK活性的影响,同时观察血管平滑肌HO活性和CO生成的变化。结果:内膜拉伤后2周血管3H-TdR掺入和MAPK活性明显增加,同时HO活性和CO的产生增加;ZnPP-9使血管的3H-TdR掺入和MAPK活性增加更为明显(分别比单独拉伤组增加34.6%和39.2%,均为P<0.01);而HLL使血管的3H-TdR掺入和MAPK活性则明显降低(比单独拉伤组分别减少29.45%和33.6%,均为P<0.01)。结论:HO活性上调或CO产生增加是血管对机械拉伤的一种保护性应激反应;内源性HO/CO系统直接参与新内膜形成中血管壁细胞的增殖调节,HO活性诱导有可能成为临床上防治血管增殖性疾病的一种新途径。
, http://www.100md.com
中国图书资料分类法分类号 R654.3-332
The role of endogenous carbon monoxide on neointimal formation and mitogen-activated protein kinase activity in aortic artery of rats after balloon-injury
OU He-Sheng#, YAN Li-Mei, YANG Jun, WANG Pei-Yong, PANG Yong-Zheng, SU Jing-Yi, TANG Chao-Shu
(#Institute of Cardiovascular Disease, the First Hospital, Beijing Medical University, Beijing 100034)
, http://www.100md.com
MeSH Heme oxygenase/pharmacol Carbon monoxide/pharmacol Mitogen-activated protein kinase☆ Tunica intima/drug off
ABSTRACT Objective: The purpose of this study was to investigate the role of endogenous carbon monoxide (CO) on neointimal formation and mitogen-activated protein kinase (MAPK) activity. Methods: On a rat model of aortic endothelium balloon-injury. Vascular 3H-TdR incorporation, MAPK activity, heme oxygenase (HO) activity and CO release were measured after treatment of ZnPP-9, an HO inhibitor, or heme-L-lysinate (HLL), an HO substrate. Results: Vascular 3H-TdR incorporation and MAPK activity were significantly increased on day 14 after endothelium balloon-injury while HO activity and CO release were up-regulated. The increased vascular 3H-TdR incorporation and MAPK activity after balloon-injury could be enhanced by pretreatment of ZnPP-9, whereas they could be inhibited by pretreatment of HLL. Conclusion: HO activity up-regulation in aorta was a protective response to balloon-injury; endogenous HO/CO system is involved in the regulation of cell proliferation during neointimal formation , and HO induction may become a new clinical approach to prevent cell proliferation in some vascular disease.
, http://www.100md.com
(J Beijing Med Univ, 1999,31:404-407)
再狭窄的主要病变是血管内膜受损部位出现内皮剥脱、内皮细胞再生、平滑肌细胞(smooth muscle cell, SMC)增殖和迁移并形成新内膜。细胞增殖和迁移的机制有待阐明。内源性一氧化碳(carbon monoxide, CO)是由血红素在加氧酶(hemeoxygen-
ase, HO)作用下降解产生的小分子气体,新近发现内源性CO在心血管系统有重要的生理和病理调节作用[1]。我们最近的工作表明,内源性HO/CO系统参与了血管内膜剥脱后血管壁增厚和新内膜形成[2]。然而内源性CO对新内膜中细胞增殖有无影响,以及对丝裂素活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号传递系统的影响,目前尚未见报道。本工作在大鼠主动脉内膜球囊剥脱模型上,观察血管3H-TdR掺入和MAPK活性改变以及与平滑肌HO活性和CO生成之间的相互关系,以探讨内源性HO/CO系统对血管壁细胞增殖及其MAPK活性调节的影响。
, http://www.100md.com
1 材料与方法
大鼠主动脉内膜球囊剥脱术[3]:选350~400 g雄性Wistar大鼠(北京医科大学动物中心提供)随机分为4组:对照组、剥脱组、HO抑制组、HO底物组。对照组为10只,其余3组为8只。剥脱组大鼠分离左颈总动脉,将改良的Forgarty球囊导管(2F)经此插入腹主动脉,充盈球囊后反复抽拉3次以剥脱主动脉内膜。后两组分别在剥脱术前给予ZnPP-9和HLL (均为45 μmol.kg-1.d-1, ip),1周后行剥脱术, 术后给药持续2周。对照组除不插入导管外,其余操作同剥脱组。
血管条3H-TdR掺入[4]:动物术后14 d,摘取胸主动脉约1 cm纵行切开后,置于1.5 ml RPMI 1640培养液中,加入5.6×104 Bq的3H-TdR,在通气条件O2与CO2体积比为9∶1, 37 ℃的恒温水浴振荡器上孵育24 h,冷PBS冲洗3次,甲酸消化后用液闪仪测定其放射强度。
, 百拇医药
MAPK活性测定[5]:将主动脉剪成碎块,加入冷提取液后匀浆,离心后取上清0.5 ml与5 μg特异性MAPK抗体于4 ℃共同孵育4 h,收集免疫复合物与预先吸附有抗鼠IgG的Agarose deads孵育30 min,沉淀下的蛋白再加入溶解液0.5 ml混匀,取其中150 μl与20 μl激酶缓冲液在25 ℃孵育25 min,取100 μl点于P81 Phosphocellulose滤纸(Whatman)上,在液闪仪上测定髓磷脂碱性蛋白中32P的掺入量,结果以每分每毫克蛋白掺入32P的pmol数表示。
主动脉平滑肌HO活性和CO释放量测定:主动脉去掉内膜和外层组织,平滑肌层用于以下HO活性和HbCO形成的测定。
HO活性测定采用Morita等[6]的方法稍加改良。主要步骤有,血管组织用5体积冷Tris/HCl(pH7.4)缓冲液匀浆,匀浆液过滤后离心两次(分别2 000 r.min-1, 20 min)以沉淀线粒体。上清液再离心(120 000 r.min-1, 90 min)分离微粒体。用100 mmol.L-1,pH7.4的焦磷酸钠去除血红蛋白后,用磷酸钾缓冲液制成微粒体悬浮液,其蛋白终浓度为40 g.L-1。取0.5 mg微粒体加于0.4 ml反应液中(含肝实质0.6 mg,NADP 0.8 mmol.L-1,6-磷酸葡萄糖,6-磷酸葡萄糖脱氢酶0.2 u),最后加入50 μl 0.25 mmol.L-1的血红素作底物。混匀后置暗室37 ℃孵育10 min, 用50 μl 100 g.L-1 HgCl2终止反应。在分光光度仪上(λ/464~530 nm)比色。HO活性用胆红素形成速率来表示。蛋白含量测定用考马斯亮蓝法。
, http://www.100md.com
HbCO生成测定采用Morita[7]等的方法加以改良。主动脉平滑肌剪成3 mm大小组织块在DMEM培养液中(每15 mg 组织加纯Hb 1 mg)孵育1 h (37 ℃, O2与 CO2体积比为9∶1)。用双波长分光光度仪比色测定培养液中HbCO生成量,单位以μmol.L-1表示。
统计学处理:结果用
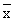 ±s表示。组间差异用方差分析q检验。
±s表示。组间差异用方差分析q检验。2 结果
2.1 ZnPP-9对大鼠主动脉内膜剥脱后血管壁细胞3H-TdR掺入和MAPK活性的影响(表1)
表1 各实验组血管3H-TdR掺入值和MAPK活性的变化(
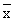 ±s)
±s), http://www.100md.com
Table 1 Changes of vascular 3H-TdR incorporation and MAPK activity in various experimental groups (
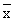 ±s) Group
±s) Groupn
f(3H-TdR incoor)
/min-1☆
MAPK activity
(pmol.min-1)☆
Control
, 百拇医药
10
2 089±265
2 295±564
Balloon alone
8
4 894±386**
5 492±378**
Balloon +ZnPP-9
8
6 589±478**##
7 643±498**##
, 百拇医药
Balloon+HLL
8
3 452±465**##
3 647±509**##
**P<0.01,compared with control; ##P<0.01,compared with balloon alone group; ☆ per mg protein. 无论是否加入ZnPP-9或HLL,球囊拉伤后血管3H-TdR掺入和MAPK活性均明显增加。拉伤加ZnPP-9组3H-TdR掺入值和MAPK活性分别比单独拉伤组增加34.6%和39.2%; 而拉伤加HLL组3H-TdR掺入值和MAPK活性比单独拉伤组分别减少29.45%和33.6%。
, 百拇医药
2.2 ZnPP-9和HLL对大鼠球囊拉伤主动脉平滑肌HO活性和HbCO生成的影响
与对照组比,单独拉伤组HO活性和HbCO生成分别增加2.1倍和2.6倍(均为P<0.01), 拉伤加ZnPP-9组HO活性和HbCO生成分别减少3.9倍和4.9倍, 而拉伤加HLL组HO活性和HbCO生成分别增加5.3倍和5.4倍。有趣的是,拉伤加ZnPP-9组的HO活性和HbCO生成比单独拉伤组分别减少11.7倍和20.4倍(均为P<0.01);而拉伤加HLL组的HO活性和HbCO生成分别比单独拉伤组增加143%和77%(均为P<0.01)。见表2所示。
表2 各实验组中血管平滑肌的HO活性和HbCO浓度(
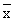 ±s)
±s)Table 2 HO activity and HbCO formation in aortic smooth muscle in experimental groups(
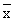 ±s) Group
±s) Group, http://www.100md.com
n
HO activity
(pmol. h-1)☆
c([HbCO])/
μmol.L-1
Control
10
408±26
6.05±0.43
Balloon alone
8
, http://www.100md.com
1 065±127**
21.78±3.86**
Balloon+ZnPP-9
8
84±12**##
1.02±0.23**##
Balloon+HLL
8
2 587±346**##
38.56±5.49**##
, 百拇医药
**P<0.01, compared with control; ##P<0.01, compared with balloon alone group; ☆ per mg protein.
3 讨论
在球囊拉伤大鼠主动脉内膜后,内皮细胞再生/平滑肌细胞的增殖和迁移可在内膜受损后24 h开始出现,以后逐渐加快,第2周可达到高峰,并形成明显增厚的新生内膜。本实验观察到,拉伤后2周血管壁细胞3H-TdR掺入明显增加,MAPK活性亦明显上调,同时发现内源性血管平滑肌HO活性和CO的生成释放明显增加。更另人感兴趣的是,应用HO抑制剂ZnPP-9抑制HO活性,继而减少CO的生成,能使血管壁细胞3H-TdR掺入和MAPK活性的增加比单独拉伤组更明显,表明ZnPP-9加重了血管壁细胞的增殖;而应用HO底物HLL则使内源性CO的生成释放明显增加,此时血管壁细胞的3H-TdR掺入和MAPK活性明显降低,即HO活性上调和CO产生增加可有效地抑制球囊拉伤所引起的细胞增殖。实验结果表明内源性HO/CO系统参与血管拉伤后细胞增殖的调节。
, 百拇医药
HO是一种蛋白酶,广泛存在于哺乳动物组织细胞微粒体中,它是血红素代谢过程中的限速酶,能降解胞浆中的血红素产生胆绿素(迅速还原成胆红素)、自由离子和CO。近来研究发现,细胞内源性CO在血管生物学功能调节中起着很重要的作用[8]。CO与另一个人们已熟知的血管功能调节分子——NO有许多相似之处,如两者都是小分子气体,都可由血管壁细胞浆中的相应底物在酶的作用下产生和释放,都能在胞浆中与可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC)结合并使之激活,继而使细胞浆cGMP水平上升[9]。目前已确定HO有两种形式:HO-1(诱导型)和HO-2(固有型),许多刺激因素均可使细胞内HO-1的活性上调,如血红素、细菌脂多糖等。ZnPP-9和ZnDPBG等重金属卟啉类化合物是HO的强抑制剂,这些抑制剂已被证实对HO-1和HO-2均有效。本实验用ZnPP-9能加重大鼠主动脉球囊剥脱术后血管新生内膜增厚的程度,这一效应与HO活性的抑制和CO的生成减少密切相关,推测内源性HO/CO系统可能直接参与血管壁细胞的增殖调节。
, http://www.100md.com
在本实验中,HO活性上调,继而CO的产生释放增加,可能是血管壁细胞对机械拉伤的一种应激性保护反应。一旦HO被抑制剂所阻断,CO的产生减少,则细胞的增殖反应加重;相反,应用HO底物增加内源性CO的产生,则细胞增殖受到抑制。这表明内源性CO的产生对细胞的增殖有明显的抑制作用,一旦这种抑制被阻断,细胞的增殖反应就加重。实验还发现,MAPK的活性变化与细胞的增殖反应相平行,提示这种作用通过细胞内MAPK信号传递途径所介导。已有报道内皮素和溶血磷脂等对平滑肌细胞的促增殖作用是通过MAPK途径介导的[10]。MAPK活性受许多因素的调节,包括其上游成分如MAP3K,MAP2K以及PKC和PKA等;内源性HO/CO系统引起MAPK活性改变的主要环节值得进一步研究。
注:国家自然科学基金(39730220)资助课题;
严丽梅 现在衡阳医学院;
☆ 自由词。
, 百拇医药
参考文献
1 Johnson RA, Lavesa M, Deseyn K, et al. Heme oxygenase substrates acutely lower blood pressure in hypertensive rats. Am J Physiol, 1996,271:H1132-H1138
2 Hesheng O, Lijia T, Jun Y, et al. Role of endogenous carbon monxide in neointimal formation induced by balloon-injury in rat aortic artery. Chin Med Sci J, 1999,14(1):41-45
3 Haudenschild CC, Schwartzman SM. Endothelial regeneration.II. Restituting of endothelial continuity. Lab Invest, 1979,41:407-418
, 百拇医药
4 Mcmurry HF, Parrot DP, Dowyer DE. A standard method of culturing aortic explants, suitable for the study of factors affecting the phenotype modulation, migration and proliferation of aortic smooth muscle cells. Atherosclerosis, 1991,86:227-236
5 李田昌,庞永政,苏静怡,等.丝裂素活化蛋白激酶活性测定.基础医学与临床, 1996,16(2):158-160
6 Morita T, Perrella MA, Lee ME, et al. Smooth muscle cell-derived carbon monoxide is a regulator of vascular cGMP. Proc Natl Acad Sci USA, 1995,92:1475-1479
, 百拇医药
7 Morita T, Kourembanas S. Endothelial cell expression of vasoconstrictors and growth factors is regulated by smooth muscle cell-derived carbon monoxide. J Clin Invest, 1995,96:2676-2682
8 Durante W, Christodoulides N, Cheng K, et al. cAMP induces heme oxygenase-1 gene expression and carbon monoxide production in vascular smooth muscle. Am J Physiol, 1997,273(1 Pt 2):H317-H323
9 Maines MD. Carbon monoxide and nitric oxide homology:differential modulation of heme oxygenases in brain and detection of protein and activity. Methods In Enzymology, 1996,268:473-488
10 Yamakawa T, Eguchi S, Yamakawa Y, et al. Lysophosphatidy-
line stimulates MAP kinase activity in rat vascular smooth muscle cells. Hypertension, 1998 ,31:248-253
(1998-08-27收稿), http://www.100md.com