8Gy全身辐射对小鼠小肠上皮内淋巴细胞数量及功能的影响
作者:徐辉 程天民 粟永萍 阎国和 林远 古德全
单位:(重庆,第三军医大学预防医学系 400038)
关键词:辐射;上皮内淋巴细胞;细胞增殖;细胞毒
中华放射医学与防护杂志980603 目的 探讨辐射损伤对粘膜免疫的影响。方法 小鼠全身照射8Gy后,分离培养小肠上皮内淋巴细胞,并对其数量、细胞增殖活力、细胞毒力、TNF-α和TGF-β分泌水平进行检测。结果 小肠上皮内淋巴细胞数量明显下降,增殖活力和细胞毒力明显受抑,都表现为伤后8小时下降,72小时达最低值。上皮内淋巴细胞分泌TNF-α和TGF-β显著增多,表现为伤后8小时增高,72小时达峰值。结论 小肠上皮内淋巴细胞数量减少和功能降低成为全身放射损伤时造成肠粘膜免疫屏障功能受损的一个重要原因。
Effects of 8Gy whole body irradiation on number and functions of small intestinal intraepithelial lymphocytes(IELs).
, 百拇医药
Xu Hui, Cheng Tianmin, Su Yongping, et al.Research Institute of Combined Injury, Faculty of Preventive Medicine, Third Military Medical University, Chongqing 400038, China.
Objective To explore the characteristics of intestinal mucosal immunity after radiation injury. Methods Number, proliferation activity, cytotoxicity of IEL as well as the TNF-α and TGF-β concentrations in supernatant of cultured IELs were studied using freshly isolated IELs from whole small intestine of Kunming strain mice whole-body irradiated with 8Gy60Co rays.Results The proliferation activity, cytotoxicity as well as the number of IELs in small intestinal mucosa were significantly decreased from 8h and reached the lowest level at 72h post-irradiation. The TNF-α and TGF-β concentrations in supernatant of cultured IELs isolated from irradiated mice elevated at 8h and reached the peak values at 72h.Conclusion The decrease in number and important functions of IELs might be one of the reasons which damage the intestinal mucosal immunity barrier after whole body irradiation.
, 百拇医药
Key words Radiation Intraepithelial lymphocytes Cell proliferation Cytotoxine
肠上皮内淋巴细胞(intraepithelial lymphocyte,简称IEL)是粘膜免疫系统中与肠腔内抗原发生最直接接触的免疫细胞,与肠上皮细胞之间存在相互的免疫生理调节,这使其在粘膜免疫中发挥着独特的作用[1]。包括放射损伤在内的多类损伤及粘膜疾病都能够造成肠粘膜结构的破坏,导致肠源性感染的发生。肠上皮干细胞及肠壁淋巴细胞本身都是辐射敏感细胞。在放射损伤时小肠粘膜免疫系统的IEL数量及功能状态的变化还不清楚。本实验以小鼠8Gy全身照射为模型,研究辐射对小肠IEL数量及功能的影响。
1 材料和方法
1.1 动物:昆明品系小鼠,雄性,体重20±5g,第三军医大学实验动物中心提供。
, http://www.100md.com
1.2 照射条件:60Coγ射线照射源,剂量率0.589Gy/min,8Gy一次性全身照射,自由进水食。照后8,24,48,72小时,7天和15天共6个时相点进行观察。
1.3 试剂:Percoll购自Pharmacia公司,PMA和ConA购自Sigma公司,anti-CD3购自宝灵曼公司。
1.4 小肠粘膜IEL计数[2]:HE染色的小肠横截面在光镜下观察,计数整个横截面绒毛及隐窝上皮细胞数,同时计数其间的IEL数,取百分比,即IEL/100个肠上皮细胞。
1.5 小肠上皮内淋巴细胞的分离:参照Mosley法[3]并加以改进,主要分三个步骤进行,即分离肠组织、分离粘膜上皮层细胞、分离肠上皮细胞层中的IEL。由此分离正常小鼠全小肠IEL,RPMI 1640培养液调细胞浓度为2×106/ml。
, 百拇医药
1.6 IEL增殖功能测定[4]:取2×106/ml IEL 100μl加入96孔平底培养板内,三复孔,加入PMA 5ng复合重组白介素-2(rIL-2)2 500U/ml刺激培养,每孔总体积200μl。在37℃5%CO2孵箱内培养72小时,培养结束前18小时每孔加入37kBq(1μCi)3H -TdR,对照组不加刺激物。用多头细胞样品收集器将细胞收集到49号玻璃纤维滤膜上,80℃烤干30分钟,放入闪烁瓶,加5ml闪烁液,稳定过夜后,用液闪仪测样品计数(.min-1)。闪烁液配方为1 000ml二甲苯中含2,5-二苯基恶唑(PPO)4g、1,4-双-[5-苯基恶唑-2]苯(POPOP)0.1g。结果以每孔每分钟计数(.min-1)表示IEL受刺激后的增殖活力。
1.7 IEL细胞毒功能测定[5]:各组分离的IEL调整到2×106/ml加入Anti-CD3(1μg/ml)诱导培养48小时,96孔平底培养板每孔加靶细胞100μl(含Raji细胞1×104个/孔),按效靶比(10~50)∶1的比例加100μl IEL细胞悬液,三复孔。加完将培养板放在37℃ 5%CO2培养箱中孵育4.5小时,最大释放孔加入100μl含2%Triton X-100的培养基,自发释放孔加入100μl培养基代替。为保证实验结果的准确性,对每一效应细胞浓度都设有自发释放对照组。反应结束后,培养板在250g 离心10分钟将细胞沉淀,每孔吸上清100μl转入另一96孔板中,采用LDH测定来反映细胞毒力,LDH试剂盒购自宝灵曼公司,按说明操作。按下列公式计算特异释放率:
, 百拇医药
1.8 IEL培养上清中TNF-α和TGF-β含量的测定:同时收集(PMA5ng+rIL-2 2 500U/ml)刺激培养后72小时的培养上清,离心后装入EP管,作好标记,封口胶封口,-70℃冰箱保存,用于细胞因子检测。
TNF-α含量测定采用ELISA试剂盒(军事医学科学院产品),按说明进行。TGF-β含量的检测采用CCL-64细胞生长抑制法[6]。
1.9 统计学分析:所有数据均以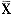 ±s表示,以t检验进行统计学处理。
±s表示,以t检验进行统计学处理。
2 结果
2.1 辐射对小肠粘膜IEL数量的影响
8Gy全身辐射后小鼠小肠粘膜IEL计数呈明显的下降趋势(见附图)。照后8小时即下降,72小时达最低值,为正常对照值的41.18%(P<0.01),IEL计数在观察的15天内呈持续下降状态。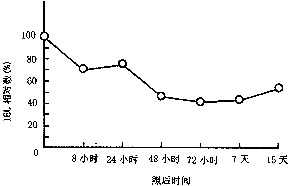
, http://www.100md.com
附图 8Gy全身照射小鼠小肠
粘膜IEL数量的变化
2.2 辐射对小肠IEL增殖活力、细胞毒力及TNF-α和TGF-β分泌的影响
辐射后小肠IEL增殖活力及细胞毒力受到明显抑制,表现为伤后8小时下降,72小时达最低值,持续到伤后15天仍未恢复正常。IEL自身分泌TNF-α和TGF-β却有增高趋势,表现为伤后8小时升高,72小时达峰值,持续增高到伤后15天仍未恢复正常的变化趋势(见附表)。
附表 8Gy全身照射小鼠小肠IEL功能变化的动态观察(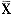 ±s) 照后时间
±s) 照后时间
(h)
增殖活力
, http://www.100md.com
计数
(.min-1)
细胞毒力
(杀伤活性百
分比,%)
培养上清
TNF-α
(ng/ml)
培养上清
TGF-β
(ng/ml)
对照
, http://www.100md.com
36.308±3.353
46.85±7.61
0.97±0.16
0.68±0.19
8
28.806±1.016*
32.98±6.98
2.74±0.38**
1.30±0.49*
24
26.164±1.355**
, http://www.100md.com
21.71±9.43**
3.04±0.48**
1.96±0.35**
48
16.257±2.267**
22.66±10.08**
4.32±0.36**
2.45±0.47**
72
7.685±0.746**
, 百拇医药
13.48±8.54**
6.54±0.29**
3.22±0.61**
7d
24.842±1.375*
18.47±10.47**
5.04±0.85**
3.04±0.42**
15d
28.255±1.393*
, 百拇医药
24.24±9.04**
4.27±0.69**
2.21±0.34**
注:与正常对照值相比 *P<0.05; **P<0.01
3 讨论
本实验小鼠受8Gy全身照射后的全身状况、外周血细胞变化和肠粘膜病变等方面,均表明符合所预想的重度骨髓型放射病伤情。肠道不仅是消化器官,同时又是淋巴细胞含量最多的脏器。肠上皮细胞和淋巴细胞均为辐射敏感细胞。IEL来源于骨髓造血干细胞和小肠集合淋巴集结(Peyer's patches,简称PP)的淋巴细胞前体[7],肠粘膜内IEL数量减少,是由来源减少和上皮层内破坏两方面因素所引起的。
, http://www.100md.com
IEL具有两方面的功能,一是受多种刺激后发生增殖并引发细胞因子的分泌,通过细胞因子起作用;二是通过其自身的细胞毒性作用保护粘膜免受病原菌的侵害[8]。目前尚未见到整体照射对IEL功能影响的研究报道。淋巴细胞的增殖能力是其功能的重要表现形式,T细胞受有丝分裂原、细菌抗原等刺激发生增殖反应,并分化为效应细胞的过程多伴随着细胞因子的分泌。IEL的细胞毒作用是其抗感染的重要手段之一。细胞毒性功能的下降会导致IEL对抗外来细菌、病毒和抗原入侵的能力下降[9]。本实验发现,8Gy全身辐射引起IEL增殖活力和细胞毒力的明显下降,都表现出照后8小时下降,到72小时达最低值,随后呈缓慢回升的过程。表明射线抑制IEL增殖和细胞毒力。
T细胞在增殖过程中能够分泌多种细胞因子,这些细胞因子是T细胞免疫生理调节功能得以实施的物质基础。射线损伤引起IEL细胞因子分泌的改变,必然会影响到粘膜免疫状态以及对肠上皮细胞的生理调节功能。本实验观察到小鼠8Gy全身辐射引起小肠IEL培养上清中TNF-α和TGF-β因子分泌增多,以伤后72小时为高峰,持续到15天尚未恢复。同时我们还提取了8Gy照射后8小时和72小时分离的IEL总RNA用斑点杂交发现其TNF-α和TGF-β2mRNA表达明显增高,说明IEL培养上清中TNF-α和TGF-β含量增高是有分子基础的,表现在蛋白质转录和翻译水平都有增高(未发表资料)。IEL能够分泌多种细胞因子,包括IL-2、IL-3、IL-5、IL-6、GM-CSF、IFN-γ、TNF-α和TGF-β等,这些细胞因子可以起多种作用,归结为两个方面:第一作用于粘膜免疫系统,刺激淋巴细胞的增殖并指导B细胞的分化,尤其是sIgA的合成和装配;第二作用于肠上皮细胞,调节其增殖和分化以及MHC-II的表达,并能够影响肠上皮细胞的生理特性以及吸收、转运功能 [10,11]。TGF-β刺激肠上皮细胞分泌IL-6,IL-6是吸引淋巴细胞向上皮层移居的趋化因子[12],由此推测放射损伤后IEL培养上清中TGF-β增多可能是一种自身的补偿作用,借以吸引淋巴细胞向上皮层移居,以补偿射线造成的IEL减少。
, 百拇医药
全身照射所致细胞功能改变,主要是射线对细胞直接和间接作用的结果。射线是通过哪些途径影响IEL的增殖和细胞毒力,目前尚无研究报道。射线的电离作用造成细胞DNA合成受抑是可能的原因之一,另外射线造成的T细胞膜表面活性分子表达的改变也是引起增殖受抑的可能因素[13]。
全身辐射损伤后IEL数量的减少以及增殖活力、细胞毒力受抑,必然会导致肠上皮IEL整体功能的削弱,从而成为肠道粘膜免疫屏障功能削弱的重要原因之一。
本课题受全军“九五”指令性攻关课题资助
参考文献
1 McGowan I,Anthony C,Graham-Radford S, et al. Advances in mucosal immunology. Gastroenterol Clin North Am, 1997, 26:145.
, 百拇医药
2 Ferguson A, Murray D.Quantitation of intraepithelial lymphocytes in human jejunum.Gut, 1971, 12:988.
3 Mosley RL, Klein JR. A rapid method for isolating murine intestinal intraepithelial lymphocytes with high yield and purity. J Immunol Methods, 1992, 156:19.
4 Viney JL, MacDonald TT. Lymphokine secretion and proliferaton of intraepithelial lymphocytes from murine small intestine. Immunology, 1992, 77:19.
, http://www.100md.com
5 Guy-Grand D, Malassis-Seris M, Briottet C, et al. Cytotoxic differentiation of mouse gut thymodependent and independent intraepithelial T lymphocytes is induced locally. Correlation between functional assays presence of perforin and granzyme transcripts and cytoplasmic granules. J Exp Med, 1991, 173:1549.
6 虞冠华,许祥裕,丁树标.转化生长因子-β的测定.上海免疫学杂志,1995,12:116.
7 Peter BE, Befus AD, Bienenstock J. Leukocytes in the intestinal epithelium:an unusual immunological compartment. Immunol Today, 1986, 7:50.
, 百拇医药
8 Goodman T, LeFrancois L. Intraepithelial lymphocytes:anatomical site, not T cell receptor form, dictates phenotype and function. J Exp Med, 1989, 170:1569.
9 Evans CM, Phillips AD, Walker-Smith JA, et al. Activation of lamina propria T cells induces crypt epithelial proliferation and goblet cell depletion in cultured human fetal colon. Gut, 1992, 33:230.
10 Janeway CA Jr, Jones B, Hayday A.Specificity and function of T cells bearing γ δ recptors. Immunol Today, 1988, 9:73.
, 百拇医药
11 Taguchi T,Aicher WK, Fujihashi K, et al. Novel function for intraepithelial lymphocytes:murine CD3+、 γ δ TCR T cells produce IFN-γ and IL-5. J Immunol, 1991, 147:3736.
12 McGee DW, Beagley KW, Aicher WK, et al. Transforming growth factor- β and IL-1 β act in synergy to enhance IL-6 secretion by the intestinal epithelial cell line IEC-6. J Immunol, 1993, 151:970.
13 闵锐,程天民,罗成基,等.电离辐射对人T淋巴细胞TCR、CD3、CD18及CD25表达的影响.第二军医大学学报,1994,15:417.
(收稿:1998-02-25 修回:1998-04-27), 百拇医药
单位:(重庆,第三军医大学预防医学系 400038)
关键词:辐射;上皮内淋巴细胞;细胞增殖;细胞毒
中华放射医学与防护杂志980603 目的 探讨辐射损伤对粘膜免疫的影响。方法 小鼠全身照射8Gy后,分离培养小肠上皮内淋巴细胞,并对其数量、细胞增殖活力、细胞毒力、TNF-α和TGF-β分泌水平进行检测。结果 小肠上皮内淋巴细胞数量明显下降,增殖活力和细胞毒力明显受抑,都表现为伤后8小时下降,72小时达最低值。上皮内淋巴细胞分泌TNF-α和TGF-β显著增多,表现为伤后8小时增高,72小时达峰值。结论 小肠上皮内淋巴细胞数量减少和功能降低成为全身放射损伤时造成肠粘膜免疫屏障功能受损的一个重要原因。
Effects of 8Gy whole body irradiation on number and functions of small intestinal intraepithelial lymphocytes(IELs).
, 百拇医药
Xu Hui, Cheng Tianmin, Su Yongping, et al.Research Institute of Combined Injury, Faculty of Preventive Medicine, Third Military Medical University, Chongqing 400038, China.
Objective To explore the characteristics of intestinal mucosal immunity after radiation injury. Methods Number, proliferation activity, cytotoxicity of IEL as well as the TNF-α and TGF-β concentrations in supernatant of cultured IELs were studied using freshly isolated IELs from whole small intestine of Kunming strain mice whole-body irradiated with 8Gy60Co rays.Results The proliferation activity, cytotoxicity as well as the number of IELs in small intestinal mucosa were significantly decreased from 8h and reached the lowest level at 72h post-irradiation. The TNF-α and TGF-β concentrations in supernatant of cultured IELs isolated from irradiated mice elevated at 8h and reached the peak values at 72h.Conclusion The decrease in number and important functions of IELs might be one of the reasons which damage the intestinal mucosal immunity barrier after whole body irradiation.
, 百拇医药
Key words Radiation Intraepithelial lymphocytes Cell proliferation Cytotoxine
肠上皮内淋巴细胞(intraepithelial lymphocyte,简称IEL)是粘膜免疫系统中与肠腔内抗原发生最直接接触的免疫细胞,与肠上皮细胞之间存在相互的免疫生理调节,这使其在粘膜免疫中发挥着独特的作用[1]。包括放射损伤在内的多类损伤及粘膜疾病都能够造成肠粘膜结构的破坏,导致肠源性感染的发生。肠上皮干细胞及肠壁淋巴细胞本身都是辐射敏感细胞。在放射损伤时小肠粘膜免疫系统的IEL数量及功能状态的变化还不清楚。本实验以小鼠8Gy全身照射为模型,研究辐射对小肠IEL数量及功能的影响。
1 材料和方法
1.1 动物:昆明品系小鼠,雄性,体重20±5g,第三军医大学实验动物中心提供。
, http://www.100md.com
1.2 照射条件:60Coγ射线照射源,剂量率0.589Gy/min,8Gy一次性全身照射,自由进水食。照后8,24,48,72小时,7天和15天共6个时相点进行观察。
1.3 试剂:Percoll购自Pharmacia公司,PMA和ConA购自Sigma公司,anti-CD3购自宝灵曼公司。
1.4 小肠粘膜IEL计数[2]:HE染色的小肠横截面在光镜下观察,计数整个横截面绒毛及隐窝上皮细胞数,同时计数其间的IEL数,取百分比,即IEL/100个肠上皮细胞。
1.5 小肠上皮内淋巴细胞的分离:参照Mosley法[3]并加以改进,主要分三个步骤进行,即分离肠组织、分离粘膜上皮层细胞、分离肠上皮细胞层中的IEL。由此分离正常小鼠全小肠IEL,RPMI 1640培养液调细胞浓度为2×106/ml。
, 百拇医药
1.6 IEL增殖功能测定[4]:取2×106/ml IEL 100μl加入96孔平底培养板内,三复孔,加入PMA 5ng复合重组白介素-2(rIL-2)2 500U/ml刺激培养,每孔总体积200μl。在37℃5%CO2孵箱内培养72小时,培养结束前18小时每孔加入37kBq(1μCi)3H -TdR,对照组不加刺激物。用多头细胞样品收集器将细胞收集到49号玻璃纤维滤膜上,80℃烤干30分钟,放入闪烁瓶,加5ml闪烁液,稳定过夜后,用液闪仪测样品计数(.min-1)。闪烁液配方为1 000ml二甲苯中含2,5-二苯基恶唑(PPO)4g、1,4-双-[5-苯基恶唑-2]苯(POPOP)0.1g。结果以每孔每分钟计数(.min-1)表示IEL受刺激后的增殖活力。
1.7 IEL细胞毒功能测定[5]:各组分离的IEL调整到2×106/ml加入Anti-CD3(1μg/ml)诱导培养48小时,96孔平底培养板每孔加靶细胞100μl(含Raji细胞1×104个/孔),按效靶比(10~50)∶1的比例加100μl IEL细胞悬液,三复孔。加完将培养板放在37℃ 5%CO2培养箱中孵育4.5小时,最大释放孔加入100μl含2%Triton X-100的培养基,自发释放孔加入100μl培养基代替。为保证实验结果的准确性,对每一效应细胞浓度都设有自发释放对照组。反应结束后,培养板在250g 离心10分钟将细胞沉淀,每孔吸上清100μl转入另一96孔板中,采用LDH测定来反映细胞毒力,LDH试剂盒购自宝灵曼公司,按说明操作。按下列公式计算特异释放率:

, 百拇医药
1.8 IEL培养上清中TNF-α和TGF-β含量的测定:同时收集(PMA5ng+rIL-2 2 500U/ml)刺激培养后72小时的培养上清,离心后装入EP管,作好标记,封口胶封口,-70℃冰箱保存,用于细胞因子检测。
TNF-α含量测定采用ELISA试剂盒(军事医学科学院产品),按说明进行。TGF-β含量的检测采用CCL-64细胞生长抑制法[6]。
1.9 统计学分析:所有数据均以
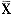 ±s表示,以t检验进行统计学处理。
±s表示,以t检验进行统计学处理。2 结果
2.1 辐射对小肠粘膜IEL数量的影响
8Gy全身辐射后小鼠小肠粘膜IEL计数呈明显的下降趋势(见附图)。照后8小时即下降,72小时达最低值,为正常对照值的41.18%(P<0.01),IEL计数在观察的15天内呈持续下降状态。

, http://www.100md.com
附图 8Gy全身照射小鼠小肠
粘膜IEL数量的变化
2.2 辐射对小肠IEL增殖活力、细胞毒力及TNF-α和TGF-β分泌的影响
辐射后小肠IEL增殖活力及细胞毒力受到明显抑制,表现为伤后8小时下降,72小时达最低值,持续到伤后15天仍未恢复正常。IEL自身分泌TNF-α和TGF-β却有增高趋势,表现为伤后8小时升高,72小时达峰值,持续增高到伤后15天仍未恢复正常的变化趋势(见附表)。
附表 8Gy全身照射小鼠小肠IEL功能变化的动态观察(
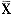 ±s) 照后时间
±s) 照后时间(h)
增殖活力
, http://www.100md.com
计数
(.min-1)
细胞毒力
(杀伤活性百
分比,%)
培养上清
TNF-α
(ng/ml)
培养上清
TGF-β
(ng/ml)
对照
, http://www.100md.com
36.308±3.353
46.85±7.61
0.97±0.16
0.68±0.19
8
28.806±1.016*
32.98±6.98
2.74±0.38**
1.30±0.49*
24
26.164±1.355**
, http://www.100md.com
21.71±9.43**
3.04±0.48**
1.96±0.35**
48
16.257±2.267**
22.66±10.08**
4.32±0.36**
2.45±0.47**
72
7.685±0.746**
, 百拇医药
13.48±8.54**
6.54±0.29**
3.22±0.61**
7d
24.842±1.375*
18.47±10.47**
5.04±0.85**
3.04±0.42**
15d
28.255±1.393*
, 百拇医药
24.24±9.04**
4.27±0.69**
2.21±0.34**
注:与正常对照值相比 *P<0.05; **P<0.01
3 讨论
本实验小鼠受8Gy全身照射后的全身状况、外周血细胞变化和肠粘膜病变等方面,均表明符合所预想的重度骨髓型放射病伤情。肠道不仅是消化器官,同时又是淋巴细胞含量最多的脏器。肠上皮细胞和淋巴细胞均为辐射敏感细胞。IEL来源于骨髓造血干细胞和小肠集合淋巴集结(Peyer's patches,简称PP)的淋巴细胞前体[7],肠粘膜内IEL数量减少,是由来源减少和上皮层内破坏两方面因素所引起的。
, http://www.100md.com
IEL具有两方面的功能,一是受多种刺激后发生增殖并引发细胞因子的分泌,通过细胞因子起作用;二是通过其自身的细胞毒性作用保护粘膜免受病原菌的侵害[8]。目前尚未见到整体照射对IEL功能影响的研究报道。淋巴细胞的增殖能力是其功能的重要表现形式,T细胞受有丝分裂原、细菌抗原等刺激发生增殖反应,并分化为效应细胞的过程多伴随着细胞因子的分泌。IEL的细胞毒作用是其抗感染的重要手段之一。细胞毒性功能的下降会导致IEL对抗外来细菌、病毒和抗原入侵的能力下降[9]。本实验发现,8Gy全身辐射引起IEL增殖活力和细胞毒力的明显下降,都表现出照后8小时下降,到72小时达最低值,随后呈缓慢回升的过程。表明射线抑制IEL增殖和细胞毒力。
T细胞在增殖过程中能够分泌多种细胞因子,这些细胞因子是T细胞免疫生理调节功能得以实施的物质基础。射线损伤引起IEL细胞因子分泌的改变,必然会影响到粘膜免疫状态以及对肠上皮细胞的生理调节功能。本实验观察到小鼠8Gy全身辐射引起小肠IEL培养上清中TNF-α和TGF-β因子分泌增多,以伤后72小时为高峰,持续到15天尚未恢复。同时我们还提取了8Gy照射后8小时和72小时分离的IEL总RNA用斑点杂交发现其TNF-α和TGF-β2mRNA表达明显增高,说明IEL培养上清中TNF-α和TGF-β含量增高是有分子基础的,表现在蛋白质转录和翻译水平都有增高(未发表资料)。IEL能够分泌多种细胞因子,包括IL-2、IL-3、IL-5、IL-6、GM-CSF、IFN-γ、TNF-α和TGF-β等,这些细胞因子可以起多种作用,归结为两个方面:第一作用于粘膜免疫系统,刺激淋巴细胞的增殖并指导B细胞的分化,尤其是sIgA的合成和装配;第二作用于肠上皮细胞,调节其增殖和分化以及MHC-II的表达,并能够影响肠上皮细胞的生理特性以及吸收、转运功能 [10,11]。TGF-β刺激肠上皮细胞分泌IL-6,IL-6是吸引淋巴细胞向上皮层移居的趋化因子[12],由此推测放射损伤后IEL培养上清中TGF-β增多可能是一种自身的补偿作用,借以吸引淋巴细胞向上皮层移居,以补偿射线造成的IEL减少。
, 百拇医药
全身照射所致细胞功能改变,主要是射线对细胞直接和间接作用的结果。射线是通过哪些途径影响IEL的增殖和细胞毒力,目前尚无研究报道。射线的电离作用造成细胞DNA合成受抑是可能的原因之一,另外射线造成的T细胞膜表面活性分子表达的改变也是引起增殖受抑的可能因素[13]。
全身辐射损伤后IEL数量的减少以及增殖活力、细胞毒力受抑,必然会导致肠上皮IEL整体功能的削弱,从而成为肠道粘膜免疫屏障功能削弱的重要原因之一。
本课题受全军“九五”指令性攻关课题资助
参考文献
1 McGowan I,Anthony C,Graham-Radford S, et al. Advances in mucosal immunology. Gastroenterol Clin North Am, 1997, 26:145.
, 百拇医药
2 Ferguson A, Murray D.Quantitation of intraepithelial lymphocytes in human jejunum.Gut, 1971, 12:988.
3 Mosley RL, Klein JR. A rapid method for isolating murine intestinal intraepithelial lymphocytes with high yield and purity. J Immunol Methods, 1992, 156:19.
4 Viney JL, MacDonald TT. Lymphokine secretion and proliferaton of intraepithelial lymphocytes from murine small intestine. Immunology, 1992, 77:19.
, http://www.100md.com
5 Guy-Grand D, Malassis-Seris M, Briottet C, et al. Cytotoxic differentiation of mouse gut thymodependent and independent intraepithelial T lymphocytes is induced locally. Correlation between functional assays presence of perforin and granzyme transcripts and cytoplasmic granules. J Exp Med, 1991, 173:1549.
6 虞冠华,许祥裕,丁树标.转化生长因子-β的测定.上海免疫学杂志,1995,12:116.
7 Peter BE, Befus AD, Bienenstock J. Leukocytes in the intestinal epithelium:an unusual immunological compartment. Immunol Today, 1986, 7:50.
, 百拇医药
8 Goodman T, LeFrancois L. Intraepithelial lymphocytes:anatomical site, not T cell receptor form, dictates phenotype and function. J Exp Med, 1989, 170:1569.
9 Evans CM, Phillips AD, Walker-Smith JA, et al. Activation of lamina propria T cells induces crypt epithelial proliferation and goblet cell depletion in cultured human fetal colon. Gut, 1992, 33:230.
10 Janeway CA Jr, Jones B, Hayday A.Specificity and function of T cells bearing γ δ recptors. Immunol Today, 1988, 9:73.
, 百拇医药
11 Taguchi T,Aicher WK, Fujihashi K, et al. Novel function for intraepithelial lymphocytes:murine CD3+、 γ δ TCR T cells produce IFN-γ and IL-5. J Immunol, 1991, 147:3736.
12 McGee DW, Beagley KW, Aicher WK, et al. Transforming growth factor- β and IL-1 β act in synergy to enhance IL-6 secretion by the intestinal epithelial cell line IEC-6. J Immunol, 1993, 151:970.
13 闵锐,程天民,罗成基,等.电离辐射对人T淋巴细胞TCR、CD3、CD18及CD25表达的影响.第二军医大学学报,1994,15:417.
(收稿:1998-02-25 修回:1998-04-27), 百拇医药