内皮素的表达与鼠肺纤维化的关系
作者:夏书月 李振华 佟振月 侯显明 于润江 姜彦多
单位:夏书月:沈阳医学院附属中心医院呼吸内科(沈阳 110024) 李振华 佟振月 侯显明 于润江:中国医科大学呼吸疾病研究所 姜彦多:解放军第二○二医院病理科
关键词:博莱霉素类;肺纤维化;内皮缩血管肽类;免疫组织化学;放射免疫测定
内皮素的表达与鼠肺纤维化的关系 摘要 目的:动态观察肺纤维化大鼠的内皮素合成和分布,了解ET与肺纤维化发生发展的关系。方法:采用放射免疫法和SP免疫组织化学方法,观察博莱霉素(BLM)组(n=25)和对照组(n=25)在用药后1、 3、 7、 14、 28 d时血浆ET浓度及肺组织ET的合成和分布情况。结果:BLM组大鼠血浆ET含量明显高于正常对照组(P
Relationship between endothelin expression and pulmonary fibrosis of rats
XIA Shu-Yue, LI Zhen-Hua, JIANG Yan-Duo, TONG Zhen-Yue,HOU Xian-Ming, YU Run-Jiang
Department of Respiratory Disease , Center Hospital Affiliated to Shenyang Medical College , Shenyang (110024)
Abstract AIM: To study the synthesis and distribution of endothelin(ET) of pulmonary fibrosis model in rat. METHODS: Rats were divided into two groups(n=25 each):control group(received saline)and fibrosis group (received 0.2~0.3 mL bleomycin),and were killed after 1,3,7,14,28 days.The plasma ET level in the rat was measured by radioimmunoassay and ET expression in the lung tissue was observed by immunohistochemistry.RESULTS: The concentration of plasma ET were significantly higher in the pulmonary fibrosis rat model than in control animals (P<0.01),ET expression was mostly localized within airway epithelium and inflammatory cells contrasted with normal rats in which there were little or no ET staining.CONCLUSION:ET may be closely related to the pathogenesis of pulmonary fibrosis.
, 百拇医药
MeSH Bleomycins; Pulmonary fibrosis; Endothelins;Immunohistochemistry; Radioimmunoassay
肺间质纤维化是一组发病机理不清、病因未明的弥漫性间质性肺疾病。目前的观点倾向于细胞因子网络相互作用在肺纤维化发病机理中起着重要作用。内皮素(endothelin, ET)作为一种强烈的缩血管,缩支气管和促增殖的活性肽是一种重要的细胞因子,在肺间质纤维化的发病机理中可能起到一定作用,有关ET对肺纤维化发生发展作用的研究报道不多。本文研究博莱霉素致鼠肺纤维化形成过程中,ET的合成规律及分布情况,以期为探明肺纤维化的发病机理,提供一些参考依据。
材料和方法
一、动物模型的复制
取体重180~250 g的Wistar雌性大鼠50只,随机分为博莱霉素(bleomycin, BLM)组25只和对照组25只,BLM组用硫喷妥钠(2 mg/kg体重)腹腔注射麻醉大鼠,在无菌操作下作颈部正中切口,暴露气管,经穿刺向气管内注入0.2~0.3 mL含BLM (5 mg/kg) (日本Kayaku公司)的生理盐水,注后立即将动物直立并旋转,使药液在肺内均匀分布。对照组在同样条件下,向气管内注入等体积的生理盐水。两组动物同步于气管灌注后的第1、 3、 7、 14、 28 d分别随机处死5只。
, http://www.100md.com
二、方法:
1.免疫组织化学染色:硫喷妥钠(2 mg/kg体重)腹腔注射麻醉后,从心脏放血,处死大鼠,无菌术开胸,摘除左肺,经主支气管向肺内注入10%中性福尔马林,结扎主支气管后置于10%中性福尔马林固定,沿肺门至胸膜行最大切面取材,常规制成5 μm厚石蜡切片。
采用链菌素-亲生物素过氧化物酶法(streptavidin-peroxidase, SP法),SP试剂盒为美国Zymed公司产品,所用特异抗体为兔抗ET-1多克隆抗体(美国Peninsula Lab公司产品)。染色具体步骤同文献[1]。
2.ET含量测定:每组5只大鼠由心脏取血约2 mL,置于10% EDTA-2Na 3 μL和400IU(40μL)抑肽酶的试管中混匀,4 ℃ 3 000 r/min离心10 min,分离血浆-70 ℃保存。采用放射免疫直接测定法测定。
, 百拇医药
3.结果判断:以细胞呈清晰棕色为阳性,按文献方法[2]将染色结果分为0~4级:0级阴性,1级灶状阳性,2级弥漫性弱阳性,3级弥漫性中等阳性,4级弥漫性强阳性。
三、统计处理:数据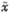 ±s表示,作t检验。
±s表示,作t检验。
结 果
一、肉眼观察:
对照组:动物双肺淡红色,表面光滑。BLM组:动物双肺暗红色,有斑点或斑片状实变灶弥漫分布,第14 d、 28 d处死的动物,肺表面有索条状凹沟,部分肺切面见小囊形成。
二、病理组织学所见:
, http://www.100md.com
与文献报道相似[3],对照组肺组织结构正常。BLM组第1 d和第3 d可见肺泡间隔轻度水肿。第7 d可见肺泡间隔仍明显水肿增厚,伴以少量巨噬细胞和淋巴细胞为主的细胞浸润,间质内开始出现成纤维细胞,肺泡腔内有巨噬细胞。第14 d可见肺泡壁有较多的淋巴细胞。巨噬细胞,伴有较多的成纤维细胞增生、肺泡壁增厚、基质明显增多,可见胶原纤维积聚。第28 d可见肺泡壁显著增厚,部分肺泡结构破坏,肺泡腔消失,由胶原纤维、纤维细胞及淋巴细胞占据。另外,从第3 d开始至第28 d均可见局灶性Ⅱ型肺泡上皮增生,变成立方样,有的呈腺腔样结构。
三、免疫组化:
1.对照组:从1~28 d,ET-1在支气管粘膜上皮、血管内皮及周围间质均有表达,为灶状阳性。第7 d起间质炎性细胞及肺泡上皮有表达,为灶状阳性,肺泡腔巨噬细胞无表达。
2.BLM组:(1)支气管粘膜上皮:从第1 d起,ET-1表达为灶状阳性,以后逐渐增强,到14~28 d,表达为弥漫性强阳性,与对照组比P<0.01;(2)血管内皮及周围间质:1~28 d,ET表达为灶状阳性,第14 d起偶有弥漫性弱阳性。与对照组比P>0.05,无显著差异。(3)间质炎性细胞:早期ET表达为灶状阳性或弥漫性弱阳性,到14~28 d ET-1表达为弥漫性强阳性P<0.01;(4)肺泡:肺泡上皮细胞早期表达,第14 d起,ET-1表达为灶状阳性,偶有弥漫性弱阳性P>0.05。肺泡腔巨噬细胞,ET-1表达从1~28 d,均为弥漫性弱阳性,与对照组比P>0.05,无显著差异,见表1。
, http://www.100md.com
表1 BLM组ET-1表达水平
Tab 1 Expression of ET-1 in BLM-induced pulmonary fibrosis of rats(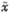 ±s, n=25)
±s, n=25)
Bronchial epithelium
Inflammatory cells
Blood vessels
Alveolar epithelium
Control
, 百拇医药
BLM
Control
BLM
Control
BLM
Control
BLM
1d
0.6±0.5
1.2±0.4
0.2±0.4
0.6±0.5
0.2±0.4
, 百拇医药
0.6±0.5
0
0
3d
0.6±0.5
2.4±0.8**
0.2±0.4
0.6±0.5
0.2±0.4
0.6±0.5
0
0
7d
, 百拇医药
0.8±0.4
2.0±0.0**
0.2±0.4
1.2±0.4*
0.8±0.4
0.6±0.5
0.2±0.4
0.8±0.4
14d
0.8±0.4
3.0±0.6**
0.4±0.5
, 百拇医药
3.4±0.5**
0.8±0.4
0.6±0.5
0.2±0.4
0.6±0.5
28
0.8±0.4
3.0±0.9
0.6±0.5
3.2±0.9**
0.8±0.4
0.8±0.4
, 百拇医药
0.4±0.5
0.8±0.7
* P<0.05,**P<0.01,vs control
四、ET含量放射免疫测定:
BLM组大鼠血浆ET含量(3~28 d)明显高于正常对照组P<0.01,如表2。 表2 大鼠血浆ET水平
Tab 2 Levels of plasm ET-1 in rats(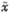 ±s,n=5)
±s,n=5)
Group
, 百拇医药
Levels of ET(pg/L)
Control
94.60±11.80
BLM
1d
108.56±20.90
3d
165.69±15.50**
7d
116.59±8.28
14d
, http://www.100md.com
138.19±7.00*
28d
194.19±29.43**
** P<0.01, vs control 讨 论
用博莱霉素制作肺纤维化动物模型是一种普遍采用的致肺间质纤维化的方法,其病理组织学与生理学改变与人肺纤维化近似[3]。从本研究可见,注药后1~7 d,肺泡炎明显,第7 d开始出现肺纤维化,至第28 d肺纤维化已成为主要病变,并有肺泡上皮细胞增生。表明本组动物模型是成功的[3,4]。
ET不仅具有强大而持久的缩血管作用,而且还可成倍提高对平滑肌细胞和成纤维细胞的促有丝分裂作用,导致平滑肌细胞、成纤维细胞和内皮细胞DNA合成,加速细胞增殖,并促进成纤维细胞合成Ⅰ和Ⅲ型胶原分解。
, 百拇医药
我们的实验结果显示:在大鼠肺泡炎期(3~7 d),移行期(7~14 d)和纤维化期(14~28 d),血浆ET含量明显高于正常对照组,尤其在3天和28天出现两个高峰,推测ET可能参与肺纤维化的渗出和增生过程,在其过程中有一些促使其合成及释放增加的理化因素存在,并协同促进肺纤维化的形成,可见ET-1也是一个强有力的促增殖因子,对肺纤维化的发生发展起着不可替代的作用。
Koracs[5]和Batlistini等[6]研究表明作为致炎性细胞因子(IL-1、TNF-α)和致纤维化细胞因子(TGF-β、PDGF)均促进ET的合成及释放增加,并协同刺激成纤维细胞增殖导致肺纤维化。此外低氧血症可诱导ET表达增强,分泌增加。可见,ET的合成及释放增加与致炎细胞因子和促增殖因子及低氧血症作用是分不开的。
ET与其他增殖因子的协同作用可能是ET与这些物质在作用途径上相互影响的结果。一些研究结果表明,某些增殖因子的部分促细胞增生作用可能是通过调节ET合成和释放完成的。而ET对某些增殖因子的合成也有促进作用。EGF、 TGF-α、 TGF-β、基质结合型成纤维细胞生长因子(FGFb)、 PDGF可分别增加ET合成和释放1.5~6.7倍。
, http://www.100md.com
血中ET-1增加可能源于其合成增加,清除减少或两者兼而有之。本实验还通过免疫组织化学染色发现,正常大鼠肺组织ET样免疫物质极少,而灌注BLM大鼠的支气管上皮、炎性细胞肺泡炎期(1~7 d)有较多ET样物质,ET表达增强。到纤维化期(14~28 d),支气管上皮、炎性细胞有大量ET样物质,ET表达明显增强。表明肺纤维化过程中支气管、炎性细胞、上皮细胞合成ET增加,导致肺组织局部ET含量增多。我们还观察到内皮细胞有极少ET样物质,与以往报道IPF病人的肺组织免疫组化染色结果有差异[7],目前对此种现象还不甚清楚。 本实验研究表明,血浆及肺组织局部ET浓度增高源于ET合成及其释放增加,增加的ET刺激成纤维细胞增殖,导致细胞外基质沉积,促使肺纤维化形成。
参考文献
1 姜彦多,何安光,夏书月,等.肺癌nm23基因产物/核苷二磷酸激酶表达的研究.中华结核和呼吸杂志,1995, 18:209.
, 百拇医药
2 Papk SH,Shaleh D,Giaid A,et al.Increased endothelin-1 bleomycin -induced pulmonary fibrosis and the effect of an endothelin receptor antagonist.Am J Respir Crit Care Med,1997,156:600.
3 Adamson IYR, Bowden DH.The pathogenesis of bleomycin- induced pulmonary fibrosis in mice.Am J Pathol,1974,77:185.
4 Khalil N,Connor RNO,Flanders KC,et al.TGF-β 1,but not TGT-β 2 or TGF-β 3,is differentially pulesent in epithelial cell of advanced pulmonary fibrosis :an immunohistochemical study. Am J Respir Cell Mol Biol, 1996,14:1 315.
, http://www.100md.com
5 Kovacs EJ, Dipietro LA. Fibrogenic cytokines and connective tissue production.FASEB J, 1994,8:854.
6 Battistini B, Chailler P, Dorleans-Juste P,et al.Growth regulatory properties of endothelins.Peptides,1993,14:385.
7 Giaid A,Michel KP,Slewart DJ,et al.Expression of endothelin-1 in lungs of patients with cryptogenic firbosing alveolitis. Lancet, 1993,341:1550.
(1998年3月5日收稿,1998年12月22日修回), 百拇医药
单位:夏书月:沈阳医学院附属中心医院呼吸内科(沈阳 110024) 李振华 佟振月 侯显明 于润江:中国医科大学呼吸疾病研究所 姜彦多:解放军第二○二医院病理科
关键词:博莱霉素类;肺纤维化;内皮缩血管肽类;免疫组织化学;放射免疫测定
内皮素的表达与鼠肺纤维化的关系 摘要 目的:动态观察肺纤维化大鼠的内皮素合成和分布,了解ET与肺纤维化发生发展的关系。方法:采用放射免疫法和SP免疫组织化学方法,观察博莱霉素(BLM)组(n=25)和对照组(n=25)在用药后1、 3、 7、 14、 28 d时血浆ET浓度及肺组织ET的合成和分布情况。结果:BLM组大鼠血浆ET含量明显高于正常对照组(P
Relationship between endothelin expression and pulmonary fibrosis of rats
XIA Shu-Yue, LI Zhen-Hua, JIANG Yan-Duo, TONG Zhen-Yue,HOU Xian-Ming, YU Run-Jiang
Department of Respiratory Disease , Center Hospital Affiliated to Shenyang Medical College , Shenyang (110024)
Abstract AIM: To study the synthesis and distribution of endothelin(ET) of pulmonary fibrosis model in rat. METHODS: Rats were divided into two groups(n=25 each):control group(received saline)and fibrosis group (received 0.2~0.3 mL bleomycin),and were killed after 1,3,7,14,28 days.The plasma ET level in the rat was measured by radioimmunoassay and ET expression in the lung tissue was observed by immunohistochemistry.RESULTS: The concentration of plasma ET were significantly higher in the pulmonary fibrosis rat model than in control animals (P<0.01),ET expression was mostly localized within airway epithelium and inflammatory cells contrasted with normal rats in which there were little or no ET staining.CONCLUSION:ET may be closely related to the pathogenesis of pulmonary fibrosis.
, 百拇医药
MeSH Bleomycins; Pulmonary fibrosis; Endothelins;Immunohistochemistry; Radioimmunoassay
肺间质纤维化是一组发病机理不清、病因未明的弥漫性间质性肺疾病。目前的观点倾向于细胞因子网络相互作用在肺纤维化发病机理中起着重要作用。内皮素(endothelin, ET)作为一种强烈的缩血管,缩支气管和促增殖的活性肽是一种重要的细胞因子,在肺间质纤维化的发病机理中可能起到一定作用,有关ET对肺纤维化发生发展作用的研究报道不多。本文研究博莱霉素致鼠肺纤维化形成过程中,ET的合成规律及分布情况,以期为探明肺纤维化的发病机理,提供一些参考依据。
材料和方法
一、动物模型的复制
取体重180~250 g的Wistar雌性大鼠50只,随机分为博莱霉素(bleomycin, BLM)组25只和对照组25只,BLM组用硫喷妥钠(2 mg/kg体重)腹腔注射麻醉大鼠,在无菌操作下作颈部正中切口,暴露气管,经穿刺向气管内注入0.2~0.3 mL含BLM (5 mg/kg) (日本Kayaku公司)的生理盐水,注后立即将动物直立并旋转,使药液在肺内均匀分布。对照组在同样条件下,向气管内注入等体积的生理盐水。两组动物同步于气管灌注后的第1、 3、 7、 14、 28 d分别随机处死5只。
, http://www.100md.com
二、方法:
1.免疫组织化学染色:硫喷妥钠(2 mg/kg体重)腹腔注射麻醉后,从心脏放血,处死大鼠,无菌术开胸,摘除左肺,经主支气管向肺内注入10%中性福尔马林,结扎主支气管后置于10%中性福尔马林固定,沿肺门至胸膜行最大切面取材,常规制成5 μm厚石蜡切片。
采用链菌素-亲生物素过氧化物酶法(streptavidin-peroxidase, SP法),SP试剂盒为美国Zymed公司产品,所用特异抗体为兔抗ET-1多克隆抗体(美国Peninsula Lab公司产品)。染色具体步骤同文献[1]。
2.ET含量测定:每组5只大鼠由心脏取血约2 mL,置于10% EDTA-2Na 3 μL和400IU(40μL)抑肽酶的试管中混匀,4 ℃ 3 000 r/min离心10 min,分离血浆-70 ℃保存。采用放射免疫直接测定法测定。
, 百拇医药
3.结果判断:以细胞呈清晰棕色为阳性,按文献方法[2]将染色结果分为0~4级:0级阴性,1级灶状阳性,2级弥漫性弱阳性,3级弥漫性中等阳性,4级弥漫性强阳性。
三、统计处理:数据
结 果
一、肉眼观察:
对照组:动物双肺淡红色,表面光滑。BLM组:动物双肺暗红色,有斑点或斑片状实变灶弥漫分布,第14 d、 28 d处死的动物,肺表面有索条状凹沟,部分肺切面见小囊形成。
二、病理组织学所见:
, http://www.100md.com
与文献报道相似[3],对照组肺组织结构正常。BLM组第1 d和第3 d可见肺泡间隔轻度水肿。第7 d可见肺泡间隔仍明显水肿增厚,伴以少量巨噬细胞和淋巴细胞为主的细胞浸润,间质内开始出现成纤维细胞,肺泡腔内有巨噬细胞。第14 d可见肺泡壁有较多的淋巴细胞。巨噬细胞,伴有较多的成纤维细胞增生、肺泡壁增厚、基质明显增多,可见胶原纤维积聚。第28 d可见肺泡壁显著增厚,部分肺泡结构破坏,肺泡腔消失,由胶原纤维、纤维细胞及淋巴细胞占据。另外,从第3 d开始至第28 d均可见局灶性Ⅱ型肺泡上皮增生,变成立方样,有的呈腺腔样结构。
三、免疫组化:
1.对照组:从1~28 d,ET-1在支气管粘膜上皮、血管内皮及周围间质均有表达,为灶状阳性。第7 d起间质炎性细胞及肺泡上皮有表达,为灶状阳性,肺泡腔巨噬细胞无表达。
2.BLM组:(1)支气管粘膜上皮:从第1 d起,ET-1表达为灶状阳性,以后逐渐增强,到14~28 d,表达为弥漫性强阳性,与对照组比P<0.01;(2)血管内皮及周围间质:1~28 d,ET表达为灶状阳性,第14 d起偶有弥漫性弱阳性。与对照组比P>0.05,无显著差异。(3)间质炎性细胞:早期ET表达为灶状阳性或弥漫性弱阳性,到14~28 d ET-1表达为弥漫性强阳性P<0.01;(4)肺泡:肺泡上皮细胞早期表达,第14 d起,ET-1表达为灶状阳性,偶有弥漫性弱阳性P>0.05。肺泡腔巨噬细胞,ET-1表达从1~28 d,均为弥漫性弱阳性,与对照组比P>0.05,无显著差异,见表1。
, http://www.100md.com
表1 BLM组ET-1表达水平
Tab 1 Expression of ET-1 in BLM-induced pulmonary fibrosis of rats(
Bronchial epithelium
Inflammatory cells
Blood vessels
Alveolar epithelium
Control
, 百拇医药
BLM
Control
BLM
Control
BLM
Control
BLM
1d
0.6±0.5
1.2±0.4
0.2±0.4
0.6±0.5
0.2±0.4
, 百拇医药
0.6±0.5
0
0
3d
0.6±0.5
2.4±0.8**
0.2±0.4
0.6±0.5
0.2±0.4
0.6±0.5
0
0
7d
, 百拇医药
0.8±0.4
2.0±0.0**
0.2±0.4
1.2±0.4*
0.8±0.4
0.6±0.5
0.2±0.4
0.8±0.4
14d
0.8±0.4
3.0±0.6**
0.4±0.5
, 百拇医药
3.4±0.5**
0.8±0.4
0.6±0.5
0.2±0.4
0.6±0.5
28
0.8±0.4
3.0±0.9
0.6±0.5
3.2±0.9**
0.8±0.4
0.8±0.4
, 百拇医药
0.4±0.5
0.8±0.7
* P<0.05,**P<0.01,vs control
四、ET含量放射免疫测定:
BLM组大鼠血浆ET含量(3~28 d)明显高于正常对照组P<0.01,如表2。 表2 大鼠血浆ET水平
Tab 2 Levels of plasm ET-1 in rats(
Group
, 百拇医药
Levels of ET(pg/L)
Control
94.60±11.80
BLM
1d
108.56±20.90
3d
165.69±15.50**
7d
116.59±8.28
14d
, http://www.100md.com
138.19±7.00*
28d
194.19±29.43**
** P<0.01, vs control 讨 论
用博莱霉素制作肺纤维化动物模型是一种普遍采用的致肺间质纤维化的方法,其病理组织学与生理学改变与人肺纤维化近似[3]。从本研究可见,注药后1~7 d,肺泡炎明显,第7 d开始出现肺纤维化,至第28 d肺纤维化已成为主要病变,并有肺泡上皮细胞增生。表明本组动物模型是成功的[3,4]。
ET不仅具有强大而持久的缩血管作用,而且还可成倍提高对平滑肌细胞和成纤维细胞的促有丝分裂作用,导致平滑肌细胞、成纤维细胞和内皮细胞DNA合成,加速细胞增殖,并促进成纤维细胞合成Ⅰ和Ⅲ型胶原分解。
, 百拇医药
我们的实验结果显示:在大鼠肺泡炎期(3~7 d),移行期(7~14 d)和纤维化期(14~28 d),血浆ET含量明显高于正常对照组,尤其在3天和28天出现两个高峰,推测ET可能参与肺纤维化的渗出和增生过程,在其过程中有一些促使其合成及释放增加的理化因素存在,并协同促进肺纤维化的形成,可见ET-1也是一个强有力的促增殖因子,对肺纤维化的发生发展起着不可替代的作用。
Koracs[5]和Batlistini等[6]研究表明作为致炎性细胞因子(IL-1、TNF-α)和致纤维化细胞因子(TGF-β、PDGF)均促进ET的合成及释放增加,并协同刺激成纤维细胞增殖导致肺纤维化。此外低氧血症可诱导ET表达增强,分泌增加。可见,ET的合成及释放增加与致炎细胞因子和促增殖因子及低氧血症作用是分不开的。
ET与其他增殖因子的协同作用可能是ET与这些物质在作用途径上相互影响的结果。一些研究结果表明,某些增殖因子的部分促细胞增生作用可能是通过调节ET合成和释放完成的。而ET对某些增殖因子的合成也有促进作用。EGF、 TGF-α、 TGF-β、基质结合型成纤维细胞生长因子(FGFb)、 PDGF可分别增加ET合成和释放1.5~6.7倍。
, http://www.100md.com
血中ET-1增加可能源于其合成增加,清除减少或两者兼而有之。本实验还通过免疫组织化学染色发现,正常大鼠肺组织ET样免疫物质极少,而灌注BLM大鼠的支气管上皮、炎性细胞肺泡炎期(1~7 d)有较多ET样物质,ET表达增强。到纤维化期(14~28 d),支气管上皮、炎性细胞有大量ET样物质,ET表达明显增强。表明肺纤维化过程中支气管、炎性细胞、上皮细胞合成ET增加,导致肺组织局部ET含量增多。我们还观察到内皮细胞有极少ET样物质,与以往报道IPF病人的肺组织免疫组化染色结果有差异[7],目前对此种现象还不甚清楚。 本实验研究表明,血浆及肺组织局部ET浓度增高源于ET合成及其释放增加,增加的ET刺激成纤维细胞增殖,导致细胞外基质沉积,促使肺纤维化形成。
参考文献
1 姜彦多,何安光,夏书月,等.肺癌nm23基因产物/核苷二磷酸激酶表达的研究.中华结核和呼吸杂志,1995, 18:209.
, 百拇医药
2 Papk SH,Shaleh D,Giaid A,et al.Increased endothelin-1 bleomycin -induced pulmonary fibrosis and the effect of an endothelin receptor antagonist.Am J Respir Crit Care Med,1997,156:600.
3 Adamson IYR, Bowden DH.The pathogenesis of bleomycin- induced pulmonary fibrosis in mice.Am J Pathol,1974,77:185.
4 Khalil N,Connor RNO,Flanders KC,et al.TGF-β 1,but not TGT-β 2 or TGF-β 3,is differentially pulesent in epithelial cell of advanced pulmonary fibrosis :an immunohistochemical study. Am J Respir Cell Mol Biol, 1996,14:1 315.
, http://www.100md.com
5 Kovacs EJ, Dipietro LA. Fibrogenic cytokines and connective tissue production.FASEB J, 1994,8:854.
6 Battistini B, Chailler P, Dorleans-Juste P,et al.Growth regulatory properties of endothelins.Peptides,1993,14:385.
7 Giaid A,Michel KP,Slewart DJ,et al.Expression of endothelin-1 in lungs of patients with cryptogenic firbosing alveolitis. Lancet, 1993,341:1550.
(1998年3月5日收稿,1998年12月22日修回), 百拇医药