毛细管区带电泳法测定三磷酸腺苷制剂含量
作者:康鲁平 尹茶 慈薇 刘荔荔 柴逸峰 吴玉田
单位:
关键词:毛细管区带电泳;三磷酸腺苷;二磷酸腺苷;一磷酸腺苷
第二军医大学学报000831 [中图分类号] R 917 [文献标识码] B
[文章编号] 0258-879X(2000)08-0794-02
三磷酸腺苷(ATP)为辅酶类药物,是机体能量的重要来源,临床上用于肌萎缩、脑溢血后遗症等多种疾病的治疗。ATP制剂在生产和贮存过程中易带进或产生二磷酸腺苷(ADP)、一磷酸腺苷(AMP),因而目前卫生部部颁及地方标准中多采用纸层析或纸电泳分离ATP后分光光度法测定。该法繁琐费时,且只能测定ATP含量。近年有用HPLC法测定的报道[1],但其仅对ATP进行了定量分析。Shao等[2]曾用毛细管电泳法(CE)分析生物体内ATP,ADP,AMP等核苷酸。本实验采用毛细管区带电泳法(CZE),以对氨基苯磺酸钠为内标(IS),同时分析ATP制剂中ATP,ADP,AMP含量,方法简便,结果准确。
, http://www.100md.com
1 材料和方法
1.1 仪器和试药 自动毛细管电泳仪 Capillary Ion Analyzer(美国Waters 公司)。熔融石英毛细管40 cm× 75 μm(河北永年光导纤维厂),有效长度33 cm,未涂渍。一磷酸腺苷钠(AMP,Sigma公司),二磷酸腺苷钠(ADP,中国科学院上海生物化学研究所东风生化技术公司),三磷酸腺苷钠(ATP,上海伯奥生物科技公司),对氨基苯磺酸钠(上海试剂三厂),三磷酸腺苷二钠注射液(江苏江化制药厂,20 mg/2 ml,批号97012511,97090511),注射用三磷酸腺苷二钠(粉针剂,上海第一生化药业公司上海生物化学制药厂,20 mg,批号9901191),水为重蒸水, 所有试剂均为分析纯。
1.2 电泳条件 柱温20℃;运行电压12 kV;虹吸法进样,高度差10 cm,5 s;检测波长214 nm;灵敏度0.01 AUFS。运行缓冲液:50 mmol/L磷酸盐缓冲液,0.1 mol/L NaOH 调节 pH为9.0,0.45 μm微孔滤膜过滤。两次进样之间用1 mol/L NaOH、双蒸水及运行缓冲液各冲洗3 min。
, http://www.100md.com
1.3 标准贮备液制备 精确称取ATP,ADP,AMP及对氨基苯磺酸钠对照品253.5,57.4,50.0,279.6 mg,分别以水定容于50 ml容量瓶,则各标准贮备液质量浓度依次为5.07,1.15,1.00,5.59 g/L。ATP易分解,应即用即配。
2 结 果
2.1 标准曲线 精确吸取ATP标准贮备液0.25,0.50,1.00,2.00,3.00,4.00,5.00 ml,ADP标准贮备液0.50,1.00,1.50,2.00,2.50,3.50,4.50 ml,AMP标准贮备液0.50,1.00,1.50,2.00,2.50,3.00,3.50 ml,置于25 ml容量瓶内,分别加入内标液2.00 ml,加水至刻度,摇匀。以校正峰面积[(A′=(A待测.tIS)/(AIS.t待测)]对对照品浓度绘制标准曲线。结果见表1。
, http://www.100md.com
2.2 精密度 在本文1.2所述电泳条件下,取一对照品溶液连续进样4次,计算校正峰面积的RSD,结果见表1。
2.3 加样回收率 向已知含量样品中加入适当对照品,连续进样5次,测定含量,计算加样回收率,结果见表2。
2.4 样品测定 精密称取样品适量(相当于ATP 20 mg),置于25 ml容量瓶,加入内标标准液2 ml,加水至刻度,摇匀,测定含量,结果见表3和图1。
表 1 标准曲线特征参数(n=7) 成 分
线性范围
(ρB/mg.L-1)
回归方程
, http://www.100md.com
r
RSD(%)
ATP
50.7~1 014
Y=0.023+
0.995 5
2.90
5.29×10-4X
ADP
22.9~206.6
Y=-0.030+
0.998 8
, 百拇医药
2.87
2.16×10-3X
AMP
20~140
Y=0.003+
0.990 6
1.67
1.75×10-3X
Y:校正峰面积; X:待测组分浓度表 2 ATP,ADP和AMP的加样回收率(n=5) 成 分
加入浓度(ρB/mg*L-1)
, http://www.100md.com
测得浓度
(ρB/mg*L-1)
回收率(%)
RSD(%)
ATP
202.80
202.1±1.5
99.64±0.74
0.737 8
ADP
45.92
46.49±1.19
, http://www.100md.com
101.3±2.6
2.558
AMP
5.00
4.960±0.062
99.21±1.24
1.251
表 3 样品分析结果(n=3) 样 品
AMP(m/mg)
ADP
(m/mg)
ATP
, 百拇医药
(m/mg)
含量
(%)
97012511
0.52
4.01
19.79
98.93
(20 mg/2 ml)
97090511
0.39
3.26
22.39
, 百拇医药
111.9
(20 mg/2 ml)
9901191
0.48
1.50
23.18
115.9
(20 mg)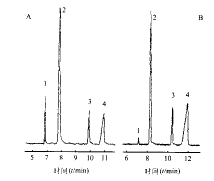
图 1 标准品(A)和样品(B)的毛细管电泳图谱
1:AMP; 2:IS; 3: ADP; 4: ATP
, 百拇医药
3 讨 论
在CZE法中,缓冲溶液pH值及浓度对选择性的影响最为突出[3]。本研究中待测的3组分均为酸性,在碱性条件下可解离而带负电荷。
本研究考察了pH 6.2~10.6 时的分离情况,发现各组分在此范围内皆可分离,但pH值较低时峰形前延或拖尾现象严重,pH>8.6时峰形对称。另外,也考察了25~100 mmol/L磷酸盐缓冲液的分离情况,发现缓冲液浓度提高,组分出峰顺序改变,峰形改善,迁移时间延长,焦耳热增多。经筛选确定分离条件为pH=9.0的50 mmol/L磷酸盐缓冲液。因为样品溶液中多种添加剂的影响,导致样品与标准品出峰时间有所差别。
[参 考 文 献]
[1] 李治洪,刘克江. 高效液相色谱法测定ATP制剂含量[J]. 药物分析杂志, 1997, 17(4):245-247.
[2] Shao XW,O′Neill K, Zhao ZX, et al. Analysis of nucleotide pools in human lymphoma cells by capillary electrophoresis[J]. J Chromatogr A, 1994,680(2):463-468.
[3] 林炳承 主编. 毛细管电泳导论[M]. 北京:科学出版社, 1996. 87-92.
[收稿日期] 2000-01-10
[修回日期] 2000-05-31, http://www.100md.com
单位:
关键词:毛细管区带电泳;三磷酸腺苷;二磷酸腺苷;一磷酸腺苷
第二军医大学学报000831 [中图分类号] R 917 [文献标识码] B
[文章编号] 0258-879X(2000)08-0794-02
三磷酸腺苷(ATP)为辅酶类药物,是机体能量的重要来源,临床上用于肌萎缩、脑溢血后遗症等多种疾病的治疗。ATP制剂在生产和贮存过程中易带进或产生二磷酸腺苷(ADP)、一磷酸腺苷(AMP),因而目前卫生部部颁及地方标准中多采用纸层析或纸电泳分离ATP后分光光度法测定。该法繁琐费时,且只能测定ATP含量。近年有用HPLC法测定的报道[1],但其仅对ATP进行了定量分析。Shao等[2]曾用毛细管电泳法(CE)分析生物体内ATP,ADP,AMP等核苷酸。本实验采用毛细管区带电泳法(CZE),以对氨基苯磺酸钠为内标(IS),同时分析ATP制剂中ATP,ADP,AMP含量,方法简便,结果准确。
, http://www.100md.com
1 材料和方法
1.1 仪器和试药 自动毛细管电泳仪 Capillary Ion Analyzer(美国Waters 公司)。熔融石英毛细管40 cm× 75 μm(河北永年光导纤维厂),有效长度33 cm,未涂渍。一磷酸腺苷钠(AMP,Sigma公司),二磷酸腺苷钠(ADP,中国科学院上海生物化学研究所东风生化技术公司),三磷酸腺苷钠(ATP,上海伯奥生物科技公司),对氨基苯磺酸钠(上海试剂三厂),三磷酸腺苷二钠注射液(江苏江化制药厂,20 mg/2 ml,批号97012511,97090511),注射用三磷酸腺苷二钠(粉针剂,上海第一生化药业公司上海生物化学制药厂,20 mg,批号9901191),水为重蒸水, 所有试剂均为分析纯。
1.2 电泳条件 柱温20℃;运行电压12 kV;虹吸法进样,高度差10 cm,5 s;检测波长214 nm;灵敏度0.01 AUFS。运行缓冲液:50 mmol/L磷酸盐缓冲液,0.1 mol/L NaOH 调节 pH为9.0,0.45 μm微孔滤膜过滤。两次进样之间用1 mol/L NaOH、双蒸水及运行缓冲液各冲洗3 min。
, http://www.100md.com
1.3 标准贮备液制备 精确称取ATP,ADP,AMP及对氨基苯磺酸钠对照品253.5,57.4,50.0,279.6 mg,分别以水定容于50 ml容量瓶,则各标准贮备液质量浓度依次为5.07,1.15,1.00,5.59 g/L。ATP易分解,应即用即配。
2 结 果
2.1 标准曲线 精确吸取ATP标准贮备液0.25,0.50,1.00,2.00,3.00,4.00,5.00 ml,ADP标准贮备液0.50,1.00,1.50,2.00,2.50,3.50,4.50 ml,AMP标准贮备液0.50,1.00,1.50,2.00,2.50,3.00,3.50 ml,置于25 ml容量瓶内,分别加入内标液2.00 ml,加水至刻度,摇匀。以校正峰面积[(A′=(A待测.tIS)/(AIS.t待测)]对对照品浓度绘制标准曲线。结果见表1。
, http://www.100md.com
2.2 精密度 在本文1.2所述电泳条件下,取一对照品溶液连续进样4次,计算校正峰面积的RSD,结果见表1。
2.3 加样回收率 向已知含量样品中加入适当对照品,连续进样5次,测定含量,计算加样回收率,结果见表2。
2.4 样品测定 精密称取样品适量(相当于ATP 20 mg),置于25 ml容量瓶,加入内标标准液2 ml,加水至刻度,摇匀,测定含量,结果见表3和图1。
表 1 标准曲线特征参数(n=7) 成 分
线性范围
(ρB/mg.L-1)
回归方程
, http://www.100md.com
r
RSD(%)
ATP
50.7~1 014
Y=0.023+
0.995 5
2.90
5.29×10-4X
ADP
22.9~206.6
Y=-0.030+
0.998 8
, 百拇医药
2.87
2.16×10-3X
AMP
20~140
Y=0.003+
0.990 6
1.67
1.75×10-3X
Y:校正峰面积; X:待测组分浓度表 2 ATP,ADP和AMP的加样回收率(n=5) 成 分
加入浓度(ρB/mg*L-1)
, http://www.100md.com
测得浓度
(ρB/mg*L-1)
回收率(%)
RSD(%)
ATP
202.80
202.1±1.5
99.64±0.74
0.737 8
ADP
45.92
46.49±1.19
, http://www.100md.com
101.3±2.6
2.558
AMP
5.00
4.960±0.062
99.21±1.24
1.251
表 3 样品分析结果(n=3) 样 品
AMP(m/mg)
ADP
(m/mg)
ATP
, 百拇医药
(m/mg)
含量
(%)
97012511
0.52
4.01
19.79
98.93
(20 mg/2 ml)
97090511
0.39
3.26
22.39
, 百拇医药
111.9
(20 mg/2 ml)
9901191
0.48
1.50
23.18
115.9
(20 mg)

图 1 标准品(A)和样品(B)的毛细管电泳图谱
1:AMP; 2:IS; 3: ADP; 4: ATP
, 百拇医药
3 讨 论
在CZE法中,缓冲溶液pH值及浓度对选择性的影响最为突出[3]。本研究中待测的3组分均为酸性,在碱性条件下可解离而带负电荷。
本研究考察了pH 6.2~10.6 时的分离情况,发现各组分在此范围内皆可分离,但pH值较低时峰形前延或拖尾现象严重,pH>8.6时峰形对称。另外,也考察了25~100 mmol/L磷酸盐缓冲液的分离情况,发现缓冲液浓度提高,组分出峰顺序改变,峰形改善,迁移时间延长,焦耳热增多。经筛选确定分离条件为pH=9.0的50 mmol/L磷酸盐缓冲液。因为样品溶液中多种添加剂的影响,导致样品与标准品出峰时间有所差别。
[参 考 文 献]
[1] 李治洪,刘克江. 高效液相色谱法测定ATP制剂含量[J]. 药物分析杂志, 1997, 17(4):245-247.
[2] Shao XW,O′Neill K, Zhao ZX, et al. Analysis of nucleotide pools in human lymphoma cells by capillary electrophoresis[J]. J Chromatogr A, 1994,680(2):463-468.
[3] 林炳承 主编. 毛细管电泳导论[M]. 北京:科学出版社, 1996. 87-92.
[收稿日期] 2000-01-10
[修回日期] 2000-05-31, http://www.100md.com