高血压病人微循环缺血区与血管内皮细胞损伤的关系高效微生态饲料添加剂作用及在动物饲养过程中的应用
作者:郭渝成 曾祖荫 雷 鸣 张志高 张碧霞 陈 敏
单位: 550009 贵阳解放军44医院
关键词:高血压病;微循环缺血区;血管内皮细胞
中国微循环990214 【摘要】 目的 检测65例非胰岛素依赖型糖尿病(NIDDM)患者中性粒细胞(PMN)膜流动性(MF)的改变,探讨这种改变与年龄、病程、BMI、FBG、PBG、TG、TC、WBC、RBC、PLT、GPI的相关关系。方法 65例无酮症及感染的NIDDM患者,30例性别、年龄、BMI相匹配的正常人为对照,以DPH为探针测定其PMN的荧光偏振值(ρ),并计算相应的细胞膜流动性、膜脂各向异性及微粘度,对PMN ρ值的影响因素进行分析。结果 1 NIDDM患者的PMN ρ值显著高于对照组(P<0.01),PMN MF明显低于对照组(P<0.05),PMN膜脂各向异性及微粘度均显著升高(P<0.01)。2 PMN MF 与FBG、PBG呈负相关(r=-0.3417,r=-0.3237,P<0.05),与GPI相关性显著(r=-0.3913,P<0.05),与年龄、病程、BMI、WBC、RBC 、PLT、TG、TC无相无性。结论 NIDDM患者PMN的MF下降,显示DM患者PMN膜的物理性质有明显改变;PMN MF下降与血糖升高、血清蛋白糖化程度增加有关。
, http://www.100md.com
细胞膜是细胞功能的重要调节器,细胞膜流动性(membrane fluidity,MF)是其重要的生物物理特性。MF受膜的成份及多种因素的影响,许多疾病发生发展过程中表现出细胞膜流动性的改变[1~3]。Ⅱ型糖尿病患者胰岛素受体的敏感性下降,白细胞的吞噬、趋化功能降低,变形能力下降及并发症的发生均与白细胞膜物理特性改变有关[4~6]。此方面的研究报道少,结论不一。本文应用荧光偏振法以DPH做探针,检测了65例NIDDM患者中性粒细胞(PMN)MF,并对年龄、病程、体重指数(BMI)、血糖、血清糖化蛋白指数(GPI)、血脂水平对PMN、MF的影响进行探讨。
材料与方法
1 65例NIDDM患者,符合1985年世界卫生组织(WHO)糖尿病诊断标准,确诊为NIDDM。男40例,女25例。平均年龄64.87±9.45岁。病程6月至26年。体重指数23.8±3.5kg/m2。部分患者采用控制饮食、口服降糖药及胰岛素注射等治疗方法。同时期健康体检者30例为对照组,年龄、性别、BMI具有可比性。
, 百拇医药
2 空腹静脉血1.5ml肝素抗凝查血脂(酶法),3ml肝素抗凝测定GPI[7],1.5ml EDTA-2Na抗凝血测定常规及分离PMN用于测定荧光偏振值。上述标本均于取血后6小时内完成测定。空腹血糖(FBG),餐后血糖(PBG)用德国宝灵曼公司快速血糖测定仪测定。
3 1.5mlEDTA-2Na抗凝血分离PMN[8],DPH标记,悬浮在2ml1640培养液中,PMN的分离与标记要求无菌操作,用岛津RF-540型荧光光度计测定ρ值,激发波长360nm,发射波长430nm,37℃恒温。荧 光偏振值即ρ值=Ivv-GIvh/Ivv+GIvh,Ivv为起偏器及检偏器光轴均垂直时荧光值;Ivh则为起偏器光轴垂直,检偏器光轴水平时荧光值,G=Ihv/Ihh,Ihv与Ihh为起偏器光轴水平,检偏器光轴分别为垂直和水平时的荧光值,由ρ值根据公式可计算出膜的流动性LFU=[ρ max/(ρr-l)]/ρ r,ρ max为0.5,ρ r为ρ的实测值,各向异性γ=2ρ/(3-ρ),微粘度 η=2ρ/(0.46-ρ)。
, http://www.100md.com
5 统计学处理:数据用均数±标准差表示,数据处理采用SAS统计程序,进行t或t检验、方差分析、方差齐性检验及直线相关分析。
结 果
1 NIDDM患者的PMN荧光偏振值,显著高于对照组(P<0.01),PMN MF 显著低于对照组(P<0.05),PMN膜脂各向异性及微粘度均显著高于对照组(P<0.01),显示DM 患者PMN膜的物理性质有明显改变。见表1
表1 NIDDM患者与对照组白细胞物理特性比较(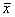 ±s) 项 目
±s) 项 目
对 照 组
NIDDM组
P值
, 百拇医药
例 数
荧光偏振值
微粘度
各向异性
流动性
30
0.3092±0.0292
4.3198±1.2221
0.2300±0.0241
2.1132±0.7940
65
0.3341±0.0331
, 百拇医药
5.7118±1.6816
0.2509±0.0274
1.6273±0.9498
<0.01
<0.01
<0.01
<0.05
2 NIDDM患者按空腹血糖水平分成三组,Ⅰ组FBG≤7.8mmol/L,Ⅱ组7.8mmol/L11.1mmol/L;PMN ρ值与空腹血糖水平呈正相关(r=0.3417,Ρ<0.05)。血糖水平控制良好者PMN ρ值低于血糖水平控制较差者而与对照组的PMN ρ值无显著差异,P>0.05,说明血糖水平对PMN的MF影响甚大。见表2。表2 不同血糖水平NIDDM患者荧光偏振值比较(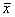 ±s) 组 别
±s) 组 别
, http://www.100md.com
例数
荧光偏振值
比 较 组
P值
对照组
Ⅰ组
Ⅱ组
Ⅲ组
30
25
25
15
0.3092±0.0292
, 百拇医药
0.3174±0.0332
0.3365±0.0170
0.3571±0.0339
Ⅰ:对照组
Ⅰ:Ⅱ组
Ⅱ:对照组
Ⅱ:Ⅲ组
Ⅰ:Ⅲ组
Ⅲ:对照组
>0.05
<0.01
<0.01
, http://www.100md.com
<0.01
<0.01
<0.01
3 NIDDM患者按GPI水平分成GPI<114.4μ(Ⅰ)组和GPI≥114.4μ(Ⅱ)组,GPI与ρ值相关性显著(r=0.3913,P<0.05),GPI正常患者(Ⅰ)组的PMN ρ值明显低于GPI升高者(Ⅱ)组(P<0.05),显示血清蛋白糖化程度对PMN的MF有明显影响,糖化水平越高则PMN的MF越低,见表3。表3 不同GPI水平NIDDM患者荧光偏振值比较(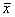 ±s) 组 别
±s) 组 别
例数
荧光偏振值
比 较 组
, 百拇医药
P值
对照组
Ⅰ组
Ⅱ组
30
20
45
0.3092±0.0292
0.3160±0.0608
0.3473±0.0454
Ⅰ:对照组
Ⅰ:Ⅱ组
Ⅱ:对照组
, 百拇医药
>0.05
<0.05
<0.01
4 NIDDM患者与对照组间TG水平相差显著,但甘油三脂(TG)<1.7mmol/L(Ⅰ)组的 PMN ρ值与TG≥1.7mmol/L(Ⅱ)组PMN ρ值无显著差异。NIDDM患者与对照组间总胆固醇(TC)水平无差异。见表4。表4 不同TG水平NIDDM患者荧光偏振值比较(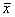 ±s) 组 别
±s) 组 别
例数
荧光偏振值
比 较 组
P值
, 百拇医药
对照组
Ⅰ组
Ⅱ组
30
32
33
0.3092±0.0299
0.3294±0.0497
0.3441±0.0512
Ⅰ:对照组
Ⅰ:Ⅱ组
Ⅱ:对照组
>0.05
, http://www.100md.com
>0.05
<0.01
5 年龄、病程、BMI、WBC、RBC、PLT、TG、TC、与PMN MF无相关性。见表5。表5 65例NIDDM患者PMN MF相关因素分析 相关因素X∶Y
r
P
年龄
病程
BMI
FBG
PBG
GPI
, 百拇医药 TC
TG
WBC
RBC
PLT
-0.0454
0.1137
0.0497
-0.3417
-0.3237
-0.3913
0.0103
-0.1095
, 百拇医药
-0.0098
-0.0004
-0.0620
>0.05
>0.05
>0.05
<0.05
<0.05
<0.05
>0.05
>0.05
>0.05
>0.05
, 百拇医药
>0.05
讨 论
膜流动性是显示细胞膜物理性质的指标,测定方法有多种,荧光偏振法因方法简便,需要的设备普通,结果灵敏,是最常用的方法。ρ越大细胞膜流动性越小,ρ的变化反应了膜流动性的变化。微粘度(microviscosity η )与各向异性(anisotropy γ )则与ρ值变化一致,人们应用荧光偏振法、电子自旋共振法、流式细胞术等多种方法研究了糖尿病患者的细胞膜流动性,但研究对 象多为红细胞、血小板。本文研究显示NIDDM患者PMN荧光偏振值升高,细胞膜流动性下降。
本文研究显示糖尿病病人的血糖水平显著升高,血糖水平控制良好的糖尿病人与正常对照组之间ρ值并无显著差异。血糖水平控制较差的糖尿病人与正常对照组之间ρ值相差显著。ρ值随血糖升高而升高,ρ值越大,细胞膜流动性越小,故PMN MF与血糖水平呈负相关。严格控制血糖可保持正常的细胞膜状态。高血糖使细胞膜流动性下降的机理可能如下[9~11]:1 高血糖可使血浆渗透压升高,血浆渗 透压升高引起细胞脱水导致细胞内溶质浓度增加,使细胞粘弹性增高,细胞膜流动性下降。2 高血糖可使血浆HbAlC含量增高,HbAlC与氧结合力明显增强,组织可因缺氧而释放血栓素等生物活性物质,使白细胞激活,细胞膜变硬,流动性下降。而且HbAlC含量增高也可引起血浆渗透压升高使 细胞膜流动性下降。3 血糖升高引起血脂代谢异常,血脂异常使白细胞膜脂质组面异常,从而引起膜粘弹性增高,则膜的流动性下降。Masuda等人应用流式细胞仪测定STZ致大鼠糖尿病的动物PMN MF,发现MF分别与检 测一周前血糖及同时期的血糖均有良好的相关性,但一周前的相关性似乎比同时期血糖相关性更好(一周前r=-0.57,P<0.01,同时期r=-0.76,P<0.01),说明血糖影响细胞膜流动性除了高血糖本身 的一种迅速直接作用之外还间接通过影响血脂、HbAlC等途径迟缓地起作用。
, 百拇医药
本实验显示:NIDDM组的糖化血清蛋白指数显著高于对照组,糖化血清蛋白指数正常患者与对照组之间ρ值相差不显著,GPI与ρ值显著正相关。Masuda[11] 动物实验显示糖尿病鼠血清中有使PMN MF下降的物质,糖基化的血清蛋白是该物质之一,Winocow PD及 Watale[12~13] 等人研究发现糖尿病病人血小板膜流动性下降,膜蛋白糖化程度与膜的流动性呈负相关,可推测糖尿病病人PMN的膜蛋白糖化增加,也是其膜流动性下降的原因。
Kamada T[14] 与Brysewka[15] 认为糖尿病 人血脂异常,导 致细胞膜脂成份异常,细胞膜流动性下降。Masuda[11] 研究示糖尿病鼠PMN的MF变化与血清脂水平相关不显著,而Tong P[4] 则发现糖尿病病人单核细胞荧光偏振值与血浆甘油三脂水平显著相关(r=-0.58,P<0.01),而与血浆总胆固醇水平无显著相关。Neufeld[10] 则示单核细胞膜MF并没有随细胞膜胆/磷比改变而改变。在本文研究中,NIDDM组的血浆总胆固醇含量与对照组之间无显著差异 ,血浆甘油三脂水平显著高于对照组,但与PMN的荧光偏振值相关性甚差。这种结果有可能是因为在标本制备过程中,用低离子强度的溶液反复洗涤、溶解,使膜脂与骨架蛋白的联系破坏,从而使结果受到影响。Tong P[16]就曾发现,经反复制备后,红细胞膜上一种重要的骨架蛋白消失了,当然也不排 除血浆脂水平对PMN的MF确无影响,血浆脂水平对细胞膜流动性的影响尚待进一步研究。
, 百拇医药
Metformin[17] 与 myricetin[18] 均可调节细胞膜流动性,使胰岛素受体功能加强,胰岛素敏感性提高。己酮可可碱(PTX)系人工合成的甲基黄嘌呤衍生物,它可抑35-磷酸腺苷二脂酶引起红细胞内cAMP增加,改善红细胞的变形性[19]。Newton JA[20] 报道,PTX可通过调节F-肌动蛋白升高幼儿MF,改变其吞噬趋化功能。Armstrong 等[21]的研究表明,用PTX 温育PMN后,PMN伪足形成率减少,滤过性增加。PTX还可使血浆纤维蛋白原浓度下降,血浆粘度降低,抑制血小板聚集和血栓形成,具有较好改善血液流变性的作用,其具体作用机理尚未明确。文献报道PMN的荧光偏振值的下降与糖尿病血管病变的发生、发展密切相关,临床控制血糖,应用改善PMN细胞膜物理状态的药物,降低糖尿病患者细胞膜流动性,提高胰岛素敏感性,改善血细胞流变性和血液流变性,控制代谢紊乱,对预防并发症的发生,具有重要意义。 参考文献
, 百拇医药
1 Bingrose TR,Thomas TH,Wilkinson R,et al.Increased mononuclear cell membrane fluidity and increased B lymphocyte HLA class I expression in IgA nephropathy.Nephrol-Dial-Transplant.1996,11:287
2 Masuda M,Komiyama T,Murakami T.Decrease of polymorphonucler leukocyte membrane bluidity in uremic patients on hemodialysis.Nephron.1990,54:36
3 Aloui R,Dacheco Y,Chabannes B,et al.Increased membrane fluidity in blood leukocytes from allergic subjects.A possible role for leukotrene B4.J lipid Mediat.1991,3:187
, 百拇医药
4 Tong P,Thomas T,Berrish T,et al.Cell membrane dynamics and insulin resistance in non-insulin-dependent diabetes mellitus.Lancet.1995,345:357
5 Spika S,Dey-l,Buda C.The mechamism of inhibitory effect of eicosapontaenoic acid in phagocytic activity and chemotaxis of human nentrophil granulocytes. Clin-Immunol-Immunopathol.1996,79:224
6 wildon RM:Neutrophil function in diabetes.Diabetic Med.1986,3:509
, 百拇医药
7 蔡庆岭.应用标准参考物进行血清糖化蛋白指数测定的研究.上海医学检验杂志.1990,5:27
8 范学工,张铮.中性粒细胞膜流动性的测定.湖南医科大学学报.1993,18:333
9 Nash GB.Abnormal flow properties of white blood cells in patients with severe ischaemia of leg .Br Med J Clin Res.1988,296:1699
10 Neufeld ND,Harris M,Corbo LM,et al.Effect of glybuide in type 2 diabetes mellitus:studies of monocyte membrane fluidity,lipid composition and insulin binding.Diabetes.1987,36:1351
, http://www.100md.com
11 Masuda M,Murakami T,Egawa H,et al.decreased fluidity of polymorphonuclear leukocyte membrane in streptozocin-induced diabetic rats.Diabetes.1990,39:466
12 Winocour PD,Bryszewska M,Watala C,et al.Reduced membrane fluidity in platelets from diabetic patients.Diabetes.1990,39:241
13 Winocour PD,Watala C,Kinlough-Rathbone RL,et al.Relationship among membrane fluidity,glycation of proteins and cholesterol to phospholipid molar ratio in isolated platelet membranes from diabetic and control subjects.Thromb Haemost.1992,67:567
, http://www.100md.com
14 Kamada T,Otsuji S.Lower levels of erythrocyte membrane fluidity in diabetic patients:a spin label study.Diabetes.1983,32:585
15 Bryszewska M,Watala C,Tcrzecka W.Changes in fluidity and composition of erythrocyte membranes and in composition of plasma lipids in type I diabetes.Br J Haematol.1986,62:111
16 Tong P,Thomas T, Wilkinson R.Membrane fluidity is different between intact erythrocytes and ghosts.Biochem Med Metab Biol.1994,52:13
, http://www.100md.com
17 Muller S,Denet S, Candiloros H.Action of metformin on erythrocyte membrane fluidity in vitro and in vivo.Eur J Pharmacol.1997,337:103
18 Ong KC,Khoo HE.Insulinomimetic effects of myricetin on lipogenesis and glucose transport in rat adipocytes but not glucose transport translocation.Biochem-pharmacol.1996,51:423
19 Satoh M,Lmaizumi K,Ressho T, et al. Increased erythrocyte aggregation in diabetes mellitus and its relationship to glycosylated haemoglobm and retinopathy.Diabetologia.1984,27:517
, 百拇医药
20 Beccerica E, Piergiacomi G,Curatola G,et al.Changes of lymphocyte membrane fluidity in rheumatoid arthritis:a fluorescence polarisation study.Ann Rheum Dis.1988,47:472
21 朱禧星,金惠铭,愈茂华,等.糖尿病患者微循环改变的观察.中华内分泌杂志.1987,11:19-21
(收稿: 1998-04-03 修回: 1998-07-14)
中国微生态学杂志 2000年第5期第12卷 论 著
高效微生态饲料添加剂作用及在动物饲养过程中的应用
作者:孙瑞峰 陈沈
单位:沈阳一药动物药品有限公司,辽宁沈阳 110023
关键词:微生态制剂;治疗作用;添加剂., http://www.100md.com
单位: 550009 贵阳解放军44医院
关键词:高血压病;微循环缺血区;血管内皮细胞
中国微循环990214 【摘要】 目的 检测65例非胰岛素依赖型糖尿病(NIDDM)患者中性粒细胞(PMN)膜流动性(MF)的改变,探讨这种改变与年龄、病程、BMI、FBG、PBG、TG、TC、WBC、RBC、PLT、GPI的相关关系。方法 65例无酮症及感染的NIDDM患者,30例性别、年龄、BMI相匹配的正常人为对照,以DPH为探针测定其PMN的荧光偏振值(ρ),并计算相应的细胞膜流动性、膜脂各向异性及微粘度,对PMN ρ值的影响因素进行分析。结果 1 NIDDM患者的PMN ρ值显著高于对照组(P<0.01),PMN MF明显低于对照组(P<0.05),PMN膜脂各向异性及微粘度均显著升高(P<0.01)。2 PMN MF 与FBG、PBG呈负相关(r=-0.3417,r=-0.3237,P<0.05),与GPI相关性显著(r=-0.3913,P<0.05),与年龄、病程、BMI、WBC、RBC 、PLT、TG、TC无相无性。结论 NIDDM患者PMN的MF下降,显示DM患者PMN膜的物理性质有明显改变;PMN MF下降与血糖升高、血清蛋白糖化程度增加有关。
, http://www.100md.com
细胞膜是细胞功能的重要调节器,细胞膜流动性(membrane fluidity,MF)是其重要的生物物理特性。MF受膜的成份及多种因素的影响,许多疾病发生发展过程中表现出细胞膜流动性的改变[1~3]。Ⅱ型糖尿病患者胰岛素受体的敏感性下降,白细胞的吞噬、趋化功能降低,变形能力下降及并发症的发生均与白细胞膜物理特性改变有关[4~6]。此方面的研究报道少,结论不一。本文应用荧光偏振法以DPH做探针,检测了65例NIDDM患者中性粒细胞(PMN)MF,并对年龄、病程、体重指数(BMI)、血糖、血清糖化蛋白指数(GPI)、血脂水平对PMN、MF的影响进行探讨。
材料与方法
1 65例NIDDM患者,符合1985年世界卫生组织(WHO)糖尿病诊断标准,确诊为NIDDM。男40例,女25例。平均年龄64.87±9.45岁。病程6月至26年。体重指数23.8±3.5kg/m2。部分患者采用控制饮食、口服降糖药及胰岛素注射等治疗方法。同时期健康体检者30例为对照组,年龄、性别、BMI具有可比性。
, 百拇医药
2 空腹静脉血1.5ml肝素抗凝查血脂(酶法),3ml肝素抗凝测定GPI[7],1.5ml EDTA-2Na抗凝血测定常规及分离PMN用于测定荧光偏振值。上述标本均于取血后6小时内完成测定。空腹血糖(FBG),餐后血糖(PBG)用德国宝灵曼公司快速血糖测定仪测定。
3 1.5mlEDTA-2Na抗凝血分离PMN[8],DPH标记,悬浮在2ml1640培养液中,PMN的分离与标记要求无菌操作,用岛津RF-540型荧光光度计测定ρ值,激发波长360nm,发射波长430nm,37℃恒温。荧 光偏振值即ρ值=Ivv-GIvh/Ivv+GIvh,Ivv为起偏器及检偏器光轴均垂直时荧光值;Ivh则为起偏器光轴垂直,检偏器光轴水平时荧光值,G=Ihv/Ihh,Ihv与Ihh为起偏器光轴水平,检偏器光轴分别为垂直和水平时的荧光值,由ρ值根据公式可计算出膜的流动性LFU=[ρ max/(ρr-l)]/ρ r,ρ max为0.5,ρ r为ρ的实测值,各向异性γ=2ρ/(3-ρ),微粘度 η=2ρ/(0.46-ρ)。
, http://www.100md.com
5 统计学处理:数据用均数±标准差表示,数据处理采用SAS统计程序,进行t或t检验、方差分析、方差齐性检验及直线相关分析。
结 果
1 NIDDM患者的PMN荧光偏振值,显著高于对照组(P<0.01),PMN MF 显著低于对照组(P<0.05),PMN膜脂各向异性及微粘度均显著高于对照组(P<0.01),显示DM 患者PMN膜的物理性质有明显改变。见表1
表1 NIDDM患者与对照组白细胞物理特性比较(
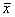 ±s) 项 目
±s) 项 目对 照 组
NIDDM组
P值
, 百拇医药
例 数
荧光偏振值
微粘度
各向异性
流动性
30
0.3092±0.0292
4.3198±1.2221
0.2300±0.0241
2.1132±0.7940
65
0.3341±0.0331
, 百拇医药
5.7118±1.6816
0.2509±0.0274
1.6273±0.9498
<0.01
<0.01
<0.01
<0.05
2 NIDDM患者按空腹血糖水平分成三组,Ⅰ组FBG≤7.8mmol/L,Ⅱ组7.8mmol/L
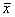 ±s) 组 别
±s) 组 别, http://www.100md.com
例数
荧光偏振值
比 较 组
P值
对照组
Ⅰ组
Ⅱ组
Ⅲ组
30
25
25
15
0.3092±0.0292
, 百拇医药
0.3174±0.0332
0.3365±0.0170
0.3571±0.0339
Ⅰ:对照组
Ⅰ:Ⅱ组
Ⅱ:对照组
Ⅱ:Ⅲ组
Ⅰ:Ⅲ组
Ⅲ:对照组
>0.05
<0.01
<0.01
, http://www.100md.com
<0.01
<0.01
<0.01
3 NIDDM患者按GPI水平分成GPI<114.4μ(Ⅰ)组和GPI≥114.4μ(Ⅱ)组,GPI与ρ值相关性显著(r=0.3913,P<0.05),GPI正常患者(Ⅰ)组的PMN ρ值明显低于GPI升高者(Ⅱ)组(P<0.05),显示血清蛋白糖化程度对PMN的MF有明显影响,糖化水平越高则PMN的MF越低,见表3。表3 不同GPI水平NIDDM患者荧光偏振值比较(
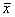 ±s) 组 别
±s) 组 别例数
荧光偏振值
比 较 组
, 百拇医药
P值
对照组
Ⅰ组
Ⅱ组
30
20
45
0.3092±0.0292
0.3160±0.0608
0.3473±0.0454
Ⅰ:对照组
Ⅰ:Ⅱ组
Ⅱ:对照组
, 百拇医药
>0.05
<0.05
<0.01
4 NIDDM患者与对照组间TG水平相差显著,但甘油三脂(TG)<1.7mmol/L(Ⅰ)组的 PMN ρ值与TG≥1.7mmol/L(Ⅱ)组PMN ρ值无显著差异。NIDDM患者与对照组间总胆固醇(TC)水平无差异。见表4。表4 不同TG水平NIDDM患者荧光偏振值比较(
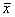 ±s) 组 别
±s) 组 别例数
荧光偏振值
比 较 组
P值
, 百拇医药
对照组
Ⅰ组
Ⅱ组
30
32
33
0.3092±0.0299
0.3294±0.0497
0.3441±0.0512
Ⅰ:对照组
Ⅰ:Ⅱ组
Ⅱ:对照组
>0.05
, http://www.100md.com
>0.05
<0.01
5 年龄、病程、BMI、WBC、RBC、PLT、TG、TC、与PMN MF无相关性。见表5。表5 65例NIDDM患者PMN MF相关因素分析 相关因素X∶Y
r
P
年龄
病程
BMI
FBG
PBG
GPI
, 百拇医药 TC
TG
WBC
RBC
PLT
-0.0454
0.1137
0.0497
-0.3417
-0.3237
-0.3913
0.0103
-0.1095
, 百拇医药
-0.0098
-0.0004
-0.0620
>0.05
>0.05
>0.05
<0.05
<0.05
<0.05
>0.05
>0.05
>0.05
>0.05
, 百拇医药
>0.05
讨 论
膜流动性是显示细胞膜物理性质的指标,测定方法有多种,荧光偏振法因方法简便,需要的设备普通,结果灵敏,是最常用的方法。ρ越大细胞膜流动性越小,ρ的变化反应了膜流动性的变化。微粘度(microviscosity η )与各向异性(anisotropy γ )则与ρ值变化一致,人们应用荧光偏振法、电子自旋共振法、流式细胞术等多种方法研究了糖尿病患者的细胞膜流动性,但研究对 象多为红细胞、血小板。本文研究显示NIDDM患者PMN荧光偏振值升高,细胞膜流动性下降。
本文研究显示糖尿病病人的血糖水平显著升高,血糖水平控制良好的糖尿病人与正常对照组之间ρ值并无显著差异。血糖水平控制较差的糖尿病人与正常对照组之间ρ值相差显著。ρ值随血糖升高而升高,ρ值越大,细胞膜流动性越小,故PMN MF与血糖水平呈负相关。严格控制血糖可保持正常的细胞膜状态。高血糖使细胞膜流动性下降的机理可能如下[9~11]:1 高血糖可使血浆渗透压升高,血浆渗 透压升高引起细胞脱水导致细胞内溶质浓度增加,使细胞粘弹性增高,细胞膜流动性下降。2 高血糖可使血浆HbAlC含量增高,HbAlC与氧结合力明显增强,组织可因缺氧而释放血栓素等生物活性物质,使白细胞激活,细胞膜变硬,流动性下降。而且HbAlC含量增高也可引起血浆渗透压升高使 细胞膜流动性下降。3 血糖升高引起血脂代谢异常,血脂异常使白细胞膜脂质组面异常,从而引起膜粘弹性增高,则膜的流动性下降。Masuda等人应用流式细胞仪测定STZ致大鼠糖尿病的动物PMN MF,发现MF分别与检 测一周前血糖及同时期的血糖均有良好的相关性,但一周前的相关性似乎比同时期血糖相关性更好(一周前r=-0.57,P<0.01,同时期r=-0.76,P<0.01),说明血糖影响细胞膜流动性除了高血糖本身 的一种迅速直接作用之外还间接通过影响血脂、HbAlC等途径迟缓地起作用。
, 百拇医药
本实验显示:NIDDM组的糖化血清蛋白指数显著高于对照组,糖化血清蛋白指数正常患者与对照组之间ρ值相差不显著,GPI与ρ值显著正相关。Masuda[11] 动物实验显示糖尿病鼠血清中有使PMN MF下降的物质,糖基化的血清蛋白是该物质之一,Winocow PD及 Watale[12~13] 等人研究发现糖尿病病人血小板膜流动性下降,膜蛋白糖化程度与膜的流动性呈负相关,可推测糖尿病病人PMN的膜蛋白糖化增加,也是其膜流动性下降的原因。
Kamada T[14] 与Brysewka[15] 认为糖尿病 人血脂异常,导 致细胞膜脂成份异常,细胞膜流动性下降。Masuda[11] 研究示糖尿病鼠PMN的MF变化与血清脂水平相关不显著,而Tong P[4] 则发现糖尿病病人单核细胞荧光偏振值与血浆甘油三脂水平显著相关(r=-0.58,P<0.01),而与血浆总胆固醇水平无显著相关。Neufeld[10] 则示单核细胞膜MF并没有随细胞膜胆/磷比改变而改变。在本文研究中,NIDDM组的血浆总胆固醇含量与对照组之间无显著差异 ,血浆甘油三脂水平显著高于对照组,但与PMN的荧光偏振值相关性甚差。这种结果有可能是因为在标本制备过程中,用低离子强度的溶液反复洗涤、溶解,使膜脂与骨架蛋白的联系破坏,从而使结果受到影响。Tong P[16]就曾发现,经反复制备后,红细胞膜上一种重要的骨架蛋白消失了,当然也不排 除血浆脂水平对PMN的MF确无影响,血浆脂水平对细胞膜流动性的影响尚待进一步研究。
, 百拇医药
Metformin[17] 与 myricetin[18] 均可调节细胞膜流动性,使胰岛素受体功能加强,胰岛素敏感性提高。己酮可可碱(PTX)系人工合成的甲基黄嘌呤衍生物,它可抑35-磷酸腺苷二脂酶引起红细胞内cAMP增加,改善红细胞的变形性[19]。Newton JA[20] 报道,PTX可通过调节F-肌动蛋白升高幼儿MF,改变其吞噬趋化功能。Armstrong 等[21]的研究表明,用PTX 温育PMN后,PMN伪足形成率减少,滤过性增加。PTX还可使血浆纤维蛋白原浓度下降,血浆粘度降低,抑制血小板聚集和血栓形成,具有较好改善血液流变性的作用,其具体作用机理尚未明确。文献报道PMN的荧光偏振值的下降与糖尿病血管病变的发生、发展密切相关,临床控制血糖,应用改善PMN细胞膜物理状态的药物,降低糖尿病患者细胞膜流动性,提高胰岛素敏感性,改善血细胞流变性和血液流变性,控制代谢紊乱,对预防并发症的发生,具有重要意义。 参考文献
, 百拇医药
1 Bingrose TR,Thomas TH,Wilkinson R,et al.Increased mononuclear cell membrane fluidity and increased B lymphocyte HLA class I expression in IgA nephropathy.Nephrol-Dial-Transplant.1996,11:287
2 Masuda M,Komiyama T,Murakami T.Decrease of polymorphonucler leukocyte membrane bluidity in uremic patients on hemodialysis.Nephron.1990,54:36
3 Aloui R,Dacheco Y,Chabannes B,et al.Increased membrane fluidity in blood leukocytes from allergic subjects.A possible role for leukotrene B4.J lipid Mediat.1991,3:187
, 百拇医药
4 Tong P,Thomas T,Berrish T,et al.Cell membrane dynamics and insulin resistance in non-insulin-dependent diabetes mellitus.Lancet.1995,345:357
5 Spika S,Dey-l,Buda C.The mechamism of inhibitory effect of eicosapontaenoic acid in phagocytic activity and chemotaxis of human nentrophil granulocytes. Clin-Immunol-Immunopathol.1996,79:224
6 wildon RM:Neutrophil function in diabetes.Diabetic Med.1986,3:509
, 百拇医药
7 蔡庆岭.应用标准参考物进行血清糖化蛋白指数测定的研究.上海医学检验杂志.1990,5:27
8 范学工,张铮.中性粒细胞膜流动性的测定.湖南医科大学学报.1993,18:333
9 Nash GB.Abnormal flow properties of white blood cells in patients with severe ischaemia of leg .Br Med J Clin Res.1988,296:1699
10 Neufeld ND,Harris M,Corbo LM,et al.Effect of glybuide in type 2 diabetes mellitus:studies of monocyte membrane fluidity,lipid composition and insulin binding.Diabetes.1987,36:1351
, http://www.100md.com
11 Masuda M,Murakami T,Egawa H,et al.decreased fluidity of polymorphonuclear leukocyte membrane in streptozocin-induced diabetic rats.Diabetes.1990,39:466
12 Winocour PD,Bryszewska M,Watala C,et al.Reduced membrane fluidity in platelets from diabetic patients.Diabetes.1990,39:241
13 Winocour PD,Watala C,Kinlough-Rathbone RL,et al.Relationship among membrane fluidity,glycation of proteins and cholesterol to phospholipid molar ratio in isolated platelet membranes from diabetic and control subjects.Thromb Haemost.1992,67:567
, http://www.100md.com
14 Kamada T,Otsuji S.Lower levels of erythrocyte membrane fluidity in diabetic patients:a spin label study.Diabetes.1983,32:585
15 Bryszewska M,Watala C,Tcrzecka W.Changes in fluidity and composition of erythrocyte membranes and in composition of plasma lipids in type I diabetes.Br J Haematol.1986,62:111
16 Tong P,Thomas T, Wilkinson R.Membrane fluidity is different between intact erythrocytes and ghosts.Biochem Med Metab Biol.1994,52:13
, http://www.100md.com
17 Muller S,Denet S, Candiloros H.Action of metformin on erythrocyte membrane fluidity in vitro and in vivo.Eur J Pharmacol.1997,337:103
18 Ong KC,Khoo HE.Insulinomimetic effects of myricetin on lipogenesis and glucose transport in rat adipocytes but not glucose transport translocation.Biochem-pharmacol.1996,51:423
19 Satoh M,Lmaizumi K,Ressho T, et al. Increased erythrocyte aggregation in diabetes mellitus and its relationship to glycosylated haemoglobm and retinopathy.Diabetologia.1984,27:517
, 百拇医药
20 Beccerica E, Piergiacomi G,Curatola G,et al.Changes of lymphocyte membrane fluidity in rheumatoid arthritis:a fluorescence polarisation study.Ann Rheum Dis.1988,47:472
21 朱禧星,金惠铭,愈茂华,等.糖尿病患者微循环改变的观察.中华内分泌杂志.1987,11:19-21
(收稿: 1998-04-03 修回: 1998-07-14)
中国微生态学杂志 2000年第5期第12卷 论 著
高效微生态饲料添加剂作用及在动物饲养过程中的应用
作者:孙瑞峰 陈沈
单位:沈阳一药动物药品有限公司,辽宁沈阳 110023
关键词:微生态制剂;治疗作用;添加剂., http://www.100md.com