白细胞介素10抑制肾系膜细胞磷脂酶A2及其介导的前列腺素E2释放的实验研究
作者:李晓玫 戴振华 唐嘉薇 王海燕
单位:100034 北京医科大学第一医院肾内科北京医科大学肾脏病研究所
关键词:
中华医学杂志/990432 肾小球系膜细胞(MC)在病理状态下产生炎症效应并自分泌多种炎症介质,是导致肾小球炎症与硬化的重要发病机制。研究表明,炎症性细胞因子白细胞介素1(IL-1)β可激活磷脂酶A2(PLA2),并介导MC释放脂类炎症介质前列腺素E2(PGE2),后者进而参与炎症反应调控[1]。本实验进一步观察IL-10对IL-1β诱导MC cPLA2基因表达和活性的作用及其对PGE2释放的影响。
一、材料和方法
, http://www.100md.com
1.试剂:胶原酶购自德国Boehringer公司。 IL-1β、佛波乙醇酯(PMA)、消炎痛、花生四烯酸标准品及蛋白酶抑制剂均购自美国Sigma公司。血小板源生长因子(PDGF)购自UBI公司。α-32P-dCTP、14C标记的花生四烯酰基卵磷脂(14C-PC)购自Dupont公司。cPLA2 cDNA探针由美国科罗拉多大学医学中心Raphael A.Nemenoff教授惠赠。PGE2放免测定试剂盒购自北京兴华生物技术中心。蛋白测定试剂及分子量标准品均购自美国Bio-Red或Gibco公司。
2.MC培养:用雄性SD大鼠按照本所方法分离肾小球并作MC培养。肾小球纯度>95%,MC于21天后传代,生长良好的细胞于第五代以后用于本实验。
3.细胞因子刺激:细胞转种后培养48小时,分别用于PGE2释放含量或cPLA2活性及基因表达检测。实验前改用含0.5%胎牛血清的培养液培养24小时使细胞生长静止。分别给10 ng/ml IL-1β、20 ng/ml IL-10、50 μmol/L消炎痛、IL-1+IL-10、IL-1+消炎痛或20 ng/ml PDGF及10-6mol/L PMA,以未刺激细胞为阴性对照,于37℃刺激所注明的时间。
, 百拇医药
4.cPLA2活性测定:参照Gronich等方法[2]进行。细胞刺激15分钟后裂解并匀浆,在4℃下1 000 r/min离心5分钟、20 000 r/ min离心1小时以提取酶蛋白,酶蛋白含量用考马斯亮蓝法测定。样品(1.5~7 μg蛋白)与14C-PC(终浓度15 μmol/L)及反应液(5 mmol/L CaCl2、50 mmol/L Hepes,pH 7.5)共同在37℃反应30分钟,加含非标记花生四烯酸的乙酸乙醇终止反应。将样品点样于硅胶TCL层析板上进行层析,经碘蒸气染色后取游离花生四烯酸条带进行液闪计数。各组样品均作双管重复测定,cPLA2活性以nmol*mg-1*min-1表示。
5.cPLA2基因表达检测:cPLA2探针以随机引物法进行标记。各组细胞刺激6或12小时,用异硫氰酸胍法提取细胞总RNA,RNA经甲醛变性凝胶电泳后转膜、预杂交与杂交、洗膜后于-70℃进行放射自显影。
, http://www.100md.com
6.PGE2释放含量测定:细胞刺激48小时,收集细胞上清液,离心后样品按PGE2试剂盒说明测定。各组细胞裂解后以Lowry法测蛋白含量。PGE2释放含量以pg/μg细胞蛋白表示。各组样品均作3孔测定取均值,实验共重复4次。
7.统计学处理:结果以均数±标准误表示。各组间比较采用多组方差检验,用Instat统计学软件处理。
二、结果
1.IL-10抑制IL-1β诱导的cPLA2活性:正常MC具有一定的cPLA2活性,20 ng/ml IL-10并不影响cPLA2的基础活性。10ng/ml IL-1β可诱导系膜细胞cPLA2激活(P<0.05),该作用能被IL-10明显抑制(P<0.01),而IL-10对PDGF或PMA诱导的cPLA2活化并无影响(图1)。IL-10对IL-1β诱导的cPLA2活性的抑制作用呈剂量依赖性,当浓度为20 ng/ml时其抑制作用达高峰,可使IL-1β诱导的cPLA2活性下降约40%。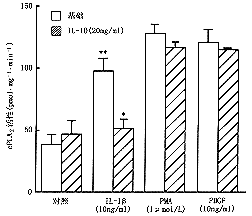
, 百拇医药
注:与对照组比较**P<0.01;*P<0.05
图1 IL-10对IL-1β诱导肾系膜细胞cPLA2活性的作用
2.IL-10抑制IL-1β诱导的cPLA2基因表达:在作用6或12小时后,IL-1β可刺激cPLA2 基因表达显著增高约2倍,而IL-10(20 ng/ml)可使IL-1β诱导MC的cPLA2基因表达完全被抑制(图2)。
注:1.对照;2.IL-1β10 ng/ml (6h);3.IL-1β10ng/ml+IL-10 25ng/ml(6h);4.IL-1β 10ng/ml(12h);5.IL-1β 10ng/ml+IL-10 25ng/ml(12h)
, http://www.100md.com
图2 IL-10对IL-1诱导系膜细胞cPLA2的基因表达
3.IL-10抑制IL-1β诱导的PGE2释放:IL-10对PGE2基础分泌无明显影响。10 ng/ml IL-1β可诱导MC释放PGE2(P<0.001),环氧化酶抑制剂消炎痛可显著抑制IL-1β诱导的PGE2释放达90%以上,而IL-10的抑制作用较弱,仅使PGE2水平下降约50%(P<0.001,图3)。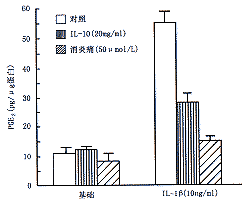
图3 IL-10对IL-1β诱导肾系膜细胞PGE2释放的作用
三、讨论
PLA2是炎症过程中脂类炎症介质产生的主要限速酶,与前列腺素类、白三烯、血栓素、血小板活化因子等的产生关系十分密切[1,3]。 哺乳动物细胞内主要存在着分泌型(sPLA2)和胞浆型(cPLA2)两种形式的PLA2,其中cPLA2可特异性从肌醇磷脂sn-2位水解并释放花生四烯酸。IL-1、TNF-α、TGF-β。等细胞因子均可使细胞内cPLA2合成增加,多种丝裂原、钙离子载体、内毒素、血栓素、IL-1、TNF-α以及佛波酯等物质均可激活cPLA2,提示其在传递外源信号使细胞产生脂类活性物质、调节细胞功能方面对炎症过程具有重要意义。在从肾组织分离的胞浆、线粒体和微粒体组分中均已发现存在着有活性的PLA2,在MC中其合成和分泌影响PGE2的释放[3]。本研究发现,IL-1β可以刺激系膜细胞cPLA2活化,使其活性较基础状态下增高2.5倍,同时IL-1β还可以刺激MC cPLA2基因表达明显增加约2倍,提示IL-1β诱导的cPLA2活化可能与其增加酶蛋白合成有关。
, http://www.100md.com
最近发现,在小鼠抗基底膜新月体肾炎中,腹腔注射IL-10可减少新月体形成及蛋白尿,提示IL-10具有体内抗炎症作用[4]。我们曾发现IL-10能抑制LPS刺激的MC表达IL-1及TNF-α,并能抑制IL-1诱导的MC增殖及表达ICAM-1[5]。本研究发现IL-10还可部分抑制IL-1诱导的PGE2释放,其作用呈剂量依赖性,提示IL-10对MC具有多方面抗炎作用。
本研究首次证实IL-10可部分抑制IL-1β刺激的cPLA2活化,同时还可以抑制cPLA2基因表达,提示其抑制作用可能与减少cPLA2蛋白合成有关。本结果表明,cPLA2合成及其活性的抑制对IL-10导致的PGE2释放减少可能只是部分机制,sPLA2和环氧化酶可能仍起一定的作用。然而,由于IL-10仅能抑制IL-1β诱导的cPLA2活化,但对PGDF和PMA刺激的cPLA2活化并无影响,表明IL-10是系膜细胞cPLA2活化的特异性抑制因子,这对进一步研究cPLA2作为细胞内信号转导分子在炎症过程中的作用具有重要的生物学意义。
, 百拇医药
本课题为国家自然科学基金资助项目(39570340)
参考文献
[1] Lianos EA. Eicosanoids in immune-mediated renal injury. Semin Nephrol,1992, 12:441-453.
[2] Gronich J, Konieczkowski M, Gelb MH, et al. Interleukin 1α causes rapid activation of cytosolic phospholipase A2 by phosphorylation in rat mesangial cells. J Clin Invest,1994,93:1224-1233.
[3] Clark JD, Lin LL, Kriz RW, et al. A novel arachidonic acid sensitive cytosolic PLA2 contains a
, http://www.100md.com
Ca2+-dependent translocation domain with homology to PKC and GAP. Cell,1991, 65:1043-1051.
[4] Holdsworth SR, Itching AR, Huang XR, et al. Interleukin-4 and interleukin-10 present experimental crescentic glomerulonephritis. JASN, 1996, 7: 1704.
[5] 戴振华,李晓玫,王海燕.白细胞介素10对肾小球系膜细胞炎症效应的抑制作用.中华医学杂志,1996,76:9-12.
(收稿:1998-03-05 修回:1999-01-19), 百拇医药
单位:100034 北京医科大学第一医院肾内科北京医科大学肾脏病研究所
关键词:
中华医学杂志/990432 肾小球系膜细胞(MC)在病理状态下产生炎症效应并自分泌多种炎症介质,是导致肾小球炎症与硬化的重要发病机制。研究表明,炎症性细胞因子白细胞介素1(IL-1)β可激活磷脂酶A2(PLA2),并介导MC释放脂类炎症介质前列腺素E2(PGE2),后者进而参与炎症反应调控[1]。本实验进一步观察IL-10对IL-1β诱导MC cPLA2基因表达和活性的作用及其对PGE2释放的影响。
一、材料和方法
, http://www.100md.com
1.试剂:胶原酶购自德国Boehringer公司。 IL-1β、佛波乙醇酯(PMA)、消炎痛、花生四烯酸标准品及蛋白酶抑制剂均购自美国Sigma公司。血小板源生长因子(PDGF)购自UBI公司。α-32P-dCTP、14C标记的花生四烯酰基卵磷脂(14C-PC)购自Dupont公司。cPLA2 cDNA探针由美国科罗拉多大学医学中心Raphael A.Nemenoff教授惠赠。PGE2放免测定试剂盒购自北京兴华生物技术中心。蛋白测定试剂及分子量标准品均购自美国Bio-Red或Gibco公司。
2.MC培养:用雄性SD大鼠按照本所方法分离肾小球并作MC培养。肾小球纯度>95%,MC于21天后传代,生长良好的细胞于第五代以后用于本实验。
3.细胞因子刺激:细胞转种后培养48小时,分别用于PGE2释放含量或cPLA2活性及基因表达检测。实验前改用含0.5%胎牛血清的培养液培养24小时使细胞生长静止。分别给10 ng/ml IL-1β、20 ng/ml IL-10、50 μmol/L消炎痛、IL-1+IL-10、IL-1+消炎痛或20 ng/ml PDGF及10-6mol/L PMA,以未刺激细胞为阴性对照,于37℃刺激所注明的时间。
, 百拇医药
4.cPLA2活性测定:参照Gronich等方法[2]进行。细胞刺激15分钟后裂解并匀浆,在4℃下1 000 r/min离心5分钟、20 000 r/ min离心1小时以提取酶蛋白,酶蛋白含量用考马斯亮蓝法测定。样品(1.5~7 μg蛋白)与14C-PC(终浓度15 μmol/L)及反应液(5 mmol/L CaCl2、50 mmol/L Hepes,pH 7.5)共同在37℃反应30分钟,加含非标记花生四烯酸的乙酸乙醇终止反应。将样品点样于硅胶TCL层析板上进行层析,经碘蒸气染色后取游离花生四烯酸条带进行液闪计数。各组样品均作双管重复测定,cPLA2活性以nmol*mg-1*min-1表示。
5.cPLA2基因表达检测:cPLA2探针以随机引物法进行标记。各组细胞刺激6或12小时,用异硫氰酸胍法提取细胞总RNA,RNA经甲醛变性凝胶电泳后转膜、预杂交与杂交、洗膜后于-70℃进行放射自显影。
, http://www.100md.com
6.PGE2释放含量测定:细胞刺激48小时,收集细胞上清液,离心后样品按PGE2试剂盒说明测定。各组细胞裂解后以Lowry法测蛋白含量。PGE2释放含量以pg/μg细胞蛋白表示。各组样品均作3孔测定取均值,实验共重复4次。
7.统计学处理:结果以均数±标准误表示。各组间比较采用多组方差检验,用Instat统计学软件处理。
二、结果
1.IL-10抑制IL-1β诱导的cPLA2活性:正常MC具有一定的cPLA2活性,20 ng/ml IL-10并不影响cPLA2的基础活性。10ng/ml IL-1β可诱导系膜细胞cPLA2激活(P<0.05),该作用能被IL-10明显抑制(P<0.01),而IL-10对PDGF或PMA诱导的cPLA2活化并无影响(图1)。IL-10对IL-1β诱导的cPLA2活性的抑制作用呈剂量依赖性,当浓度为20 ng/ml时其抑制作用达高峰,可使IL-1β诱导的cPLA2活性下降约40%。

, 百拇医药
注:与对照组比较**P<0.01;*P<0.05
图1 IL-10对IL-1β诱导肾系膜细胞cPLA2活性的作用
2.IL-10抑制IL-1β诱导的cPLA2基因表达:在作用6或12小时后,IL-1β可刺激cPLA2 基因表达显著增高约2倍,而IL-10(20 ng/ml)可使IL-1β诱导MC的cPLA2基因表达完全被抑制(图2)。

注:1.对照;2.IL-1β10 ng/ml (6h);3.IL-1β10ng/ml+IL-10 25ng/ml(6h);4.IL-1β 10ng/ml(12h);5.IL-1β 10ng/ml+IL-10 25ng/ml(12h)
, http://www.100md.com
图2 IL-10对IL-1诱导系膜细胞cPLA2的基因表达
3.IL-10抑制IL-1β诱导的PGE2释放:IL-10对PGE2基础分泌无明显影响。10 ng/ml IL-1β可诱导MC释放PGE2(P<0.001),环氧化酶抑制剂消炎痛可显著抑制IL-1β诱导的PGE2释放达90%以上,而IL-10的抑制作用较弱,仅使PGE2水平下降约50%(P<0.001,图3)。

图3 IL-10对IL-1β诱导肾系膜细胞PGE2释放的作用
三、讨论
PLA2是炎症过程中脂类炎症介质产生的主要限速酶,与前列腺素类、白三烯、血栓素、血小板活化因子等的产生关系十分密切[1,3]。 哺乳动物细胞内主要存在着分泌型(sPLA2)和胞浆型(cPLA2)两种形式的PLA2,其中cPLA2可特异性从肌醇磷脂sn-2位水解并释放花生四烯酸。IL-1、TNF-α、TGF-β。等细胞因子均可使细胞内cPLA2合成增加,多种丝裂原、钙离子载体、内毒素、血栓素、IL-1、TNF-α以及佛波酯等物质均可激活cPLA2,提示其在传递外源信号使细胞产生脂类活性物质、调节细胞功能方面对炎症过程具有重要意义。在从肾组织分离的胞浆、线粒体和微粒体组分中均已发现存在着有活性的PLA2,在MC中其合成和分泌影响PGE2的释放[3]。本研究发现,IL-1β可以刺激系膜细胞cPLA2活化,使其活性较基础状态下增高2.5倍,同时IL-1β还可以刺激MC cPLA2基因表达明显增加约2倍,提示IL-1β诱导的cPLA2活化可能与其增加酶蛋白合成有关。
, http://www.100md.com
最近发现,在小鼠抗基底膜新月体肾炎中,腹腔注射IL-10可减少新月体形成及蛋白尿,提示IL-10具有体内抗炎症作用[4]。我们曾发现IL-10能抑制LPS刺激的MC表达IL-1及TNF-α,并能抑制IL-1诱导的MC增殖及表达ICAM-1[5]。本研究发现IL-10还可部分抑制IL-1诱导的PGE2释放,其作用呈剂量依赖性,提示IL-10对MC具有多方面抗炎作用。
本研究首次证实IL-10可部分抑制IL-1β刺激的cPLA2活化,同时还可以抑制cPLA2基因表达,提示其抑制作用可能与减少cPLA2蛋白合成有关。本结果表明,cPLA2合成及其活性的抑制对IL-10导致的PGE2释放减少可能只是部分机制,sPLA2和环氧化酶可能仍起一定的作用。然而,由于IL-10仅能抑制IL-1β诱导的cPLA2活化,但对PGDF和PMA刺激的cPLA2活化并无影响,表明IL-10是系膜细胞cPLA2活化的特异性抑制因子,这对进一步研究cPLA2作为细胞内信号转导分子在炎症过程中的作用具有重要的生物学意义。
, 百拇医药
本课题为国家自然科学基金资助项目(39570340)
参考文献
[1] Lianos EA. Eicosanoids in immune-mediated renal injury. Semin Nephrol,1992, 12:441-453.
[2] Gronich J, Konieczkowski M, Gelb MH, et al. Interleukin 1α causes rapid activation of cytosolic phospholipase A2 by phosphorylation in rat mesangial cells. J Clin Invest,1994,93:1224-1233.
[3] Clark JD, Lin LL, Kriz RW, et al. A novel arachidonic acid sensitive cytosolic PLA2 contains a
, http://www.100md.com
Ca2+-dependent translocation domain with homology to PKC and GAP. Cell,1991, 65:1043-1051.
[4] Holdsworth SR, Itching AR, Huang XR, et al. Interleukin-4 and interleukin-10 present experimental crescentic glomerulonephritis. JASN, 1996, 7: 1704.
[5] 戴振华,李晓玫,王海燕.白细胞介素10对肾小球系膜细胞炎症效应的抑制作用.中华医学杂志,1996,76:9-12.
(收稿:1998-03-05 修回:1999-01-19), 百拇医药