HPLC测定银杏愈伤组织内酯A的研究
作者:陈云龙 徐程 徐礼根 杨志竖
单位:陈云龙 徐程 徐礼根 杨志竖 浙江大学西溪校区生命科学学院(杭州310012)
关键词:银杏;愈伤组织;银杏内酯A;HPLC
HPLC测定银杏愈伤组织内酯A的研究 摘 要 建立了一种可用于银杏离体细胞培养物中内酯A含量分析的RP-HPLC方法。样品经低浓度甲醇提取后,用中性或酸性氧化铝固相萃取柱纯化,用示差检测器检测,银杏内酯A的最低检测限为0.012 μg,方法回收率为(96.0±2)%,RSD为3.1%。
Detection of Ginkgolide A in Ginkgo
(Ginkgo biloba) Callus Culture by HPLC
, 百拇医药
Chen Yunlong, Xu Cheng, Xu Ligen, et al.
(College of Life Sciences, Zhejiang University, Hangzhou 310012)
Abstract An analytical method was developed to confirm the production of ginkgolide A by Ginkgo biloba L. callus cultured in vitro. Biomass samples were selectively extracted with 10% methanol and the resulting extract was purified on aluminium oxide solid-phase extraction column. After concentration, the ginkgolide A was determined by HPLC on a C18 column with refractive index detection. The recovery of the method was 96.0±2%. The detection limit was around 0.012 μg, which was low enough for the determination of ginkgolides produced by Ginkgo biloba L. callus cultured in vitro.
, 百拇医药
Key words Ginkgo biloba L. callus ginkgolide A
银杏内酯(包括内酯A、B、C)作为一类特异有效的血小板活化因子(platelet-activating factor)受体拮抗剂,近年来受到了世界各国药学工作者的广泛关注。由于这类化合物分子立体结构复杂,人工合成的技术难度大,目前仍以银杏叶作为提取银杏内酯化合物的主要来源[1]。关于银杏离体培养产生内酯化合物的研究,尽管做了大量工作,但由于分析测试技术上的限制,银杏细胞培养中内酯含量分析尚有一定困难[2~4]。笔者通过采用细直径HPLC快速分析柱,检测到了愈伤组织培养物中银杏内酯A化合物。
1 仪器和材料
高效液相色谱仪:日本岛津,包括LC-6A型输液泵,RID-6A型示差检测器,SCL-6A型系统控制器,以及C-R3A型数据处理机。
, http://www.100md.com
银杏幼叶:1998年4月中旬采自浙江大学西溪校区,银杏种实(大佛手)购自浙江富阳。
银杏内酯A、B对照品由日本梅田诚一教授提供;中性氧化铝、聚酰胺为柱层析用;C18固相萃取柱,大连依利特科学仪器有限公司出产。甲醇为色谱纯,其它试剂均为分析纯级。
2 色谱条件
色谱柱:Hypersil ODS2 3μ 2.0 mm (id)×100 mm;流动相:甲醇-水(33∶67);柱温:30℃;流速:0.2 mL/min;示差检测器:1.0×10-6RIU。
3 愈伤组织诱导培养
银杏幼叶、种胚愈伤组织按文献[3]方法进行诱导,MS固体培养基中含 1.0 mg/L NAA、 0.1 mg/L KT、30 g/L蔗糖,调pH至6.0,培养温度(25±1)℃,每3周继代一次,继代两代后,将愈伤组织取出,冷冻干燥后供样品制备用。
, http://www.100md.com
4 样品提取制备
参照姚渭溪等人方法[5]并作改进。称取1.0 g 干愈伤组织,置于50 mL圆底烧瓶中,加10%甲醇溶液10 mL和少量沸石,回流提取3次,每次60 min,趁热用布氏漏斗抽滤,合并滤液,用旋转蒸发器浓缩至干,残渣溶于5 mL甲醇中,将溶液加入装有5 g中性氧化铝的小层析柱上(预先用甲醇装柱并冲洗),用甲醇洗脱,收集洗脱液25 mL,浓缩并用N2吹干后,再用0.2~0.5 mL甲醇溶液溶解,密封后置于50℃水浴中恒温60 min,取出,供HPLC分析用。
5 方法回收率试验和工作曲线制作
称取1 g干愈伤组织,加入30 μg银杏内酯A和20 μg银杏内酯B标样,按上述样品提取纯化过程制备分析样品,重复3次,计算各自方法回收率。
将银杏内酯A标准样品,稀释配制成0.024、0.036、0.048、0.060、0.070 μg/μL系列浓度,进样10 μL,以最小二乘法作线性回归处理,得回归方程 Y(峰高)=20.9122+3298.66C(μg),r=0.9934。
, http://www.100md.com
6 结果与讨论
6.1 由于银杏内酯化合物是不挥发性的,在未衍生化前无法进行GC分析,同时它们在219 nm处的微弱紫外吸收系数,易受其它杂质干扰,故也难以用特异性的灵敏的HPLC-UV方法检测[1],对于目前银杏内酯浓度仅为 μg范围的离体愈伤组织、细胞悬浮培养物来说,受方法最低检测量等灵敏度因素限制,尚无法用常规的HPLC-RI分析方法来监控银杏内酯的生物合成。
6.2 本试验通过采用直径为2.0 mm的快速RP-HPLC分析柱,可节约大量流动相(流速为0.2 mL/min),分析时间不到常规柱的二分之一,银杏内酯A的最低检出限为0.012 μg,从而使 HPLC-RI方法分析检测离体愈伤组织、悬浮细胞培养物中的银杏内酯含量成为可能。
6.3 银杏内酯分析难度大,除了缺乏特异灵敏的检测器外,一个重要原因是样品纯化处理复杂[6,7]。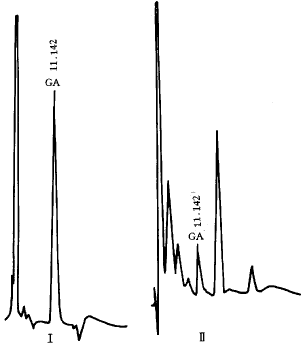
, 百拇医药
Ⅰ-银杏内酯A Ⅱ-幼叶愈伤组织
图1 样品的HPLC谱
有文献报道,使用硅胶柱来提纯样品的方法[4],从理论上讲氧化铝对酚性杂质的去除效果要好于硅胶,但在 pH>7.5的碱性条件下,银杏萜内酯化合物易发生开环反应[8],故必须选用中性或酸性氧化铝作固相提取柱。本试验在干愈伤组织中加入约50~70 nmol 内酯标准品,采取以上方法提取纯化,进行方法回收率试验,结果银杏内酯A、B回收率分别为(96.0±2)%,(93.1±3%),RSD为3.1%,3.8%。表明该提取纯化方法是准确可行的。
6.4 按以上分析条件,经继代两代的银杏幼叶、种胚愈伤组织的高效液相色谱图上仍能看到明显的银杏内酯A峰,见图1,说明叶和种胚愈伤组织都能生物合成银杏内酯A化合物,其在叶愈伤组织中的含量要高于胚性愈伤组织,分别为48 和12 μg/g,见表1。至于银杏内酯B,本试验未能检测到,尚有待进一步深入研究。
, 百拇医药
表1 不同样品中银杏内酯的含量
内酯种类
A(mg/g)
B(mg/g)
银杏幼叶
0.54
0.63
银杏种实
-
-
幼叶愈伤
0.048
-
, http://www.100md.com
种胚愈伤
0.012
-
参 考 文 献
1 Van Beek T A,et al. J Chromatogr, 1991,543:37
2 Nakanishi K,et al. J Am Chem Soc,1971,93:3546
3 Carrier D J,et al. Plant Cell Rep,1990,8:635
4 Nathalie Chauret. J Chromatogr, 1991,588:281
5 Yao Weixi,et al. Proceedings of 97 International Seminar on Ginkgo. Beijing,1997:182
6 Hoon Huh,et al.Planta Med,1993,59:232
7 Mee Hee Jeon,et al. Plant Cell Rep,1995,14:501
8 林启寿编著.中草药成分化学.北京:科学出版社,1977:244
(1998-11-16 收稿), 百拇医药
单位:陈云龙 徐程 徐礼根 杨志竖 浙江大学西溪校区生命科学学院(杭州310012)
关键词:银杏;愈伤组织;银杏内酯A;HPLC
HPLC测定银杏愈伤组织内酯A的研究 摘 要 建立了一种可用于银杏离体细胞培养物中内酯A含量分析的RP-HPLC方法。样品经低浓度甲醇提取后,用中性或酸性氧化铝固相萃取柱纯化,用示差检测器检测,银杏内酯A的最低检测限为0.012 μg,方法回收率为(96.0±2)%,RSD为3.1%。
Detection of Ginkgolide A in Ginkgo
(Ginkgo biloba) Callus Culture by HPLC
, 百拇医药
Chen Yunlong, Xu Cheng, Xu Ligen, et al.
(College of Life Sciences, Zhejiang University, Hangzhou 310012)
Abstract An analytical method was developed to confirm the production of ginkgolide A by Ginkgo biloba L. callus cultured in vitro. Biomass samples were selectively extracted with 10% methanol and the resulting extract was purified on aluminium oxide solid-phase extraction column. After concentration, the ginkgolide A was determined by HPLC on a C18 column with refractive index detection. The recovery of the method was 96.0±2%. The detection limit was around 0.012 μg, which was low enough for the determination of ginkgolides produced by Ginkgo biloba L. callus cultured in vitro.
, 百拇医药
Key words Ginkgo biloba L. callus ginkgolide A
银杏内酯(包括内酯A、B、C)作为一类特异有效的血小板活化因子(platelet-activating factor)受体拮抗剂,近年来受到了世界各国药学工作者的广泛关注。由于这类化合物分子立体结构复杂,人工合成的技术难度大,目前仍以银杏叶作为提取银杏内酯化合物的主要来源[1]。关于银杏离体培养产生内酯化合物的研究,尽管做了大量工作,但由于分析测试技术上的限制,银杏细胞培养中内酯含量分析尚有一定困难[2~4]。笔者通过采用细直径HPLC快速分析柱,检测到了愈伤组织培养物中银杏内酯A化合物。
1 仪器和材料
高效液相色谱仪:日本岛津,包括LC-6A型输液泵,RID-6A型示差检测器,SCL-6A型系统控制器,以及C-R3A型数据处理机。
, http://www.100md.com
银杏幼叶:1998年4月中旬采自浙江大学西溪校区,银杏种实(大佛手)购自浙江富阳。
银杏内酯A、B对照品由日本梅田诚一教授提供;中性氧化铝、聚酰胺为柱层析用;C18固相萃取柱,大连依利特科学仪器有限公司出产。甲醇为色谱纯,其它试剂均为分析纯级。
2 色谱条件
色谱柱:Hypersil ODS2 3μ 2.0 mm (id)×100 mm;流动相:甲醇-水(33∶67);柱温:30℃;流速:0.2 mL/min;示差检测器:1.0×10-6RIU。
3 愈伤组织诱导培养
银杏幼叶、种胚愈伤组织按文献[3]方法进行诱导,MS固体培养基中含 1.0 mg/L NAA、 0.1 mg/L KT、30 g/L蔗糖,调pH至6.0,培养温度(25±1)℃,每3周继代一次,继代两代后,将愈伤组织取出,冷冻干燥后供样品制备用。
, http://www.100md.com
4 样品提取制备
参照姚渭溪等人方法[5]并作改进。称取1.0 g 干愈伤组织,置于50 mL圆底烧瓶中,加10%甲醇溶液10 mL和少量沸石,回流提取3次,每次60 min,趁热用布氏漏斗抽滤,合并滤液,用旋转蒸发器浓缩至干,残渣溶于5 mL甲醇中,将溶液加入装有5 g中性氧化铝的小层析柱上(预先用甲醇装柱并冲洗),用甲醇洗脱,收集洗脱液25 mL,浓缩并用N2吹干后,再用0.2~0.5 mL甲醇溶液溶解,密封后置于50℃水浴中恒温60 min,取出,供HPLC分析用。
5 方法回收率试验和工作曲线制作
称取1 g干愈伤组织,加入30 μg银杏内酯A和20 μg银杏内酯B标样,按上述样品提取纯化过程制备分析样品,重复3次,计算各自方法回收率。
将银杏内酯A标准样品,稀释配制成0.024、0.036、0.048、0.060、0.070 μg/μL系列浓度,进样10 μL,以最小二乘法作线性回归处理,得回归方程 Y(峰高)=20.9122+3298.66C(μg),r=0.9934。
, http://www.100md.com
6 结果与讨论
6.1 由于银杏内酯化合物是不挥发性的,在未衍生化前无法进行GC分析,同时它们在219 nm处的微弱紫外吸收系数,易受其它杂质干扰,故也难以用特异性的灵敏的HPLC-UV方法检测[1],对于目前银杏内酯浓度仅为 μg范围的离体愈伤组织、细胞悬浮培养物来说,受方法最低检测量等灵敏度因素限制,尚无法用常规的HPLC-RI分析方法来监控银杏内酯的生物合成。
6.2 本试验通过采用直径为2.0 mm的快速RP-HPLC分析柱,可节约大量流动相(流速为0.2 mL/min),分析时间不到常规柱的二分之一,银杏内酯A的最低检出限为0.012 μg,从而使 HPLC-RI方法分析检测离体愈伤组织、悬浮细胞培养物中的银杏内酯含量成为可能。
6.3 银杏内酯分析难度大,除了缺乏特异灵敏的检测器外,一个重要原因是样品纯化处理复杂[6,7]。

, 百拇医药
Ⅰ-银杏内酯A Ⅱ-幼叶愈伤组织
图1 样品的HPLC谱
有文献报道,使用硅胶柱来提纯样品的方法[4],从理论上讲氧化铝对酚性杂质的去除效果要好于硅胶,但在 pH>7.5的碱性条件下,银杏萜内酯化合物易发生开环反应[8],故必须选用中性或酸性氧化铝作固相提取柱。本试验在干愈伤组织中加入约50~70 nmol 内酯标准品,采取以上方法提取纯化,进行方法回收率试验,结果银杏内酯A、B回收率分别为(96.0±2)%,(93.1±3%),RSD为3.1%,3.8%。表明该提取纯化方法是准确可行的。
6.4 按以上分析条件,经继代两代的银杏幼叶、种胚愈伤组织的高效液相色谱图上仍能看到明显的银杏内酯A峰,见图1,说明叶和种胚愈伤组织都能生物合成银杏内酯A化合物,其在叶愈伤组织中的含量要高于胚性愈伤组织,分别为48 和12 μg/g,见表1。至于银杏内酯B,本试验未能检测到,尚有待进一步深入研究。
, 百拇医药
表1 不同样品中银杏内酯的含量
内酯种类
A(mg/g)
B(mg/g)
银杏幼叶
0.54
0.63
银杏种实
-
-
幼叶愈伤
0.048
-
, http://www.100md.com
种胚愈伤
0.012
-
参 考 文 献
1 Van Beek T A,et al. J Chromatogr, 1991,543:37
2 Nakanishi K,et al. J Am Chem Soc,1971,93:3546
3 Carrier D J,et al. Plant Cell Rep,1990,8:635
4 Nathalie Chauret. J Chromatogr, 1991,588:281
5 Yao Weixi,et al. Proceedings of 97 International Seminar on Ginkgo. Beijing,1997:182
6 Hoon Huh,et al.Planta Med,1993,59:232
7 Mee Hee Jeon,et al. Plant Cell Rep,1995,14:501
8 林启寿编著.中草药成分化学.北京:科学出版社,1977:244
(1998-11-16 收稿), 百拇医药