抗卵巢癌单链免疫毒素的载体构建及高效表达
作者:尤芳蕾 冯捷 成夜霞 钱和年 周萍 叶雪
单位:北京大学人民医院妇科肿瘤实验室,北京 100044
关键词:抗体;肿瘤;免疫毒素类;药物载体;代谢;卵巢肿瘤;重组融合蛋白质类;代谢
北京医科大学学报000419 [摘 要] 目的:构建抗卵巢癌单链抗体183B2ScFv 与假单孢外毒素(peudononas exotoxin, PE38)的融合蛋白表达载体并制备抗人卵巢癌单链免疫毒素蛋白183B2ScFvPE38,为卵巢癌导向治疗打下基础。方法:采用基因工程技术,经过3次亚克隆,将编码单链抗体的基因及编码毒素的基因亚克隆至原核表达载体pET30a(+)上,并在IPTG的诱导下进行表达。采用直接ELISA及细胞杀伤对抗体及毒素部分的活性进行检查。结果:表达蛋白183B2ScFvPE38具有较好的抗体活性及毒素活性。结论:抗卵巢癌单链免疫毒素183B2ScFvPE38 具有良好的免疫学活性及生物学活性,可能有良好的应用前景。
, http://www.100md.com
[中图分类号] R966 [文献标识码] A [文章编号] 1000-1530(2000)04-0347-04
Vector construction and high level expression of single chain
immunotoxin against ovarian carcinoma
YOU Fang-Lei
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
FENG Jie
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
, 百拇医药
CHEN Ye-Xia
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
QIAN He-Nian
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
ZHOU Ping
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
, 百拇医药
YE Xue
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
ABSTRACT Objective:
To construct an expression vector for co_expression of single chain Fv antibody (OC183B2) and peudomonas exotoxin(PE38). Methods: Clone the genes of ScFv (OC183B2) and PE38 into PET30a(+) and then express the immunotoxin after induced with IPTG. Results: Liable activity of antibody and toxic in were both observed in the fusion recombinant protein. Conclusion: The recombinant fusion protein 183B2ScFvPE38 keeps the activity of both components and may be of great use in the future to deal with ovarian carcinoma.
, 百拇医药
KEY WORDS Antibodies, neoplasm; Immunotoxins; Drug carriers/metab; Ovarian neoplasms; Recombinant fusion proteins/metab
(J Beijing Med Univ, 2000,32:347-350)
近年来,随着分子生物学及免疫学技术的发展,肿瘤的生物学治疗已经成为除手术治疗、放疗、化疗之外重要的治疗方式。我室多年来一直从事以单克隆抗体为载体,荷载同位素、药物、毒素蛋白等,对卵巢癌进行免疫导向诊断和免疫导向治疗的研究,现已成功制备了小分子单抗[1],经99mTc标记下进行裸鼠荷瘤模型放射免疫显像的研究,并获得了清晰的图象。在此基础上,本实验意在应用本室制备的单链抗体构建免疫毒素,研究在抗体导向下,携带毒素蛋白对卵巢癌进行靶向治疗的可能性。
, 百拇医药
免疫毒素是肿瘤生物治疗的一种新方法。在国外,部分免疫毒素已进入Ⅰ期及Ⅱ期临床实验研究阶段。实验证实免疫毒素具有良好的应用前景[2,3]。但在国外卵巢癌特异性单克隆抗体构建免疫毒素的研究报道还很少见,国内未见有关报道。
1 材料与方法
1.1 载体构建及免疫毒素的高效表达
1.1.1 质粒和菌株 pET16-183B2 ScFv为本室构建的含有183B2单链抗体基因(183B2ScFv)的质粒, PAGIT为含有毒素基因(peudononas exotoxin, PE38)的质粒。高效表达质粒pET30a(+),质粒pUC18,大肠杆菌Bl21,DH5α为本室保存。质粒PAGIT及菌株GI724 为中国科学院遗传研究所黄华梁教授赠送。
, 百拇医药
1.1.2 限制性内切酶和工具酶 购自Promega公司。细胞系:卵巢癌细胞系SKOV3,宫颈癌细胞系HeLa 为本室保存。
1.1.3 免疫毒素表达载体的构建(图1) (1) pUC18-183B2ScFv的构建: pET16-183B2ScFv用NdeⅠ,EcoRⅠ消化,以切下单链抗体,并回收小片段;pUC18以相同位点酶切,回收大片段。在T4 DNA 连接酶的作用下将单链抗体亚克隆至pUC18中,并称之为pUC18-183B2ScFv。(2) pUC18-ScFvPE38的构建:将质粒pUC18-183B2ScFv用SacⅠ,EcoRⅠ消化,回收大片段;毒素PE38自PAGIT中由相同位点切下,回收并定向亚克隆至已回收的大片段中。此时所得质粒被命名为pUC18-ScFvPE38。(3) pET30-ScFvPE38的构建:pUC18-ScFvPE38 NdeⅠ,EcoRⅠ酶切下含有免疫毒素的片段,再以相同位点亚克隆至pET30a(+)中,完成高效表达载体pET30-ScFvPE38的构建。并对该质粒进行酶切鉴定。
, 百拇医药
图1 载体构建图示
Figure 1 Construction route of the vectors
1.1.4 重组质粒的诱导表达、包涵体裂解及蛋白复性 将含有重组质粒的Bl21大肠杆菌在37℃活化,1∶100(体积比)转接后继续培养至600 nm光密度约为0.4时,加IPTG至终浓度为0.4 mmol.L-1,诱导4 h后收集菌体,超声破碎细菌,离心分离包涵体,并保留上清液。上清液用PBS透析过夜。包涵体经反复洗涤后,8mol.L-1尿素溶解,加入复性液(成分:50 mmol.L-1 Tris-HCl,5mmol.L-1 EDTA,1mmol.L-1 氧化型谷光甘肽,5mmol.L-1 还原型谷光甘肽)稀释复性,10℃复性48h。PEG 20000浓缩后,对20mmol.L-1的Tris-Cl及不同浓度的尿素做梯度透析。
, 百拇医药
1.1.5 结果分析 SDS-聚丙烯酰胺凝胶电泳分析各阶段产物及其纯度。
1.2 表达蛋白活性检测
1.2.1 主要材料 抗卵巢癌单克隆抗体COC183B2为本中心制备;溴化氰活化的Sephorose4B购自Parmacia公司;辣根过氧化物酶购自北方同正生物技术发展公司。
1.2.2 测活所需的抗原的提取及标记 (1)腹水癌细胞检测OC183B2抗原阳性的病人腹水经饱和硫酸铵粗提两次,然后采用亲和层析提取抗原。亲和层析填料采用溴化氰活化的Sephorose4B,经活化后与平衡后的全抗体室温相偶联2 h后装柱,经乙醇胺封闭,醋酸缓冲液、硼酸缓冲液、硫氰酸钾洗涤后上样,并用3 mol.L-1硫氢酸钾洗脱,紫外分析仪检测。(2) 酶标抗原制备方法:亲和层析所得蛋白经浓缩透析后放入pH 9.2的0.001 mol.L-1碳酸盐缓冲液中平衡备用。辣根过氧化物酶经醛化及透析后加入上述抗原室温避光搅拌2 h,再加入新鲜配制的4g.L-1的硼氢酸钠,4℃ 2 h,并透析,即可完成标记过程。
, http://www.100md.com
1.2.3 免疫毒素的活性测定 (1)抗体活性 用直接ELISA法检测。复性蛋白以10 mg.L-1在4℃包板过夜,HRP-抗原OC183B2检测;超声裂解液上清(可溶性表达成分)用包被液梯度稀释后4℃包板过夜,用HRP-抗原检测。实验采用空载体pET30a(+)平行制备产物作为阴性对照。完整抗体COC183B2作为阳性对照。(2) 毒素活性采用细胞毒实验(MTT法)检测。靶细胞为表达OC183B2抗原的卵巢癌细胞系SKOV3,阴性细胞对照为宫颈癌细胞系HeLa(OC183B2 抗原阴性)。将培养细胞按1×105浓度接种于96孔培养板中。培养1 d后,按梯度加入经透析的免疫毒素超声裂解上清。以空载体表达上清加入SKOV3作为对照。24及48 h后观察细胞形态。48 h后加入MTT,37℃继续培养4 h,加入酸性SDS终止反应,检测570 nm光密度值(D570nm值),并按下述公式计算杀伤率。
, http://www.100md.com
细胞生存率%=(实验组D570nm-死细胞对照组D570nm)/(活细胞对照D570nm-死细胞对照D570nm)
2 结果
2.1 高效表达载体的酶切鉴定(图2)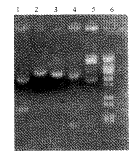
1, recombinants digested with NdeI,EcoRI; 2, recombinants digested with SpeI;
3, recombinants digested with HindⅢ; 4, recombinants digested with SacI;
, 百拇医药 5, recombinants;6, molecular weight markers (λDNA/BstEⅡ).
图2 重组载体pET30-ScFvPE38酶切产物琼脂糖电泳结果
Figure 2 Agarose electrophoresis of cloned vector pET30-ScFvPE38
digested with restriction enzymes.
表达载体pET30-ScFvPE38经SacⅠ酶切,可以切下约1 200 bp左右大小的片段,与理论计算值相符。pET30-ScFv PE38 经NdeⅠ及EcoRⅠ 酶切所得小片段大小与免疫毒素大小相符和。HindⅢ,SpeⅠ酶切后pET30-ScFvPE38呈线性。SpeI为克隆单链抗体引进的位点。HindⅢ为pET30a(+)上的酶切位点。
, 百拇医药
2.2 表达产物免疫毒素蛋白的分析(图3)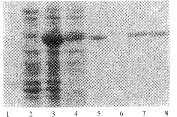
1, molecular weight markers; 2, pET30a(+)/BL21(DE3),37℃ 4 hours after induced with 0.4 mmol.L-1 IPTG;
3, pET30-ScFvPE38, 37℃ 4 hours after induced with 0.4 mmol.L-1 IPTG;
4, sonicated supernatant; 5, inclusion body; 7,8, renatured fusion protein.
, 百拇医药 图3 SDS-PAGE鉴定pET30-ScFvPE38融合蛋白的表达和纯度
Figure 3 SDS-PAGE analysis of expression and purity
of pET30-ScFvPE38 fusion proteins
pET30-ScFvPE38 转化大肠杆菌Bl21(DE3)后,经IPTG诱导,免疫毒素以包涵体形式为主高效表达,超声裂解上清中有少量可溶形式表达。SDS-聚丙烯酰胺凝胶电泳可见包涵体及全菌在相对分子质量68 000处有浓表达带,表达量占全菌的30%以上。超声裂解液上清中,亦可在此处见到新生条带。包涵体溶解复性后,纯度达90%以上。
2.3 表达蛋白质的活性检测
(1) 直接ELISA法结果490 nm光密度值: 阴性对照 0.210;阳性对照1.191;复性蛋白 0.632;超声裂解液上清 0.796。待测值均高于阴性对照3倍以上。活性良好。(2) 细胞杀伤结果表明,对相同剂量的毒素蛋白,SKOV3很敏感,作用24 h后细胞崩解,形态不完整,少数部位仅余细胞痕迹,培养液中细胞碎片堆积,大部分细胞死亡。作用48 h后细胞完全死亡,已见不到细胞形态。HeLa细胞形态基本正常。pET30a(+)空载体表达后超声裂解上清对SKOV3无明显影响。表1结果说明免疫毒素对SKOV3有特异性杀伤作用。
, http://www.100md.com
表1 免疫毒素183B2ScFvPE38的杀伤作用(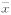 ±s)
±s)
Table 1 The cytotoxicity of immunotoxin 183B2ScFvPE38(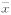 ±s) Immunotoxin
±s) Immunotoxin
volume
SKOV3
HeLa
D570nm
SR
, 百拇医药
(%)
D570nm
SR
(%)
5 μl
0.359±0.257
54.5
0.954±0.090
102.0
8 μl
0.242±0.037
36.8
, 百拇医药
0.853±0.031
91.7
10 μl
0.150±0.046
21.5
0.868±0.042
94.0
12 μl
0.137±0.052
19.3
0.789±0.059
85.8
, 百拇医药
15 μl
0.051±0.019
3.5
0.904±0.008
89.3
Live cell
0.572±0.012
-
92.704±0.102
-
Dead cell
0.030±0.006
, 百拇医药
-
0.081±0.040
-
*P<0.02 vs HeLa; SR, survival rate.3 讨论
免疫毒素是指将抗体与毒素蛋白相融合而产生的一种大分子蛋白。其中抗体部分主要负责引导毒素蛋白与靶抗原特异性结合,毒素部分则主要是实施对细胞的杀伤作用。免疫毒素能够选择性地针对表达相应抗原的细胞(如肿瘤细胞),产生杀伤作用[4]。
本实验中所采用的假单孢外毒素(PE)的作用原理为使真核细胞延伸因子EF-2失活,导致靶细胞的蛋白合成途径受阻,从而使细胞死亡。PE 是由3个结构域(domain,D)构成的[5]: DI, DⅡ, DⅢ。其中DI 又分DIa和DIb。DIa具有结合细胞的能力,负责引导PE与靶细胞膜受体相结合。DIb功能尚不清楚。DⅡ负责PE 的跨膜运输。而DⅢ则具有核糖基转移酶活性,负责催化EF-2的ADP-核糖基化。
, 百拇医药
所谓P E 3 8就是将 P E基因中编码受体识别和结合的那部分基因( Dla和部分Dlb)删除后所得到的基因及其蛋白产物[6]。由缺失了结合区的 P E与抗体相连,利用抗体分子能与抗原特异性结合的特点将毒素导向表达相应抗原的细胞,大大提高了免疫毒素对靶细胞的特异性。
另外,抗体的选择对于细胞的特异性和亲和力有着至关重要的作用。选择一个适宜的抗体必须遵循一条原则,即抗体所针对的细胞表面抗原是癌细胞独有的或在正常组织中相对较少。我室构建的抗卵巢癌单链抗体183B2 ScFv 为卵巢癌特异性[7],与正常组织交叉少。这无疑提高了免疫毒素治疗的特异性。
本实验中免疫毒素的抗体部分采用单链抗体,具有分子小、穿透力强;异源性低;导向性强;易于大量生产;又能保持完整抗体的特异性等优点。而且,具有一些有利于导向治疗的药代动力学特征,如较大的体内分布容积,较高的组织内分布比例等。
, 百拇医药
实验中,采用原核细胞表达技术,使免疫毒素的产量达到30%以上,即获得了高效表达,这为免疫毒素的大量制备及后期的临床应用打下了基础。
在抗体活性测定中,由于单链抗体缺乏Fc段,活性较难测定,因此我们利用自行纯化的抗原,经HRP标记,采用直接ELISA方法检测获得了较好的结果。ELISA结果与SDS-PAGE电泳结果均证实pET30- ScFvPE38有少量可溶性表达并具有良好的活性。所以在细胞毒性实验中,我们采用了超声裂解液上清进行杀伤实验并显示了对靶细胞特异性的杀伤作用。复性蛋白的抗体活性亦得到了证实。今后的工作中我们将进一步纯化免疫毒素蛋白,对其体内外活性进行更深入的探讨。
总之,我们成功地构建了抗卵巢癌单链免疫毒素,并初步在体外确定了表达蛋白的活性。为卵巢癌免疫导向治疗奠定了基础。
参考文献
1,周 萍,冯 捷,蒋 欣,等.抗人卵巢癌单克隆抗体COC183-B2重链可变区基因的体外扩增、克隆及序列分析[J].北京医科大学学报,1998,30:202-204
, http://www.100md.com
2,LoRusso PM, Lomen PL, Redman BG, et al. Phase I study of monoclonal antibody-ricin A chain immunoconjugate Xomazyme-791 in patients with metastatic colon cancer[J]. Am J Clin Oncol, 1995 ,18(4):307-312
3,Kuan C, Pastan I. Recombinant immunotoxin Containing a Disulfide-Stabilized Fv Directed at erbB2 that does not require proteolytic activity[J]. Biochemistry,1996,36:2872-2877
4,Kuan C, Pastan I. Improved anti-tumor activity of a recombinant anti-Lewisy immunotoxin not requiring proteolytic activition[J]. Proc Natl Acad Sci USA, 1996 , 93:974-978
, http://www.100md.com
5,Allured VS, Collier RJ, Corroll SF, et al. Structure of exotoxin A of pseudomonas aeruginosa at 3.0-Angstrom resolution[J]. Proc Natl Acad Sci USA, 1986,83:1320-1324
6,Batra JK, Kasprizyk PG, Bird RE, et al. Recombinant anti-erbB2 immunotoxins containing pseudomonas exotoxin[J]. Proc Natl Acad Sci USA, 1992,89:5867-5871
7,冯 捷,钱和年,崔 恒,等.三种抗卵巢上皮癌单克隆抗体的制备及其性能的研究与比较[J].北京医科大学学报,1989,21:11-13
(2000-04-20收稿), http://www.100md.com
单位:北京大学人民医院妇科肿瘤实验室,北京 100044
关键词:抗体;肿瘤;免疫毒素类;药物载体;代谢;卵巢肿瘤;重组融合蛋白质类;代谢
北京医科大学学报000419 [摘 要] 目的:构建抗卵巢癌单链抗体183B2ScFv 与假单孢外毒素(peudononas exotoxin, PE38)的融合蛋白表达载体并制备抗人卵巢癌单链免疫毒素蛋白183B2ScFvPE38,为卵巢癌导向治疗打下基础。方法:采用基因工程技术,经过3次亚克隆,将编码单链抗体的基因及编码毒素的基因亚克隆至原核表达载体pET30a(+)上,并在IPTG的诱导下进行表达。采用直接ELISA及细胞杀伤对抗体及毒素部分的活性进行检查。结果:表达蛋白183B2ScFvPE38具有较好的抗体活性及毒素活性。结论:抗卵巢癌单链免疫毒素183B2ScFvPE38 具有良好的免疫学活性及生物学活性,可能有良好的应用前景。
, http://www.100md.com
[中图分类号] R966 [文献标识码] A [文章编号] 1000-1530(2000)04-0347-04
Vector construction and high level expression of single chain
immunotoxin against ovarian carcinoma
YOU Fang-Lei
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
FENG Jie
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
, 百拇医药
CHEN Ye-Xia
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
QIAN He-Nian
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
ZHOU Ping
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
, 百拇医药
YE Xue
(Department of Gynecologic Oncology, Peking University People's Hospital,Beijing 100044, China)
ABSTRACT Objective:
To construct an expression vector for co_expression of single chain Fv antibody (OC183B2) and peudomonas exotoxin(PE38). Methods: Clone the genes of ScFv (OC183B2) and PE38 into PET30a(+) and then express the immunotoxin after induced with IPTG. Results: Liable activity of antibody and toxic in were both observed in the fusion recombinant protein. Conclusion: The recombinant fusion protein 183B2ScFvPE38 keeps the activity of both components and may be of great use in the future to deal with ovarian carcinoma.
, 百拇医药
KEY WORDS Antibodies, neoplasm; Immunotoxins; Drug carriers/metab; Ovarian neoplasms; Recombinant fusion proteins/metab
(J Beijing Med Univ, 2000,32:347-350)
近年来,随着分子生物学及免疫学技术的发展,肿瘤的生物学治疗已经成为除手术治疗、放疗、化疗之外重要的治疗方式。我室多年来一直从事以单克隆抗体为载体,荷载同位素、药物、毒素蛋白等,对卵巢癌进行免疫导向诊断和免疫导向治疗的研究,现已成功制备了小分子单抗[1],经99mTc标记下进行裸鼠荷瘤模型放射免疫显像的研究,并获得了清晰的图象。在此基础上,本实验意在应用本室制备的单链抗体构建免疫毒素,研究在抗体导向下,携带毒素蛋白对卵巢癌进行靶向治疗的可能性。
, 百拇医药
免疫毒素是肿瘤生物治疗的一种新方法。在国外,部分免疫毒素已进入Ⅰ期及Ⅱ期临床实验研究阶段。实验证实免疫毒素具有良好的应用前景[2,3]。但在国外卵巢癌特异性单克隆抗体构建免疫毒素的研究报道还很少见,国内未见有关报道。
1 材料与方法
1.1 载体构建及免疫毒素的高效表达
1.1.1 质粒和菌株 pET16-183B2 ScFv为本室构建的含有183B2单链抗体基因(183B2ScFv)的质粒, PAGIT为含有毒素基因(peudononas exotoxin, PE38)的质粒。高效表达质粒pET30a(+),质粒pUC18,大肠杆菌Bl21,DH5α为本室保存。质粒PAGIT及菌株GI724 为中国科学院遗传研究所黄华梁教授赠送。
, 百拇医药
1.1.2 限制性内切酶和工具酶 购自Promega公司。细胞系:卵巢癌细胞系SKOV3,宫颈癌细胞系HeLa 为本室保存。
1.1.3 免疫毒素表达载体的构建(图1) (1) pUC18-183B2ScFv的构建: pET16-183B2ScFv用NdeⅠ,EcoRⅠ消化,以切下单链抗体,并回收小片段;pUC18以相同位点酶切,回收大片段。在T4 DNA 连接酶的作用下将单链抗体亚克隆至pUC18中,并称之为pUC18-183B2ScFv。(2) pUC18-ScFvPE38的构建:将质粒pUC18-183B2ScFv用SacⅠ,EcoRⅠ消化,回收大片段;毒素PE38自PAGIT中由相同位点切下,回收并定向亚克隆至已回收的大片段中。此时所得质粒被命名为pUC18-ScFvPE38。(3) pET30-ScFvPE38的构建:pUC18-ScFvPE38 NdeⅠ,EcoRⅠ酶切下含有免疫毒素的片段,再以相同位点亚克隆至pET30a(+)中,完成高效表达载体pET30-ScFvPE38的构建。并对该质粒进行酶切鉴定。

, 百拇医药
图1 载体构建图示
Figure 1 Construction route of the vectors
1.1.4 重组质粒的诱导表达、包涵体裂解及蛋白复性 将含有重组质粒的Bl21大肠杆菌在37℃活化,1∶100(体积比)转接后继续培养至600 nm光密度约为0.4时,加IPTG至终浓度为0.4 mmol.L-1,诱导4 h后收集菌体,超声破碎细菌,离心分离包涵体,并保留上清液。上清液用PBS透析过夜。包涵体经反复洗涤后,8mol.L-1尿素溶解,加入复性液(成分:50 mmol.L-1 Tris-HCl,5mmol.L-1 EDTA,1mmol.L-1 氧化型谷光甘肽,5mmol.L-1 还原型谷光甘肽)稀释复性,10℃复性48h。PEG 20000浓缩后,对20mmol.L-1的Tris-Cl及不同浓度的尿素做梯度透析。
, 百拇医药
1.1.5 结果分析 SDS-聚丙烯酰胺凝胶电泳分析各阶段产物及其纯度。
1.2 表达蛋白活性检测
1.2.1 主要材料 抗卵巢癌单克隆抗体COC183B2为本中心制备;溴化氰活化的Sephorose4B购自Parmacia公司;辣根过氧化物酶购自北方同正生物技术发展公司。
1.2.2 测活所需的抗原的提取及标记 (1)腹水癌细胞检测OC183B2抗原阳性的病人腹水经饱和硫酸铵粗提两次,然后采用亲和层析提取抗原。亲和层析填料采用溴化氰活化的Sephorose4B,经活化后与平衡后的全抗体室温相偶联2 h后装柱,经乙醇胺封闭,醋酸缓冲液、硼酸缓冲液、硫氰酸钾洗涤后上样,并用3 mol.L-1硫氢酸钾洗脱,紫外分析仪检测。(2) 酶标抗原制备方法:亲和层析所得蛋白经浓缩透析后放入pH 9.2的0.001 mol.L-1碳酸盐缓冲液中平衡备用。辣根过氧化物酶经醛化及透析后加入上述抗原室温避光搅拌2 h,再加入新鲜配制的4g.L-1的硼氢酸钠,4℃ 2 h,并透析,即可完成标记过程。
, http://www.100md.com
1.2.3 免疫毒素的活性测定 (1)抗体活性 用直接ELISA法检测。复性蛋白以10 mg.L-1在4℃包板过夜,HRP-抗原OC183B2检测;超声裂解液上清(可溶性表达成分)用包被液梯度稀释后4℃包板过夜,用HRP-抗原检测。实验采用空载体pET30a(+)平行制备产物作为阴性对照。完整抗体COC183B2作为阳性对照。(2) 毒素活性采用细胞毒实验(MTT法)检测。靶细胞为表达OC183B2抗原的卵巢癌细胞系SKOV3,阴性细胞对照为宫颈癌细胞系HeLa(OC183B2 抗原阴性)。将培养细胞按1×105浓度接种于96孔培养板中。培养1 d后,按梯度加入经透析的免疫毒素超声裂解上清。以空载体表达上清加入SKOV3作为对照。24及48 h后观察细胞形态。48 h后加入MTT,37℃继续培养4 h,加入酸性SDS终止反应,检测570 nm光密度值(D570nm值),并按下述公式计算杀伤率。
, http://www.100md.com
细胞生存率%=(实验组D570nm-死细胞对照组D570nm)/(活细胞对照D570nm-死细胞对照D570nm)
2 结果
2.1 高效表达载体的酶切鉴定(图2)

1, recombinants digested with NdeI,EcoRI; 2, recombinants digested with SpeI;
3, recombinants digested with HindⅢ; 4, recombinants digested with SacI;
, 百拇医药 5, recombinants;6, molecular weight markers (λDNA/BstEⅡ).
图2 重组载体pET30-ScFvPE38酶切产物琼脂糖电泳结果
Figure 2 Agarose electrophoresis of cloned vector pET30-ScFvPE38
digested with restriction enzymes.
表达载体pET30-ScFvPE38经SacⅠ酶切,可以切下约1 200 bp左右大小的片段,与理论计算值相符。pET30-ScFv PE38 经NdeⅠ及EcoRⅠ 酶切所得小片段大小与免疫毒素大小相符和。HindⅢ,SpeⅠ酶切后pET30-ScFvPE38呈线性。SpeI为克隆单链抗体引进的位点。HindⅢ为pET30a(+)上的酶切位点。
, 百拇医药
2.2 表达产物免疫毒素蛋白的分析(图3)

1, molecular weight markers; 2, pET30a(+)/BL21(DE3),37℃ 4 hours after induced with 0.4 mmol.L-1 IPTG;
3, pET30-ScFvPE38, 37℃ 4 hours after induced with 0.4 mmol.L-1 IPTG;
4, sonicated supernatant; 5, inclusion body; 7,8, renatured fusion protein.
, 百拇医药 图3 SDS-PAGE鉴定pET30-ScFvPE38融合蛋白的表达和纯度
Figure 3 SDS-PAGE analysis of expression and purity
of pET30-ScFvPE38 fusion proteins
pET30-ScFvPE38 转化大肠杆菌Bl21(DE3)后,经IPTG诱导,免疫毒素以包涵体形式为主高效表达,超声裂解上清中有少量可溶形式表达。SDS-聚丙烯酰胺凝胶电泳可见包涵体及全菌在相对分子质量68 000处有浓表达带,表达量占全菌的30%以上。超声裂解液上清中,亦可在此处见到新生条带。包涵体溶解复性后,纯度达90%以上。
2.3 表达蛋白质的活性检测
(1) 直接ELISA法结果490 nm光密度值: 阴性对照 0.210;阳性对照1.191;复性蛋白 0.632;超声裂解液上清 0.796。待测值均高于阴性对照3倍以上。活性良好。(2) 细胞杀伤结果表明,对相同剂量的毒素蛋白,SKOV3很敏感,作用24 h后细胞崩解,形态不完整,少数部位仅余细胞痕迹,培养液中细胞碎片堆积,大部分细胞死亡。作用48 h后细胞完全死亡,已见不到细胞形态。HeLa细胞形态基本正常。pET30a(+)空载体表达后超声裂解上清对SKOV3无明显影响。表1结果说明免疫毒素对SKOV3有特异性杀伤作用。
, http://www.100md.com
表1 免疫毒素183B2ScFvPE38的杀伤作用(
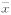 ±s)
±s)Table 1 The cytotoxicity of immunotoxin 183B2ScFvPE38(
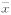 ±s) Immunotoxin
±s) Immunotoxinvolume
SKOV3
HeLa
D570nm
SR
, 百拇医药
(%)
D570nm
SR
(%)
5 μl
0.359±0.257
54.5
0.954±0.090
102.0
8 μl
0.242±0.037
36.8
, 百拇医药
0.853±0.031
91.7
10 μl
0.150±0.046
21.5
0.868±0.042
94.0
12 μl
0.137±0.052
19.3
0.789±0.059
85.8
, 百拇医药
15 μl
0.051±0.019
3.5
0.904±0.008
89.3
Live cell
0.572±0.012
-
92.704±0.102
-
Dead cell
0.030±0.006
, 百拇医药
-
0.081±0.040
-
*P<0.02 vs HeLa; SR, survival rate.3 讨论
免疫毒素是指将抗体与毒素蛋白相融合而产生的一种大分子蛋白。其中抗体部分主要负责引导毒素蛋白与靶抗原特异性结合,毒素部分则主要是实施对细胞的杀伤作用。免疫毒素能够选择性地针对表达相应抗原的细胞(如肿瘤细胞),产生杀伤作用[4]。
本实验中所采用的假单孢外毒素(PE)的作用原理为使真核细胞延伸因子EF-2失活,导致靶细胞的蛋白合成途径受阻,从而使细胞死亡。PE 是由3个结构域(domain,D)构成的[5]: DI, DⅡ, DⅢ。其中DI 又分DIa和DIb。DIa具有结合细胞的能力,负责引导PE与靶细胞膜受体相结合。DIb功能尚不清楚。DⅡ负责PE 的跨膜运输。而DⅢ则具有核糖基转移酶活性,负责催化EF-2的ADP-核糖基化。
, 百拇医药
所谓P E 3 8就是将 P E基因中编码受体识别和结合的那部分基因( Dla和部分Dlb)删除后所得到的基因及其蛋白产物[6]。由缺失了结合区的 P E与抗体相连,利用抗体分子能与抗原特异性结合的特点将毒素导向表达相应抗原的细胞,大大提高了免疫毒素对靶细胞的特异性。
另外,抗体的选择对于细胞的特异性和亲和力有着至关重要的作用。选择一个适宜的抗体必须遵循一条原则,即抗体所针对的细胞表面抗原是癌细胞独有的或在正常组织中相对较少。我室构建的抗卵巢癌单链抗体183B2 ScFv 为卵巢癌特异性[7],与正常组织交叉少。这无疑提高了免疫毒素治疗的特异性。
本实验中免疫毒素的抗体部分采用单链抗体,具有分子小、穿透力强;异源性低;导向性强;易于大量生产;又能保持完整抗体的特异性等优点。而且,具有一些有利于导向治疗的药代动力学特征,如较大的体内分布容积,较高的组织内分布比例等。
, 百拇医药
实验中,采用原核细胞表达技术,使免疫毒素的产量达到30%以上,即获得了高效表达,这为免疫毒素的大量制备及后期的临床应用打下了基础。
在抗体活性测定中,由于单链抗体缺乏Fc段,活性较难测定,因此我们利用自行纯化的抗原,经HRP标记,采用直接ELISA方法检测获得了较好的结果。ELISA结果与SDS-PAGE电泳结果均证实pET30- ScFvPE38有少量可溶性表达并具有良好的活性。所以在细胞毒性实验中,我们采用了超声裂解液上清进行杀伤实验并显示了对靶细胞特异性的杀伤作用。复性蛋白的抗体活性亦得到了证实。今后的工作中我们将进一步纯化免疫毒素蛋白,对其体内外活性进行更深入的探讨。
总之,我们成功地构建了抗卵巢癌单链免疫毒素,并初步在体外确定了表达蛋白的活性。为卵巢癌免疫导向治疗奠定了基础。
参考文献
1,周 萍,冯 捷,蒋 欣,等.抗人卵巢癌单克隆抗体COC183-B2重链可变区基因的体外扩增、克隆及序列分析[J].北京医科大学学报,1998,30:202-204
, http://www.100md.com
2,LoRusso PM, Lomen PL, Redman BG, et al. Phase I study of monoclonal antibody-ricin A chain immunoconjugate Xomazyme-791 in patients with metastatic colon cancer[J]. Am J Clin Oncol, 1995 ,18(4):307-312
3,Kuan C, Pastan I. Recombinant immunotoxin Containing a Disulfide-Stabilized Fv Directed at erbB2 that does not require proteolytic activity[J]. Biochemistry,1996,36:2872-2877
4,Kuan C, Pastan I. Improved anti-tumor activity of a recombinant anti-Lewisy immunotoxin not requiring proteolytic activition[J]. Proc Natl Acad Sci USA, 1996 , 93:974-978
, http://www.100md.com
5,Allured VS, Collier RJ, Corroll SF, et al. Structure of exotoxin A of pseudomonas aeruginosa at 3.0-Angstrom resolution[J]. Proc Natl Acad Sci USA, 1986,83:1320-1324
6,Batra JK, Kasprizyk PG, Bird RE, et al. Recombinant anti-erbB2 immunotoxins containing pseudomonas exotoxin[J]. Proc Natl Acad Sci USA, 1992,89:5867-5871
7,冯 捷,钱和年,崔 恒,等.三种抗卵巢上皮癌单克隆抗体的制备及其性能的研究与比较[J].北京医科大学学报,1989,21:11-13
(2000-04-20收稿), http://www.100md.com