聚乳酸作为骨形态发生蛋白载体修复骨缺损的实验研究
作者:谭祖键 李起鸿 许建中 杨柳 戴刚
单位:第三军医大学附属西南医院骨科,重庆,400038
关键词:羟基乳酸聚合物910;骨形态发生蛋白质类;药物载体
中华骨科杂志001210
【摘要】目的探讨聚乳酸(polylactic acid,PLA)作为骨形态发生蛋白(bone morphogenetic protein, BMP)载体的可行性及观察其诱导成骨能力。方法手术造成日本大耳白兔左尺骨中上段12mm骨缺损实验模型,随机分为实验、对照及空白组,实验组植入以PLA为载体的BM P10 mg、对照组植入以牛松质骨基质为载体的BMP 10 mg、空白组不做任何处理。术后摄X线片观察各组不同时相骨缺损修复情况,并于术后第4、8、12周观察各组缺损内组织学变化,图像分析骨小梁的生成量。结果实验组骨生成情况优于对照组,无论是骨连接发生时间还是骨成熟时间,实验组均较对照组提前2周左右,同期骨生成量也明显多于对照组,而空白组缺损内主要形成纤维组织。结论PLA可以作为BMP的载体修复骨缺损,它比异种松质骨基质载体的成骨效果更理想。此外,PLA和其它载体相比还具有以下优点:(1)可在修复骨缺损的过程中逐渐释放BMP,使缺损部位BMP维持在有效的浓度;(2)具有一定刚度,并随PLA的降解逐渐减弱,对骨折具有弹性固定的作用;(3)可根据骨折固定要求将PLA制成不同的形状;(4)具有良好的生物相容性及可调性。但是,对PLA相对分子质量及孔径与最佳成骨效果间的关系有待进一步研究。
, 百拇医药
An experimental study of bone defects repaired with bone morphogenetic protein using polylactic acid as carrier
TAN Zujian,LI Qihong,XU Jianzhong
(Department of Orthopaedics, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
【Abstract】 Objective To study the feasibility of polylactic acid(PLA) as carrier of bone morphogenetic protein(BMP), and observe its results of inducing osteogenesis. Methods A 12 mm bone defect experimental model in the left ulna of rabbits was made, the animals were divided into three groups at random, bovine BMP 10 mg with PLA carrier was implanted into the defect area in the experimental group, bovine BMP 10 mg with bovine cancellous bone matrix carrier was implanted in the control group, and nothing was implanted in the blank group. The osteogenesis of the bone in the defect area was observed by regular roentgenography, the histological changes of the bone defect tissue in 4th, 8th, 12th week after operation were studied and the new bone formation was measured by image analysis. Results The results revealed that the bone defect in the experimental group had excellent repair than that seen in the control and blank group, both bone union and the period of bone mature were earlier than that seen in the control and blank groups. There was fibration in the blank group at 12th week. Conclusion The result indicated that PLA is a material able to be used as a carrier of BMP in inducing osteogenesis, it has a better effect of inducing osteogenesis than xenogenous cancellous bone matrix. Compared with other carriers, PLA has the following advantages: 1)It releases BMP gradually during degradation, so the BMP concentration in bone defect can be maintained effectively. 2)It is a material with some rigidity, so is able to exert flexible fixation of the fractures. 3)It can be shaped to adjust itself for the individual fractures. 4)It has a good histocompatibility and an adjustable property. However, the relationship between the molecule weight, aperture of PLA and the best inducing osteogenesis need a further study.
, 百拇医药
【Key words】 Polyglactin 910; Bone morphogenetic proteins; Drug carriers
有关骨形态发生蛋白(bonemorphogeneticprotein,BMP)载体研究的文献报道较多,现已有报道的载体材料有骨基质、脱蛋白骨、胶原、羟基磷灰石(HA)、磷酸三钙(TPC)、生物玻璃颗粒、人工陶瓷等[1-5],但都存在着一定的缺陷与不足,如胶原及脱蛋白骨仍存在一定的免疫原性,HA、TPC、生物玻璃及人工陶瓷降解速度慢,阻碍新骨的形成等,所以效果都不甚理想。随着生物医学的发展,可降解生物材料的研究日益受到重视,这类材料具有较好的组织相容性及可吸收性,在骨折内固定材料及作为成骨因子的载体方面都具有良好的应用前景。本研究着重探讨聚乳酸(polylacticacid,PLA)作为BMP载体的可行性及修复骨缺损的效果。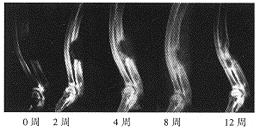
, http://www.100md.com
图1实验组术后各期X线表现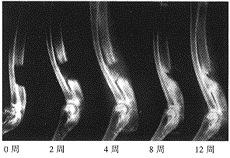
图2 对照组术后各期X线表现
图3空白组术后各期X线表现
材料与方法
一、材料制备
牛BMP由本实验室按Urist方法制备,小鼠肌袋实验证实其有诱导成骨活性;骨基质载体为脱钙、脱蛋白后经高温、高压(121℃、0.11MPa)1h消毒灭活的牛松质骨颗粒(直径约0.4mm)。高分子生物降解材料PLA由兰州大学化学系提供,孔隙率为80%,孔径为70μm。复合方法:将PLA制成长12mm、直径3mm的棒材,取BMP20mg用0.2kg/L的盐酸胍溶液2ml溶解,分成两份,分别加入牛松质骨基质载体或PLA,置于Edwards4K冷冻干燥箱中真空冻干,使BMP吸附于PLA及牛松质骨基质载体内。双层聚乙烯薄膜封装,环氧乙烷消毒2h,置4℃冰箱保存。
, 百拇医药
二、动物模型及实验方法
选用月龄8~12个月、体重2~3kg日本大耳白兔30只(雌雄不拘),3kg/L戊巴比妥钠静脉麻醉,无菌条件下手术造成左尺骨中上段12mm长的骨缺损实验模型(连同骨膜一并切除),随机分为实验组、对照组及空白组,每组10只。实验组骨缺损内植入以PLA作载体的BMP10mg,对照组植入以牛松质骨基质为载体的BMP10mg,空白组不做任何处理。植入后均不做内、外固定。分别于术后定期摄左上肢X线片(曝光条件完全一致),观察骨缺损修复情况。术后第4、8、12周每组各取2只动物对缺损中部组织采用石蜡包埋连续横行切片(厚度25μm),HE染色,镜下观察。每只动物取3张间断切片观察新骨形成情况并用图像分析新生骨的面积百分比(每组可得6个数据)。所得数据用方差分析及两两t检验做统计学分析。
结果
一、X线检查结果
, 百拇医药 本实验的X线片特点为实验组新骨形成为自骨缺损两断端及靠近桡骨侧逐渐向中心生长,基本上呈现为“包围”式生长方式。对照组这种现象不明显(图1~3)。按Yasko骨缺损修复分期方法[6],0期:无新骨形成;1期:新骨占骨缺损的百分比<25%;2期:25%~49%:3期:50%~74%;4期:75%~99%;5期:全部被新骨替代。本实验各组不同时相骨缺损修复的X线表现结果见表1。
二、组织学观察
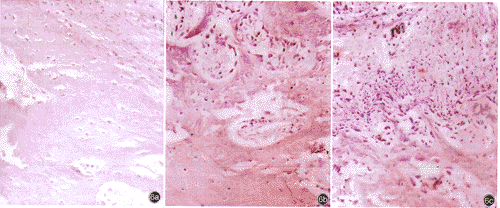
4周大体组织学观察见实验组植入的PLA被部分吸收,表面形成微孔,有大量纤维样组织长入。对照组植入的牛松质骨基质大部分被吸收,实验组及对照组骨缺损两断端及靠近桡骨侧有大量硬度较高的类骨样组织形成,空白组主要为纤维组织。第4周实验组PLA降解成网孔状,缺损内有大量的软骨细胞,骨基质较少(图4a),对照组有大量软骨细胞生成(图4b),空白组为纤维组织(图4c)。第8周实验组PLA大部分降解,生成大量的软骨基质(图5a),对照组软骨基质生成较少(图5b),空白组主要为纤维组织(图5c)。第12周实验组PLA完全降解,被较成熟的骨组织所替代(图6a);对照组缺损内基本为正常骨组织,但仍存在纤维样组织及软骨基质(图6b);空白组缺损内主要为纤维组织,有少量软骨基质生成(图6c)。三组不同时相新生骨(包括软骨基质、骨小梁、成熟骨组织)图像分析及其在骨缺损中所占面积百分比分别见表2,3。
, http://www.100md.com
表1不同时相三组骨缺损修复X线表现
分组
第2周(n=10)
第4周(n=10)
第8周(n=8)
第12周(n=6)
实验组
8(1),2(2)
3(1),7(2)
2(2),3(3),3(4)
3(4),3(5)
对照组
, 百拇医药
9(1),1(2)
6(1),4(2)
5(2),3(3)
3(3),2(4),1(5)
空白组
10(0)
10(0)
7(0),1(1)
5(0),1(1)
注:1.()内为分期
2.第8周χ2=30.429,P<0.01;第12周χ2
, 百拇医药
图4a第4周实验组PLA降解成网孔状,有大量软骨细胞生成HE染色×250图4b第4周对照组缺损内大量软骨细胞生成
HE染色×250图4c第4周空白组缺损内有纤维组织生成HE染色×250
表2三组不同时相的骨小梁像素(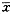 ±s,每视野像素)
±s,每视野像素)
分组
第4周
第8周
第12周
实验组(n=6)
41438±445
, http://www.100md.com
61070±481
86238±465
对照组(n=6)
30706±336
47918±496
72968±489
空白组(n=6)
18770±366
22817±415
28034±365
注:(1)每个像素面积为0.816μm×0.816μm,每视野为94323.16像素。
, 百拇医药
(2)第8周和第12周数据经方差分析差异有显著性意义,实验组与对照组相比P<0.05,实验组与空白组相比P<0.01。
表3三组不同时相骨小梁所占面积百分比(x±s,%)
分组
第4周
第8周
第12周
实验组(n=6)
43.93±0.47
64.75±0.51
91.43±0.49
对照组(n=6)
, http://www.100md.com
32.55±0.36
50.80±0.53
77.36±0.52
空白组(n=6)
19.90±0.39
24.19±0.44
29.72±0.39
讨论
BMP的应用需要有载体的支持,否则会形成局部高浓度及分布不均匀,很快被吸收。纵观多年来对BMP的研究,我们认为其理想的载体应具有以下特性:(1)生物相容性好,不引起明显的组织排异反应及炎性反应;(2)孔径及孔隙率适当,有利于组织细胞及血管长入;(3)BMP从载体中释放是逐渐进行的;(4)具有一定刚度,能在早期对骨折端起稳定作用;(5)具有细胞吸附作用及细胞与BMP反应的界面;(6)具有生物降解作用,能随新骨的形成而逐渐被吸收。本研究将PLA作为BMP的载体用于骨缺损修复取得了满意的效果。
, 百拇医药
本研究选用的PLA的相对分子质量为42×103,经兰州医学院骨科研究所及口腔科实验证明其组织相容性良好,对机体无急、慢性毒性作用,无致畸及致突变作用,14C同位素标记示踪法研究表明其降解产物——乳酸在体内参与能量代谢后以CO2的形式经肺排出,是一种安全的体内植入材料。
载体PLA与BMP复合及BMP逐渐释放的机制是:在真空条件下,PLA孔径增大,BMP被吸入PLA微孔中,吸附于PLA表面的BMP早期作用于接触的靶细胞,以后随着PLA的逐渐降解,微孔变大,BMP逐渐被释放,使骨缺损部的BMP维持在一定浓度,作用于周围间充质细胞,或间充质细胞和成纤维细胞向PLA微孔内长入,这些细胞在BMP诱导下转化为软骨和成骨细胞,产生基质,钙化形成新骨,并逐渐取代降解的PLA而使骨缺损修复,诱导新骨不断产生。余家阔等[7]研究表明:BMP载体的孔径大小直接影响其诱导成骨能力,微孔直径在75~500μm的骨基质为BMP的最佳载体,孔径太大降低了局部BMP的浓度和新骨的强度,孔径太小则间充质细胞、软骨细胞不易长入孔隙。本研究所用PLA经兰州医学院骨科研究所测试,证明其经4周降解后孔隙直径达75μm以上。实验中我们也发现4周后实验组有成骨加快的现象。这可能是由于PLA降解,孔隙加大,BMP释放增多所致。本实验采用相对分子质量较小(42×103)、降解速度较快的PLA,观察至术后第12周时PLA已基本降解完毕,能满足BMP诱导成骨的需要,取得了较满意的效果。
, http://www.100md.com
图5a第8周实验组PLA大部分降解,有大量软骨基质生成HE染色×250图5b第8周对照组有大量软骨基质生成HE染色×250图5c第8周空白组仍为纤维组织HE染色×250图6a第12周实验组有基本成熟的骨组织形成HE染色×250图6b第12周对照组有较成熟的骨组织形成,软骨基质仍存在HE染色×250图6c第12周空白组主要为纤维组织,少量软骨基质形成HE染色×250
实验研究表明,当骨折端稳定时,骨缺损以膜内或软骨内成骨的方式修复,反之则生成大量纤维组织,形成骨不连。本研究通过桡骨来稳定骨缺损端和保持骨缺损的长度,因而实验组和对照组的条件基本相同。在温度及pH值稳定的情况下,PLA的刚度与相对分子质量成正比,降解速度与相对分子质量成反比,故选用既具有一定刚度,又能在一定时间内完全降解的PLA是非常重要的。我们将在今后对这个问题做进一步研究。
虽然对照组未见明显的免疫排斥反应,但我们发现其早期缺损内仍有较多炎细胞浸润,故我们认为虽经消毒灭活,异种骨基质仍具有一定的异种蛋白反应,从而影响了骨缺损的修复能力,本实验表现为对照组的骨缺损修复时间较实验组相对滞后。
, 百拇医药
本研究还发现:(1)诱导性新骨不是在骨缺损部位均匀生成的,而是呈一“包围”性生长方式。这是由于PLA降解开始较慢,间充质细胞向PLA内“渗入”也较少,诱导性新骨仅发生在PLA与缺损的组织接触界面,后期随着PLA的降解,孔径增大,降解速度加快,BMP释放增多,中心部位成骨逐渐加速,表现为“向心性”生长方式。(2)骨痂的形成在靠近桡骨侧较多。因近桡骨侧有桡骨骨膜及骨间膜,存在大量的间充质细胞,能为BMP提供更丰富的靶细胞,从而形成更多的新骨。术后第8、12周实验组与对照组的骨生成差异有显著性意义,实验组和空白组、对照组和空白组各期骨生成差异均有非常显著性意义(P<0.01)。但是,PLA作为BMP的载体也具有局限性:(1)PLA的相对降解速度较慢,阻碍了新骨的形成,实验中我们观察到对照组牛松质骨基质在术后4周左右即被基本吸收,而PLA则要至植入后12周才被完全吸收,PLA占据了新骨形成的空间;(2)因PLA的限制作用,单位时间内BMP的释放量要较以牛松质骨基质为载体组的释放量少,而诱导成骨能力与单位体积内BMP的浓度成正比;(3)由于PLA网孔的限制,血管长入相对于牛松质骨基质为载体组少,不利于诱导性新骨的形成。但是PLA作为BMP的载体有以下优点:(1)可以根据力学要求采用相对分子质量不同的PLA,以达到弹性固定的目的;(2)可使骨缺损部位BMP在一定时间内维持有效浓度;(3)可以根据需要将PLA制成不同的形状以供不同的部位使用;(4)无需二次手术。因此,我们认为将PLA作为BMP的载体具有很大的临床和实践意义。
, http://www.100md.com
参考文献
1,Omura S, Mizuki N, Kawabe R, et al. A carrier for clinical use of recombinant human BMP-2: dehydrothermally cross-linked composite of fibrillar and denatured atelocollagen sponge. Int J Oral Maxillofac Surg, 1998, 27: 129-134.
2,Kuboki Y, Takita H, Kobayashi D, et al. BMP-induced osteogenesis on the surface of hydroxyapatite with geometrically feasible and nonfeasible structures: topology of osteogenesis. J Biomed Mater Res, 1998, 39: 190-199.
, http://www.100md.com
3,Ijiri S, Nakamura T, Fujisawa Y, et al. Ectopic bone induction in porous apatite-wollastonite-containing glass ceramic combined with bone morphogenetic protein. J Biomed Mater Res, 1997, 35: 421-432.
4,Sasano Y, Mizoguchi I, Takahashi I, et al. BMPs induce endochondral ossification in rats when implanted ectopically within a carrier made of fibrous glass membrane. Anat Rec, 1997, 247: 472-478.
5,Jacob E, Cierny G 3rd, Zorn K, et al. Delayed local treatment of rabbit tibial fractures with biodegradable cefazolin microspheres. Clin Orthop, 1997, (336): 278-285.
, http://www.100md.com
6,Yasko AW, Lane JM, Fellinger EJ, et al. The healing of segmental bone defects, induced by recombinant human bone morphogenetic protein (rhBMP-2):a radiographic, histological, and biomechanical study in rats. J Bone Joint Surg(Am), 1992, 74: 659-670.
7,余家阔,曲绵域,田得祥,等.载体对BMP活性影响的实验研究.中华外科杂志,1996,34:592-594.
(收稿日期:1999-10-12), 百拇医药
单位:第三军医大学附属西南医院骨科,重庆,400038
关键词:羟基乳酸聚合物910;骨形态发生蛋白质类;药物载体
中华骨科杂志001210
【摘要】目的探讨聚乳酸(polylactic acid,PLA)作为骨形态发生蛋白(bone morphogenetic protein, BMP)载体的可行性及观察其诱导成骨能力。方法手术造成日本大耳白兔左尺骨中上段12mm骨缺损实验模型,随机分为实验、对照及空白组,实验组植入以PLA为载体的BM P10 mg、对照组植入以牛松质骨基质为载体的BMP 10 mg、空白组不做任何处理。术后摄X线片观察各组不同时相骨缺损修复情况,并于术后第4、8、12周观察各组缺损内组织学变化,图像分析骨小梁的生成量。结果实验组骨生成情况优于对照组,无论是骨连接发生时间还是骨成熟时间,实验组均较对照组提前2周左右,同期骨生成量也明显多于对照组,而空白组缺损内主要形成纤维组织。结论PLA可以作为BMP的载体修复骨缺损,它比异种松质骨基质载体的成骨效果更理想。此外,PLA和其它载体相比还具有以下优点:(1)可在修复骨缺损的过程中逐渐释放BMP,使缺损部位BMP维持在有效的浓度;(2)具有一定刚度,并随PLA的降解逐渐减弱,对骨折具有弹性固定的作用;(3)可根据骨折固定要求将PLA制成不同的形状;(4)具有良好的生物相容性及可调性。但是,对PLA相对分子质量及孔径与最佳成骨效果间的关系有待进一步研究。
, 百拇医药
An experimental study of bone defects repaired with bone morphogenetic protein using polylactic acid as carrier
TAN Zujian,LI Qihong,XU Jianzhong
(Department of Orthopaedics, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
【Abstract】 Objective To study the feasibility of polylactic acid(PLA) as carrier of bone morphogenetic protein(BMP), and observe its results of inducing osteogenesis. Methods A 12 mm bone defect experimental model in the left ulna of rabbits was made, the animals were divided into three groups at random, bovine BMP 10 mg with PLA carrier was implanted into the defect area in the experimental group, bovine BMP 10 mg with bovine cancellous bone matrix carrier was implanted in the control group, and nothing was implanted in the blank group. The osteogenesis of the bone in the defect area was observed by regular roentgenography, the histological changes of the bone defect tissue in 4th, 8th, 12th week after operation were studied and the new bone formation was measured by image analysis. Results The results revealed that the bone defect in the experimental group had excellent repair than that seen in the control and blank group, both bone union and the period of bone mature were earlier than that seen in the control and blank groups. There was fibration in the blank group at 12th week. Conclusion The result indicated that PLA is a material able to be used as a carrier of BMP in inducing osteogenesis, it has a better effect of inducing osteogenesis than xenogenous cancellous bone matrix. Compared with other carriers, PLA has the following advantages: 1)It releases BMP gradually during degradation, so the BMP concentration in bone defect can be maintained effectively. 2)It is a material with some rigidity, so is able to exert flexible fixation of the fractures. 3)It can be shaped to adjust itself for the individual fractures. 4)It has a good histocompatibility and an adjustable property. However, the relationship between the molecule weight, aperture of PLA and the best inducing osteogenesis need a further study.
, 百拇医药
【Key words】 Polyglactin 910; Bone morphogenetic proteins; Drug carriers
有关骨形态发生蛋白(bonemorphogeneticprotein,BMP)载体研究的文献报道较多,现已有报道的载体材料有骨基质、脱蛋白骨、胶原、羟基磷灰石(HA)、磷酸三钙(TPC)、生物玻璃颗粒、人工陶瓷等[1-5],但都存在着一定的缺陷与不足,如胶原及脱蛋白骨仍存在一定的免疫原性,HA、TPC、生物玻璃及人工陶瓷降解速度慢,阻碍新骨的形成等,所以效果都不甚理想。随着生物医学的发展,可降解生物材料的研究日益受到重视,这类材料具有较好的组织相容性及可吸收性,在骨折内固定材料及作为成骨因子的载体方面都具有良好的应用前景。本研究着重探讨聚乳酸(polylacticacid,PLA)作为BMP载体的可行性及修复骨缺损的效果。

, http://www.100md.com
图1实验组术后各期X线表现

图2 对照组术后各期X线表现

图3空白组术后各期X线表现
材料与方法
一、材料制备
牛BMP由本实验室按Urist方法制备,小鼠肌袋实验证实其有诱导成骨活性;骨基质载体为脱钙、脱蛋白后经高温、高压(121℃、0.11MPa)1h消毒灭活的牛松质骨颗粒(直径约0.4mm)。高分子生物降解材料PLA由兰州大学化学系提供,孔隙率为80%,孔径为70μm。复合方法:将PLA制成长12mm、直径3mm的棒材,取BMP20mg用0.2kg/L的盐酸胍溶液2ml溶解,分成两份,分别加入牛松质骨基质载体或PLA,置于Edwards4K冷冻干燥箱中真空冻干,使BMP吸附于PLA及牛松质骨基质载体内。双层聚乙烯薄膜封装,环氧乙烷消毒2h,置4℃冰箱保存。
, 百拇医药
二、动物模型及实验方法
选用月龄8~12个月、体重2~3kg日本大耳白兔30只(雌雄不拘),3kg/L戊巴比妥钠静脉麻醉,无菌条件下手术造成左尺骨中上段12mm长的骨缺损实验模型(连同骨膜一并切除),随机分为实验组、对照组及空白组,每组10只。实验组骨缺损内植入以PLA作载体的BMP10mg,对照组植入以牛松质骨基质为载体的BMP10mg,空白组不做任何处理。植入后均不做内、外固定。分别于术后定期摄左上肢X线片(曝光条件完全一致),观察骨缺损修复情况。术后第4、8、12周每组各取2只动物对缺损中部组织采用石蜡包埋连续横行切片(厚度25μm),HE染色,镜下观察。每只动物取3张间断切片观察新骨形成情况并用图像分析新生骨的面积百分比(每组可得6个数据)。所得数据用方差分析及两两t检验做统计学分析。
结果
一、X线检查结果
, 百拇医药 本实验的X线片特点为实验组新骨形成为自骨缺损两断端及靠近桡骨侧逐渐向中心生长,基本上呈现为“包围”式生长方式。对照组这种现象不明显(图1~3)。按Yasko骨缺损修复分期方法[6],0期:无新骨形成;1期:新骨占骨缺损的百分比<25%;2期:25%~49%:3期:50%~74%;4期:75%~99%;5期:全部被新骨替代。本实验各组不同时相骨缺损修复的X线表现结果见表1。
二、组织学观察
4周大体组织学观察见实验组植入的PLA被部分吸收,表面形成微孔,有大量纤维样组织长入。对照组植入的牛松质骨基质大部分被吸收,实验组及对照组骨缺损两断端及靠近桡骨侧有大量硬度较高的类骨样组织形成,空白组主要为纤维组织。第4周实验组PLA降解成网孔状,缺损内有大量的软骨细胞,骨基质较少(图4a),对照组有大量软骨细胞生成(图4b),空白组为纤维组织(图4c)。第8周实验组PLA大部分降解,生成大量的软骨基质(图5a),对照组软骨基质生成较少(图5b),空白组主要为纤维组织(图5c)。第12周实验组PLA完全降解,被较成熟的骨组织所替代(图6a);对照组缺损内基本为正常骨组织,但仍存在纤维样组织及软骨基质(图6b);空白组缺损内主要为纤维组织,有少量软骨基质生成(图6c)。三组不同时相新生骨(包括软骨基质、骨小梁、成熟骨组织)图像分析及其在骨缺损中所占面积百分比分别见表2,3。
, http://www.100md.com
表1不同时相三组骨缺损修复X线表现
分组
第2周(n=10)
第4周(n=10)
第8周(n=8)
第12周(n=6)
实验组
8(1),2(2)
3(1),7(2)
2(2),3(3),3(4)
3(4),3(5)
对照组
, 百拇医药
9(1),1(2)
6(1),4(2)
5(2),3(3)
3(3),2(4),1(5)
空白组
10(0)
10(0)
7(0),1(1)
5(0),1(1)
注:1.()内为分期
2.第8周χ2=30.429,P<0.01;第12周χ2

, 百拇医药
图4a第4周实验组PLA降解成网孔状,有大量软骨细胞生成HE染色×250图4b第4周对照组缺损内大量软骨细胞生成
HE染色×250图4c第4周空白组缺损内有纤维组织生成HE染色×250
表2三组不同时相的骨小梁像素(
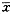 ±s,每视野像素)
±s,每视野像素)分组
第4周
第8周
第12周
实验组(n=6)
41438±445
, http://www.100md.com
61070±481
86238±465
对照组(n=6)
30706±336
47918±496
72968±489
空白组(n=6)
18770±366
22817±415
28034±365
注:(1)每个像素面积为0.816μm×0.816μm,每视野为94323.16像素。
, 百拇医药
(2)第8周和第12周数据经方差分析差异有显著性意义,实验组与对照组相比P<0.05,实验组与空白组相比P<0.01。
表3三组不同时相骨小梁所占面积百分比(x±s,%)
分组
第4周
第8周
第12周
实验组(n=6)
43.93±0.47
64.75±0.51
91.43±0.49
对照组(n=6)
, http://www.100md.com
32.55±0.36
50.80±0.53
77.36±0.52
空白组(n=6)
19.90±0.39
24.19±0.44
29.72±0.39
讨论
BMP的应用需要有载体的支持,否则会形成局部高浓度及分布不均匀,很快被吸收。纵观多年来对BMP的研究,我们认为其理想的载体应具有以下特性:(1)生物相容性好,不引起明显的组织排异反应及炎性反应;(2)孔径及孔隙率适当,有利于组织细胞及血管长入;(3)BMP从载体中释放是逐渐进行的;(4)具有一定刚度,能在早期对骨折端起稳定作用;(5)具有细胞吸附作用及细胞与BMP反应的界面;(6)具有生物降解作用,能随新骨的形成而逐渐被吸收。本研究将PLA作为BMP的载体用于骨缺损修复取得了满意的效果。
, 百拇医药
本研究选用的PLA的相对分子质量为42×103,经兰州医学院骨科研究所及口腔科实验证明其组织相容性良好,对机体无急、慢性毒性作用,无致畸及致突变作用,14C同位素标记示踪法研究表明其降解产物——乳酸在体内参与能量代谢后以CO2的形式经肺排出,是一种安全的体内植入材料。
载体PLA与BMP复合及BMP逐渐释放的机制是:在真空条件下,PLA孔径增大,BMP被吸入PLA微孔中,吸附于PLA表面的BMP早期作用于接触的靶细胞,以后随着PLA的逐渐降解,微孔变大,BMP逐渐被释放,使骨缺损部的BMP维持在一定浓度,作用于周围间充质细胞,或间充质细胞和成纤维细胞向PLA微孔内长入,这些细胞在BMP诱导下转化为软骨和成骨细胞,产生基质,钙化形成新骨,并逐渐取代降解的PLA而使骨缺损修复,诱导新骨不断产生。余家阔等[7]研究表明:BMP载体的孔径大小直接影响其诱导成骨能力,微孔直径在75~500μm的骨基质为BMP的最佳载体,孔径太大降低了局部BMP的浓度和新骨的强度,孔径太小则间充质细胞、软骨细胞不易长入孔隙。本研究所用PLA经兰州医学院骨科研究所测试,证明其经4周降解后孔隙直径达75μm以上。实验中我们也发现4周后实验组有成骨加快的现象。这可能是由于PLA降解,孔隙加大,BMP释放增多所致。本实验采用相对分子质量较小(42×103)、降解速度较快的PLA,观察至术后第12周时PLA已基本降解完毕,能满足BMP诱导成骨的需要,取得了较满意的效果。


, http://www.100md.com
图5a第8周实验组PLA大部分降解,有大量软骨基质生成HE染色×250图5b第8周对照组有大量软骨基质生成HE染色×250图5c第8周空白组仍为纤维组织HE染色×250图6a第12周实验组有基本成熟的骨组织形成HE染色×250图6b第12周对照组有较成熟的骨组织形成,软骨基质仍存在HE染色×250图6c第12周空白组主要为纤维组织,少量软骨基质形成HE染色×250
实验研究表明,当骨折端稳定时,骨缺损以膜内或软骨内成骨的方式修复,反之则生成大量纤维组织,形成骨不连。本研究通过桡骨来稳定骨缺损端和保持骨缺损的长度,因而实验组和对照组的条件基本相同。在温度及pH值稳定的情况下,PLA的刚度与相对分子质量成正比,降解速度与相对分子质量成反比,故选用既具有一定刚度,又能在一定时间内完全降解的PLA是非常重要的。我们将在今后对这个问题做进一步研究。
虽然对照组未见明显的免疫排斥反应,但我们发现其早期缺损内仍有较多炎细胞浸润,故我们认为虽经消毒灭活,异种骨基质仍具有一定的异种蛋白反应,从而影响了骨缺损的修复能力,本实验表现为对照组的骨缺损修复时间较实验组相对滞后。
, 百拇医药
本研究还发现:(1)诱导性新骨不是在骨缺损部位均匀生成的,而是呈一“包围”性生长方式。这是由于PLA降解开始较慢,间充质细胞向PLA内“渗入”也较少,诱导性新骨仅发生在PLA与缺损的组织接触界面,后期随着PLA的降解,孔径增大,降解速度加快,BMP释放增多,中心部位成骨逐渐加速,表现为“向心性”生长方式。(2)骨痂的形成在靠近桡骨侧较多。因近桡骨侧有桡骨骨膜及骨间膜,存在大量的间充质细胞,能为BMP提供更丰富的靶细胞,从而形成更多的新骨。术后第8、12周实验组与对照组的骨生成差异有显著性意义,实验组和空白组、对照组和空白组各期骨生成差异均有非常显著性意义(P<0.01)。但是,PLA作为BMP的载体也具有局限性:(1)PLA的相对降解速度较慢,阻碍了新骨的形成,实验中我们观察到对照组牛松质骨基质在术后4周左右即被基本吸收,而PLA则要至植入后12周才被完全吸收,PLA占据了新骨形成的空间;(2)因PLA的限制作用,单位时间内BMP的释放量要较以牛松质骨基质为载体组的释放量少,而诱导成骨能力与单位体积内BMP的浓度成正比;(3)由于PLA网孔的限制,血管长入相对于牛松质骨基质为载体组少,不利于诱导性新骨的形成。但是PLA作为BMP的载体有以下优点:(1)可以根据力学要求采用相对分子质量不同的PLA,以达到弹性固定的目的;(2)可使骨缺损部位BMP在一定时间内维持有效浓度;(3)可以根据需要将PLA制成不同的形状以供不同的部位使用;(4)无需二次手术。因此,我们认为将PLA作为BMP的载体具有很大的临床和实践意义。
, http://www.100md.com
参考文献
1,Omura S, Mizuki N, Kawabe R, et al. A carrier for clinical use of recombinant human BMP-2: dehydrothermally cross-linked composite of fibrillar and denatured atelocollagen sponge. Int J Oral Maxillofac Surg, 1998, 27: 129-134.
2,Kuboki Y, Takita H, Kobayashi D, et al. BMP-induced osteogenesis on the surface of hydroxyapatite with geometrically feasible and nonfeasible structures: topology of osteogenesis. J Biomed Mater Res, 1998, 39: 190-199.
, http://www.100md.com
3,Ijiri S, Nakamura T, Fujisawa Y, et al. Ectopic bone induction in porous apatite-wollastonite-containing glass ceramic combined with bone morphogenetic protein. J Biomed Mater Res, 1997, 35: 421-432.
4,Sasano Y, Mizoguchi I, Takahashi I, et al. BMPs induce endochondral ossification in rats when implanted ectopically within a carrier made of fibrous glass membrane. Anat Rec, 1997, 247: 472-478.
5,Jacob E, Cierny G 3rd, Zorn K, et al. Delayed local treatment of rabbit tibial fractures with biodegradable cefazolin microspheres. Clin Orthop, 1997, (336): 278-285.
, http://www.100md.com
6,Yasko AW, Lane JM, Fellinger EJ, et al. The healing of segmental bone defects, induced by recombinant human bone morphogenetic protein (rhBMP-2):a radiographic, histological, and biomechanical study in rats. J Bone Joint Surg(Am), 1992, 74: 659-670.
7,余家阔,曲绵域,田得祥,等.载体对BMP活性影响的实验研究.中华外科杂志,1996,34:592-594.
(收稿日期:1999-10-12), 百拇医药