低频电磁场对细胞生物效应的研究
作者:陈树德 张红锋 陈家森 叶士景 王耀发
单位:200062 上海,华东师范大学
关键词:磁力学;表皮/代谢;生物学效用
中华物理医学杂志980205 摘 要 目的 研究低频电磁场对细胞的生物效应中场作用时间和细胞密度对该效应的影响,并探讨产生影响的机制。方法 用MTT比色分析法检测了脉冲电场作用时间不同对人表皮细胞增殖的影响,并用MTT比色分析法检测脉冲电场作用条件相同而样品细胞密度数不同时对人表皮细胞增殖的影响。结果 脉冲电场作用时间不同,对细胞产生的效应是不同的。较短时间(小于10分钟)的脉冲电场作用能促进人表皮细胞增殖,而较长时间(大于10分钟)的脉冲电场作用则抑制细胞的增殖。若脉冲电场作用条件相同(场强,频率,脉宽,作用时间等均相同),而样品细胞密度数不同时,其实验结果也是不同的。结论 低频电磁场对细胞增殖存在直接和间接作用,而这种间接作用机理可能起着不能被忽视的影响。
, 百拇医药
中图号 R318.03
Study on Biological Effects of Low-fequency Electromagnetic Fields on Cell Chen Shude, Zhang Hongfeng, Chen Jiasen, et al.Department of Physics,East China Normal University, Shanghai 200062
Abstract Objective To study the biological effects of low-frequency electromagnetic fields on cell in different exposure time and different concentration of target cell and to elucidate the mechanism of the effects.Methods The effects of low-frequency pulsed electric fields on cell proliferation of human epidermis were examined in different exposure time and different concentration of target cell by MTT colorimetry.Results Different effects were obtained in different exposure time.In short time(<10 minutes), the pulsed electric fields promoted cell proliferation and in longer time(>10 minutes), the pulsed electric fields inhibited cell proliferation.Distinct alteration of the effects was also obtained in different concentration of target cell.Conclusion Low-frequency pulsed electric fields could affect the cell proliferation not only in direct manner,but also in indirect manner.The effects of indirect manner on cell proliferation may be important.
, 百拇医药
Key Words magnetics;epidermis/metab;biological availability
电磁场影响细胞增殖的研究已有多篇文献报道〔1~4〕。即使是强度很弱,频率很低的电磁场,若长时间作用于细胞,也能产生明显的生物电磁效应〔3〕。在我们的实验中研究了短时间(1~30分钟)较强的低频脉冲电场(在培养液中电场强度峰-峰值为Epp=1V/m)对人表皮细胞增殖的影响。
材料和方法
一、细胞和细胞培养
每次实验,所有的人表皮细胞均取自同一人包皮组织。经胰蛋白酶消化、剥离、滴管吹打、过滤、离心等过程,收集实验所需的表皮细胞。培养液为含10%小牛血清,20 μg/ml表皮生长因子,5 μg/ml胰岛素的DMEM细胞培养液(Dubecco's modified eagle medium),制成5×105 cell/ml密度数的表皮细胞悬液(在检测样品细胞密度影响时,该细胞悬液的密度数为2×105 cell/ml至10×105 cell/ml)。将悬液接种于96孔细胞培养板中。其中每孔取100 μl细胞悬液,制成实验用细胞样品。每一样品(包括对照组和各种实验条件的实验组样品)均由每一块细胞培养板中间部分的48孔组成,以便对实验结果进行统计分析。实验前需将样品静置于37℃下培养24小时,以消除细胞消化、移植等过程对细胞生长所造成的影响。对实验组细胞进行电磁场处理时,对照组和实验组细胞同时从培养箱中取出置于室温下相同的时间,然后再同时放入37℃培养箱中继续培养3天,换培养液后继续培养2天,前后培养5天后用MTT比色分析法检测每组细胞增殖情况。
, 百拇医药
二、施加脉冲电场实验
实验用自制的脉冲电场发生器,其频率为50赫兹(f=50 Hz),脉宽为20微秒(τ=20 μs)。脉冲电场存在于两圆形平板电极中,将实验组样品细胞培养板置于两圆形平板电极之间。根据实验需要,样品细胞在电场中作用时间分别为1分钟,5分钟,10分钟,15分钟,20分钟,30分钟。根据电磁学原理测算,作用在细胞培养液中的脉冲电场强度的峰-峰值为Epp=1V/m(我们认为用培养液中场强来表示实验条件更为精确)。
三、改变样品细胞密度数实验
实验中所用的脉冲电场仍为频率f=50 Hz,脉宽τ=20 μs,场强峰-峰值Epp=1V/m,并且对不同细胞密度数的实验样品的作用时间均为15分钟(t=15 min)。细胞密度数分别为2×105、5×105、8×105、10×105 cell/ml,每组样品均设有对照组。
, 百拇医药
四、MTT比色分析法检测细胞增殖〔5〕
MTT〔3-(4,5-dimethylthiazol-2-yl) 2,5-diphenyl tetrazolium bromide〕为德国BOEHRINGER MANNHEIM公司产品。细胞线粒体对MTT的代谢会产生紫色的甲月 替结晶。在实验中用无血清DMEM培养液配成浓度为5 mg/ml的MTT溶液在样品细胞培养终止前4小时,同时将每孔的培养液换成100 μL的MTT溶液,继续培养4小时后倒去上清液,用二甲亚矾(100 μL/孔)充分溶解甲月 替结晶,旋转振荡数次,在显微镜下观察,直到紫色结晶全部溶解后,用酶联免疫检测仪测定各孔在570 nm波长处的光密度值。该光密度值与每孔中细胞密度成线性关系〔5〕,求出各样品48孔的光密度值的统计平均值 以及标准偏差Δx,再求出各实验样品相对对照组样品的光密度值的百分变化率(cp)
以及标准偏差Δx,再求出各实验样品相对对照组样品的光密度值的百分变化率(cp)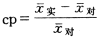
, http://www.100md.com
式中 实为实验样品光密度值的平均值,
实为实验样品光密度值的平均值, 对为对照组样品光密度值的平均值。该光密度的百分变化率(cp)即为各实验样品相对于对照组样品的细胞密度数的变化率。由于样品制备时,实验样品和对照组样品的细胞密度数均相同,实验测得的各实验样品细胞密度数的百分变化率,即为各实验样品细胞增殖快慢的百分变化率。并用t检验来确定实验样品和对照组样品之间差异的显著性。
对为对照组样品光密度值的平均值。该光密度的百分变化率(cp)即为各实验样品相对于对照组样品的细胞密度数的变化率。由于样品制备时,实验样品和对照组样品的细胞密度数均相同,实验测得的各实验样品细胞密度数的百分变化率,即为各实验样品细胞增殖快慢的百分变化率。并用t检验来确定实验样品和对照组样品之间差异的显著性。
结果与讨论
一、表1为同一脉冲电场(f=50 Hz,Epp=1V/m,τ=20 μs)、不同作用时间产生不同效应的实验结果,在该实验中,各实验样品和对照组样品的细胞密度数均为5×105 cell/ml。No.1和No.2二块细胞培养板均未经电场作用,它们的光密度值的平均值分别为0.267±0.017和0.272±0.019。经t检验,二平均值之间无明显差异(P<0.2)。这一结果说明,在实验过程中实验条件的控制是好的,故测量误差较小(百分变化率为1.8%)。
, http://www.100md.com
二、No.3至No.8细胞培养板,分别被电场处理1分钟至30分钟。从表中可看出它们的光密度值的平均值与对照组(No.1)的光密度值的平均值有明显(P<0.05)或极明显(P<0.001)的差异。这说明脉冲电场作用使人表皮细胞的增殖发生了明显的变化。并且脉冲电场对人表皮细胞作用1分钟和5分钟均产生了促进细胞增殖的效果。而较长时间(10分钟至30分钟)的作用则会抑制细胞的正常增殖。
表1 不同作用时间对细胞增殖的影响(细胞浓度均为5×105 cell/ml) 细胞培养
板序号(No.)
1
2
3
4
, 百拇医药
5
6
7
8
电场作用
时间(min)
0
0
1
5
10
15
20
30
, 百拇医药
光密度平均值
0.267±0.017
0.272±0.019
0.326±0.054
0.299±0.044
0.239±0.089
0.245±0.075
0.238±0.035
0.194±0.057
光密度平均值
百分变化率
, http://www.100md.com +1.8%
+22.0%
+12.0%
-10.7%
-8.4%
-10.9%
-27.4%
t检验(P)
<0.2
<0.001
<0.001
<0.05
<0.05
, http://www.100md.com
<0.001
<0.001
表2 不同细胞密度数对细胞增殖的影响 细胞培养
板序号(No.)
1
2
3
4
5
6
7
8
细胞浓度
, http://www.100md.com
(×105cell/ml)
2
2
4
4
8
8
10
10
电场作用时间(min)
0
15
0
, 百拇医药
15
0
15
0
15
光密度平均值
0.170±0.040
0.140±0.020
0.250±0.080
0.223±0.035
0.326±0.040
0.340±0.050
, 百拇医药
0.435±0.068
0.462±0.051
光密度平均值
变化率
-17.6
-10.8%
+4.3%
+6.2%
t检验(P)
<0.001
p<0.005
p<0.3
, 百拇医药
<0.05
三、表2是相同的脉冲电场、相同的场作用时间(f=50 Hz,Epp=1V/m,τ=20 μs,t=15 min)及不同的细胞密度数的实验结果。其中No.1,No.3,No.5,No.7为对照组。No.2,No.4,No.6,No.8为实验组。实验发现在细胞密度数较小时(≤5×105 cell/ml),脉冲电场产生抑制细胞增殖的效应(P<0.05,P<0.001),而在细胞密度数较大的情况下(≥8×105 cell/ml),同样条件的脉冲电场则没有产生抑制细胞增殖的效应,且在细胞密度为10×105 cell/ml时还出现了促进细胞增殖的效应(P<0.05)。根据报道,相同的电场对细胞直接作用所产生的效应(如对胞内某些酶的活性的影响〔6〕)应是不随细胞密度数的变化而变化的。但相同的电场通过影响细胞周围的环境(如培养液的理化特性)进而再影响细胞增殖的间接效应则可能是随细胞密度数的改变而变化的。故这一实验结果表明:脉冲电场除了直接对细胞作用,产生促进或抑制细胞增殖的效应外,可能还对细胞周围的环境产生了影响(如培养液的理化特性)进而再间接地影响那些促进或抑制细胞增殖的效应。脉冲电场是如何影响胞外的环境再进而间接地影响细胞增殖的问题,我们将另文报道。
, 百拇医药
参考文献
1 Mcleod KJ,Lee RC, Ehrich HP. Frequency dependence of electric field modulation of fibroblast protein synthesis. Science, 1987, 236:1465-1469.
2 Liboff AR, Williams T, Strong DM,et al.Time-varying magnetic fields:effects on DNA synthesis. Science, 1984,233:818-820.
3 Stephen M.Combined DC and ELF magnetic fields can alter cell proliferation. Bioelectromagnetics, 1990, 11:27-36.
, http://www.100md.com
4 Berg H, Zhang L.Electrostimulation in cell biology by low-frequency electromagnetic fields. Electro and Magnotobiology,1993,12(2):147-163.
5 Mosmann TJ. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Immunol Methods, 1983,65: 55-63.
6 Blank M, Sool L, Papstein V.Effects of low frequency magnetic fields on Na,K-ATPase activity. Bioelectochem Bioenerg, 1995,38:267-273.
(收稿 1997-12-04 修回 1998-04-17), http://www.100md.com
单位:200062 上海,华东师范大学
关键词:磁力学;表皮/代谢;生物学效用
中华物理医学杂志980205 摘 要 目的 研究低频电磁场对细胞的生物效应中场作用时间和细胞密度对该效应的影响,并探讨产生影响的机制。方法 用MTT比色分析法检测了脉冲电场作用时间不同对人表皮细胞增殖的影响,并用MTT比色分析法检测脉冲电场作用条件相同而样品细胞密度数不同时对人表皮细胞增殖的影响。结果 脉冲电场作用时间不同,对细胞产生的效应是不同的。较短时间(小于10分钟)的脉冲电场作用能促进人表皮细胞增殖,而较长时间(大于10分钟)的脉冲电场作用则抑制细胞的增殖。若脉冲电场作用条件相同(场强,频率,脉宽,作用时间等均相同),而样品细胞密度数不同时,其实验结果也是不同的。结论 低频电磁场对细胞增殖存在直接和间接作用,而这种间接作用机理可能起着不能被忽视的影响。
, 百拇医药
中图号 R318.03
Study on Biological Effects of Low-fequency Electromagnetic Fields on Cell Chen Shude, Zhang Hongfeng, Chen Jiasen, et al.Department of Physics,East China Normal University, Shanghai 200062
Abstract Objective To study the biological effects of low-frequency electromagnetic fields on cell in different exposure time and different concentration of target cell and to elucidate the mechanism of the effects.Methods The effects of low-frequency pulsed electric fields on cell proliferation of human epidermis were examined in different exposure time and different concentration of target cell by MTT colorimetry.Results Different effects were obtained in different exposure time.In short time(<10 minutes), the pulsed electric fields promoted cell proliferation and in longer time(>10 minutes), the pulsed electric fields inhibited cell proliferation.Distinct alteration of the effects was also obtained in different concentration of target cell.Conclusion Low-frequency pulsed electric fields could affect the cell proliferation not only in direct manner,but also in indirect manner.The effects of indirect manner on cell proliferation may be important.
, 百拇医药
Key Words magnetics;epidermis/metab;biological availability
电磁场影响细胞增殖的研究已有多篇文献报道〔1~4〕。即使是强度很弱,频率很低的电磁场,若长时间作用于细胞,也能产生明显的生物电磁效应〔3〕。在我们的实验中研究了短时间(1~30分钟)较强的低频脉冲电场(在培养液中电场强度峰-峰值为Epp=1V/m)对人表皮细胞增殖的影响。
材料和方法
一、细胞和细胞培养
每次实验,所有的人表皮细胞均取自同一人包皮组织。经胰蛋白酶消化、剥离、滴管吹打、过滤、离心等过程,收集实验所需的表皮细胞。培养液为含10%小牛血清,20 μg/ml表皮生长因子,5 μg/ml胰岛素的DMEM细胞培养液(Dubecco's modified eagle medium),制成5×105 cell/ml密度数的表皮细胞悬液(在检测样品细胞密度影响时,该细胞悬液的密度数为2×105 cell/ml至10×105 cell/ml)。将悬液接种于96孔细胞培养板中。其中每孔取100 μl细胞悬液,制成实验用细胞样品。每一样品(包括对照组和各种实验条件的实验组样品)均由每一块细胞培养板中间部分的48孔组成,以便对实验结果进行统计分析。实验前需将样品静置于37℃下培养24小时,以消除细胞消化、移植等过程对细胞生长所造成的影响。对实验组细胞进行电磁场处理时,对照组和实验组细胞同时从培养箱中取出置于室温下相同的时间,然后再同时放入37℃培养箱中继续培养3天,换培养液后继续培养2天,前后培养5天后用MTT比色分析法检测每组细胞增殖情况。
, 百拇医药
二、施加脉冲电场实验
实验用自制的脉冲电场发生器,其频率为50赫兹(f=50 Hz),脉宽为20微秒(τ=20 μs)。脉冲电场存在于两圆形平板电极中,将实验组样品细胞培养板置于两圆形平板电极之间。根据实验需要,样品细胞在电场中作用时间分别为1分钟,5分钟,10分钟,15分钟,20分钟,30分钟。根据电磁学原理测算,作用在细胞培养液中的脉冲电场强度的峰-峰值为Epp=1V/m(我们认为用培养液中场强来表示实验条件更为精确)。
三、改变样品细胞密度数实验
实验中所用的脉冲电场仍为频率f=50 Hz,脉宽τ=20 μs,场强峰-峰值Epp=1V/m,并且对不同细胞密度数的实验样品的作用时间均为15分钟(t=15 min)。细胞密度数分别为2×105、5×105、8×105、10×105 cell/ml,每组样品均设有对照组。
, 百拇医药
四、MTT比色分析法检测细胞增殖〔5〕
MTT〔3-(4,5-dimethylthiazol-2-yl) 2,5-diphenyl tetrazolium bromide〕为德国BOEHRINGER MANNHEIM公司产品。细胞线粒体对MTT的代谢会产生紫色的甲月 替结晶。在实验中用无血清DMEM培养液配成浓度为5 mg/ml的MTT溶液在样品细胞培养终止前4小时,同时将每孔的培养液换成100 μL的MTT溶液,继续培养4小时后倒去上清液,用二甲亚矾(100 μL/孔)充分溶解甲月 替结晶,旋转振荡数次,在显微镜下观察,直到紫色结晶全部溶解后,用酶联免疫检测仪测定各孔在570 nm波长处的光密度值。该光密度值与每孔中细胞密度成线性关系〔5〕,求出各样品48孔的光密度值的统计平均值
 以及标准偏差Δx,再求出各实验样品相对对照组样品的光密度值的百分变化率(cp)
以及标准偏差Δx,再求出各实验样品相对对照组样品的光密度值的百分变化率(cp)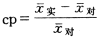
, http://www.100md.com
式中
 实为实验样品光密度值的平均值,
实为实验样品光密度值的平均值, 对为对照组样品光密度值的平均值。该光密度的百分变化率(cp)即为各实验样品相对于对照组样品的细胞密度数的变化率。由于样品制备时,实验样品和对照组样品的细胞密度数均相同,实验测得的各实验样品细胞密度数的百分变化率,即为各实验样品细胞增殖快慢的百分变化率。并用t检验来确定实验样品和对照组样品之间差异的显著性。
对为对照组样品光密度值的平均值。该光密度的百分变化率(cp)即为各实验样品相对于对照组样品的细胞密度数的变化率。由于样品制备时,实验样品和对照组样品的细胞密度数均相同,实验测得的各实验样品细胞密度数的百分变化率,即为各实验样品细胞增殖快慢的百分变化率。并用t检验来确定实验样品和对照组样品之间差异的显著性。结果与讨论
一、表1为同一脉冲电场(f=50 Hz,Epp=1V/m,τ=20 μs)、不同作用时间产生不同效应的实验结果,在该实验中,各实验样品和对照组样品的细胞密度数均为5×105 cell/ml。No.1和No.2二块细胞培养板均未经电场作用,它们的光密度值的平均值分别为0.267±0.017和0.272±0.019。经t检验,二平均值之间无明显差异(P<0.2)。这一结果说明,在实验过程中实验条件的控制是好的,故测量误差较小(百分变化率为1.8%)。
, http://www.100md.com
二、No.3至No.8细胞培养板,分别被电场处理1分钟至30分钟。从表中可看出它们的光密度值的平均值与对照组(No.1)的光密度值的平均值有明显(P<0.05)或极明显(P<0.001)的差异。这说明脉冲电场作用使人表皮细胞的增殖发生了明显的变化。并且脉冲电场对人表皮细胞作用1分钟和5分钟均产生了促进细胞增殖的效果。而较长时间(10分钟至30分钟)的作用则会抑制细胞的正常增殖。
表1 不同作用时间对细胞增殖的影响(细胞浓度均为5×105 cell/ml) 细胞培养
板序号(No.)
1
2
3
4
, 百拇医药
5
6
7
8
电场作用
时间(min)
0
0
1
5
10
15
20
30
, 百拇医药
光密度平均值
0.267±0.017
0.272±0.019
0.326±0.054
0.299±0.044
0.239±0.089
0.245±0.075
0.238±0.035
0.194±0.057
光密度平均值
百分变化率
, http://www.100md.com +1.8%
+22.0%
+12.0%
-10.7%
-8.4%
-10.9%
-27.4%
t检验(P)
<0.2
<0.001
<0.001
<0.05
<0.05
, http://www.100md.com
<0.001
<0.001
表2 不同细胞密度数对细胞增殖的影响 细胞培养
板序号(No.)
1
2
3
4
5
6
7
8
细胞浓度
, http://www.100md.com
(×105cell/ml)
2
2
4
4
8
8
10
10
电场作用时间(min)
0
15
0
, 百拇医药
15
0
15
0
15
光密度平均值
0.170±0.040
0.140±0.020
0.250±0.080
0.223±0.035
0.326±0.040
0.340±0.050
, 百拇医药
0.435±0.068
0.462±0.051
光密度平均值
变化率
-17.6
-10.8%
+4.3%
+6.2%
t检验(P)
<0.001
p<0.005
p<0.3
, 百拇医药
<0.05
三、表2是相同的脉冲电场、相同的场作用时间(f=50 Hz,Epp=1V/m,τ=20 μs,t=15 min)及不同的细胞密度数的实验结果。其中No.1,No.3,No.5,No.7为对照组。No.2,No.4,No.6,No.8为实验组。实验发现在细胞密度数较小时(≤5×105 cell/ml),脉冲电场产生抑制细胞增殖的效应(P<0.05,P<0.001),而在细胞密度数较大的情况下(≥8×105 cell/ml),同样条件的脉冲电场则没有产生抑制细胞增殖的效应,且在细胞密度为10×105 cell/ml时还出现了促进细胞增殖的效应(P<0.05)。根据报道,相同的电场对细胞直接作用所产生的效应(如对胞内某些酶的活性的影响〔6〕)应是不随细胞密度数的变化而变化的。但相同的电场通过影响细胞周围的环境(如培养液的理化特性)进而再影响细胞增殖的间接效应则可能是随细胞密度数的改变而变化的。故这一实验结果表明:脉冲电场除了直接对细胞作用,产生促进或抑制细胞增殖的效应外,可能还对细胞周围的环境产生了影响(如培养液的理化特性)进而再间接地影响那些促进或抑制细胞增殖的效应。脉冲电场是如何影响胞外的环境再进而间接地影响细胞增殖的问题,我们将另文报道。
, 百拇医药
参考文献
1 Mcleod KJ,Lee RC, Ehrich HP. Frequency dependence of electric field modulation of fibroblast protein synthesis. Science, 1987, 236:1465-1469.
2 Liboff AR, Williams T, Strong DM,et al.Time-varying magnetic fields:effects on DNA synthesis. Science, 1984,233:818-820.
3 Stephen M.Combined DC and ELF magnetic fields can alter cell proliferation. Bioelectromagnetics, 1990, 11:27-36.
, http://www.100md.com
4 Berg H, Zhang L.Electrostimulation in cell biology by low-frequency electromagnetic fields. Electro and Magnotobiology,1993,12(2):147-163.
5 Mosmann TJ. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Immunol Methods, 1983,65: 55-63.
6 Blank M, Sool L, Papstein V.Effects of low frequency magnetic fields on Na,K-ATPase activity. Bioelectochem Bioenerg, 1995,38:267-273.
(收稿 1997-12-04 修回 1998-04-17), http://www.100md.com