H2O2对大鼠神经细胞的氧化损伤及硒的保护作用
作者:孔祥锋 陈婉蓉 倪兵 彭华恩
单位:华东师范大学生物学系,上海 200062
关键词:神经细胞培养;硒;氧化损伤;扫描电镜
卫生毒理学杂志000208 【摘要】 目的 研究过氧化氢(H2O2)对体外培养的分化期大鼠胚胎神经细胞的氧化损伤以及硒的保护作用。方法 MTT法检测细胞存活率,硫代巴比妥酸法测定丙二醛(MDA)含量,黄嘌呤氧化酶法测定超氧化岐化酶(SOD)活性,扫描电镜观察细胞膜完整性。结果 H2O2抑制分化期神经细胞分裂增殖,经过氧化氢作用24 h的神经细胞,其胞液中SOD活力下降,MDA含量升高,并表现为浓度-效应关系;扫描电镜观察可见细胞膜损伤。细胞培养液中加入一定浓度硒可有效地减轻H2O2引起的神经细胞损伤。结论 硒对H2O2引起的神经细胞氧化损伤可能有明显的保护作用。
, 百拇医药
The protective effects of selenium on oxidative damages of differentiating neuron exposed to H2O2
Kong Xing-feng,Chen Wan-rong,NIBing
(Biology Department of East China Normal University,Shanghai 200062,China.)
【Abstract】 Objective The oxidative damages of rat differentiating embryo neuron exposed to H2O2 and the protective effects of selenium(Se) were studied in vitro. Methods The neuronal viability was detected using MTT stain.The concentrations of malondialdehyde (MDA) were determined by thiobarbiturif acid reactive substance method.The activity of superoxide dismutase (SOD) was determined by xianthine-xanthine oxidase method.The cell membrane was examined by scanning electron microscopy (SEM). Results H2O2 could inhibite the proliferation and survival of differentiating neuron.When the neuron exposed to H2O2 for 24h,the SOD activities declined,and MDA contents increased with a relation of dose-effect response.The degree of Lipid peroxidation corresponded with the results of membrane damage observed by SEM.Adding Se with given concentrations into cell culture could effectively reduce the neuron damages caused by H2O2.Conclusion Se could protect neurons against oxidative damages caused by H2O2.
, 百拇医药
【Key words】 Hydrogen peroxide;embrgo Neuron culture; oxidative damage; Selenium;Rats
过氧化氢(H2O2)是一种较强的氧化剂,它产生的羟自由基(*OH)可引发脂质过氧化反应,并持续为链式反应,使自由基反应扩增放大,对细胞有明显的损伤作用[1,2]。硒作为人体必需的微量元素和谷胱甘肽过氧化物酶(GPx)的组成成分,具有明确的抗氧化,延缓衰老等功能,近年来受到广泛的重视和研究。是有效的抗氧化酶,能阻断或减轻脂自由基(LOO*)所致的脂质过氧化连锁反应[3]。已有资料表明,低浓度硒可促进细胞增殖,高浓度硒可引起细胞毒性[4],但硒对神经细胞分化的作用尚未见报道。我们用大鼠胚胎中脑神经细胞微团培养技术,观察H2O2对分化期神经元细胞集落形成、脂质过氧化作用以及细胞膜结构的影响,并探讨硒对神经元氧化损伤的保护作用。
, 百拇医药
1 材料与方法
1.1 主要试剂和仪器 F-12培养基为GIBCO公司产品;胰酶及MTT试剂(四甲基偶氮唑蓝)均为SERVA公司产品;神经元特异性烯醇化酶抗血清(1∶100)为DAKO公司产品;ABC免疫组化试剂盒和羊抗兔IgG为VECTOK公司产品;超氧化物岐化酶(SOD),GSH-Px,丙二醛(MDA)试剂盒均为南京建成生物工程研究所产品;其余试剂为国产分析纯试剂。
CO2培养箱(NAPCO,美国),倒置相差显微镜(HFX,NIKON),酶标仪(MC-318型),扫描电镜(JXA-840,JEOL)。
1.2 细胞的培养、观察和鉴定
1.2.1 神经细胞微团培养及集落形成率观察 妊娠第13 d SD大鼠脱颈推处死,无菌条件下取大鼠胚胎中脑部分,胰酶消化制成密度为1×106/ml的细胞悬液,按我们以前建立的方法进行微团培养[5]。培养5 d后用体积分数为10 %的甲醛固定2 h,苏木精染液染色后在光镜下计数每一微团中集落数,以对照组集落数为100 %,计算各浓度组集落形成率。
, 百拇医药
1.2.2 神经元鉴定 细胞用体积分数为4 %的多聚甲醛固定12 h后,用神经元特异性烯醇化酶(NSE)免疫细胞化学的方法进行染色以鉴定神经元[6],兔抗NSE,羊抗兔IgG工作浓度均为1∶200,光镜观察NSE是否为阳性反应。
1.3 MTT法检测细胞毒性 将神经细胞接种于96孔板中(密度5×105/ml,每孔200 μ1),待细胞贴壁后,加入不同浓度的亚硒酸钠(Na2SeO3,终浓度为0.01、0.05、0.1、0、1、5、10 μmol/L),作用24 h,再加入不同浓度的H2O2(终浓度为10、50、100、200、500 μmol/L),继续培养24 h后,用MTT法检测活细胞数[7]。根据所测OD值计算细胞存活率(细胞存活率=实验组OD值/对照组OD值×100 %)。
1.4 SOD与MDA的测定 将密度为4×105/ml细胞接种于24孔板,每孔1 ml。加入不同浓度的H2O2(终浓度同上),作用24 h后继续培养3 d,胰酶消化,收集不同浓度组细胞,光镜下计数。细胞悬液反复冻融3次,10 000 r/min离心取上清液。用Lowrys法测定蛋白浓度,用黄嘌呤氧化酶法测SOD活力,用硫代巴比妥法测定MDA含量[8]。
, 百拇医药
1.5 扫描电镜观察 按前述微团培养法将神经细胞接种于24孔板玻片上(各孔事先放入经多聚赖氨酸处理的5×5 mm2的洁净无菌玻片)中,经不同浓度的Na2SeO3和H2O2(浓度同上)作用后依次用体积分数为2.5 %的戊二醛磷酸缓冲液和体积分数为10 %的锇酸固定,按常规乙醇梯度脱水,HMDS干燥,离子溅射喷金,扫描电镜观察并摄片。
2 结果
2.1 正常分化期神经细胞形态观察 大鼠胚胎神经细胞正常培养5 d 后细胞生长分化完全,形成明显的细胞集落,集落间神经突起丰富,并连结成网络状。NES染色呈现特异性的红棕色。
2.2 H2O2对神经细胞的损伤
2.2.1 H2O2对神经细胞存活和分化的影响 不同浓度H2O2使神经细胞生长受到不同程度抑制,并呈剂量依赖关系,浓度大于200 μmol/L表现明显的细胞毒性。其半数生长抑制浓度IC50为120 μmol/L(图1)。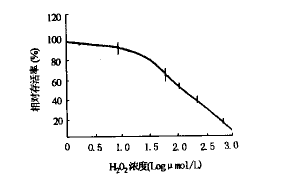
, 百拇医药
图1 MTT法测得不同浓度H2O2对神经细胞生长的影响
在无明显细胞毒的情况下(细胞存活率大于80 %),用集落形成率的减少作为细胞分化抑制程度的终点[5],结果显示,在H2O2作用下,集落形成率有不同程度下降,并呈剂量-效应关系。
2.2.2 SOD和MDA的变化 经不同浓度H2O2作用24 h后的神经细胞,细胞内SOD活力下降(图2),脂质过氧化产物MDA的含量升高(图3);H2O2浓度大于100 μmol/L时,与对照组比较,差异有显著性。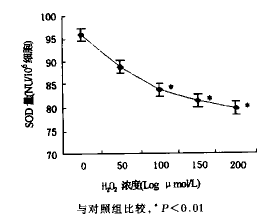
图2 不同浓度H2O2作用下的神经细胞SOD的变化
, 百拇医药
图3 不同浓度H2O2作用下的神经细胞MDA的变化
2.2.3 H2O2对细胞损伤的扫描电镜观察 正常神经细胞经微团培养,集落密集,突起丰富,胞体匀称,细胞膜光滑、平整(图4 a、b)。经不同浓度H2O2作用后,细胞膜受到不同程度损伤。50 μmol/L H2O2作用,集落数及神经突起减少不明显,可见到部分细胞膜受到破坏,只有极少数细胞膜破损较严重;经100 μmol/L H2O2作用24 h后,集落数目减少,突起减少,胞体肿胀,折光率下降,细胞膜受损较严重,部分细胞膜穿孔破裂,有些仅剩细胞骨架(图4,c、d)。
a、c、e为放大50倍的扫描电镜图像,显示神经细胞集落整体观;b、d、f分别为各自的局部放大像,显示单个细胞的形态。a、b为正常培养的神经细胞,集落密集,突起丰富,胞体匀称,细胞膜完整;c、d为100 μmol/L H2O2作用24 h的神经细胞,集落稀疏,突起很少,细胞膜受到严重损伤,有些仅剩细胞骨架;e、f为100 μmol/L H2O2作用24 h,但培养液中加入5 μmol/LNa2SeO3作的神经细胞。
, 百拇医药
图4 H2O2对分化期大鼠胚胎神经元的氧化损伤及硒的保护作用扫描电镜观察
图5 MTT法检测不同浓度的Se对100 μmol/LH2O2作用的神经细胞的保护作用
2.3 Se对H2O2所致细胞损伤的保护作用
2.3.1 对细胞存活率的影响 在100 μmol/LH2O2浓度,Na2SeO3浓度0.01~5 μmol/L范围内,随着Se浓度的增高,细胞存活率升高(图5),与对照组(Na2SeO3浓度为0)比较,差异均有显著性。
, 百拇医药
2.3.2 电镜观察 神经细胞培养液中预先加入不同浓度亚硒酸钠,均可不同程度地减轻细胞膜损伤,但小于0.5 μmol/L保护作用不明显,硒浓度1~5 μmol/L可明显抵抗H2O2诱发的细胞膜损伤(图4,d、e、f)。
3 讨论
H2O2对细胞的损伤是多方面的,但最基本的损伤机理是通过Haber-Weiss或Fentons反应生成.OH造成的。本研究以体外培养的分化期神经细胞为模型,从各个指标观察H2O2对细胞的损伤作用。结果表明,H2O2浓度大于10 μmol/L时即可使细胞存活率下降,SOD活性下降,脂质过氧化产物MDA升高,并呈剂量-效应关系。有报道H2O2可使细胞或组织中的SOD活性下降[1],我们的实验支持了这个结果。当H2O2浓度超地其半数生长抑制浓度120 μmiol/L时,神经细胞分化受到明显抑制,表现为集落数减少,集落间神经突起减少或消失[7],MDA的量有显著升高,提示H2O2的脂质过氧化作用抑制了神经细胞的分化和成熟。我们曾用化学发光仪测定细胞体系的发光强度,发现经H2O2作用后发光强度升高。揭示细胞内自由基水平升高,脂质过氧化程度加重。扫描电镜观察结果进一步证实了脂质过氧化作用引起细胞膜的严重损伤。我们的实验中,H2O2的细胞毒性、生化指标变化以及扫描电镜观察细胞膜完整性,结果是一致的,提供了H2O2的自由基损伤理论在神经细胞中的实验证据。
, http://www.100md.com
相当多的研究表明,硒能对抗自由基引发的细胞脂质过氧化作用。本实验观察了Se对H2O2引起的神经细胞损伤的作用,并且通过扫描电镜观察到Se对于H2O2引起的神经细胞膜损伤有明显的保护作用。我们曾观察了Se对分化期神经细胞增殖生长的影响,发现低浓度Se(0.01~1 μmol/L)可明显促进神经细胞增殖,较高浓度则抑制神经细胞增殖,10 μmol/L以上可引起毒性。我们在培养液中预先加不同浓度Se后再加H2O2,以观察Se对H2O2引起的细胞损伤的对抗作用,发现较高浓度的Se(1~5 μmol/L)对细胞的保护作用较低浓度Se(0.01~1 μmol/L)更为明显。说明在有H2O2存在时,由于细胞受到不同程度氧化损伤,需要有较高浓度的Se补充到细胞的抗氧化体系才能使细胞得到有效的保护。我们曾对培养的神经细胞中GPX活性进行检测,发现在培养液中加入Se可以升高GPX活性,并显示剂量-效应关系,揭示Se通过提高GPX活性发生抗脂质过氧化的作用。
, 百拇医药
参考文献
[1] 王德清,沈文梅,田亚平,等.羟自由基对细胞损伤作用的实验观察.生物化学与生物物理进展,1995,22:278-281.
[2] 曾昭惠,张宗玉.自由基对线粒体DNA的氧化损伤.生物化学与生物物理进展,1995,22:429-432.
[3] Kayanoki Y,Fujii J,Islam KN,et al.The protective role of glotathione peroxidase in apoptosis induced by reactive oxygen species.J Biochem,1996,119:817-822.
[4] Ciappellaana S,Erba D,Bermano G,et al.Dietary selenium intake and selenoproteins in rat plasma.Ann Nutr Metab,1996,40:296-300.
, http://www.100md.com
[5] 陈婉蓉,傅中滇,端礼荣.用神经细胞微团培养法筛选化学致畸物.中华预防医学杂志,1991,25:180-183.
[6] 陈婉蓉,端礼荣,张志坚.四氯化碳对神经细胞超微结构的影响.上海铁道医学院学报,1995,9:4-8.
[7] Mosmann T.Rapid colorimetric assay for cellular growth and survival.J Immouno Methods,1983,65:55-58.
[8] Mizuno Y.Changes in superoxide dismutase,catalase,glutathione peroxidase and glutathione reductase activities and thiobarbituric acid reactive product levels in early stages of development in dyxtrophic chichens.Exp Neurol,1984,84:58-62。
(收稿日期:1999-09-20), 百拇医药
单位:华东师范大学生物学系,上海 200062
关键词:神经细胞培养;硒;氧化损伤;扫描电镜
卫生毒理学杂志000208 【摘要】 目的 研究过氧化氢(H2O2)对体外培养的分化期大鼠胚胎神经细胞的氧化损伤以及硒的保护作用。方法 MTT法检测细胞存活率,硫代巴比妥酸法测定丙二醛(MDA)含量,黄嘌呤氧化酶法测定超氧化岐化酶(SOD)活性,扫描电镜观察细胞膜完整性。结果 H2O2抑制分化期神经细胞分裂增殖,经过氧化氢作用24 h的神经细胞,其胞液中SOD活力下降,MDA含量升高,并表现为浓度-效应关系;扫描电镜观察可见细胞膜损伤。细胞培养液中加入一定浓度硒可有效地减轻H2O2引起的神经细胞损伤。结论 硒对H2O2引起的神经细胞氧化损伤可能有明显的保护作用。
, 百拇医药
The protective effects of selenium on oxidative damages of differentiating neuron exposed to H2O2
Kong Xing-feng,Chen Wan-rong,NIBing
(Biology Department of East China Normal University,Shanghai 200062,China.)
【Abstract】 Objective The oxidative damages of rat differentiating embryo neuron exposed to H2O2 and the protective effects of selenium(Se) were studied in vitro. Methods The neuronal viability was detected using MTT stain.The concentrations of malondialdehyde (MDA) were determined by thiobarbiturif acid reactive substance method.The activity of superoxide dismutase (SOD) was determined by xianthine-xanthine oxidase method.The cell membrane was examined by scanning electron microscopy (SEM). Results H2O2 could inhibite the proliferation and survival of differentiating neuron.When the neuron exposed to H2O2 for 24h,the SOD activities declined,and MDA contents increased with a relation of dose-effect response.The degree of Lipid peroxidation corresponded with the results of membrane damage observed by SEM.Adding Se with given concentrations into cell culture could effectively reduce the neuron damages caused by H2O2.Conclusion Se could protect neurons against oxidative damages caused by H2O2.
, 百拇医药
【Key words】 Hydrogen peroxide;embrgo Neuron culture; oxidative damage; Selenium;Rats
过氧化氢(H2O2)是一种较强的氧化剂,它产生的羟自由基(*OH)可引发脂质过氧化反应,并持续为链式反应,使自由基反应扩增放大,对细胞有明显的损伤作用[1,2]。硒作为人体必需的微量元素和谷胱甘肽过氧化物酶(GPx)的组成成分,具有明确的抗氧化,延缓衰老等功能,近年来受到广泛的重视和研究。是有效的抗氧化酶,能阻断或减轻脂自由基(LOO*)所致的脂质过氧化连锁反应[3]。已有资料表明,低浓度硒可促进细胞增殖,高浓度硒可引起细胞毒性[4],但硒对神经细胞分化的作用尚未见报道。我们用大鼠胚胎中脑神经细胞微团培养技术,观察H2O2对分化期神经元细胞集落形成、脂质过氧化作用以及细胞膜结构的影响,并探讨硒对神经元氧化损伤的保护作用。
, 百拇医药
1 材料与方法
1.1 主要试剂和仪器 F-12培养基为GIBCO公司产品;胰酶及MTT试剂(四甲基偶氮唑蓝)均为SERVA公司产品;神经元特异性烯醇化酶抗血清(1∶100)为DAKO公司产品;ABC免疫组化试剂盒和羊抗兔IgG为VECTOK公司产品;超氧化物岐化酶(SOD),GSH-Px,丙二醛(MDA)试剂盒均为南京建成生物工程研究所产品;其余试剂为国产分析纯试剂。
CO2培养箱(NAPCO,美国),倒置相差显微镜(HFX,NIKON),酶标仪(MC-318型),扫描电镜(JXA-840,JEOL)。
1.2 细胞的培养、观察和鉴定
1.2.1 神经细胞微团培养及集落形成率观察 妊娠第13 d SD大鼠脱颈推处死,无菌条件下取大鼠胚胎中脑部分,胰酶消化制成密度为1×106/ml的细胞悬液,按我们以前建立的方法进行微团培养[5]。培养5 d后用体积分数为10 %的甲醛固定2 h,苏木精染液染色后在光镜下计数每一微团中集落数,以对照组集落数为100 %,计算各浓度组集落形成率。
, 百拇医药
1.2.2 神经元鉴定 细胞用体积分数为4 %的多聚甲醛固定12 h后,用神经元特异性烯醇化酶(NSE)免疫细胞化学的方法进行染色以鉴定神经元[6],兔抗NSE,羊抗兔IgG工作浓度均为1∶200,光镜观察NSE是否为阳性反应。
1.3 MTT法检测细胞毒性 将神经细胞接种于96孔板中(密度5×105/ml,每孔200 μ1),待细胞贴壁后,加入不同浓度的亚硒酸钠(Na2SeO3,终浓度为0.01、0.05、0.1、0、1、5、10 μmol/L),作用24 h,再加入不同浓度的H2O2(终浓度为10、50、100、200、500 μmol/L),继续培养24 h后,用MTT法检测活细胞数[7]。根据所测OD值计算细胞存活率(细胞存活率=实验组OD值/对照组OD值×100 %)。
1.4 SOD与MDA的测定 将密度为4×105/ml细胞接种于24孔板,每孔1 ml。加入不同浓度的H2O2(终浓度同上),作用24 h后继续培养3 d,胰酶消化,收集不同浓度组细胞,光镜下计数。细胞悬液反复冻融3次,10 000 r/min离心取上清液。用Lowrys法测定蛋白浓度,用黄嘌呤氧化酶法测SOD活力,用硫代巴比妥法测定MDA含量[8]。
, 百拇医药
1.5 扫描电镜观察 按前述微团培养法将神经细胞接种于24孔板玻片上(各孔事先放入经多聚赖氨酸处理的5×5 mm2的洁净无菌玻片)中,经不同浓度的Na2SeO3和H2O2(浓度同上)作用后依次用体积分数为2.5 %的戊二醛磷酸缓冲液和体积分数为10 %的锇酸固定,按常规乙醇梯度脱水,HMDS干燥,离子溅射喷金,扫描电镜观察并摄片。
2 结果
2.1 正常分化期神经细胞形态观察 大鼠胚胎神经细胞正常培养5 d 后细胞生长分化完全,形成明显的细胞集落,集落间神经突起丰富,并连结成网络状。NES染色呈现特异性的红棕色。
2.2 H2O2对神经细胞的损伤
2.2.1 H2O2对神经细胞存活和分化的影响 不同浓度H2O2使神经细胞生长受到不同程度抑制,并呈剂量依赖关系,浓度大于200 μmol/L表现明显的细胞毒性。其半数生长抑制浓度IC50为120 μmol/L(图1)。

, 百拇医药
图1 MTT法测得不同浓度H2O2对神经细胞生长的影响
在无明显细胞毒的情况下(细胞存活率大于80 %),用集落形成率的减少作为细胞分化抑制程度的终点[5],结果显示,在H2O2作用下,集落形成率有不同程度下降,并呈剂量-效应关系。
2.2.2 SOD和MDA的变化 经不同浓度H2O2作用24 h后的神经细胞,细胞内SOD活力下降(图2),脂质过氧化产物MDA的含量升高(图3);H2O2浓度大于100 μmol/L时,与对照组比较,差异有显著性。

图2 不同浓度H2O2作用下的神经细胞SOD的变化

, 百拇医药
图3 不同浓度H2O2作用下的神经细胞MDA的变化
2.2.3 H2O2对细胞损伤的扫描电镜观察 正常神经细胞经微团培养,集落密集,突起丰富,胞体匀称,细胞膜光滑、平整(图4 a、b)。经不同浓度H2O2作用后,细胞膜受到不同程度损伤。50 μmol/L H2O2作用,集落数及神经突起减少不明显,可见到部分细胞膜受到破坏,只有极少数细胞膜破损较严重;经100 μmol/L H2O2作用24 h后,集落数目减少,突起减少,胞体肿胀,折光率下降,细胞膜受损较严重,部分细胞膜穿孔破裂,有些仅剩细胞骨架(图4,c、d)。

a、c、e为放大50倍的扫描电镜图像,显示神经细胞集落整体观;b、d、f分别为各自的局部放大像,显示单个细胞的形态。a、b为正常培养的神经细胞,集落密集,突起丰富,胞体匀称,细胞膜完整;c、d为100 μmol/L H2O2作用24 h的神经细胞,集落稀疏,突起很少,细胞膜受到严重损伤,有些仅剩细胞骨架;e、f为100 μmol/L H2O2作用24 h,但培养液中加入5 μmol/LNa2SeO3作的神经细胞。
, 百拇医药
图4 H2O2对分化期大鼠胚胎神经元的氧化损伤及硒的保护作用扫描电镜观察

图5 MTT法检测不同浓度的Se对100 μmol/LH2O2作用的神经细胞的保护作用
2.3 Se对H2O2所致细胞损伤的保护作用
2.3.1 对细胞存活率的影响 在100 μmol/LH2O2浓度,Na2SeO3浓度0.01~5 μmol/L范围内,随着Se浓度的增高,细胞存活率升高(图5),与对照组(Na2SeO3浓度为0)比较,差异均有显著性。
, 百拇医药
2.3.2 电镜观察 神经细胞培养液中预先加入不同浓度亚硒酸钠,均可不同程度地减轻细胞膜损伤,但小于0.5 μmol/L保护作用不明显,硒浓度1~5 μmol/L可明显抵抗H2O2诱发的细胞膜损伤(图4,d、e、f)。
3 讨论
H2O2对细胞的损伤是多方面的,但最基本的损伤机理是通过Haber-Weiss或Fentons反应生成.OH造成的。本研究以体外培养的分化期神经细胞为模型,从各个指标观察H2O2对细胞的损伤作用。结果表明,H2O2浓度大于10 μmol/L时即可使细胞存活率下降,SOD活性下降,脂质过氧化产物MDA升高,并呈剂量-效应关系。有报道H2O2可使细胞或组织中的SOD活性下降[1],我们的实验支持了这个结果。当H2O2浓度超地其半数生长抑制浓度120 μmiol/L时,神经细胞分化受到明显抑制,表现为集落数减少,集落间神经突起减少或消失[7],MDA的量有显著升高,提示H2O2的脂质过氧化作用抑制了神经细胞的分化和成熟。我们曾用化学发光仪测定细胞体系的发光强度,发现经H2O2作用后发光强度升高。揭示细胞内自由基水平升高,脂质过氧化程度加重。扫描电镜观察结果进一步证实了脂质过氧化作用引起细胞膜的严重损伤。我们的实验中,H2O2的细胞毒性、生化指标变化以及扫描电镜观察细胞膜完整性,结果是一致的,提供了H2O2的自由基损伤理论在神经细胞中的实验证据。
, http://www.100md.com
相当多的研究表明,硒能对抗自由基引发的细胞脂质过氧化作用。本实验观察了Se对H2O2引起的神经细胞损伤的作用,并且通过扫描电镜观察到Se对于H2O2引起的神经细胞膜损伤有明显的保护作用。我们曾观察了Se对分化期神经细胞增殖生长的影响,发现低浓度Se(0.01~1 μmol/L)可明显促进神经细胞增殖,较高浓度则抑制神经细胞增殖,10 μmol/L以上可引起毒性。我们在培养液中预先加不同浓度Se后再加H2O2,以观察Se对H2O2引起的细胞损伤的对抗作用,发现较高浓度的Se(1~5 μmol/L)对细胞的保护作用较低浓度Se(0.01~1 μmol/L)更为明显。说明在有H2O2存在时,由于细胞受到不同程度氧化损伤,需要有较高浓度的Se补充到细胞的抗氧化体系才能使细胞得到有效的保护。我们曾对培养的神经细胞中GPX活性进行检测,发现在培养液中加入Se可以升高GPX活性,并显示剂量-效应关系,揭示Se通过提高GPX活性发生抗脂质过氧化的作用。
, 百拇医药
参考文献
[1] 王德清,沈文梅,田亚平,等.羟自由基对细胞损伤作用的实验观察.生物化学与生物物理进展,1995,22:278-281.
[2] 曾昭惠,张宗玉.自由基对线粒体DNA的氧化损伤.生物化学与生物物理进展,1995,22:429-432.
[3] Kayanoki Y,Fujii J,Islam KN,et al.The protective role of glotathione peroxidase in apoptosis induced by reactive oxygen species.J Biochem,1996,119:817-822.
[4] Ciappellaana S,Erba D,Bermano G,et al.Dietary selenium intake and selenoproteins in rat plasma.Ann Nutr Metab,1996,40:296-300.
, http://www.100md.com
[5] 陈婉蓉,傅中滇,端礼荣.用神经细胞微团培养法筛选化学致畸物.中华预防医学杂志,1991,25:180-183.
[6] 陈婉蓉,端礼荣,张志坚.四氯化碳对神经细胞超微结构的影响.上海铁道医学院学报,1995,9:4-8.
[7] Mosmann T.Rapid colorimetric assay for cellular growth and survival.J Immouno Methods,1983,65:55-58.
[8] Mizuno Y.Changes in superoxide dismutase,catalase,glutathione peroxidase and glutathione reductase activities and thiobarbituric acid reactive product levels in early stages of development in dyxtrophic chichens.Exp Neurol,1984,84:58-62。
(收稿日期:1999-09-20), 百拇医药