嵌合抗CD20抗体Fab片段在大肠杆菌中表达及活性鉴定
作者:赖增祖 熊冬生 范冬梅 彭辉 许元富 朱祯平 杨纯正
单位:杨纯正,男,62岁,博士生导师,主要从事肿瘤多药耐药基因及肿瘤分子药理学研究;赖增祖(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020);熊冬生(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020);范冬梅(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
关键词:单克隆抗体;嵌合抗体Fab片段;CD20
中国免疫学杂志001002 摘 要 目的:构建抗CD20嵌合抗体Fab片段表达载体,并在大肠杆菌中进行高效可溶性分泌表达。方法:利用PCR方法从抗CD20单链抗体(ScFv)表达载体上扩增抗CD20抗体轻链可变区基因(VL)、重链可变区基因(VH),然后将VH、VL基因重组到Fab表达载体pYZF中,构建抗CD20Fab表达载体pYZF1cd20,并在27C7菌中高效表这。结果:经Fab表达载体转化的27C7菌株,进行表达培养,经分离纯化获得具有CD20特异结合活性的Fab片段,竞争性免疫荧光抑制实验表明,表达产物Fab片段能竞争性抑制鼠源性抗CD20抗体HI47和CD20表达细胞Raji细胞结合。结论:在大肠杆菌中高效可溶性分泌表达有活性的抗CD20嵌合抗体Fab片段。
, 百拇医药
中国图书分类号 R392.12
High expression of the chimeric antibody Fab against-CD20 in E.coli and bioactivity determination
LAI Zeng-Zu,XIONG Dong-Sheng,FAN Dong-Mei
(The National Laboratory of Experimental Hematology,Institute of Hematology,Chinese Academy of Medical Sciences & Peking Union Medical College,Tianjin 300020)
Abstract Objective:Construct the expression vector of the chimeric antibody Fab fragment against CD20 and express in E.coli.Methods:Amplify the gene of the variable region of heavy chain(VH) and light chain(VL)of the antibody against CD20 from the anti-CD20 single chain Fv antibody fragment(ScFv)expression vector by PCR method,clone the VH,VL into the plasmid pYZF to construct the Fab expression vector pYZF1cd20,transformate 27C7 with pYZF1cd20,and the expression of Fab in 27C7.Results:The CD20 binding Fab was expressed, isolated and purified,the competitive inhibition of immune fluorescence experiment show that the Fab inhibits the binding of monoclonal antibody HI47 to CD20 on the surface of Raji cell.
, 百拇医药
Key words Monoclonal antibody Chimeric Fab antibody frament CD20
作为B淋巴细胞表面膜蛋白,CD20与B淋巴细胞Ca2+的跨膜传导密切相关,CD20对B淋巴细胞的增殖和分化具有调节作用[1]。由于CD20仅在前-B淋巴细胞、未成熟B淋巴细胞、成熟B淋巴细胞、激活B淋巴细胞中表达,而在浆细胞、淋巴多能干细胞以及其它组织均无CD20的表达[2-4],在人体血清中亦无游离CD20的存在[5]。因此CD20可作为B淋巴细胞瘤治疗的一个很好治疗靶点。1997年以CD20为靶点的嵌合抗CD20单克隆抗体Rituxan已获准应用于B淋巴细胞瘤临床治疗[6]。这是单克隆抗体研究的又一个里程碑。单克隆抗体HI47(IgG3)是我所于1990年研制成功的抗CD20鼠源性单克隆抗体,第四届国际人类白细胞分化抗原会议将HI47命名为CD20+X[7]。本研究目的在于利用基因工程方法将鼠源性抗CD20单克隆抗体HI47可变区和人源抗体恒定区连接起来,构建嵌合抗CD20抗体Fab片段,以降低鼠源性抗体的免疫源性,并在大肠杆菌中可溶性分泌表达嵌合抗CD20抗体Fab片段,以利于临床应用。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 菌体与材料 抗CD20ScFv表达载体由我室构建(另文发表),pYZL、pYZH1载体、表达载体pYZF为我室构建,大肠杆菌27C7由我室保存。
1.1.2 酶与试剂 Taq酶购于上海生物工程公司,Protein G Agrose亲和柱,限制性内切酶Apa I、Mlu I、Nhe I、Spe I、Sph I、Sty I购于GIBCOBRL公司,抗CD20单克隆抗体HI47、抗CD3单克隆抗体HIT3a、FITC标记的羊抗鼠IgG由我所免疫室提供,兔抗人IgG(Fab')2单克隆抗体,辣根过氧化物酶标记的羊抗兔IgG,购于北京中山生物工程公司。
1.1.3 细胞系 Raji细胞由我室保存,用RPMI1640培养基培养。
, 百拇医药
1.1.4 培养基 2×YT培养基:蛋白胨1.6%,酵母膏1%,氯化钠0.5%,pH7.4。AP5培养基:每1 000 ml含酸水解酪蛋白11 g,酵母膏0.6 g,硫酸镁0.19 g,葡萄糖1.5 g,氯化铵1.07 g,氯化钾3.73 g,氯化钠1.2 g,1 mol/L三乙醇胺(pH7.4)120 ml,过滤灭菌。细菌周质腔蛋白提取液:三羟甲基氨基甲烷25 mmol/L,乙二胺四乙酸1 mmol/L,20%蔗糖(W/V),氯化钠200 mmol/L,苯*****0.01 mmol/L,pH7.5。引物:①VH5’端引物GCTACAAACGCGTACGCTCGGTGAAGCTG(MluI),②VH3’端引物GACCGATGGGCCCTTGGTGGSGGCTGAGGAGACGGT(ApaI),③VL5’端引物GCTACAAACGCGTACGCTGACATCGAGCTC(MluI),④VL3’端引物TTTCAGCTCCACCTTGGTCC(StyI),下画线为括号内的内切酶酶切位点。
, http://www.100md.com
1.2 抗CD20Fab表达载体构建 利用PCR法从抗CD20ScFv表达载体上扩增VH、VL基因,经琼脂糖电泳分离纯化后,分别以MluI+ApaI、MluI+StyI消化,然后重组到带有人免疫球蛋白相应CH1、CL的pYZH1、pYZL载体相应的内切酶位点中,用所得的重组子pYZH1cd20、pYZH1cd20转化27C7菌株,扩增培养后提取pYZLcd20、pYZH1cd20质粒,分别以MluI+NheI,SpeI+SphI消化pYZLcd20、pYZH1cd20,琼脂糖电泳分离纯化含VL、VH的相应DNA片段,利用NheI、SpeI同裂酶的特点,将这两个片段和经MluI+SphI消化所得的pYZF载体片段连接成抗CD20Fab表达载体pYZF1cd20(见图1)。
1.3 抗CD20Fab片段可溶性表达及分离纯化 将载体pYZF1cd20转化27C7菌株,挑取单菌落接种5 ml含氨苄青霉素50 μg/ml的2×YT培养基,37℃,200 r/min,振荡培养6 h,至OD600=0.6;6 000 r/min、4℃离心10 min收集菌株,将菌株重新悬浮于20 ml含氨苄青霉素50 μg/ml的AP5培养基,30℃,250 r/min,振荡培养20 h;6 000 r/min、4℃离心10 min收集菌体,将菌体于-20℃冻存1 h,化冻后加1 ml细菌周质腔蛋白提取液,混匀,置于4℃轻摇1 h,12 000 r/min,4℃离心20 min,取上清,用Protein G Agrose亲和柱分离纯化Fab。
, 百拇医药
1.4 蛋白质印迹实验(Western-blot)[8] 12%SDS-PAGE电泳Fab表达产物,后将其转移到硝酸纤维素膜上,5%脱脂奶溶液4℃封闭过夜,加一抗兔抗人IgG(Fab’)2,4℃,孵育2 h,磷酸盐缓冲液(PBS)洗3次,加二抗辣根过氧化物酶标记羊抗兔IgG,4℃,孵育2 h,Tween Tris缓冲盐溶液(TBST)洗3次,每次10 min,然后用二氨基联苯胺(DAB)进行显色。
1.5 竞争性免疫荧光抑制实验 将浓度为20 μg/ml的HI47溶液和1×106Raji细胞在4℃下孵育1 h,2 000 r/min,4℃离心8 min,弃上清,PBS洗细胞3次,将细胞重悬于30 μl浓度为40 μg/ml Fab溶液,4℃放置1 h,2 000 r/min,4℃离心10 min,弃上清,PBS洗细胞3次,将细胞重悬30 μl按效价稀释好的羊抗鼠IgG-FITC溶液,4℃放置1 h,2 000 r/min,4℃离心10 min,弃上清,PBS洗细胞3次,FACS测定。
, 百拇医药
2 结果
2.1 抗CD20Fab表达载体构建 利用PCR法从抗CD20Fab表达载体上扩增VH、VL基因,将VH、VL基因重组到表达载体pYZF的相应酶切位点中,构建嵌合抗CD20Fab片段表达载体pYZF1cd20,核酸序列测定结果表明VH、VL基因正确重组到表达载体pYZF相应的酶切位点中。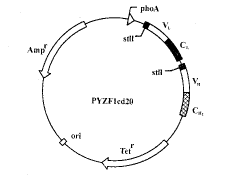
图1 表达载体pYZF1cd20的结构
Fig.1 Map of the expression vector pYZF1cd20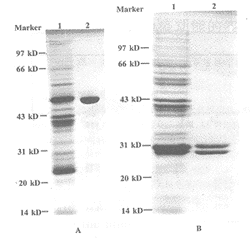
, 百拇医药
图2 SDS-PAGE电泳分析
Fig.2 SDS-PAGE analysis
Note: A.unreduced condition;1.periplasm extract;2.purified Fab;B.reduced condition;1.periplasm extract;2.purified Fab
图3 Western-blot检测
Fig.3 Detection of Western blot
Note:1.periplasm extract;2.purified Fab
, http://www.100md.com
2.2 抗CD20Fab在大肠杆菌中可溶性分泌表达及分离纯化 挑取单菌落接种2×YT培养基,培养至OD600约为0.6时,转接AP5培养基进行诱导表达,表达产物用细菌周质腔蛋白提取液提取,用Protein G Agrose亲和柱纯化,12%SDS-PAGE电泳分析纯化的表达产物(见图3),在非还原条件下Fab的分子量约为48 kD,与Fab预期的分子量一致,在还原条件下,Fab轻链重链间二硫键断裂,重链与轻链分开,结果48 kD处带消失,分别在23,25 kD处有一条带,分别与Fab轻重链的预期分子量相一致,这些结果表明纯化的表达产物为Fab片段。
2.3 蛋白质印迹实验(Western-blot) SDS-PAGE电泳后,将Fab转移到硝酸纤维素膜上,依次与兔抗人IgG(Fab’)2抗体,辣根过氧化物酶标记的羊抗兔抗体孵育,然后用DAB显色,结果表明(见图3),在48 kD处有一条带,与Fab的预期分子量相同,表明所纯化的表达产物为嵌合Fab。
, http://www.100md.com
2.4 竞争性免疫荧光抑制实验 为了检验Fab表达产物结合特异性,我们以抗CD3单克隆抗体HIT3a作阴性对照,用表达纯化产物Fab和抗CD20单克隆抗体HI47进行竞争性免疫荧光结合抑制实验,FACS测定结果显示(见图4),在无Fab存在的条件下,HI47结合Raji细胞的阳性率为94.49%,而在Fab存在的条件下,HI47结合Raji细胞的阳性率仅为61.55%,表明纯化产物Fab能抑制HI47和Raji细胞表面CD20抗原结合,纯化产物Fab具有CD20结合特异性。
3 讨论
人体对鼠源性抗体的免疫反应(HAMA)以及单克隆抗体的产量是单克隆抗体在肿瘤临床治疗应用的主要制约因素。人源抗体制备、抗体人源化、抗体模拟物的研制、嵌合抗体的构建等策略大大降低鼠源性抗体的免疫原性。由于人源抗体制备比较困难,人源化抗体难以维持原有的亲和力,目前嵌合抗体的构建是用于降低鼠源性抗体免疫原性主要方法。嵌合抗体是用人源抗体的恒定区取代鼠源性抗体的恒定区而得到的一种组合抗体,尽管鼠源性可变区具有潜在的免疫原性,但嵌合抗体引起的HAMA反应并不象人们想象中的那样高。利用抗CD20嵌合抗体Rituxan治疗B淋巴细胞瘤,在注射Rituxan后3个月,甚至1年,病人血清中均无抗Rituxan抗体形成[9]。许多研究亦显示嵌合抗体应用于肿瘤临床治疗是安全有效的[10]。至此抗CD20嵌合抗体产量已成为抗CD20嵌合抗体广泛应用于B淋巴细胞瘤临床治疗的主要制约因素。
, 百拇医药
由于大肠杆菌无糖基化作用,在大肠杆菌中表达有生物活性完整抗体相当困难,为此我们构建了嵌合抗CD20抗体Fab片段,并在大肠杆菌中可溶性分泌表达。经分离纯化获得较高纯度、较高产量的Fab表达产物。与其它表达系统相比,可溶性分泌表达系统具有许多优点,外源蛋白在引导肽引导下,可分泌进入细菌周质腔,在周质腔中外源蛋白折叠成正确的空间构象,并以有活性的可溶状态存在,以分泌形式表达外源蛋白,可避免细菌蛋白酶对外源蛋白的降解,降低外源蛋白对宿主细胞的毒性作用,提高外源蛋白的表达量。我们利用普通的三角瓶表达培养,抗CD20嵌合抗体Fab产量可达1 mg/L。且Fab表达产物以可溶的活性状态存在于细菌周质腔中,这一形式利于Fab分离纯化。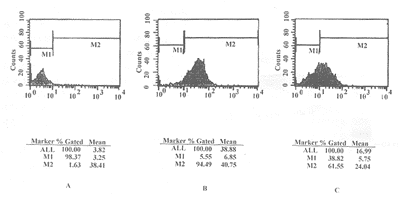
图4 竞争性免疫荧光抑制实验
Fig.4 Competitive inhibition of immune fluorescence experiment
, 百拇医药
Note: A.Fab+GIT3a;B.HI47+PBS;C.HI47+Fab
和完整抗体相比,Fab没有抗体依赖的细胞毒作用(ADDC)、补体依赖的细胞毒作用(CDDC),但有资料表明,抗CD20抗体与CD20结合引起的B淋巴瘤细胞增殖抑制、B淋巴瘤细胞凋亡是抗CD20抗体抗瘤作用的主要机制之一[11]。我们表达的嵌合Fab能特异和CD20结合,这一嵌合抗CD20抗体Fab片段有望用于B淋巴细胞瘤的临床治疗。
863计划资助项目(102-09-03-03)
作者简介:赖增祖,男,32岁,博士研究生,主要从事抗体基因工程及肿瘤分子药理学研究;
作者单位:彭辉(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
, 百拇医药
许元富(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
朱祯平(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
杨纯正(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
参考文献
1,Tedder T F,Boyd A W,Freedman A S et al. The B cell surface molecule B1 is functionally linked with B cell activation and differentiation.J Immunol,1985;135:97
2,Stashenko P,Nadier L M,Hardy R et al.Characterization of a human B lymphocyte specific antigen.J Immunol,1980;125:1678
, 百拇医药
3,Naddoer L M,Korsmeyer S J,Anderson K C et al. B cell origin of non-T cell acute lymphoblasticleukemia a model for discrete stages of neoplastic and normal pre-B cell differentiation.J Clin Invest,1984;74:332
4,Chang K L,Arber D A,Weiss L M et al. CD20:A review.Applied Immunohistochem,1996;4:1
5,Einfeld D A,Broen J P,Valentine M A et al.Molecular cloning of the human B cell CD20 receptor predicts a hydrophobic protein with multiple transmembrane domains.EMBO J,1988;7:711
, http://www.100md.com
6,Magic Bullets.Finally-approval of a monoclonal antibody for the treatment of cancer.Cancer Biotherapy&Radio Pharmaceuticals,1997;14(4):223
7,杨希峰,沈德诚,金宇光et al.HI47,一种人成熟B细胞单克隆抗体制备,鉴定及其生物特性研究.上海免疫学杂志,1990;10(2):65
8,鄂,征主编.组织培养和分子细胞技术.北京:北京出版社,1994:12
9,Maloney D G,Liles T M,Czerwinski D K et al.Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody(IDEC-C2B8)in patients with recurrent B-cell lymphoma.Blood,1994;84(8):2457
10,Depalml A.Therapeutic monoclonal antibodies.Genetic Engineering News,1998;2:1
11,Shan D,Ledbetter J A,Press O W et al.Apoptosis of malignant human B cell by Ligation of CD20 with monoclonal antibodies.Blood,1998;91(5):1664
[收稿2000-01-29], http://www.100md.com
单位:杨纯正,男,62岁,博士生导师,主要从事肿瘤多药耐药基因及肿瘤分子药理学研究;赖增祖(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020);熊冬生(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020);范冬梅(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
关键词:单克隆抗体;嵌合抗体Fab片段;CD20
中国免疫学杂志001002 摘 要 目的:构建抗CD20嵌合抗体Fab片段表达载体,并在大肠杆菌中进行高效可溶性分泌表达。方法:利用PCR方法从抗CD20单链抗体(ScFv)表达载体上扩增抗CD20抗体轻链可变区基因(VL)、重链可变区基因(VH),然后将VH、VL基因重组到Fab表达载体pYZF中,构建抗CD20Fab表达载体pYZF1cd20,并在27C7菌中高效表这。结果:经Fab表达载体转化的27C7菌株,进行表达培养,经分离纯化获得具有CD20特异结合活性的Fab片段,竞争性免疫荧光抑制实验表明,表达产物Fab片段能竞争性抑制鼠源性抗CD20抗体HI47和CD20表达细胞Raji细胞结合。结论:在大肠杆菌中高效可溶性分泌表达有活性的抗CD20嵌合抗体Fab片段。
, 百拇医药
中国图书分类号 R392.12
High expression of the chimeric antibody Fab against-CD20 in E.coli and bioactivity determination
LAI Zeng-Zu,XIONG Dong-Sheng,FAN Dong-Mei
(The National Laboratory of Experimental Hematology,Institute of Hematology,Chinese Academy of Medical Sciences & Peking Union Medical College,Tianjin 300020)
Abstract Objective:Construct the expression vector of the chimeric antibody Fab fragment against CD20 and express in E.coli.Methods:Amplify the gene of the variable region of heavy chain(VH) and light chain(VL)of the antibody against CD20 from the anti-CD20 single chain Fv antibody fragment(ScFv)expression vector by PCR method,clone the VH,VL into the plasmid pYZF to construct the Fab expression vector pYZF1cd20,transformate 27C7 with pYZF1cd20,and the expression of Fab in 27C7.Results:The CD20 binding Fab was expressed, isolated and purified,the competitive inhibition of immune fluorescence experiment show that the Fab inhibits the binding of monoclonal antibody HI47 to CD20 on the surface of Raji cell.
, 百拇医药
Key words Monoclonal antibody Chimeric Fab antibody frament CD20
作为B淋巴细胞表面膜蛋白,CD20与B淋巴细胞Ca2+的跨膜传导密切相关,CD20对B淋巴细胞的增殖和分化具有调节作用[1]。由于CD20仅在前-B淋巴细胞、未成熟B淋巴细胞、成熟B淋巴细胞、激活B淋巴细胞中表达,而在浆细胞、淋巴多能干细胞以及其它组织均无CD20的表达[2-4],在人体血清中亦无游离CD20的存在[5]。因此CD20可作为B淋巴细胞瘤治疗的一个很好治疗靶点。1997年以CD20为靶点的嵌合抗CD20单克隆抗体Rituxan已获准应用于B淋巴细胞瘤临床治疗[6]。这是单克隆抗体研究的又一个里程碑。单克隆抗体HI47(IgG3)是我所于1990年研制成功的抗CD20鼠源性单克隆抗体,第四届国际人类白细胞分化抗原会议将HI47命名为CD20+X[7]。本研究目的在于利用基因工程方法将鼠源性抗CD20单克隆抗体HI47可变区和人源抗体恒定区连接起来,构建嵌合抗CD20抗体Fab片段,以降低鼠源性抗体的免疫源性,并在大肠杆菌中可溶性分泌表达嵌合抗CD20抗体Fab片段,以利于临床应用。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 菌体与材料 抗CD20ScFv表达载体由我室构建(另文发表),pYZL、pYZH1载体、表达载体pYZF为我室构建,大肠杆菌27C7由我室保存。
1.1.2 酶与试剂 Taq酶购于上海生物工程公司,Protein G Agrose亲和柱,限制性内切酶Apa I、Mlu I、Nhe I、Spe I、Sph I、Sty I购于GIBCOBRL公司,抗CD20单克隆抗体HI47、抗CD3单克隆抗体HIT3a、FITC标记的羊抗鼠IgG由我所免疫室提供,兔抗人IgG(Fab')2单克隆抗体,辣根过氧化物酶标记的羊抗兔IgG,购于北京中山生物工程公司。
1.1.3 细胞系 Raji细胞由我室保存,用RPMI1640培养基培养。
, 百拇医药
1.1.4 培养基 2×YT培养基:蛋白胨1.6%,酵母膏1%,氯化钠0.5%,pH7.4。AP5培养基:每1 000 ml含酸水解酪蛋白11 g,酵母膏0.6 g,硫酸镁0.19 g,葡萄糖1.5 g,氯化铵1.07 g,氯化钾3.73 g,氯化钠1.2 g,1 mol/L三乙醇胺(pH7.4)120 ml,过滤灭菌。细菌周质腔蛋白提取液:三羟甲基氨基甲烷25 mmol/L,乙二胺四乙酸1 mmol/L,20%蔗糖(W/V),氯化钠200 mmol/L,苯*****0.01 mmol/L,pH7.5。引物:①VH5’端引物GCTACAAACGCGTACGCTCGGTGAAGCTG(MluI),②VH3’端引物GACCGATGGGCCCTTGGTGGSGGCTGAGGAGACGGT(ApaI),③VL5’端引物GCTACAAACGCGTACGCTGACATCGAGCTC(MluI),④VL3’端引物TTTCAGCTCCACCTTGGTCC(StyI),下画线为括号内的内切酶酶切位点。
, http://www.100md.com
1.2 抗CD20Fab表达载体构建 利用PCR法从抗CD20ScFv表达载体上扩增VH、VL基因,经琼脂糖电泳分离纯化后,分别以MluI+ApaI、MluI+StyI消化,然后重组到带有人免疫球蛋白相应CH1、CL的pYZH1、pYZL载体相应的内切酶位点中,用所得的重组子pYZH1cd20、pYZH1cd20转化27C7菌株,扩增培养后提取pYZLcd20、pYZH1cd20质粒,分别以MluI+NheI,SpeI+SphI消化pYZLcd20、pYZH1cd20,琼脂糖电泳分离纯化含VL、VH的相应DNA片段,利用NheI、SpeI同裂酶的特点,将这两个片段和经MluI+SphI消化所得的pYZF载体片段连接成抗CD20Fab表达载体pYZF1cd20(见图1)。
1.3 抗CD20Fab片段可溶性表达及分离纯化 将载体pYZF1cd20转化27C7菌株,挑取单菌落接种5 ml含氨苄青霉素50 μg/ml的2×YT培养基,37℃,200 r/min,振荡培养6 h,至OD600=0.6;6 000 r/min、4℃离心10 min收集菌株,将菌株重新悬浮于20 ml含氨苄青霉素50 μg/ml的AP5培养基,30℃,250 r/min,振荡培养20 h;6 000 r/min、4℃离心10 min收集菌体,将菌体于-20℃冻存1 h,化冻后加1 ml细菌周质腔蛋白提取液,混匀,置于4℃轻摇1 h,12 000 r/min,4℃离心20 min,取上清,用Protein G Agrose亲和柱分离纯化Fab。
, 百拇医药
1.4 蛋白质印迹实验(Western-blot)[8] 12%SDS-PAGE电泳Fab表达产物,后将其转移到硝酸纤维素膜上,5%脱脂奶溶液4℃封闭过夜,加一抗兔抗人IgG(Fab’)2,4℃,孵育2 h,磷酸盐缓冲液(PBS)洗3次,加二抗辣根过氧化物酶标记羊抗兔IgG,4℃,孵育2 h,Tween Tris缓冲盐溶液(TBST)洗3次,每次10 min,然后用二氨基联苯胺(DAB)进行显色。
1.5 竞争性免疫荧光抑制实验 将浓度为20 μg/ml的HI47溶液和1×106Raji细胞在4℃下孵育1 h,2 000 r/min,4℃离心8 min,弃上清,PBS洗细胞3次,将细胞重悬于30 μl浓度为40 μg/ml Fab溶液,4℃放置1 h,2 000 r/min,4℃离心10 min,弃上清,PBS洗细胞3次,将细胞重悬30 μl按效价稀释好的羊抗鼠IgG-FITC溶液,4℃放置1 h,2 000 r/min,4℃离心10 min,弃上清,PBS洗细胞3次,FACS测定。
, 百拇医药
2 结果
2.1 抗CD20Fab表达载体构建 利用PCR法从抗CD20Fab表达载体上扩增VH、VL基因,将VH、VL基因重组到表达载体pYZF的相应酶切位点中,构建嵌合抗CD20Fab片段表达载体pYZF1cd20,核酸序列测定结果表明VH、VL基因正确重组到表达载体pYZF相应的酶切位点中。

图1 表达载体pYZF1cd20的结构
Fig.1 Map of the expression vector pYZF1cd20

, 百拇医药
图2 SDS-PAGE电泳分析
Fig.2 SDS-PAGE analysis
Note: A.unreduced condition;1.periplasm extract;2.purified Fab;B.reduced condition;1.periplasm extract;2.purified Fab

图3 Western-blot检测
Fig.3 Detection of Western blot
Note:1.periplasm extract;2.purified Fab
, http://www.100md.com
2.2 抗CD20Fab在大肠杆菌中可溶性分泌表达及分离纯化 挑取单菌落接种2×YT培养基,培养至OD600约为0.6时,转接AP5培养基进行诱导表达,表达产物用细菌周质腔蛋白提取液提取,用Protein G Agrose亲和柱纯化,12%SDS-PAGE电泳分析纯化的表达产物(见图3),在非还原条件下Fab的分子量约为48 kD,与Fab预期的分子量一致,在还原条件下,Fab轻链重链间二硫键断裂,重链与轻链分开,结果48 kD处带消失,分别在23,25 kD处有一条带,分别与Fab轻重链的预期分子量相一致,这些结果表明纯化的表达产物为Fab片段。
2.3 蛋白质印迹实验(Western-blot) SDS-PAGE电泳后,将Fab转移到硝酸纤维素膜上,依次与兔抗人IgG(Fab’)2抗体,辣根过氧化物酶标记的羊抗兔抗体孵育,然后用DAB显色,结果表明(见图3),在48 kD处有一条带,与Fab的预期分子量相同,表明所纯化的表达产物为嵌合Fab。
, http://www.100md.com
2.4 竞争性免疫荧光抑制实验 为了检验Fab表达产物结合特异性,我们以抗CD3单克隆抗体HIT3a作阴性对照,用表达纯化产物Fab和抗CD20单克隆抗体HI47进行竞争性免疫荧光结合抑制实验,FACS测定结果显示(见图4),在无Fab存在的条件下,HI47结合Raji细胞的阳性率为94.49%,而在Fab存在的条件下,HI47结合Raji细胞的阳性率仅为61.55%,表明纯化产物Fab能抑制HI47和Raji细胞表面CD20抗原结合,纯化产物Fab具有CD20结合特异性。
3 讨论
人体对鼠源性抗体的免疫反应(HAMA)以及单克隆抗体的产量是单克隆抗体在肿瘤临床治疗应用的主要制约因素。人源抗体制备、抗体人源化、抗体模拟物的研制、嵌合抗体的构建等策略大大降低鼠源性抗体的免疫原性。由于人源抗体制备比较困难,人源化抗体难以维持原有的亲和力,目前嵌合抗体的构建是用于降低鼠源性抗体免疫原性主要方法。嵌合抗体是用人源抗体的恒定区取代鼠源性抗体的恒定区而得到的一种组合抗体,尽管鼠源性可变区具有潜在的免疫原性,但嵌合抗体引起的HAMA反应并不象人们想象中的那样高。利用抗CD20嵌合抗体Rituxan治疗B淋巴细胞瘤,在注射Rituxan后3个月,甚至1年,病人血清中均无抗Rituxan抗体形成[9]。许多研究亦显示嵌合抗体应用于肿瘤临床治疗是安全有效的[10]。至此抗CD20嵌合抗体产量已成为抗CD20嵌合抗体广泛应用于B淋巴细胞瘤临床治疗的主要制约因素。
, 百拇医药
由于大肠杆菌无糖基化作用,在大肠杆菌中表达有生物活性完整抗体相当困难,为此我们构建了嵌合抗CD20抗体Fab片段,并在大肠杆菌中可溶性分泌表达。经分离纯化获得较高纯度、较高产量的Fab表达产物。与其它表达系统相比,可溶性分泌表达系统具有许多优点,外源蛋白在引导肽引导下,可分泌进入细菌周质腔,在周质腔中外源蛋白折叠成正确的空间构象,并以有活性的可溶状态存在,以分泌形式表达外源蛋白,可避免细菌蛋白酶对外源蛋白的降解,降低外源蛋白对宿主细胞的毒性作用,提高外源蛋白的表达量。我们利用普通的三角瓶表达培养,抗CD20嵌合抗体Fab产量可达1 mg/L。且Fab表达产物以可溶的活性状态存在于细菌周质腔中,这一形式利于Fab分离纯化。

图4 竞争性免疫荧光抑制实验
Fig.4 Competitive inhibition of immune fluorescence experiment
, 百拇医药
Note: A.Fab+GIT3a;B.HI47+PBS;C.HI47+Fab
和完整抗体相比,Fab没有抗体依赖的细胞毒作用(ADDC)、补体依赖的细胞毒作用(CDDC),但有资料表明,抗CD20抗体与CD20结合引起的B淋巴瘤细胞增殖抑制、B淋巴瘤细胞凋亡是抗CD20抗体抗瘤作用的主要机制之一[11]。我们表达的嵌合Fab能特异和CD20结合,这一嵌合抗CD20抗体Fab片段有望用于B淋巴细胞瘤的临床治疗。
863计划资助项目(102-09-03-03)
作者简介:赖增祖,男,32岁,博士研究生,主要从事抗体基因工程及肿瘤分子药理学研究;
作者单位:彭辉(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
, 百拇医药
许元富(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
朱祯平(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
杨纯正(中国医学科学院中国协和医科大学血液学研究所实验血液学国家重点实验室,天津300020)
参考文献
1,Tedder T F,Boyd A W,Freedman A S et al. The B cell surface molecule B1 is functionally linked with B cell activation and differentiation.J Immunol,1985;135:97
2,Stashenko P,Nadier L M,Hardy R et al.Characterization of a human B lymphocyte specific antigen.J Immunol,1980;125:1678
, 百拇医药
3,Naddoer L M,Korsmeyer S J,Anderson K C et al. B cell origin of non-T cell acute lymphoblasticleukemia a model for discrete stages of neoplastic and normal pre-B cell differentiation.J Clin Invest,1984;74:332
4,Chang K L,Arber D A,Weiss L M et al. CD20:A review.Applied Immunohistochem,1996;4:1
5,Einfeld D A,Broen J P,Valentine M A et al.Molecular cloning of the human B cell CD20 receptor predicts a hydrophobic protein with multiple transmembrane domains.EMBO J,1988;7:711
, http://www.100md.com
6,Magic Bullets.Finally-approval of a monoclonal antibody for the treatment of cancer.Cancer Biotherapy&Radio Pharmaceuticals,1997;14(4):223
7,杨希峰,沈德诚,金宇光et al.HI47,一种人成熟B细胞单克隆抗体制备,鉴定及其生物特性研究.上海免疫学杂志,1990;10(2):65
8,鄂,征主编.组织培养和分子细胞技术.北京:北京出版社,1994:12
9,Maloney D G,Liles T M,Czerwinski D K et al.Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody(IDEC-C2B8)in patients with recurrent B-cell lymphoma.Blood,1994;84(8):2457
10,Depalml A.Therapeutic monoclonal antibodies.Genetic Engineering News,1998;2:1
11,Shan D,Ledbetter J A,Press O W et al.Apoptosis of malignant human B cell by Ligation of CD20 with monoclonal antibodies.Blood,1998;91(5):1664
[收稿2000-01-29], http://www.100md.com