γ-射线诱导HL-60细胞凋亡相关基因的分离和鉴定*
作者:李小明 童新宋天保 孙志贤
单位:李小明 宋天保 (组织学与胚胎学教研室 西安 710061);童新 孙志贤 军事医学科学院放射医学研究所 北京 100850
关键词:γ-射线;细胞调亡;caspase-3/CPP-32/Yama;分子克隆
西安医科大学学报/990301 摘要 为明确参与γ-射线诱导HL-60细胞凋亡的caspase家族成员,根据已知caspase家族成员保守肽序列设计简并引物,经RT-PCR从凋亡HL-60细胞mRNA扩增出一条带,通过基因克隆及序列测定进行鉴定。结果克隆出caspase-3 cDNA的一段序列。说明caspase-3参与了γ-射线诱导的HL-60细胞凋亡,可能是该凋亡途径的枢纽元件。
ISOLATION AND IDENTIFICATION OF THE RELATED
, 百拇医药
GENE MEDIATING γ-RADIATION-INDUCED APOPTOSIS IN HUMAN HL-60 CELLS
Li Xiaoming,Tong Xin, Song Tianbao et al
(Department of Histology and Embryology)
Abstract To identify the member of the caspase family proteases involved in γ-radiation-induced apoptosis in HL-60 cells, using degenerated oligonucleotide primers encoding the highly conserved peptides,which were present in all known caspases, RT-PCR was performed on poly(A) RNA from the γ-radiation-induced apoptotic HL-60 cells.Then,cloned and sequenced to identify the amplified DNA fragments.The results showed that the amplified DNA fragments were identified with a part of caspase-3 cDNA.It indicated that caspase-3 was involved in γ-radiation-induced apoptosis in HL-60 cells and may be the pivotal element of radiation-induced apoptosis。
, 百拇医药
Key words γ-radiation;apoptosis;caspase-3/CPP-32/Yama;molecular cloning
近年来的研究结果表明,天冬氨酸特异的半胱氨酸蛋白酶caspase家族成员在细胞凋亡执行阶段发挥重要功能[1]。辐射作为一种基因毒素能诱发细胞凋亡,但目前对其调控机制不甚明了。已知,不同诱发因素导致不同细胞凋亡时,参与信号引发、调控执行阶段的相关分子不尽相同,最终显示出的形态特征也有一定的差异,反映出凋亡发生机制的多样性[2,3]。
新近,从γ-射线诱发的凋亡U937细胞中克隆出了caspase-3/CPP-32/Yama基因片段,并发现,并非是caspase-1(ICE)特异性蛋白酶抑制剂,而是caspase-3蛋白酶抑制剂可阻抑这一细胞凋亡的进程[4]。HL-60细胞与U937细胞不同,它是辐射敏感细胞,而且是p53缺陷型细胞。大量事实证明,辐射诱发细胞凋亡存在抑癌基因产物p53依赖性和p53非依赖性两种机制,但其蛋白酶级联反应机制知之甚少[5,6]。 本实验从γ-射线诱导的凋亡 HL-60 细胞中提取 mRNA, 根据caspase家族成员保守肽序列设计合成简并引物,经RT-PCR、基因克隆及测序鉴定扩增产物,以明确该凋亡过程中可能参与的caspase家族成员。
, 百拇医药
材料与方法
1 细胞培养及照射 人髓性白血病细胞株HL-60细胞在含10%新生牛血清的RPMI1640培养基中培养。照射时细胞浓度为1×106/ml,以5Gy γ-射线照射,剂量率1.943 Gy/min,于照后继续培养9、12、24、30h收获细胞用于以下实验。以未照射常规培养HL-60细胞为阴性对照。
2 细胞凋亡及凋亡时限的确定
Hoechst 33258染色荧光显微镜观察 PBS洗涤,分别制备单细胞涂片,甲醇∶冰乙酸(3∶1)固定5min,点加Hoechst 33258染液(5μg/ml)染色10min,稍洗,荧光显微镜WU下观察。活细胞核呈弥散均匀白色荧光,出现凋亡细胞时,细胞核或胞质内可见浓染致密的白色颗粒状荧光。
透射电镜观察 PBS洗涤,离心入琼脂块,3%戊二醛固定2h、1%锇酸固定1h,50%~90%乙醇系列脱水,10min/次,丙酮浸透,EPON812包埋,常规制备超薄切片(Lerica Company′s Model S),透射电镜(Philip EM-400T)观察。 检测DNA梯状带确定凋亡时限 在1×106个经PBS洗涤后的沉淀细胞中加入0.5ml低渗裂解液(1mmol/L EDTA,10mmol/L Tris,100mmol/L NaCl,1% SDS, 含100μg/ml蛋白酶K),混匀,37℃ 30min,离心沉淀;上清用酚:氯仿:异戊醇抽提,无水乙醇和NaAc沉淀DNA,溶于TE中。1%琼脂糖凝胶电泳,端电压60V, 1h,紫外光下观察。以出现DNA 梯状带(DNA ladder)作为细胞凋亡判断标准。取阴性对照、5Gy照射24h和5Gy照射30h HL-60细胞用于以下实验。
, 百拇医药
3 mRNA分离 分别用总RNA提取试剂盒TRIzol Rengent(GIBCO公司)和mRNA提取试剂盒Poly ATtract(Promega公司)按说明分离纯化mRNA。
4 Caspases克隆及序列测定 mRNA逆转录成cDNA,以其为模板,用简并引物半巢式-PCR扩增。引物序列如下:
引物1:5′-AA(A/G)CCCAA(G/A)(G/C)T(C/G)TTC(A/T)T(C/T)AT-3′;
引物2:5′-AT(C/T)CAGGCITG(C/T)CG(T/A)GG-3′;
引物3:5′-(C/T)TG(A/G)ATG(A/T)ACCCA(G/T)GAGCC-3′
扩增产物经玻璃奶法回收,克隆入pGEM-T载体(Promega),转化JM109感受态细胞,利用PCR阳性克隆筛选试剂盒(军事医学科学院王升启教授设计合成)鉴定重组质粒。序列分析按试剂盒(70770 Sequenase Version 2.0 DNA Sequencing Kit,Amersham公司)说明书进行。
, http://www.100md.com
结果
1 γ-射线诱导HL-60细胞死亡方式 Hoechst 33258染色荧光显微镜观察,可见HL-60细胞膜出泡明显,细胞核荧光增强,染色质边聚形成新月状。后期,大多数细胞核碎裂形成多个大小不一染色质致密团分散于细胞内。细胞间可见许多大小不一的凋亡小体。电镜观察,可见除正常形态细胞外,多为具凋亡形态特征的凋亡细胞。包括细胞核染色质增粗,沿核膜不均匀边聚或形成新月状。粗面内质网增多,多层环绕胞核。后期,细胞核分割形成两个或多个核碎片。还可见大小不一的圆形凋亡小体,分散于细胞之间。
2 γ-射线诱导HL-60细胞凋亡时限 以DNA梯状带作为判断细胞凋亡的标准,HL-60细胞在5Gy照射后24h开始出现凋亡。结合形态学观察,可见随着时间的推移,凋亡细胞数量增加及程度增强。
3 RT-PCR、基因克隆及测序结果 纯化的mRNA反转录为cDNA,经半巢式-PCR二次扩增,二扩产物琼脂糖凝胶电泳分析。未照射阴性对照、5Gy照射后24h及5Gy照射后30h调亡细胞出一条特异性带,但5Gy照后30h扩增产量明显高于未照射阴性对照和5Gy照后24h扩增产量(图1)。故回收5Gy照射后30h cDNA片段进行基因克隆,阳性克隆筛选结果见图2。最后经序列测定,GenBank联机检索,证明是已报道的caspase-3/CPP-32/Yama cDNA的一段序列。
, http://www.100md.com
图1 RT-PCR扩增产物的电泳分析
A:DNA Marker;B:5Gy照后30h;C:5Gy照后24h;
D:未照射阴性对照;E:已知caspase-3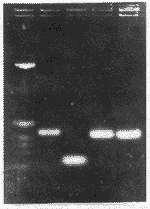
图2 PCR筛选阳性克隆
A:DNA Marker;B、D和E为阳性克隆;
C为阴性克隆
讨论
不同因素诱发的不同种类细胞的凋亡,凋亡的进程及调控机制不尽相同。HL-60细胞是各种抗肿瘤药及辐射诱导凋亡敏感细胞,且其凋亡是p53不依赖性凋亡[5,6]。推测HL-60细胞存在一种最基本的凋亡途径[7]。已知caspase-3参与了γ-射线诱发的U937细胞凋亡,而且是该途径所必需的[4],但尚不清楚caspase家族哪些成员参与了γ-射线诱发的HL-60细胞凋亡。
, 百拇医药
实验证明,caspase家族成员以休眠状态酶原存在于正常细胞中,当接收到死亡信号时被激活,根据已发现的caspase家族蛋白保守氨基酸序列,设计筛选出三条简并引物。提取γ-射线诱发的HL-60凋亡细胞mRNA,反转录PCR,经简并引物半巢式-PCR,排除阴性对照出现的扩增产物,可扩增出参与该凋亡过程的所有caspase cDNA。理论上引物1可以结合64种序列,引物2结合32种,引物3则与16种序列结合,它们的配对基本上覆盖了所有大的编码序列。在设计时同时还充分考虑到引物的特异性。该实验结果仅从5Gy γ-射线照射后30h凋亡HL-60细胞扩增出一段caspase-3 cDNA,充分说明,caspase-3参与了γ-射线诱发的HL-60细胞凋亡。
Caspase是近年来发现的哺乳动物细胞凋亡相关蛋白酶。大量的事实证明,细胞凋亡发生是一个复杂的由caspase家族成员介导的蛋白酶级联反应过程。Caspase在组织分布和降解已知底物的功能上彼此有重叠现象,但在不同组织细胞或同一细胞受不同刺激诱发凋亡过程中,激活的caspase不尽相同。但普遍认为该家族成员caspase-3是哺乳动物细胞凋亡中的关键蛋白酶,它的活化预示着细胞凋亡执行阶段的开始[1,8,9]。因为人类caspase-3全长氨基酸序列与线虫死亡蛋白酶Ced-3最接近,被认为是Ced-3在哺乳动物中真正的对应者;虽然该家族第一个被发现的成员caspase-1是一个重要成分,caspase-1敲除鼠并不影响凋亡的发生,而caspase-3敲除鼠神经系统及大脑发育过程中的程序性细胞死亡受阻;caspase-3特异性蛋白酶抑制剂在体外可阻抑凋亡的发生;caspase-3可被该家族其它成员激活。然而caspase-3并不是所有调亡途径所必需的。Hakem R等[10]通过caspase-3和caspase-9基因敲除鼠研究不同因素诱导的各种不同类型在体细胞的凋亡,发现紫外线诱导的胸腺细胞以及地塞米松和γ-射线诱导的胸腺细胞、脾细胞及胚胎干细胞的凋亡均为caspase-3非依赖性。
, 百拇医药
虽然本实验获得的只是caspase-3的一段序列,但可初步证明,caspase-3参与了γ-射线诱发的HL-60细胞凋亡,可能是该凋亡途径的枢纽元件。它为临床治疗细胞凋亡相关疾病及治疗所用药物的设计提供了理论基础。
*国家自然科学基金资助(No.39770823)
参考文献
1 Alnemri ES.Mammalian cell death proteases:A family of highly conserved aspartate specific custeine proteases.J Cell Biochem, 1997;64(1)∶33
2 Martins LM,Mesner PW,Kottke TJ et al.Comparison of caspase activation and subcellular localization HL-60 and K562 cells undergoing etoposide-induced apoptosis.Blood,1997;90(11)∶4283
, http://www.100md.com
3 Dini L,Coppola S,Ruzittu MT et al.Multiple pathways for apoptotic nuclear fragmentation.Exp Cell Res ,1996;223(4)∶340
4 童新,罗 瑛,董 燕等.辐射诱发白血病U937细胞凋亡基因分离与鉴定.军事医学科学院院刊.1998;22(1)∶51
5 Han Z,Chatterjee D,He DM et al.Evidence for a G2 checkpoint in p53 -independent apoptosis induction by X-irradiation.Mol Cell Bio,1995;15(11)∶5849
6 Silva A,Wyllie A,Collin MKL.p53 is not required for regulation of apoptosis or radioprotection by interleukin-3. Blood,1997;89(8)∶2717
, 百拇医药
7 Woloschak GE.Different pathways for radiation-induced apoptosis.In J Radia Oncol BioPhys, 1997;39(5)∶951
8 Fernandes-Alnemri T,Litwack G,Alnemri ES.CPP32, a novel human apoptotic protein with homology to caeorhabditis elegans cell death protein ced-3 and mammalian interleukin-1 β-converting enzyme.J Bio Chem,1994;269(49)∶30761
9 Wyllie A.An endonuclease at last.Nature,1998;391(1)∶20
10 Hakem R,Hakem A,Duncan GS et al.Differential requirment for caspase 9 in apoptotic pathways in vivo.Cell ,1998;94(7)∶339
(1999-01-26收稿 1999-04-28修回), 百拇医药
单位:李小明 宋天保 (组织学与胚胎学教研室 西安 710061);童新 孙志贤 军事医学科学院放射医学研究所 北京 100850
关键词:γ-射线;细胞调亡;caspase-3/CPP-32/Yama;分子克隆
西安医科大学学报/990301 摘要 为明确参与γ-射线诱导HL-60细胞凋亡的caspase家族成员,根据已知caspase家族成员保守肽序列设计简并引物,经RT-PCR从凋亡HL-60细胞mRNA扩增出一条带,通过基因克隆及序列测定进行鉴定。结果克隆出caspase-3 cDNA的一段序列。说明caspase-3参与了γ-射线诱导的HL-60细胞凋亡,可能是该凋亡途径的枢纽元件。
ISOLATION AND IDENTIFICATION OF THE RELATED
, 百拇医药
GENE MEDIATING γ-RADIATION-INDUCED APOPTOSIS IN HUMAN HL-60 CELLS
Li Xiaoming,Tong Xin, Song Tianbao et al
(Department of Histology and Embryology)
Abstract To identify the member of the caspase family proteases involved in γ-radiation-induced apoptosis in HL-60 cells, using degenerated oligonucleotide primers encoding the highly conserved peptides,which were present in all known caspases, RT-PCR was performed on poly(A) RNA from the γ-radiation-induced apoptotic HL-60 cells.Then,cloned and sequenced to identify the amplified DNA fragments.The results showed that the amplified DNA fragments were identified with a part of caspase-3 cDNA.It indicated that caspase-3 was involved in γ-radiation-induced apoptosis in HL-60 cells and may be the pivotal element of radiation-induced apoptosis。
, 百拇医药
Key words γ-radiation;apoptosis;caspase-3/CPP-32/Yama;molecular cloning
近年来的研究结果表明,天冬氨酸特异的半胱氨酸蛋白酶caspase家族成员在细胞凋亡执行阶段发挥重要功能[1]。辐射作为一种基因毒素能诱发细胞凋亡,但目前对其调控机制不甚明了。已知,不同诱发因素导致不同细胞凋亡时,参与信号引发、调控执行阶段的相关分子不尽相同,最终显示出的形态特征也有一定的差异,反映出凋亡发生机制的多样性[2,3]。
新近,从γ-射线诱发的凋亡U937细胞中克隆出了caspase-3/CPP-32/Yama基因片段,并发现,并非是caspase-1(ICE)特异性蛋白酶抑制剂,而是caspase-3蛋白酶抑制剂可阻抑这一细胞凋亡的进程[4]。HL-60细胞与U937细胞不同,它是辐射敏感细胞,而且是p53缺陷型细胞。大量事实证明,辐射诱发细胞凋亡存在抑癌基因产物p53依赖性和p53非依赖性两种机制,但其蛋白酶级联反应机制知之甚少[5,6]。 本实验从γ-射线诱导的凋亡 HL-60 细胞中提取 mRNA, 根据caspase家族成员保守肽序列设计合成简并引物,经RT-PCR、基因克隆及测序鉴定扩增产物,以明确该凋亡过程中可能参与的caspase家族成员。
, 百拇医药
材料与方法
1 细胞培养及照射 人髓性白血病细胞株HL-60细胞在含10%新生牛血清的RPMI1640培养基中培养。照射时细胞浓度为1×106/ml,以5Gy γ-射线照射,剂量率1.943 Gy/min,于照后继续培养9、12、24、30h收获细胞用于以下实验。以未照射常规培养HL-60细胞为阴性对照。
2 细胞凋亡及凋亡时限的确定
Hoechst 33258染色荧光显微镜观察 PBS洗涤,分别制备单细胞涂片,甲醇∶冰乙酸(3∶1)固定5min,点加Hoechst 33258染液(5μg/ml)染色10min,稍洗,荧光显微镜WU下观察。活细胞核呈弥散均匀白色荧光,出现凋亡细胞时,细胞核或胞质内可见浓染致密的白色颗粒状荧光。
透射电镜观察 PBS洗涤,离心入琼脂块,3%戊二醛固定2h、1%锇酸固定1h,50%~90%乙醇系列脱水,10min/次,丙酮浸透,EPON812包埋,常规制备超薄切片(Lerica Company′s Model S),透射电镜(Philip EM-400T)观察。 检测DNA梯状带确定凋亡时限 在1×106个经PBS洗涤后的沉淀细胞中加入0.5ml低渗裂解液(1mmol/L EDTA,10mmol/L Tris,100mmol/L NaCl,1% SDS, 含100μg/ml蛋白酶K),混匀,37℃ 30min,离心沉淀;上清用酚:氯仿:异戊醇抽提,无水乙醇和NaAc沉淀DNA,溶于TE中。1%琼脂糖凝胶电泳,端电压60V, 1h,紫外光下观察。以出现DNA 梯状带(DNA ladder)作为细胞凋亡判断标准。取阴性对照、5Gy照射24h和5Gy照射30h HL-60细胞用于以下实验。
, 百拇医药
3 mRNA分离 分别用总RNA提取试剂盒TRIzol Rengent(GIBCO公司)和mRNA提取试剂盒Poly ATtract(Promega公司)按说明分离纯化mRNA。
4 Caspases克隆及序列测定 mRNA逆转录成cDNA,以其为模板,用简并引物半巢式-PCR扩增。引物序列如下:
引物1:5′-AA(A/G)CCCAA(G/A)(G/C)T(C/G)TTC(A/T)T(C/T)AT-3′;
引物2:5′-AT(C/T)CAGGCITG(C/T)CG(T/A)GG-3′;
引物3:5′-(C/T)TG(A/G)ATG(A/T)ACCCA(G/T)GAGCC-3′
扩增产物经玻璃奶法回收,克隆入pGEM-T载体(Promega),转化JM109感受态细胞,利用PCR阳性克隆筛选试剂盒(军事医学科学院王升启教授设计合成)鉴定重组质粒。序列分析按试剂盒(70770 Sequenase Version 2.0 DNA Sequencing Kit,Amersham公司)说明书进行。
, http://www.100md.com
结果
1 γ-射线诱导HL-60细胞死亡方式 Hoechst 33258染色荧光显微镜观察,可见HL-60细胞膜出泡明显,细胞核荧光增强,染色质边聚形成新月状。后期,大多数细胞核碎裂形成多个大小不一染色质致密团分散于细胞内。细胞间可见许多大小不一的凋亡小体。电镜观察,可见除正常形态细胞外,多为具凋亡形态特征的凋亡细胞。包括细胞核染色质增粗,沿核膜不均匀边聚或形成新月状。粗面内质网增多,多层环绕胞核。后期,细胞核分割形成两个或多个核碎片。还可见大小不一的圆形凋亡小体,分散于细胞之间。
2 γ-射线诱导HL-60细胞凋亡时限 以DNA梯状带作为判断细胞凋亡的标准,HL-60细胞在5Gy照射后24h开始出现凋亡。结合形态学观察,可见随着时间的推移,凋亡细胞数量增加及程度增强。
3 RT-PCR、基因克隆及测序结果 纯化的mRNA反转录为cDNA,经半巢式-PCR二次扩增,二扩产物琼脂糖凝胶电泳分析。未照射阴性对照、5Gy照射后24h及5Gy照射后30h调亡细胞出一条特异性带,但5Gy照后30h扩增产量明显高于未照射阴性对照和5Gy照后24h扩增产量(图1)。故回收5Gy照射后30h cDNA片段进行基因克隆,阳性克隆筛选结果见图2。最后经序列测定,GenBank联机检索,证明是已报道的caspase-3/CPP-32/Yama cDNA的一段序列。

, http://www.100md.com
图1 RT-PCR扩增产物的电泳分析
A:DNA Marker;B:5Gy照后30h;C:5Gy照后24h;
D:未照射阴性对照;E:已知caspase-3

图2 PCR筛选阳性克隆
A:DNA Marker;B、D和E为阳性克隆;
C为阴性克隆
讨论
不同因素诱发的不同种类细胞的凋亡,凋亡的进程及调控机制不尽相同。HL-60细胞是各种抗肿瘤药及辐射诱导凋亡敏感细胞,且其凋亡是p53不依赖性凋亡[5,6]。推测HL-60细胞存在一种最基本的凋亡途径[7]。已知caspase-3参与了γ-射线诱发的U937细胞凋亡,而且是该途径所必需的[4],但尚不清楚caspase家族哪些成员参与了γ-射线诱发的HL-60细胞凋亡。
, 百拇医药
实验证明,caspase家族成员以休眠状态酶原存在于正常细胞中,当接收到死亡信号时被激活,根据已发现的caspase家族蛋白保守氨基酸序列,设计筛选出三条简并引物。提取γ-射线诱发的HL-60凋亡细胞mRNA,反转录PCR,经简并引物半巢式-PCR,排除阴性对照出现的扩增产物,可扩增出参与该凋亡过程的所有caspase cDNA。理论上引物1可以结合64种序列,引物2结合32种,引物3则与16种序列结合,它们的配对基本上覆盖了所有大的编码序列。在设计时同时还充分考虑到引物的特异性。该实验结果仅从5Gy γ-射线照射后30h凋亡HL-60细胞扩增出一段caspase-3 cDNA,充分说明,caspase-3参与了γ-射线诱发的HL-60细胞凋亡。
Caspase是近年来发现的哺乳动物细胞凋亡相关蛋白酶。大量的事实证明,细胞凋亡发生是一个复杂的由caspase家族成员介导的蛋白酶级联反应过程。Caspase在组织分布和降解已知底物的功能上彼此有重叠现象,但在不同组织细胞或同一细胞受不同刺激诱发凋亡过程中,激活的caspase不尽相同。但普遍认为该家族成员caspase-3是哺乳动物细胞凋亡中的关键蛋白酶,它的活化预示着细胞凋亡执行阶段的开始[1,8,9]。因为人类caspase-3全长氨基酸序列与线虫死亡蛋白酶Ced-3最接近,被认为是Ced-3在哺乳动物中真正的对应者;虽然该家族第一个被发现的成员caspase-1是一个重要成分,caspase-1敲除鼠并不影响凋亡的发生,而caspase-3敲除鼠神经系统及大脑发育过程中的程序性细胞死亡受阻;caspase-3特异性蛋白酶抑制剂在体外可阻抑凋亡的发生;caspase-3可被该家族其它成员激活。然而caspase-3并不是所有调亡途径所必需的。Hakem R等[10]通过caspase-3和caspase-9基因敲除鼠研究不同因素诱导的各种不同类型在体细胞的凋亡,发现紫外线诱导的胸腺细胞以及地塞米松和γ-射线诱导的胸腺细胞、脾细胞及胚胎干细胞的凋亡均为caspase-3非依赖性。
, 百拇医药
虽然本实验获得的只是caspase-3的一段序列,但可初步证明,caspase-3参与了γ-射线诱发的HL-60细胞凋亡,可能是该凋亡途径的枢纽元件。它为临床治疗细胞凋亡相关疾病及治疗所用药物的设计提供了理论基础。
*国家自然科学基金资助(No.39770823)
参考文献
1 Alnemri ES.Mammalian cell death proteases:A family of highly conserved aspartate specific custeine proteases.J Cell Biochem, 1997;64(1)∶33
2 Martins LM,Mesner PW,Kottke TJ et al.Comparison of caspase activation and subcellular localization HL-60 and K562 cells undergoing etoposide-induced apoptosis.Blood,1997;90(11)∶4283
, http://www.100md.com
3 Dini L,Coppola S,Ruzittu MT et al.Multiple pathways for apoptotic nuclear fragmentation.Exp Cell Res ,1996;223(4)∶340
4 童新,罗 瑛,董 燕等.辐射诱发白血病U937细胞凋亡基因分离与鉴定.军事医学科学院院刊.1998;22(1)∶51
5 Han Z,Chatterjee D,He DM et al.Evidence for a G2 checkpoint in p53 -independent apoptosis induction by X-irradiation.Mol Cell Bio,1995;15(11)∶5849
6 Silva A,Wyllie A,Collin MKL.p53 is not required for regulation of apoptosis or radioprotection by interleukin-3. Blood,1997;89(8)∶2717
, 百拇医药
7 Woloschak GE.Different pathways for radiation-induced apoptosis.In J Radia Oncol BioPhys, 1997;39(5)∶951
8 Fernandes-Alnemri T,Litwack G,Alnemri ES.CPP32, a novel human apoptotic protein with homology to caeorhabditis elegans cell death protein ced-3 and mammalian interleukin-1 β-converting enzyme.J Bio Chem,1994;269(49)∶30761
9 Wyllie A.An endonuclease at last.Nature,1998;391(1)∶20
10 Hakem R,Hakem A,Duncan GS et al.Differential requirment for caspase 9 in apoptotic pathways in vivo.Cell ,1998;94(7)∶339
(1999-01-26收稿 1999-04-28修回), 百拇医药