赤芍总甙对原代培养大鼠神经细胞损伤模型的保护作用
作者:何丽娜 杨军 何素冰 王静 刘超
单位:安徽省医学科学研究所,省生物医药重点实验室,合肥 230061
关键词:赤芍总甙;神经细胞;脑缺血
中国临床药理学与治疗学000108
目的 探讨赤芍总甙对大鼠神经细胞脑缺血样损伤模型的保护作用及其机制。方法 采用组织培养法,以原代大鼠大脑皮层神经细胞为材料,制备缺糖损伤、缺氧损伤、自由基损伤、咖啡因损伤、一氧化氮损伤及NMDA毒性损伤模型。结果 形态学检查发现赤芍总甙(total paeony glycoside,TPG)对6六种脑缺血样损伤模型中的大鼠神经细胞具有明显保护作用,结晶紫染色也提示TPG可显著提高损伤模型中神经细胞的存活数。结论 TPG对上述6种大鼠神经细胞缺血损伤均有显著的保护作用。
, 百拇医药 中图分类号 R285.5
Protective effect of total paeony glocoside against ischemia injury in cultured primary cortex neurons
HE Li-Na YANG Jun HE Su-Bing WANG Jing LIU Chao
(Biological & Medicinal Central Laboratory of Anhui,Hefei 230061)
Aim To investigate protective effects and mechanism of TPG on ischemia-like injury models.Methods Six ischemia models including hypoxia,hypoglucose,oxidant injury,calcium overload,nitric oxide neurotoxicity and excitatory amino acid injury were used to assay the anti-ischemic roles of TPG in cultured primary cortex neurons.Results It was found that TPG possessed obvious protective effects on primary neurons in injury models by the way of morphological examination.Crystal violet staining also indicated that TPG increased number of life neurons in injury models significantly.Couclusions 50~200 μg.ml-1 TPG protected rat cortex cells from all injury models effectively in vitro.
, 百拇医药
Key words total paeony glycoside;cortex neuron;cerebral ischemia
缺血性脑血管病所致的神经细胞损伤涉及多种因素,微循环障碍可导致细胞能量供应短缺,缺血后再灌注所致的NO和氧自由基损伤加重细胞病变的进展,兴奋性氨基酸的毒性作用引起细胞内的钙超载最后导致细胞坏死。治疗缺血性脑血管病药物主要通过影响上述一个或多个环节,从而发挥药物的保护作用。
赤芍总甙为单萜化合物,其主要活性单体成分为芍药甙(paeoniflorin)。文献报道赤芍提取物及芍药甙在钴诱发的局灶性癫痫中对海马CA1区神经原损伤有明显保护作用[1],赤芍提取物可改善东莨菪碱所致小鼠学习记忆障碍,并增强大鼠学习能力[2]。芍药甙显著减轻衰老大鼠学习记忆障碍[3],并对大鼠空间辨别障碍有改善作用[4]。临床上也常见以赤芍治疗缺血性脑血管疾病的报道[5]。为进一步探讨赤芍治疗缺血性脑血管疾病的作用及机理,我们观察了赤芍总甙对6种大鼠神经细胞缺血损伤模型的影响。
, http://www.100md.com
1 材料
1.1 药品与试剂 赤芍总甙(TPG)与白芍总甙(TGP):由安徽省医学科学研究所药化研究室制备。先用60 %乙醇溶解为20 mg.ml-1,再用双蒸水配制浓度为2 mg.ml-1受试溶液。氯酯醒( meclofenoxane,MEC),上海淮海制药厂产品,批号970702,双蒸水溶解。上述三种药物均以微孔滤膜除菌过滤,4 ℃冰箱保存备用。实验时以DMEM培养液稀释至所需浓度。DMEM培养基及马血清购自Gibco公司。连二亚硫酸钠(Na2S2O4)为宜兴市化学制剂三厂产品。葡萄糖氧化酶,武汉中健科技发展有限公司产品。硝普钠(sodium nitroprusside,SNP),北京制药工业研究所实验药厂产品。咖啡因(caffeine,Caf)、NMDA(N-methyl-D-aspartate) 购自Sigma公司。多聚赖氨酸,华美生物工程有限公司产品。胰蛋白酶,美国Diffic公司产品。
, 百拇医药
1.2 动物 Wister乳鼠,1~2日龄。由安徽省医学科学研究所实验动物研究室提供,合格证号:皖医实动准字第03号。
2 方法
2.1 原代大鼠乳鼠脑皮层神经细胞的制备及培养 取Wister大鼠乳鼠数只,常规消毒头颈部,解剖大脑,分离出脑皮层,Hank's液洗涤3次,剪碎成1 mm3小块,置0.25%胰酶中,37 ℃消化1 h,吸弃消化液,Hank's液洗涤3次,滴管吹打至细胞分散。用DMEM生长液(含10%马血清,10%小牛血清)调整细胞浓度为1×106· ml-1,将细胞悬液加至用0.01%多聚赖氨酸浸泡过夜的96孔细胞培养板中,37 ℃,5%CO2温箱中培养,每周换液2次。培养至第7天,换含10 μmol. L-1阿糖胞苷的DMEM培养液培养48 h,以抑制非神经原细胞增殖,再换成DMEM生长液,继续培养至11~14 d进行实验。
, 百拇医药
2.2 药物细胞毒实验 神经细胞培养至11~14 d,吸弃培养上清,分别加入含200、 100、50 μg.ml-1赤芍总甙,200、 100、50 μg.ml-1白芍总甙,1000、500、250 μg.ml-1氯酯醒的DMEM维持液(含5 %马血清和5%小牛血清),100 μl/孔,置37 ℃,5% CO2温箱中培养3 d,观察细胞病变作用(cytopathiceffect,CPE)。同时设相应浓度乙醇对照组。
2.3 药物对实验模型的保护作用
2.3.1 药物对缺糖损伤模型的保护作用 不同浓度的赤芍总甙、白芍总甙和氯酯醒(DMEM维持液稀释)作用细胞24 h后,吸弃药液,加入无糖Earle's液,作用10 h后,换成DMEM维持液,继续培养18 h,观察实验结果。实验同时设损伤模型对照及正常细胞对照。
, http://www.100md.com
2.3.2 药物对缺氧损伤模型的保护作用 将Na2S2O4干粉加入DMEM培养液中,使终浓度为5 mmol.L-1,充分搅拌,调整pH为7.2,即为缺氧溶液。缺氧损伤8 h造成损伤模型。实验除设损伤对照及正常对照外,还设非低氧溶液(配制同缺氧溶液,但需放置3 d以上)对照,以消除Na2S2O4 在水中分解产物的影响。
2.3.3 药物对自由基损伤模型的保护作用 含葡萄糖(25 mmol.L-1)-葡萄糖氧化酶(12.5 mU.ml-1)的无血清DMEM培养基,作用3 h造成自由基损伤模型。实验分组及结果观察同上。
2.3.4 药物对咖啡因损伤模型的保护作用 含10 mmol.L-1咖啡因的DMEM培养液作用45 min后,造成细胞损伤模型。实验分组及结果观察同上。
, http://www.100md.com
2.3.5 药物对NO神经毒性损伤模型的保护作用 含SNP100 μmol.L-1的DMEM培养液作用细胞10 min后,造成 NO神经毒性损伤模型。实验分组及结果观察同上。
2.3.6 药物对NMDA神经毒性损伤模型的保护作用 用无Mg2+ Earle's液洗涤细胞3次,加入含30 μmol.L-1的NMDA,0.5 μmol.L-1甘氨酸的无Mg2+Earle's液,37 ℃,5%CO2温箱中作用4 h后,吸弃培养上清,Earle's液洗涤3次,再换成正常维持液,37 ℃,5%CO2温箱中继续培养18 h,观察实验结果。
2.4 观察指标
2.4.1 细胞形态 倒置显微镜下观察细胞生长情况和细胞形态,摄片。
, http://www.100md.com
2.4.2 结晶紫活细胞染色 模型损伤18 h后,吸弃上清,以37 ℃,pH 7.4 PBS洗涤3次,加入0.2%结晶紫溶液(内含0.2%乙醇)染色1 min,洗涤6次,加1% SDS(十二烷基硫酸钠)溶液100 μl /孔,37 ℃温育30 min,使细胞彻底裂解,用DG3002酶联检测仪测定OD值(λ=630 nm)。
2.5 统计学处理 数据以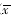 ±s表示,组间数据进行t检验。
±s表示,组间数据进行t检验。
3 结果
3.1 培养细胞形态学观察 细胞接种于多聚赖氨酸处理过的细胞培养板,37 ℃,5%CO2温箱孵育2 h后,倒置显微镜观察:镜下见细胞贴壁,形状呈圆形,分布均匀。培养48 h,细胞逐渐伸出突触。d 4,细胞大多伸展,突触相互交织成网状,胞体呈梭形,三角形。培养至d 11,细胞生长成单层。
, http://www.100md.com
3.2 药物细胞毒性测定 赤芍总甙、白芍总甙、氯酯醒所稀释各浓度组及乙醇对照组均无细胞毒性作用。
3.3 药物对实验模型的保护作用
3.3.1 药物对损伤模型中结晶紫染色活细胞吸光度的影响 存活细胞吸收结晶紫着色,通过测量染色活细胞在630 nm波长处的吸光度,可计算存活神经细胞的比值,结果见表1。
表1 TGP对原代培养的大脑皮层神经细胞缺血损伤的保护作用(OD值)(n=10,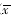 ±s) 组别
±s) 组别
剂量
/μg.ml-1
缺糖损伤
, 百拇医药
缺氧损伤
自由基损伤
咖啡因损伤
NO损伤
NMDA损伤
对照组
0.52±0.06
0.20±0.02
0.39±0.03
0.68±0.06
0.50±0.01
0.28±0.02
, http://www.100md.com
模型组
0.21±0.04△△
0.09±0.03△△
0.11±0.01△△
0.31±0.01△△
0.42±0.03△△
0.02±0.01△△
TPG
200
0.47±0.06**
, 百拇医药
0.13±0.06
0.15±0.04
0.56±0.05*
0.52±0.01**
0.10±0.01**
TPG
50
0.45±0.09**
0.14±0.02*
0.19±0.01**
, 百拇医药
0.62±0.03**
0.48±0.02*
0.07±0.02**
TPG
12.5
0.12±0.08
0.15±0.01**
0.19±0.09
0.59±0.05*
0.54±0.01**
, 百拇医药
0.04±0.02
TPG
3.125
0.09±0.06
0.15±0.02*
0.12±0.03
1.08±0.01*
0.54±0.04**
0.04±0.02
TPG
50
, http://www.100md.com
0.38±0.10*
0.017±0.03**
0.18±0.03*
0.52±0.02**
0.56±0.01**
0.06±0.01**
MEC
100
0.43±0.04**
0.15±0.01**
, http://www.100md.com
0.16±0.03*
0.53±0.02**
0.53±0.01**
0.09±0.01**
与对照组比较△△P<0.01;与模型组比较*P<0.05;**P<0.01
表1结果显示:与正常细胞组相比,六种脑缺血样损伤模型组细胞的OD值有极显著降低,表明活细胞数显著减少。加入药物保护后,可明显提高损伤细胞的 OD值,相应的存活细胞数增加。某些组别中药物的量效关系不明显,可能是由于进行原代细胞培养时,个别培养孔中残存的其它非皮层神经细胞量的差异所致。
, 百拇医药
3.3.2 药物对脑缺血模型中损伤细胞形态的影响 倒置显微镜下观察:在各类缺血性损伤模型中,神经细胞均出明显的细胞病变,表现为胞体肿胀,折光性减弱,突触断裂,呈拉网状,最终细胞圆缩,脱落。细胞加药保护后,细胞损伤明显减轻,细胞形态基本保持完整,仅见部分突触断裂、胞体略有肿胀等现象。结果见图1。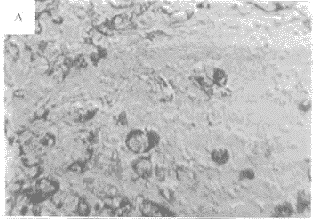

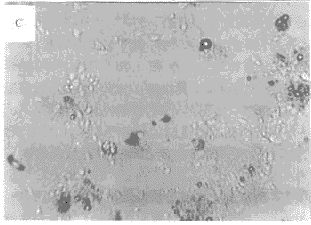

图1 脑缺血模型中损伤细胞形态的显微变化
A:对照组;B:神经细胞损伤开始变化;C:死亡细胞膜分裂、紊乱;D:TPG对损伤的细胞保护作用
, 百拇医药
4 讨论
脑缺血最初过程为神经细胞能量供应缺乏,药物是否具有保护作用,可通过缺氧和缺糖损伤模型进行验证。实验证实赤芍总甙对这两种细胞损伤模型具有不同程度的保护,以50 μg.ml-1组作用最为显著。
自由基、NO和NMDA所致神经细胞损伤模型可模拟脑缺血损伤的具体过程,高浓度Caf也导致细胞内钙释放,从而引起神经细胞死亡。以上模型从不同方面反映出脑缺血损伤过程中,由于细胞缺氧导致钙内流,同时受损细胞器内的钙离子释放,使钙离子浓度上升,出现Ca2+超载而致细胞死亡[6,7]。实验发现赤芍总甙能抑制氧自由基损伤过程,对NO-氧自由基损伤途径同样发挥抑制作用,尤其对Caf导致的Ca2+大量释放所致细胞死亡表现出非常显著的保护作用。有报道芍药有效成分可抗大鼠心脏缺血再灌注损伤,并具有抗脂质过氧化作用[8],推测赤芍总甙抗氧自由基的作用可能与增强超氧化物歧化酶作用相关。NMDA受体激活后可引起受体型钙通道开放,刺激Ca2+内流,引起钙超载。同时激活诱导型一氧化氮合成酶产生NO,进一步损伤细胞。赤芍总甙对此类模型的保护作用提示其作用机理可能是直接抑制了NMDA受体依赖性的钙通道。
, http://www.100md.com
文献报道芍药甙对离体大鼠主动脉具有血管内皮依赖性舒张作用[9],芍药甙能抑制Ca2+-水母发光蛋白的发光,该作用与其抑制膜外Ca2+动态有关[10]。此外,采用胎小鼠大脑皮质原代神经细胞,用电压钳记录探讨离子通道开放及离子流变化,全细胞膜片钳(whole-cell patch)记录,芍药浸膏200 μg.ml-1可抑制五甲烯四氮唑(PTZ)造成的细胞暴发性放电(bursting activity,BA)。用膜片钳记录K+通道开放及离子流变化,发现芍药浸膏可抑制PTZ造成的该通道开放,并且抑制细胞外Ca2+浓度变化[10]。以上研究结果均提示赤芍总甙及其有效成分芍药甙作用机制与抑制Ca2+离子内流密切相关。
何丽娜,女,43岁,副研究员,主要研究药物作用的分子机制及医学病毒学等。
, http://www.100md.com
参考文献
1,Tsuda T,Sugaya A,Ohguchi H,et al.Protective effects of peony root extract and its components on neuron damage in the hipocampus induced by the cobalt focus epilepsy model.Exp Neurol,1997;146(2):58
2,楚正绪,沈洪兴,竺青,等.赤芍提取物改善学习记忆的作用.第二军医大学学报,1991;12(5):465
3,Ohta H,Matsumoto K,Shimizu M,et al.Paeoniflorin attenuates learning impairment of aged rats in operant brightness discrimination task.Pharmacol Biochem Behav,1994;49(1):213
, 百拇医药
4,赤泽康平.芍药中芍药甙相关成分对东莨菪碱诱发大鼠空间辨别障碍的作用.和汉医药学杂志,1995;12(4):376
5,阴健,郭力弓,主编.中药现代研究与临床应用(Ⅰ).北京:学苑出版社,1993;352
6,Pedata F,Latnini S,Puglises AM,et al.Investigations into the adenosine outflow from hippocampal slices evoked by ischemia-like conditions.J Neurochem,1994;61:284
7,Salvaterra CG,Goldman WF.Direct effect of hypoxia on apparent intraellular calcium levels in cultured pulmonary vascular smooth muscles cells.Am Rev Respir Dis, 1991;143:A373
, 百拇医药
8,Zhang WG,Zhang ZS.Anti-ischemia reperfusion damage and anti-lipid peroxidation effects of paeonol in rat heart.Acta Pharmaceutica Sinica,1994;29
(2):145
9,Goto H,Shimada Y,Akechi Y,et al.Endothelium dependent vasodilator effect of extract prepared from the roots of Paeonia lactiflora on isolated rat aorta.Planta Med,1996;62(5):436
10,菅谷爱子.芍药的药理及药效.国外医学中医中药分册,1992;14(5):271
收稿日期:2000-01-29
修回日期:2000-02-24, 百拇医药
单位:安徽省医学科学研究所,省生物医药重点实验室,合肥 230061
关键词:赤芍总甙;神经细胞;脑缺血
中国临床药理学与治疗学000108
目的 探讨赤芍总甙对大鼠神经细胞脑缺血样损伤模型的保护作用及其机制。方法 采用组织培养法,以原代大鼠大脑皮层神经细胞为材料,制备缺糖损伤、缺氧损伤、自由基损伤、咖啡因损伤、一氧化氮损伤及NMDA毒性损伤模型。结果 形态学检查发现赤芍总甙(total paeony glycoside,TPG)对6六种脑缺血样损伤模型中的大鼠神经细胞具有明显保护作用,结晶紫染色也提示TPG可显著提高损伤模型中神经细胞的存活数。结论 TPG对上述6种大鼠神经细胞缺血损伤均有显著的保护作用。
, 百拇医药 中图分类号 R285.5
Protective effect of total paeony glocoside against ischemia injury in cultured primary cortex neurons
HE Li-Na YANG Jun HE Su-Bing WANG Jing LIU Chao
(Biological & Medicinal Central Laboratory of Anhui,Hefei 230061)
Aim To investigate protective effects and mechanism of TPG on ischemia-like injury models.Methods Six ischemia models including hypoxia,hypoglucose,oxidant injury,calcium overload,nitric oxide neurotoxicity and excitatory amino acid injury were used to assay the anti-ischemic roles of TPG in cultured primary cortex neurons.Results It was found that TPG possessed obvious protective effects on primary neurons in injury models by the way of morphological examination.Crystal violet staining also indicated that TPG increased number of life neurons in injury models significantly.Couclusions 50~200 μg.ml-1 TPG protected rat cortex cells from all injury models effectively in vitro.
, 百拇医药
Key words total paeony glycoside;cortex neuron;cerebral ischemia
缺血性脑血管病所致的神经细胞损伤涉及多种因素,微循环障碍可导致细胞能量供应短缺,缺血后再灌注所致的NO和氧自由基损伤加重细胞病变的进展,兴奋性氨基酸的毒性作用引起细胞内的钙超载最后导致细胞坏死。治疗缺血性脑血管病药物主要通过影响上述一个或多个环节,从而发挥药物的保护作用。
赤芍总甙为单萜化合物,其主要活性单体成分为芍药甙(paeoniflorin)。文献报道赤芍提取物及芍药甙在钴诱发的局灶性癫痫中对海马CA1区神经原损伤有明显保护作用[1],赤芍提取物可改善东莨菪碱所致小鼠学习记忆障碍,并增强大鼠学习能力[2]。芍药甙显著减轻衰老大鼠学习记忆障碍[3],并对大鼠空间辨别障碍有改善作用[4]。临床上也常见以赤芍治疗缺血性脑血管疾病的报道[5]。为进一步探讨赤芍治疗缺血性脑血管疾病的作用及机理,我们观察了赤芍总甙对6种大鼠神经细胞缺血损伤模型的影响。
, http://www.100md.com
1 材料
1.1 药品与试剂 赤芍总甙(TPG)与白芍总甙(TGP):由安徽省医学科学研究所药化研究室制备。先用60 %乙醇溶解为20 mg.ml-1,再用双蒸水配制浓度为2 mg.ml-1受试溶液。氯酯醒( meclofenoxane,MEC),上海淮海制药厂产品,批号970702,双蒸水溶解。上述三种药物均以微孔滤膜除菌过滤,4 ℃冰箱保存备用。实验时以DMEM培养液稀释至所需浓度。DMEM培养基及马血清购自Gibco公司。连二亚硫酸钠(Na2S2O4)为宜兴市化学制剂三厂产品。葡萄糖氧化酶,武汉中健科技发展有限公司产品。硝普钠(sodium nitroprusside,SNP),北京制药工业研究所实验药厂产品。咖啡因(caffeine,Caf)、NMDA(N-methyl-D-aspartate) 购自Sigma公司。多聚赖氨酸,华美生物工程有限公司产品。胰蛋白酶,美国Diffic公司产品。
, 百拇医药
1.2 动物 Wister乳鼠,1~2日龄。由安徽省医学科学研究所实验动物研究室提供,合格证号:皖医实动准字第03号。
2 方法
2.1 原代大鼠乳鼠脑皮层神经细胞的制备及培养 取Wister大鼠乳鼠数只,常规消毒头颈部,解剖大脑,分离出脑皮层,Hank's液洗涤3次,剪碎成1 mm3小块,置0.25%胰酶中,37 ℃消化1 h,吸弃消化液,Hank's液洗涤3次,滴管吹打至细胞分散。用DMEM生长液(含10%马血清,10%小牛血清)调整细胞浓度为1×106· ml-1,将细胞悬液加至用0.01%多聚赖氨酸浸泡过夜的96孔细胞培养板中,37 ℃,5%CO2温箱中培养,每周换液2次。培养至第7天,换含10 μmol. L-1阿糖胞苷的DMEM培养液培养48 h,以抑制非神经原细胞增殖,再换成DMEM生长液,继续培养至11~14 d进行实验。
, 百拇医药
2.2 药物细胞毒实验 神经细胞培养至11~14 d,吸弃培养上清,分别加入含200、 100、50 μg.ml-1赤芍总甙,200、 100、50 μg.ml-1白芍总甙,1000、500、250 μg.ml-1氯酯醒的DMEM维持液(含5 %马血清和5%小牛血清),100 μl/孔,置37 ℃,5% CO2温箱中培养3 d,观察细胞病变作用(cytopathiceffect,CPE)。同时设相应浓度乙醇对照组。
2.3 药物对实验模型的保护作用
2.3.1 药物对缺糖损伤模型的保护作用 不同浓度的赤芍总甙、白芍总甙和氯酯醒(DMEM维持液稀释)作用细胞24 h后,吸弃药液,加入无糖Earle's液,作用10 h后,换成DMEM维持液,继续培养18 h,观察实验结果。实验同时设损伤模型对照及正常细胞对照。
, http://www.100md.com
2.3.2 药物对缺氧损伤模型的保护作用 将Na2S2O4干粉加入DMEM培养液中,使终浓度为5 mmol.L-1,充分搅拌,调整pH为7.2,即为缺氧溶液。缺氧损伤8 h造成损伤模型。实验除设损伤对照及正常对照外,还设非低氧溶液(配制同缺氧溶液,但需放置3 d以上)对照,以消除Na2S2O4 在水中分解产物的影响。
2.3.3 药物对自由基损伤模型的保护作用 含葡萄糖(25 mmol.L-1)-葡萄糖氧化酶(12.5 mU.ml-1)的无血清DMEM培养基,作用3 h造成自由基损伤模型。实验分组及结果观察同上。
2.3.4 药物对咖啡因损伤模型的保护作用 含10 mmol.L-1咖啡因的DMEM培养液作用45 min后,造成细胞损伤模型。实验分组及结果观察同上。
, http://www.100md.com
2.3.5 药物对NO神经毒性损伤模型的保护作用 含SNP100 μmol.L-1的DMEM培养液作用细胞10 min后,造成 NO神经毒性损伤模型。实验分组及结果观察同上。
2.3.6 药物对NMDA神经毒性损伤模型的保护作用 用无Mg2+ Earle's液洗涤细胞3次,加入含30 μmol.L-1的NMDA,0.5 μmol.L-1甘氨酸的无Mg2+Earle's液,37 ℃,5%CO2温箱中作用4 h后,吸弃培养上清,Earle's液洗涤3次,再换成正常维持液,37 ℃,5%CO2温箱中继续培养18 h,观察实验结果。
2.4 观察指标
2.4.1 细胞形态 倒置显微镜下观察细胞生长情况和细胞形态,摄片。
, http://www.100md.com
2.4.2 结晶紫活细胞染色 模型损伤18 h后,吸弃上清,以37 ℃,pH 7.4 PBS洗涤3次,加入0.2%结晶紫溶液(内含0.2%乙醇)染色1 min,洗涤6次,加1% SDS(十二烷基硫酸钠)溶液100 μl /孔,37 ℃温育30 min,使细胞彻底裂解,用DG3002酶联检测仪测定OD值(λ=630 nm)。
2.5 统计学处理 数据以
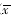 ±s表示,组间数据进行t检验。
±s表示,组间数据进行t检验。3 结果
3.1 培养细胞形态学观察 细胞接种于多聚赖氨酸处理过的细胞培养板,37 ℃,5%CO2温箱孵育2 h后,倒置显微镜观察:镜下见细胞贴壁,形状呈圆形,分布均匀。培养48 h,细胞逐渐伸出突触。d 4,细胞大多伸展,突触相互交织成网状,胞体呈梭形,三角形。培养至d 11,细胞生长成单层。
, http://www.100md.com
3.2 药物细胞毒性测定 赤芍总甙、白芍总甙、氯酯醒所稀释各浓度组及乙醇对照组均无细胞毒性作用。
3.3 药物对实验模型的保护作用
3.3.1 药物对损伤模型中结晶紫染色活细胞吸光度的影响 存活细胞吸收结晶紫着色,通过测量染色活细胞在630 nm波长处的吸光度,可计算存活神经细胞的比值,结果见表1。
表1 TGP对原代培养的大脑皮层神经细胞缺血损伤的保护作用(OD值)(n=10,
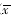 ±s) 组别
±s) 组别剂量
/μg.ml-1
缺糖损伤
, 百拇医药
缺氧损伤
自由基损伤
咖啡因损伤
NO损伤
NMDA损伤
对照组
0.52±0.06
0.20±0.02
0.39±0.03
0.68±0.06
0.50±0.01
0.28±0.02
, http://www.100md.com
模型组
0.21±0.04△△
0.09±0.03△△
0.11±0.01△△
0.31±0.01△△
0.42±0.03△△
0.02±0.01△△
TPG
200
0.47±0.06**
, 百拇医药
0.13±0.06
0.15±0.04
0.56±0.05*
0.52±0.01**
0.10±0.01**
TPG
50
0.45±0.09**
0.14±0.02*
0.19±0.01**
, 百拇医药
0.62±0.03**
0.48±0.02*
0.07±0.02**
TPG
12.5
0.12±0.08
0.15±0.01**
0.19±0.09
0.59±0.05*
0.54±0.01**
, 百拇医药
0.04±0.02
TPG
3.125
0.09±0.06
0.15±0.02*
0.12±0.03
1.08±0.01*
0.54±0.04**
0.04±0.02
TPG
50
, http://www.100md.com
0.38±0.10*
0.017±0.03**
0.18±0.03*
0.52±0.02**
0.56±0.01**
0.06±0.01**
MEC
100
0.43±0.04**
0.15±0.01**
, http://www.100md.com
0.16±0.03*
0.53±0.02**
0.53±0.01**
0.09±0.01**
与对照组比较△△P<0.01;与模型组比较*P<0.05;**P<0.01
表1结果显示:与正常细胞组相比,六种脑缺血样损伤模型组细胞的OD值有极显著降低,表明活细胞数显著减少。加入药物保护后,可明显提高损伤细胞的 OD值,相应的存活细胞数增加。某些组别中药物的量效关系不明显,可能是由于进行原代细胞培养时,个别培养孔中残存的其它非皮层神经细胞量的差异所致。
, 百拇医药
3.3.2 药物对脑缺血模型中损伤细胞形态的影响 倒置显微镜下观察:在各类缺血性损伤模型中,神经细胞均出明显的细胞病变,表现为胞体肿胀,折光性减弱,突触断裂,呈拉网状,最终细胞圆缩,脱落。细胞加药保护后,细胞损伤明显减轻,细胞形态基本保持完整,仅见部分突触断裂、胞体略有肿胀等现象。结果见图1。




图1 脑缺血模型中损伤细胞形态的显微变化
A:对照组;B:神经细胞损伤开始变化;C:死亡细胞膜分裂、紊乱;D:TPG对损伤的细胞保护作用
, 百拇医药
4 讨论
脑缺血最初过程为神经细胞能量供应缺乏,药物是否具有保护作用,可通过缺氧和缺糖损伤模型进行验证。实验证实赤芍总甙对这两种细胞损伤模型具有不同程度的保护,以50 μg.ml-1组作用最为显著。
自由基、NO和NMDA所致神经细胞损伤模型可模拟脑缺血损伤的具体过程,高浓度Caf也导致细胞内钙释放,从而引起神经细胞死亡。以上模型从不同方面反映出脑缺血损伤过程中,由于细胞缺氧导致钙内流,同时受损细胞器内的钙离子释放,使钙离子浓度上升,出现Ca2+超载而致细胞死亡[6,7]。实验发现赤芍总甙能抑制氧自由基损伤过程,对NO-氧自由基损伤途径同样发挥抑制作用,尤其对Caf导致的Ca2+大量释放所致细胞死亡表现出非常显著的保护作用。有报道芍药有效成分可抗大鼠心脏缺血再灌注损伤,并具有抗脂质过氧化作用[8],推测赤芍总甙抗氧自由基的作用可能与增强超氧化物歧化酶作用相关。NMDA受体激活后可引起受体型钙通道开放,刺激Ca2+内流,引起钙超载。同时激活诱导型一氧化氮合成酶产生NO,进一步损伤细胞。赤芍总甙对此类模型的保护作用提示其作用机理可能是直接抑制了NMDA受体依赖性的钙通道。
, http://www.100md.com
文献报道芍药甙对离体大鼠主动脉具有血管内皮依赖性舒张作用[9],芍药甙能抑制Ca2+-水母发光蛋白的发光,该作用与其抑制膜外Ca2+动态有关[10]。此外,采用胎小鼠大脑皮质原代神经细胞,用电压钳记录探讨离子通道开放及离子流变化,全细胞膜片钳(whole-cell patch)记录,芍药浸膏200 μg.ml-1可抑制五甲烯四氮唑(PTZ)造成的细胞暴发性放电(bursting activity,BA)。用膜片钳记录K+通道开放及离子流变化,发现芍药浸膏可抑制PTZ造成的该通道开放,并且抑制细胞外Ca2+浓度变化[10]。以上研究结果均提示赤芍总甙及其有效成分芍药甙作用机制与抑制Ca2+离子内流密切相关。
何丽娜,女,43岁,副研究员,主要研究药物作用的分子机制及医学病毒学等。
, http://www.100md.com
参考文献
1,Tsuda T,Sugaya A,Ohguchi H,et al.Protective effects of peony root extract and its components on neuron damage in the hipocampus induced by the cobalt focus epilepsy model.Exp Neurol,1997;146(2):58
2,楚正绪,沈洪兴,竺青,等.赤芍提取物改善学习记忆的作用.第二军医大学学报,1991;12(5):465
3,Ohta H,Matsumoto K,Shimizu M,et al.Paeoniflorin attenuates learning impairment of aged rats in operant brightness discrimination task.Pharmacol Biochem Behav,1994;49(1):213
, 百拇医药
4,赤泽康平.芍药中芍药甙相关成分对东莨菪碱诱发大鼠空间辨别障碍的作用.和汉医药学杂志,1995;12(4):376
5,阴健,郭力弓,主编.中药现代研究与临床应用(Ⅰ).北京:学苑出版社,1993;352
6,Pedata F,Latnini S,Puglises AM,et al.Investigations into the adenosine outflow from hippocampal slices evoked by ischemia-like conditions.J Neurochem,1994;61:284
7,Salvaterra CG,Goldman WF.Direct effect of hypoxia on apparent intraellular calcium levels in cultured pulmonary vascular smooth muscles cells.Am Rev Respir Dis, 1991;143:A373
, 百拇医药
8,Zhang WG,Zhang ZS.Anti-ischemia reperfusion damage and anti-lipid peroxidation effects of paeonol in rat heart.Acta Pharmaceutica Sinica,1994;29
(2):145
9,Goto H,Shimada Y,Akechi Y,et al.Endothelium dependent vasodilator effect of extract prepared from the roots of Paeonia lactiflora on isolated rat aorta.Planta Med,1996;62(5):436
10,菅谷爱子.芍药的药理及药效.国外医学中医中药分册,1992;14(5):271
收稿日期:2000-01-29
修回日期:2000-02-24, 百拇医药