成骨细胞样细胞体外培养的实验研究
作者:饶寒敏 徐荣辉 朱雅萍 柴本甫
单位:200025 上海第二医科大学生 上海市骨伤科研究所
关键词:骨细胞;细胞培养;骨质形成;骨质吸收
中华医学杂志960419
目的 阐明不骨组织来源的成骨细胞样细胞,在各个发育阶段中的形态与功能以及它与骨形成之间的关系。方法 从大鼠及鸡胚胎颅盖骨分离出3种形态的成骨细胞样细胞,即长梭形细胞、圆球形细胞、鳞片形细胞,进行体外培养。结果 长梭形细胞、圆球形细胞均可向鳞片形细胞方向发展,它们有着一致的演变趋势与结果。同时处于不同发育阶段的3种形态细胞分别表现出所处阶段的功能状态,分泌酸性粘多糖、胶原、钙盐、碱性磷酸酶等物质,分泌特堆积即形成新生骨组织。同时在成骨区附近还呈现酸性磷酸酶阳性反应细胞。结论 说明颅盖骨分离细胞含有两种不同来源的骨系细胞,在形成新骨的同时还进行着骨吸收的过程。
, 百拇医药
Osteoblast-like cells cultured in vitro Rao Hanmin, Xu Ronghui, Zhu Yaping, et al. Shanghai Institute of Traumatology and Orthopedics, Shanghai Second Medical University, Shanghai, 200025
Objective To identify the relationship of osteogenesis and osteoblast-like cells form different tissues, and the shape and functional changes of these cells in their different growing stages. Methods Three types of osteoblast-like cells, long spindle-shaped, spherical, and squamous cells were obtained from the fetal calvaria of SD rats or Leghorn chickens cultrued in vitro. Results The long spindle-shaped and the spherical cells developed into the squamous cells. They had the same developing tendency and the same results of develpment. Three types of cells in their different growing stages displayed separately their functional status. They secreded acid mucopolysaccharide, collagen, calcium salt, alkaline phosphatase, etc. The secreted substances heaped up to form new bone tissues. At the same time there were positive acid phosphatase-staining cells around the new bone tissues. Conclusions The cells isolated from the fetal calvaria contained two lines of bone cells, carrying out both bone formation and bone resrption.
, 百拇医药
Key words Osteoblast-like cells Cell cultured Bone formation Bone resorption
(Natl Med J China, 1996, 76: 301-304)
骨组织自始至终经历着新陈代谢、改建修复等一系列过程,与其他结缔组织一样,骨组织也由细胞、纤维及基质所构成。但是形成骨的细胞有其特定的来源,其形态与功能可随机体的状态而发生改变。我们通过大鼠及鸡胚胎颅盖骨分离细胞体外培养,观察不同组织来源的成骨细胞样细胞在各自不同发育阶段的形态与功能变化,从而探讨其成骨机理。
材料和方法
一、材料
妊娠第19~20天SD纯种雌性大鼠,乙醚麻醉下剖腹,无菌取出其胚胎鼠颅盖骨。孵育12天的纯种Leghorn鸡蛋,无菌条件下取出两侧颅盖骨(额骨)。
, http://www.100md.com
二、方法
1.取出的颅盖骨经冲洗、剪碎,加入10倍于碎片容积的0.3%胰蛋白酶消化过滤,滤液经离心,充上清液,沉淀物即为颅盖骨分离细胞。
2.上述颅盖骨分离细胞加入灭菌改良伊格乐氏培养基(Eagle MEM)培养液,打匀制成细胞悬液,将悬液分装于25ml的培养瓶内,每瓶内置2条洁净无菌的载玻片,培养瓶置于37℃、5%CO2培养箱内培养,每隔2~3天换液1次。
3.用倒置显微镜联接显微缩时录像系统,对成骨细胞样细胞的形态与功能变化作跟踪观察,并选择特定目标作显微摄影记录。
4.用组织学、组织化学染色技术,包括HE、AS、ARS染色、碱性磷酸酶-酸性磷酸酶(ALP-ACP)反应、趋骨性四环素荧光标记等,分别对处于不同发育阶段的成骨细胞样细胞的形态、分泌物(酸性粘多糖、胶原、钙盐、碱性磷酸酶、酸性磷酸酶等)的产生堆积及新骨形成等过程作系统观察。
, 百拇医药
5.用微分干涉相差显微镜,立体观察成骨细胞样细胞所形成的骨结节的形态与结构。
结果
一、活体相差显微镜观察
两种颅盖骨分离细胞经24小时培养费基本贴壁。细胞形态主要有长梭形、圆球形、鳞片形3种,数量以鳞片形细胞居多。培养3天后,部分鳞片形细胞开始有小颗粒产生,并在突起部见其逐渐向外分泌。随后3种细胞均出现分泌现象。分泌物可以是颗粒状,也可以是透亮小泡状。细胞汇集形成细胞集落,集落周围的细胞活动加强,形态不定,集落中的细胞产生透亮小泡,并不断在其上面堆积,逐渐形成一白色云雾状团块。随细胞迁移,团块收缩而变得更为致密。周围细胞分泌黑色颗粒进入团块,团块由透亮变灰黑,再变黑色不透光。培养5天,可见初期骨小结节雏型亮物及黑色小颗粒汇入,结节由此扩展。在20天左右,出现骨小片雏型,随后骨片、骨小梁均可形成(图1)。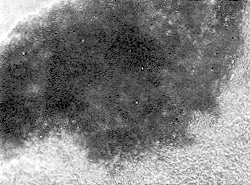
, 百拇医药
图1 颅骨分离细胞培养34天时,骨小片的活体倒置显微镜照片 ×62.5
二、HE染色观察
两种颅盖骨分离细胞培养,HE染色显示细胞形态多为鳞片形细胞。圆球形细胞分化后可长出针状突起,也可长出粗大伪足,向长梭形、鳞片形细胞方面发展。长梭形细胞发育成熟,突起表面出现许多红色小泡,并由此可被其包围。分泌颗粒可见于胞浆内,也可见于细胞突起部或细胞间隙中,有的内含紫色小粒。堆积后的颗粒融合紫外线红色小结,并随分泌颗粒堆积程度而逐渐变深。
三、微分干涉相差显微镜观察
上述两种颅盖骨分离细胞形成的小结清晰显示,小结中被基质包围的细胞呈圆形或椭圆形,结节中细胞向外伸出的突起以端对端形式与其它细胞相接触,以致在成骨区形成密集的骨小管网络。周围圆形或不规则隆起物附着在细胞突起部或散在于细胞间隙中。分泌颗粒堆积后的结节可呈圆形、椭圆形、长梭形等形状。
, http://www.100md.com
四、AS染色观察
两种颅盖骨分离细胞培养5天,3种形态的细胞均有AS染色阳性现象。在经20天培养后,仍可表现为不同分化与发育阶段的细胞形态与功能。既有AS染色性细胞,也有AS染色阴性细胞或Alcian blue单独阳性、Sirius red单独阳性细胞。Alcian blue阳性显示细胞内或细胞外有蓝绿色絮状、细颗粒状酸性粘多糖;Sirius red阳性显示细胞内细胞外有红色细丝状、颗粒状胶原性物质(图2)。这些分泌物堆积形成的小结均被染成红色絮网状、团块状(图3),外围可有蓝染的酸性粘多糖不断沉淀,结节有继续扩展趋。
图2 颅骨细胞培养5周酸性粘多糖呈絮状蓝绿着色()胶原呈细丝颗粒状鲜红着色(↑),AS染色
, http://www.100md.com
图3 颅骨细胞培养5周,结节形成过程中,有大量胶原性物质堆积,AS染色
图4 颅骨细胞培养5周,分泌的钙盐呈红色颗粒状,ARS染色
五、ARS染色观察
两种颅盖骨分离细胞培养至一定阶段发育成熟,胞浆内可有钙颗粒分泌,ARS染色显示红色(图4)。骨小结、骨小片亦均显阳性,随分泌物堆积程度增加列显强阳性。但如果结节过于浓密而不透光则又可使染色不显。
六、ALP-ACP反应
两种颅盖骨分离细胞分离细胞发育成熟,可表现为胞浆及周围基质中有蓝黑色细小颗料的ALP阳性反应,阳性细胞多呈鳞片形。在细胞聚集、骨小结形成区,ALP阳性反应尤为强烈,结节中央呈黑色,周围呈蓝黑色。在成骨区及其周围,还可同时见到一些内含红色细颗粒的ACP阳性反应细胞(图5)。
, http://www.100md.com
由两种颅盖骨成骨细胞样细胞形成的小结、小梁或小片经活体四环素荧光标记,在荧光显微镜下显示金黄色荧(图6)。结节形成早期荧光相对较弱,结节形成中后期荧光较为强烈,周围细胞多呈淡黄绿色鳞片形。
图5 颅骨细胞培养5周,在结节形成区,碱性磷酸酶呈蓝黑色强阳反应(↑),周围有酸性磷酸酶呈红色阳性反应( );ALP-ACP反应
);ALP-ACP反应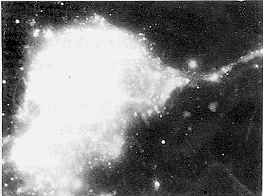
图6 颅骨细胞培养5周围,细胞形成的新生骨结节,活体轩环素荧光标记照片
讨论
大鼠及鸡胚胎颅盖骨由不完整的内外两层骨板、骨板间骨刺及骨内外膜所构成[1],由此消化分离的颅盖骨细胞主要含有4种成份:骨内膜细胞、骨外膜细胞、骨细胞和未分化间充质细胞。在体外培养中表现为3种形态:来自骨外膜的长梭形细胞,来自骨内膜和骨组织的鳞片形细胞,以及来自未来骨髓区和骨原基的圆球形细胞。骨细胞一旦经胰酶消化从骨陷窝中脱离出来,即又成为功能活跃的成骨细胞。3种形态的细胞组成了一成骨细胞样细胞群。
, 百拇医药
虽然颅盖骨分离细胞的形态可以各不相同,但它们都有一致的演变趋势与结果。圆球形细胞由于其生长环境发生改变,其形态与功能也因此出现了变化,开始向成骨细胞方向分化,其外形也变得纤长或扁平。长梭形细胞是成骨细胞的早期阶段,体外培养环境促使其发育成熟,表现出与鳞片形细胞类似功能。由此可在认为鳞片形、长梭形、圆球形3种形态的细胞实为处于不同发育阶段的同一型细胞。随培养时间的延续,鳞片形细胞不断增多,从而成为培养细胞的主体。鳞片形细胞从其外形与功能看则是一种较为成熟的成骨细胞,ALP反应强阳性是其成高活性的标志[2]。其分泌物堆积形成的骨小结、骨小梁经活体四环素荧光标记证实为新生骨组织[3]。微分干涉相差显微镜观察显示该骨组织与体内形成的骨组织一样具有骨细胞、骨陷窝及骨小管。其体外成骨的超微的结构研究也显示与体内骨形成相一致的结果[4]。因此,大鼠及鸡胚胎颅盖骨分离细胞体外培养是研究成骨细胞样细胞分化成熟过程以及探索骨形成机理的极好模型,为临床开发应用新医新药提供了很好的实验基础[5]。
, 百拇医药
成骨细胞一般不会分裂,但在整个生命中又必须不断进行成骨活动,这样就需要来自成骨前体细胞的一个连结性别分化[2]。骨髓中已被确认的器官特异性干细胞系有成骨细胞、成纤维细胞、网状细胞等[6]。成骨细胞的功能并不仅限于成骨活动。本实验中。在ALP阳性反应区附近还见有ACP阳性反应,可见颅盖骨分离细胞中还混有骨髓成分。人类骨髓培养14天[7],小鼠骨髓培养8天[8],均可形成破骨细胞样多核细胞(MNCs),成骨细胞为骨髓组织内破骨细胞前体分化为多核破骨细胞所必须,其产生的分化诱导因子(DRF)可刺激TRACP阳性的MNCs形成[8]。颅盖骨分离细胞体外培养后期,ALP与ACP阳性反应同时出现于骨形成区及其周围,反应了分离细胞含有两种不同来源的骨系细胞,在形成骨组织的同时又进行着骨吸收的活动。成骨细胞对破骨细胞的产生[8]与功能调节[9,10],又反映了这两种细胞在骨改建过程中的统一关系,二者相互间信息的传递,在一定程度上控制着整个骨组织的功能状态与结构变化。
, http://www.100md.com
本课题为国家自然科学基金资助项目
参考文献
1 徐荣辉,失雅萍,柴本甫.胚胎大鼠颅盖骨分离细胞早期体外培养的组织化学观察,解剖学报,1988,19:53.
2 Connor JM. soft tissue ossification. Belin: Springer, 1983. 117.
3 Lillie RD, Fullmer HM. Histopathologic technic and practical histochemistry. Fourth edition. New York: McGraw-Hill Book Company, 1976. 802.
4 Tenenbaum HC, Palangio KG, Holyard DP, ed al. An ultrastructural study of osteogenesis in chick periosteum in vitor. Bone, 1986, 7: 295.
, http://www.100md.com
5 徐荣辉,柴本甫,失雅萍.丹参注射液对鸡胚额骨分离细胞培养生长影响的组织化学观察-成骨细胞样细胞的发育与成熟.中华骨科杂志,1994,14:185.
6 Bereford JN. Osteogenic stem cells and the stomal system of bone and marrow. Clin Orthop Rel REs., 1989, 240: 270.
7 Birch MA, Hirst JP, Boothroyd B, et al. Assessment of the resorptive capacity of multiucleate cells from haman bone marrow culture. Calcif Tissue Int, 1990, 46: 15.
8 Suda t, Takahashi N. Osteblasts are cssential for osteoclast formation. Calcif Tissue Int, 1994, 44: 45.
, 百拇医药
9 Fuller K, Gallagher AC, Chambers TJ. Evidence that an osteoclastic resorption stimulatory activity is associated with the osteobast cell surface and/or the extracellular matrix. Calcif Tissue Int, 1990, 46: 19.
10 chambers TJ. The regulation of osteoclastic function. Calcif Tissue Int. 1989, 44: 32.
(收稿:1995-03-25 修回:1995-12-20), 百拇医药
单位:200025 上海第二医科大学生 上海市骨伤科研究所
关键词:骨细胞;细胞培养;骨质形成;骨质吸收
中华医学杂志960419
目的 阐明不骨组织来源的成骨细胞样细胞,在各个发育阶段中的形态与功能以及它与骨形成之间的关系。方法 从大鼠及鸡胚胎颅盖骨分离出3种形态的成骨细胞样细胞,即长梭形细胞、圆球形细胞、鳞片形细胞,进行体外培养。结果 长梭形细胞、圆球形细胞均可向鳞片形细胞方向发展,它们有着一致的演变趋势与结果。同时处于不同发育阶段的3种形态细胞分别表现出所处阶段的功能状态,分泌酸性粘多糖、胶原、钙盐、碱性磷酸酶等物质,分泌特堆积即形成新生骨组织。同时在成骨区附近还呈现酸性磷酸酶阳性反应细胞。结论 说明颅盖骨分离细胞含有两种不同来源的骨系细胞,在形成新骨的同时还进行着骨吸收的过程。
, 百拇医药
Osteoblast-like cells cultured in vitro Rao Hanmin, Xu Ronghui, Zhu Yaping, et al. Shanghai Institute of Traumatology and Orthopedics, Shanghai Second Medical University, Shanghai, 200025
Objective To identify the relationship of osteogenesis and osteoblast-like cells form different tissues, and the shape and functional changes of these cells in their different growing stages. Methods Three types of osteoblast-like cells, long spindle-shaped, spherical, and squamous cells were obtained from the fetal calvaria of SD rats or Leghorn chickens cultrued in vitro. Results The long spindle-shaped and the spherical cells developed into the squamous cells. They had the same developing tendency and the same results of develpment. Three types of cells in their different growing stages displayed separately their functional status. They secreded acid mucopolysaccharide, collagen, calcium salt, alkaline phosphatase, etc. The secreted substances heaped up to form new bone tissues. At the same time there were positive acid phosphatase-staining cells around the new bone tissues. Conclusions The cells isolated from the fetal calvaria contained two lines of bone cells, carrying out both bone formation and bone resrption.
, 百拇医药
Key words Osteoblast-like cells Cell cultured Bone formation Bone resorption
(Natl Med J China, 1996, 76: 301-304)
骨组织自始至终经历着新陈代谢、改建修复等一系列过程,与其他结缔组织一样,骨组织也由细胞、纤维及基质所构成。但是形成骨的细胞有其特定的来源,其形态与功能可随机体的状态而发生改变。我们通过大鼠及鸡胚胎颅盖骨分离细胞体外培养,观察不同组织来源的成骨细胞样细胞在各自不同发育阶段的形态与功能变化,从而探讨其成骨机理。
材料和方法
一、材料
妊娠第19~20天SD纯种雌性大鼠,乙醚麻醉下剖腹,无菌取出其胚胎鼠颅盖骨。孵育12天的纯种Leghorn鸡蛋,无菌条件下取出两侧颅盖骨(额骨)。
, http://www.100md.com
二、方法
1.取出的颅盖骨经冲洗、剪碎,加入10倍于碎片容积的0.3%胰蛋白酶消化过滤,滤液经离心,充上清液,沉淀物即为颅盖骨分离细胞。
2.上述颅盖骨分离细胞加入灭菌改良伊格乐氏培养基(Eagle MEM)培养液,打匀制成细胞悬液,将悬液分装于25ml的培养瓶内,每瓶内置2条洁净无菌的载玻片,培养瓶置于37℃、5%CO2培养箱内培养,每隔2~3天换液1次。
3.用倒置显微镜联接显微缩时录像系统,对成骨细胞样细胞的形态与功能变化作跟踪观察,并选择特定目标作显微摄影记录。
4.用组织学、组织化学染色技术,包括HE、AS、ARS染色、碱性磷酸酶-酸性磷酸酶(ALP-ACP)反应、趋骨性四环素荧光标记等,分别对处于不同发育阶段的成骨细胞样细胞的形态、分泌物(酸性粘多糖、胶原、钙盐、碱性磷酸酶、酸性磷酸酶等)的产生堆积及新骨形成等过程作系统观察。
, 百拇医药
5.用微分干涉相差显微镜,立体观察成骨细胞样细胞所形成的骨结节的形态与结构。
结果
一、活体相差显微镜观察
两种颅盖骨分离细胞经24小时培养费基本贴壁。细胞形态主要有长梭形、圆球形、鳞片形3种,数量以鳞片形细胞居多。培养3天后,部分鳞片形细胞开始有小颗粒产生,并在突起部见其逐渐向外分泌。随后3种细胞均出现分泌现象。分泌物可以是颗粒状,也可以是透亮小泡状。细胞汇集形成细胞集落,集落周围的细胞活动加强,形态不定,集落中的细胞产生透亮小泡,并不断在其上面堆积,逐渐形成一白色云雾状团块。随细胞迁移,团块收缩而变得更为致密。周围细胞分泌黑色颗粒进入团块,团块由透亮变灰黑,再变黑色不透光。培养5天,可见初期骨小结节雏型亮物及黑色小颗粒汇入,结节由此扩展。在20天左右,出现骨小片雏型,随后骨片、骨小梁均可形成(图1)。

, 百拇医药
图1 颅骨分离细胞培养34天时,骨小片的活体倒置显微镜照片 ×62.5
二、HE染色观察
两种颅盖骨分离细胞培养,HE染色显示细胞形态多为鳞片形细胞。圆球形细胞分化后可长出针状突起,也可长出粗大伪足,向长梭形、鳞片形细胞方面发展。长梭形细胞发育成熟,突起表面出现许多红色小泡,并由此可被其包围。分泌颗粒可见于胞浆内,也可见于细胞突起部或细胞间隙中,有的内含紫色小粒。堆积后的颗粒融合紫外线红色小结,并随分泌颗粒堆积程度而逐渐变深。
三、微分干涉相差显微镜观察
上述两种颅盖骨分离细胞形成的小结清晰显示,小结中被基质包围的细胞呈圆形或椭圆形,结节中细胞向外伸出的突起以端对端形式与其它细胞相接触,以致在成骨区形成密集的骨小管网络。周围圆形或不规则隆起物附着在细胞突起部或散在于细胞间隙中。分泌颗粒堆积后的结节可呈圆形、椭圆形、长梭形等形状。
, http://www.100md.com
四、AS染色观察
两种颅盖骨分离细胞培养5天,3种形态的细胞均有AS染色阳性现象。在经20天培养后,仍可表现为不同分化与发育阶段的细胞形态与功能。既有AS染色性细胞,也有AS染色阴性细胞或Alcian blue单独阳性、Sirius red单独阳性细胞。Alcian blue阳性显示细胞内或细胞外有蓝绿色絮状、细颗粒状酸性粘多糖;Sirius red阳性显示细胞内细胞外有红色细丝状、颗粒状胶原性物质(图2)。这些分泌物堆积形成的小结均被染成红色絮网状、团块状(图3),外围可有蓝染的酸性粘多糖不断沉淀,结节有继续扩展趋。

图2 颅骨细胞培养5周酸性粘多糖呈絮状蓝绿着色(

, http://www.100md.com
图3 颅骨细胞培养5周,结节形成过程中,有大量胶原性物质堆积,AS染色

图4 颅骨细胞培养5周,分泌的钙盐呈红色颗粒状,ARS染色
五、ARS染色观察
两种颅盖骨分离细胞培养至一定阶段发育成熟,胞浆内可有钙颗粒分泌,ARS染色显示红色(图4)。骨小结、骨小片亦均显阳性,随分泌物堆积程度增加列显强阳性。但如果结节过于浓密而不透光则又可使染色不显。
六、ALP-ACP反应
两种颅盖骨分离细胞分离细胞发育成熟,可表现为胞浆及周围基质中有蓝黑色细小颗料的ALP阳性反应,阳性细胞多呈鳞片形。在细胞聚集、骨小结形成区,ALP阳性反应尤为强烈,结节中央呈黑色,周围呈蓝黑色。在成骨区及其周围,还可同时见到一些内含红色细颗粒的ACP阳性反应细胞(图5)。
, http://www.100md.com
由两种颅盖骨成骨细胞样细胞形成的小结、小梁或小片经活体四环素荧光标记,在荧光显微镜下显示金黄色荧(图6)。结节形成早期荧光相对较弱,结节形成中后期荧光较为强烈,周围细胞多呈淡黄绿色鳞片形。

图5 颅骨细胞培养5周,在结节形成区,碱性磷酸酶呈蓝黑色强阳反应(↑),周围有酸性磷酸酶呈红色阳性反应(
 );ALP-ACP反应
);ALP-ACP反应
图6 颅骨细胞培养5周围,细胞形成的新生骨结节,活体轩环素荧光标记照片
讨论
大鼠及鸡胚胎颅盖骨由不完整的内外两层骨板、骨板间骨刺及骨内外膜所构成[1],由此消化分离的颅盖骨细胞主要含有4种成份:骨内膜细胞、骨外膜细胞、骨细胞和未分化间充质细胞。在体外培养中表现为3种形态:来自骨外膜的长梭形细胞,来自骨内膜和骨组织的鳞片形细胞,以及来自未来骨髓区和骨原基的圆球形细胞。骨细胞一旦经胰酶消化从骨陷窝中脱离出来,即又成为功能活跃的成骨细胞。3种形态的细胞组成了一成骨细胞样细胞群。
, 百拇医药
虽然颅盖骨分离细胞的形态可以各不相同,但它们都有一致的演变趋势与结果。圆球形细胞由于其生长环境发生改变,其形态与功能也因此出现了变化,开始向成骨细胞方向分化,其外形也变得纤长或扁平。长梭形细胞是成骨细胞的早期阶段,体外培养环境促使其发育成熟,表现出与鳞片形细胞类似功能。由此可在认为鳞片形、长梭形、圆球形3种形态的细胞实为处于不同发育阶段的同一型细胞。随培养时间的延续,鳞片形细胞不断增多,从而成为培养细胞的主体。鳞片形细胞从其外形与功能看则是一种较为成熟的成骨细胞,ALP反应强阳性是其成高活性的标志[2]。其分泌物堆积形成的骨小结、骨小梁经活体四环素荧光标记证实为新生骨组织[3]。微分干涉相差显微镜观察显示该骨组织与体内形成的骨组织一样具有骨细胞、骨陷窝及骨小管。其体外成骨的超微的结构研究也显示与体内骨形成相一致的结果[4]。因此,大鼠及鸡胚胎颅盖骨分离细胞体外培养是研究成骨细胞样细胞分化成熟过程以及探索骨形成机理的极好模型,为临床开发应用新医新药提供了很好的实验基础[5]。
, 百拇医药
成骨细胞一般不会分裂,但在整个生命中又必须不断进行成骨活动,这样就需要来自成骨前体细胞的一个连结性别分化[2]。骨髓中已被确认的器官特异性干细胞系有成骨细胞、成纤维细胞、网状细胞等[6]。成骨细胞的功能并不仅限于成骨活动。本实验中。在ALP阳性反应区附近还见有ACP阳性反应,可见颅盖骨分离细胞中还混有骨髓成分。人类骨髓培养14天[7],小鼠骨髓培养8天[8],均可形成破骨细胞样多核细胞(MNCs),成骨细胞为骨髓组织内破骨细胞前体分化为多核破骨细胞所必须,其产生的分化诱导因子(DRF)可刺激TRACP阳性的MNCs形成[8]。颅盖骨分离细胞体外培养后期,ALP与ACP阳性反应同时出现于骨形成区及其周围,反应了分离细胞含有两种不同来源的骨系细胞,在形成骨组织的同时又进行着骨吸收的活动。成骨细胞对破骨细胞的产生[8]与功能调节[9,10],又反映了这两种细胞在骨改建过程中的统一关系,二者相互间信息的传递,在一定程度上控制着整个骨组织的功能状态与结构变化。
, http://www.100md.com
本课题为国家自然科学基金资助项目
参考文献
1 徐荣辉,失雅萍,柴本甫.胚胎大鼠颅盖骨分离细胞早期体外培养的组织化学观察,解剖学报,1988,19:53.
2 Connor JM. soft tissue ossification. Belin: Springer, 1983. 117.
3 Lillie RD, Fullmer HM. Histopathologic technic and practical histochemistry. Fourth edition. New York: McGraw-Hill Book Company, 1976. 802.
4 Tenenbaum HC, Palangio KG, Holyard DP, ed al. An ultrastructural study of osteogenesis in chick periosteum in vitor. Bone, 1986, 7: 295.
, http://www.100md.com
5 徐荣辉,柴本甫,失雅萍.丹参注射液对鸡胚额骨分离细胞培养生长影响的组织化学观察-成骨细胞样细胞的发育与成熟.中华骨科杂志,1994,14:185.
6 Bereford JN. Osteogenic stem cells and the stomal system of bone and marrow. Clin Orthop Rel REs., 1989, 240: 270.
7 Birch MA, Hirst JP, Boothroyd B, et al. Assessment of the resorptive capacity of multiucleate cells from haman bone marrow culture. Calcif Tissue Int, 1990, 46: 15.
8 Suda t, Takahashi N. Osteblasts are cssential for osteoclast formation. Calcif Tissue Int, 1994, 44: 45.
, 百拇医药
9 Fuller K, Gallagher AC, Chambers TJ. Evidence that an osteoclastic resorption stimulatory activity is associated with the osteobast cell surface and/or the extracellular matrix. Calcif Tissue Int, 1990, 46: 19.
10 chambers TJ. The regulation of osteoclastic function. Calcif Tissue Int. 1989, 44: 32.
(收稿:1995-03-25 修回:1995-12-20), 百拇医药