恶性疟原虫多表位重组疫苗在大肠杆菌中的表达及纯化
作者:陈白虹 李明 吴岚晓 赖声礼
单位:陈白虹(华南理工大学电子与通信工程系 510641);李明(第一军医大学热带病研究室 510515);吴岚晓(第一军医大学热带病研究室 510515);赖声礼(华南理工大学电子与通信工程系 510641)
关键词:恶性疟原虫;非融合蛋白;表达;纯化;疫苗
广东医学000507 【摘要】 目的 在体外表达和纯化目的蛋白,为下一步抗攻击试验提供安全有效的产品。方法 将化学合成的恶性疟原虫保护性抗原复合基因(HGFSP)与表达载体pRSET重组,在大肠杆菌BL21进行表达:工程菌经超声破菌、离心、离子交换层析、疏水层析、分子筛层析等步骤纯化。结果 SDS-PAGE显示表达产物以非融合、可溶性的形式表达,相对分子质量为23 kDa,占总菌体蛋白的23.65%;纯度可达95%以上。Western-blot分析表明表达产物具有免疫原性。结论 成功构建pRSET-HGFSP重组表达系统并得到高效表达,纯化工艺令人满意。
, 百拇医药
Expression and purification of hybrid genes of protective antigens of plasmodium falciparum in non-fusion system
Chen Baihong Li Ming Wu Lanxiao et al
(Department of Electronic and Telecommunication Engineering, South China University of Technology, Guangzhou 510641)
【Abstract】 Objective To express and purify the target protein in vitro and to obtain safer and more efficient product for further anti-challenge test. Methods The chemically synthesized hybrid genes of protective antigens(HGFSP) was recombinated with pRSET expression vector and expressed in E coli BL21. The E coli was lysed by ultrasonication. Supernatant of the lysate was purified by ion-exchange chromatography, reversed chromatography and gel filtration. Results SDS-PAGE analysis suggested the target protein was expressed in soluble and non-fusion form after induced by IPTG. Its molecular weight was 23kDa and consisted of 23.65% of the total bacterial proteins. Purity of the target protein was above 95% after purification. Western blotting showed that the target protein had immunogenicity. Conclusion The pRSET-HGFSP expression recombinant has been successfully constructed and can be highly expressed in E coli BL21. The result of purification was satisfying.
, 百拇医药
【Key words】 Plasmodium falciparum Non-fusion protein Gene expression Purification Vaccine
恶性疟原虫保护性抗原复合基因(HGFSP)为编码恶性疟原虫不同发育阶段的抗原表位(包括MSA1,MSA2,CSP和RESA)以及来自白细胞介素-1和破伤风类毒素的T细胞激活位点等。经初步鉴定,原核表达产物具有体外抑制疟原虫生长和细胞毒等作用[1]。但以往HGFSP均是以融合蛋白的形式表达,其表达产物含有载体蛋白,不利于复合抗原本身生物学性质和免疫学特性的研究,同时作为疫苗应用会引起一些毒副作用。为了进一步评价HGFSP复合疫苗的保护效果,本研究利用基因的分子亚克隆技术,成功地将HGFSP克隆到pRSET载体,构建了pRSET-HGFSP重组表达系统,HGFSP在大肠杆菌中以非融合、可溶性的形式得到高效表达,对重组蛋白进行分离纯化并初步鉴定,结果显示该蛋白具有免疫原性。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 pWR450-HGFSP质粒由本室构建;pRSET为T7启动子控制下的N端含有6个His的融合表达载体;大肠杆菌BL21含有λ溶源的T7RNA聚合酶基因,可作为高效表达T7质粒的宿主菌。
1.1.2 试剂 本试验所用限制性内切酶和T4DNA连接酶为New England Biolabs公司或Boehringer Mannheim公司产品;PCR标准分子量为华美生物工程公司产品;IPTG为Promega公司产品;Q Sepharose F.F., Octyl Sepharose 4 F.F.和Superdex 75 prep grade填料为Amersham Pharmacia生物技术公司产品;丙烯酰胺和N,N-亚甲双丙烯酰胺为Serva公司产品;低分子量标准蛋白质为上海丽珠东风生物技术有限公司产品;其他试剂为国产分析纯。
, http://www.100md.com
1.1.3 抗体 兔抗恶性疟原虫全虫抗血清由本室自制。HRP-羊抗兔IgG结合物购自华美生物工程公司。
1.2 方法
1.2.1 pRSET-HGFSP重组子的构建
1.2.1.1 载体和目的基因的酶切及酶切片段的回收 按常规方法用Nde Ⅰ和EcoR Ⅰ分别酶切pRSET载体和pWR450-HGFSP重组质粒,经Klenow酶补平,酚抽提后,用Hind Ⅲ酶切,并经琼脂糖凝胶冻融法回收可得到2.8 Kb Nde Ⅰ-Hind Ⅲ酶切载体片段和600 bp EcoR Ⅰ-Hind Ⅲ酶切目的基因片段。
1.2.1.2 连接和转化 将回收片段按基因和载体摩尔比为5∶1,反应体系10 μl,总DNA量为10 ng, 16℃水浴连接过夜,次日转化TG1感受态菌,涂布于LB-Amp平板上,37℃培养过夜。
, 百拇医药
1.2.1.3 克隆鉴定 从培养板上挑取单菌落,碱法提取质粒DNA,与载体质粒比较,确定质粒大小正确的克隆;然后用Sal Ⅰ酶切鉴定所选质粒。
1.2.2 重组质粒在大肠杆菌中的表达 将重组质粒转化BL21宿主菌,挑取单菌落接入LB-Amp培养基中,37℃振摇过夜,次日按1%比例转入新鲜LB-Amp培养基,37℃摇至OD600达0.5~0.8时,用终浓度为1 mmol/L IPTG诱导培养4 h,离心收菌。
1.2.3 表达产物的分离纯化 将收集菌体超声破菌、15 000 r/min 4℃离心后依次经过Q Sepharose F.F.(缓冲液A:20 mmol/L pH 6.0 Tris-HCl, 缓冲液B:含1 mol/L NaCl的A液)、Octyl Sepharose 4 F.F.[缓冲液C:20 mmol/L pH 7.4 Tris-HCl, 缓冲液D:含1 mol/L (NH4)2SO4的C液]和Superdex 75 prep grade(缓冲液E:20 mmol/L pH 7.4 PBS)柱层析进行分离纯化。
, 百拇医药
1.2.4 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE) 按常规方法进行。胶含量12%,考马斯亮兰染色。
1.2.5 免疫印迹试验(Western-blot) 参照Talbot等方法[2],SDS-PAGE后将蛋白转移至硝酸纤维素膜上,用兔抗恶性疟原虫全虫抗血清进行Western-blot分析。
2 结果
2.1 重组质粒的筛选和鉴定
2.1.1 质粒初筛 碱法提取克隆质粒,经1%琼脂糖凝胶电泳与空载体比较,结果显示较大者可能为阳性克隆。
2.1.2 酶切鉴定 用Sal Ⅰ酶切大小正确的克隆,并与pWR450-HGFSP比较,1%琼脂糖凝胶电泳结果显示在约350 bp处出现大小一致的片段(图1),表明该重组质粒已正确插入HGFSP基因。
, 百拇医药
图1 Sal Ⅰ酶切鉴定pRSET-HGFSP重组质粒
注:1. pWR450-HGFSP重组质粒; 2. pWR450-HGFSP重组质粒Sal Ⅰ酶切产物; 3. pRSET-HGFSP重组质粒; 4. pRSET-HGFSP重组质粒Sal Ⅰ酶切产物;M. λDNA Hind Ⅲ+PCR标准分子量
2.2 表达产物的分析
2.2.1 SDS-PAGE分析 结果显示,与无插入基因载体的宿主菌相比,含重组质粒pRSET-HGFSP的宿主菌约在23 kDa处出现一条增加的蛋白条带,这与理论预测值22 kDa相符,提示新增条带可能为重组质粒表达的目的蛋白。将pRSET-HGFSP/BL21工程菌经IPTG诱导后超声破菌、离心,可见目的蛋白主要存在于上清中(图2)。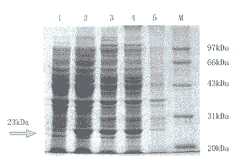
, 百拇医药
图2 12% SDS-PAGE检测pRSET-HGFSP重组子在
大肠杆菌BL21中的表达
注:1. 大肠杆菌BL21; 2. IPTG诱导pRSET-HGFSP/BL21; 3. 未诱导pRSET-HGFSP/BL21; 4. 超声后上清; 5. 超声后沉淀;M. 低分子量标准蛋白质
2.2.2 纯化产物的分析 对上清液中的目的蛋白进行分离纯化,步骤包括:阴离子交换层析初级纯化;疏水层析次级纯化;分子筛层析终纯化。采用Pharmacia FPLC层析仪,SDS-PAGE结果见图3。
图3 12% SDS-PAGE检测目的蛋白纯化结果
, 百拇医药
注:1. Q Sepharose层析后; 2. Octyl Sepharose层析后; 3. Superdex 75层析后; M. 低分子量标准蛋白质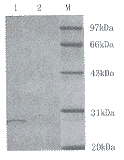
图4 pRSET-HGFSP表达产物的Western-blot分析
注:M. 低分子量标准蛋白质; 1. pRSET-HGFSP表达产物;
2. 大肠杆菌BL21
2.2.3 Western-blot分析 将pRSET-HGFSP/BL21表达产物经SDS-PAGE后,转移至硝酸纤维素膜,进行Western-blot分析,可见在 23 kDa处出现特异性反应区带,而BL21宿主菌在相应位置无显色区带出现(图4)。
, http://www.100md.com
3 讨论
以往的研究表明,pWR450-HGFSP表达产物具有明显的免疫原性[3],其免疫血清对疟原虫体外增殖也有抑制作用[1],在小鼠体内进行的细胞免疫功能试验也初步证实该产物具有特异性地刺激T淋巴细胞增殖和分泌IL-2的能力,同时具有一定的突破MHC限制的能力[4],从而显示HGFSP有望成为较好的恶性疟候选疫苗。融合蛋白表达产物虽具有高效表达、稳定、不易降解,易于纯化、监测等优点,但由于其表达产物含有载体蛋白,不利于复合抗原本身的生物学功能和免疫学特性分析,而且作为疫苗应用会引起一些毒副作用,使得其实际应用受到限制。为此,本研究将HGFSP与原核表达载体pRSET重组,该载体是一种带有编码6个组氨酸的融合表达载体,我们采用限制性内切酶将其切除,3′端补平后与HGFSP连接,经Sal Ⅰ酶切鉴定证实(该酶切位点位于目的基因的226和580核苷酸位置,为HGFSP所独有),成功构建了pRSET-HGFSP重组子。
, 百拇医药
许多蛋白的高水平表达最后都会导致包涵体形成,虽以包涵体形式表达具有易于纯化,表达产物较稳定等优点,但得到的目的蛋白需经过变性、复性处理后才能获得生物活性,且复性率较低,因此若能获得完全可溶性的目的蛋白在天然状态下纯化,其纯化产物将更可能保持原有的生物学活性。我们将pRSET-HGFSP重组子转化BL21宿主菌,经IPTG诱导,对其表达产物进行超声破碎,SDS-PAGE结果显示表达产物主要存在于上清,提示该产物主要以可溶性形式表达,经GDS-750 uvp凝胶光密度图像分析系统检测,表达量占总菌体蛋白的23.65%。
我们对目的蛋白的纯化工艺进行研究,采用阴离子交换层析初级纯化、疏水层析次级纯化、分子筛层析终纯化,结果令人满意,经凝胶光密度图像分析系统检测纯度达到98%。Western-blot分析表明,表达产物能被兔抗恶性疟原虫抗血清所识别,从而进一步证实pRSET-HGFSP重组子构建成功且能正确表达,这将有利于对HGFSP的生物学功能和免疫学特性作进一步研究。
, 百拇医药
本研究为联合国计划开发署/世界银行/世界卫生组织热带病研究和培训特别规划署(TDR)资助项目(项目编号:980226)
参考文献
1,李全贞,毕惠祥,李英杰,等. 抗恶性疟重组复合抗原的免疫血清对恶性疟原虫体外生长的抑制作用. 中国寄生虫学与寄生虫病杂志,1995, 13(3):209
2,Talbot PJ, Knobler RL, Buchmeier MJ. Western and dot immunobloting analysis of viral antigens and antibodies: application to murine hepatitis virus. J Immunol Methods, 1984, 73: 177
3,陈白虹,缪 军,薛采芳. 一种恶性疟原虫多价重组疫苗的体液免疫反应研究. 第四军医大学学报,1995, 16(3):232
4,缪 军,薛采芳,陈白虹.一种恶性疟原虫保护性抗原重组复合基因表达产物的细胞免疫特性研究. 第四军医大学学报,1997, 18(4):307
收稿日期:1999-11-16, http://www.100md.com
单位:陈白虹(华南理工大学电子与通信工程系 510641);李明(第一军医大学热带病研究室 510515);吴岚晓(第一军医大学热带病研究室 510515);赖声礼(华南理工大学电子与通信工程系 510641)
关键词:恶性疟原虫;非融合蛋白;表达;纯化;疫苗
广东医学000507 【摘要】 目的 在体外表达和纯化目的蛋白,为下一步抗攻击试验提供安全有效的产品。方法 将化学合成的恶性疟原虫保护性抗原复合基因(HGFSP)与表达载体pRSET重组,在大肠杆菌BL21进行表达:工程菌经超声破菌、离心、离子交换层析、疏水层析、分子筛层析等步骤纯化。结果 SDS-PAGE显示表达产物以非融合、可溶性的形式表达,相对分子质量为23 kDa,占总菌体蛋白的23.65%;纯度可达95%以上。Western-blot分析表明表达产物具有免疫原性。结论 成功构建pRSET-HGFSP重组表达系统并得到高效表达,纯化工艺令人满意。
, 百拇医药
Expression and purification of hybrid genes of protective antigens of plasmodium falciparum in non-fusion system
Chen Baihong Li Ming Wu Lanxiao et al
(Department of Electronic and Telecommunication Engineering, South China University of Technology, Guangzhou 510641)
【Abstract】 Objective To express and purify the target protein in vitro and to obtain safer and more efficient product for further anti-challenge test. Methods The chemically synthesized hybrid genes of protective antigens(HGFSP) was recombinated with pRSET expression vector and expressed in E coli BL21. The E coli was lysed by ultrasonication. Supernatant of the lysate was purified by ion-exchange chromatography, reversed chromatography and gel filtration. Results SDS-PAGE analysis suggested the target protein was expressed in soluble and non-fusion form after induced by IPTG. Its molecular weight was 23kDa and consisted of 23.65% of the total bacterial proteins. Purity of the target protein was above 95% after purification. Western blotting showed that the target protein had immunogenicity. Conclusion The pRSET-HGFSP expression recombinant has been successfully constructed and can be highly expressed in E coli BL21. The result of purification was satisfying.
, 百拇医药
【Key words】 Plasmodium falciparum Non-fusion protein Gene expression Purification Vaccine
恶性疟原虫保护性抗原复合基因(HGFSP)为编码恶性疟原虫不同发育阶段的抗原表位(包括MSA1,MSA2,CSP和RESA)以及来自白细胞介素-1和破伤风类毒素的T细胞激活位点等。经初步鉴定,原核表达产物具有体外抑制疟原虫生长和细胞毒等作用[1]。但以往HGFSP均是以融合蛋白的形式表达,其表达产物含有载体蛋白,不利于复合抗原本身生物学性质和免疫学特性的研究,同时作为疫苗应用会引起一些毒副作用。为了进一步评价HGFSP复合疫苗的保护效果,本研究利用基因的分子亚克隆技术,成功地将HGFSP克隆到pRSET载体,构建了pRSET-HGFSP重组表达系统,HGFSP在大肠杆菌中以非融合、可溶性的形式得到高效表达,对重组蛋白进行分离纯化并初步鉴定,结果显示该蛋白具有免疫原性。
, 百拇医药
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 pWR450-HGFSP质粒由本室构建;pRSET为T7启动子控制下的N端含有6个His的融合表达载体;大肠杆菌BL21含有λ溶源的T7RNA聚合酶基因,可作为高效表达T7质粒的宿主菌。
1.1.2 试剂 本试验所用限制性内切酶和T4DNA连接酶为New England Biolabs公司或Boehringer Mannheim公司产品;PCR标准分子量为华美生物工程公司产品;IPTG为Promega公司产品;Q Sepharose F.F., Octyl Sepharose 4 F.F.和Superdex 75 prep grade填料为Amersham Pharmacia生物技术公司产品;丙烯酰胺和N,N-亚甲双丙烯酰胺为Serva公司产品;低分子量标准蛋白质为上海丽珠东风生物技术有限公司产品;其他试剂为国产分析纯。
, http://www.100md.com
1.1.3 抗体 兔抗恶性疟原虫全虫抗血清由本室自制。HRP-羊抗兔IgG结合物购自华美生物工程公司。
1.2 方法
1.2.1 pRSET-HGFSP重组子的构建
1.2.1.1 载体和目的基因的酶切及酶切片段的回收 按常规方法用Nde Ⅰ和EcoR Ⅰ分别酶切pRSET载体和pWR450-HGFSP重组质粒,经Klenow酶补平,酚抽提后,用Hind Ⅲ酶切,并经琼脂糖凝胶冻融法回收可得到2.8 Kb Nde Ⅰ-Hind Ⅲ酶切载体片段和600 bp EcoR Ⅰ-Hind Ⅲ酶切目的基因片段。
1.2.1.2 连接和转化 将回收片段按基因和载体摩尔比为5∶1,反应体系10 μl,总DNA量为10 ng, 16℃水浴连接过夜,次日转化TG1感受态菌,涂布于LB-Amp平板上,37℃培养过夜。
, 百拇医药
1.2.1.3 克隆鉴定 从培养板上挑取单菌落,碱法提取质粒DNA,与载体质粒比较,确定质粒大小正确的克隆;然后用Sal Ⅰ酶切鉴定所选质粒。
1.2.2 重组质粒在大肠杆菌中的表达 将重组质粒转化BL21宿主菌,挑取单菌落接入LB-Amp培养基中,37℃振摇过夜,次日按1%比例转入新鲜LB-Amp培养基,37℃摇至OD600达0.5~0.8时,用终浓度为1 mmol/L IPTG诱导培养4 h,离心收菌。
1.2.3 表达产物的分离纯化 将收集菌体超声破菌、15 000 r/min 4℃离心后依次经过Q Sepharose F.F.(缓冲液A:20 mmol/L pH 6.0 Tris-HCl, 缓冲液B:含1 mol/L NaCl的A液)、Octyl Sepharose 4 F.F.[缓冲液C:20 mmol/L pH 7.4 Tris-HCl, 缓冲液D:含1 mol/L (NH4)2SO4的C液]和Superdex 75 prep grade(缓冲液E:20 mmol/L pH 7.4 PBS)柱层析进行分离纯化。
, 百拇医药
1.2.4 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE) 按常规方法进行。胶含量12%,考马斯亮兰染色。
1.2.5 免疫印迹试验(Western-blot) 参照Talbot等方法[2],SDS-PAGE后将蛋白转移至硝酸纤维素膜上,用兔抗恶性疟原虫全虫抗血清进行Western-blot分析。
2 结果
2.1 重组质粒的筛选和鉴定
2.1.1 质粒初筛 碱法提取克隆质粒,经1%琼脂糖凝胶电泳与空载体比较,结果显示较大者可能为阳性克隆。
2.1.2 酶切鉴定 用Sal Ⅰ酶切大小正确的克隆,并与pWR450-HGFSP比较,1%琼脂糖凝胶电泳结果显示在约350 bp处出现大小一致的片段(图1),表明该重组质粒已正确插入HGFSP基因。

, 百拇医药
图1 Sal Ⅰ酶切鉴定pRSET-HGFSP重组质粒
注:1. pWR450-HGFSP重组质粒; 2. pWR450-HGFSP重组质粒Sal Ⅰ酶切产物; 3. pRSET-HGFSP重组质粒; 4. pRSET-HGFSP重组质粒Sal Ⅰ酶切产物;M. λDNA Hind Ⅲ+PCR标准分子量
2.2 表达产物的分析
2.2.1 SDS-PAGE分析 结果显示,与无插入基因载体的宿主菌相比,含重组质粒pRSET-HGFSP的宿主菌约在23 kDa处出现一条增加的蛋白条带,这与理论预测值22 kDa相符,提示新增条带可能为重组质粒表达的目的蛋白。将pRSET-HGFSP/BL21工程菌经IPTG诱导后超声破菌、离心,可见目的蛋白主要存在于上清中(图2)。

, 百拇医药
图2 12% SDS-PAGE检测pRSET-HGFSP重组子在
大肠杆菌BL21中的表达
注:1. 大肠杆菌BL21; 2. IPTG诱导pRSET-HGFSP/BL21; 3. 未诱导pRSET-HGFSP/BL21; 4. 超声后上清; 5. 超声后沉淀;M. 低分子量标准蛋白质
2.2.2 纯化产物的分析 对上清液中的目的蛋白进行分离纯化,步骤包括:阴离子交换层析初级纯化;疏水层析次级纯化;分子筛层析终纯化。采用Pharmacia FPLC层析仪,SDS-PAGE结果见图3。

图3 12% SDS-PAGE检测目的蛋白纯化结果
, 百拇医药
注:1. Q Sepharose层析后; 2. Octyl Sepharose层析后; 3. Superdex 75层析后; M. 低分子量标准蛋白质

图4 pRSET-HGFSP表达产物的Western-blot分析
注:M. 低分子量标准蛋白质; 1. pRSET-HGFSP表达产物;
2. 大肠杆菌BL21
2.2.3 Western-blot分析 将pRSET-HGFSP/BL21表达产物经SDS-PAGE后,转移至硝酸纤维素膜,进行Western-blot分析,可见在 23 kDa处出现特异性反应区带,而BL21宿主菌在相应位置无显色区带出现(图4)。
, http://www.100md.com
3 讨论
以往的研究表明,pWR450-HGFSP表达产物具有明显的免疫原性[3],其免疫血清对疟原虫体外增殖也有抑制作用[1],在小鼠体内进行的细胞免疫功能试验也初步证实该产物具有特异性地刺激T淋巴细胞增殖和分泌IL-2的能力,同时具有一定的突破MHC限制的能力[4],从而显示HGFSP有望成为较好的恶性疟候选疫苗。融合蛋白表达产物虽具有高效表达、稳定、不易降解,易于纯化、监测等优点,但由于其表达产物含有载体蛋白,不利于复合抗原本身的生物学功能和免疫学特性分析,而且作为疫苗应用会引起一些毒副作用,使得其实际应用受到限制。为此,本研究将HGFSP与原核表达载体pRSET重组,该载体是一种带有编码6个组氨酸的融合表达载体,我们采用限制性内切酶将其切除,3′端补平后与HGFSP连接,经Sal Ⅰ酶切鉴定证实(该酶切位点位于目的基因的226和580核苷酸位置,为HGFSP所独有),成功构建了pRSET-HGFSP重组子。
, 百拇医药
许多蛋白的高水平表达最后都会导致包涵体形成,虽以包涵体形式表达具有易于纯化,表达产物较稳定等优点,但得到的目的蛋白需经过变性、复性处理后才能获得生物活性,且复性率较低,因此若能获得完全可溶性的目的蛋白在天然状态下纯化,其纯化产物将更可能保持原有的生物学活性。我们将pRSET-HGFSP重组子转化BL21宿主菌,经IPTG诱导,对其表达产物进行超声破碎,SDS-PAGE结果显示表达产物主要存在于上清,提示该产物主要以可溶性形式表达,经GDS-750 uvp凝胶光密度图像分析系统检测,表达量占总菌体蛋白的23.65%。
我们对目的蛋白的纯化工艺进行研究,采用阴离子交换层析初级纯化、疏水层析次级纯化、分子筛层析终纯化,结果令人满意,经凝胶光密度图像分析系统检测纯度达到98%。Western-blot分析表明,表达产物能被兔抗恶性疟原虫抗血清所识别,从而进一步证实pRSET-HGFSP重组子构建成功且能正确表达,这将有利于对HGFSP的生物学功能和免疫学特性作进一步研究。
, 百拇医药
本研究为联合国计划开发署/世界银行/世界卫生组织热带病研究和培训特别规划署(TDR)资助项目(项目编号:980226)
参考文献
1,李全贞,毕惠祥,李英杰,等. 抗恶性疟重组复合抗原的免疫血清对恶性疟原虫体外生长的抑制作用. 中国寄生虫学与寄生虫病杂志,1995, 13(3):209
2,Talbot PJ, Knobler RL, Buchmeier MJ. Western and dot immunobloting analysis of viral antigens and antibodies: application to murine hepatitis virus. J Immunol Methods, 1984, 73: 177
3,陈白虹,缪 军,薛采芳. 一种恶性疟原虫多价重组疫苗的体液免疫反应研究. 第四军医大学学报,1995, 16(3):232
4,缪 军,薛采芳,陈白虹.一种恶性疟原虫保护性抗原重组复合基因表达产物的细胞免疫特性研究. 第四军医大学学报,1997, 18(4):307
收稿日期:1999-11-16, http://www.100md.com