α-MSH拮抗剂对内毒素及肿瘤坏死因子性发热的作用
作者:胡巢凤 王彦平 李楚杰
单位:胡巢凤 暨南大学医学院;王彦平 病理生理教研室;李楚杰 发热研究室(广州510632)
关键词:发热;内毒素类;肿瘤坏死因子;黑素细胞刺激素
中国病理生理杂志990513 摘 要 目的:观察α-黑素细胞刺激素(α-MSH)拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide对家兔内毒素(ET)及肿瘤坏死因子(TNF)性发热的影响。方法:侧脑室给药,ST-1型数字温度计测家兔的结肠温度。结果:(1)静脉注射ET,家兔体温呈典型的双相热;若事先侧脑室注射α-MSH拮抗剂, 则体温升高更明显,且热程明显延长,6h体温反应指数(TRI6)显著高于NS+ET组(P<0.01)。(2)侧脑室注射TNF-α引起体温明显升高;事先给予α-MSH拮抗剂,则显著增强TNF-α性发热效应(P<0.01)。而α-MSH拮抗剂对正常体温无影响。结论:内源性解热物质α-MSH在限制发热中发挥了重要作用。
, 百拇医药
The effect of α-MSH antagonist on fever induced by ET and TNF-α
HU Chao-Feng, WANG Yan-Ping, LI Chu-Jie
Department of Pathophysiology, Research Institute of Fever, Medical College of Jinan University, Guangzhou (510632)
Abstract AIM: To observe the effect of α-MSH antagonist [D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide on fever induced by endotoxin(ET) and tumour necrosis factor-α(TNF-α).METHODS: α-MSH antagonist was injected into a lateral cerebral ventricle of rabbits. Colonic temperature was measureed with thermistor probes. RESULTS: (1) Intravenous injection of ET caused fever with biphasic thermal response. Pretretment with [D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide significantly enhanced and prolonged the febrile response to ET. Colonic temperature remained elevated through 6h recording period. (2) Intracerebroventricular injection of TNF-α produced the rise in temperature. [D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide markedly increased TNF-α-induced fever but did not alter normal temperature. CONCLUSION: Endogenous central α-MSH contributes to physiological limitation of fever.
, 百拇医药
MeSH Fever; Endotoxins; Tumor necrosis factor; Melanocyte-stimulating hormone
α-黑素细胞刺激素(α-melanocyte-stimulating hormone, α-MSH)是一种强效的内源性解热物质,无论外周静脉还是脑室内或脑中腹隔注射α-MSH,均能抑制多种致热原引起的体温升高,但最主要的作用部位是脑腹中隔[1~3]。化学合成的六肽[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide是α-MSH拮抗剂,能拮抗内源性α-MSH的活性[4]。为进一步探讨α-MSH在正常体温及发热体温调节中的作用,本实验观察α-MSH拮抗剂对内毒素(endotoxin, ET)及肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)性发热的作用。
, 百拇医药
材料与方法
一、实验动物:
实验动物为封闭群新西兰家兔(本校动物所提供),体重2.0~2.5 kg,雌雄不拘。单笼饲养,自由饮水,实验室温度保持在(20±1)℃。实验前模拟正式实验条件,将家兔置于特制的兔架上,用模拟测温探头的导管经肛门插入10 cm并固定,适应3 d,第4 d正式实验。
二、试剂和仪器:
大肠杆菌内毒素ET(serotype,055:B5)、α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide为Sigma公司产品,实验中试剂用无热原生理盐水(normal saline, NS)稀释。TNF-α由北京邦定医学生物公司提供。ST-型数字温度计为上海医用仪表厂生产。
, 百拇医药
三、体温测定:
实验时,将测温探头由肛门插入10 cm并固定,待体温稳定后,连续测定结肠温度3次,每次间隔10 min,取均数值为基础体温。注射试剂后分别记录结肠温度6 h、3 h。
四、侧脑室插管:
家兔用3%戊巴比妥钠1 mL/kg(iv)麻醉,在APO,L4-5或R4-5处颅骨钻孔,埋植有机玻璃底座,将外径1 mm带针蕊的塑料管经底座中间小孔插入H5水平,拔出针蕊,调整塑料管位置,见脑脊液徐缓上升,封闭其上段,缝合切口。术后肌注青霉素2×104 U/kg.d-1, 连续3 d, 第4 d进行实验。实验结束后,解剖兔脑,检查插管位置是否正确。
五、实验分组及步骤:
, 百拇医药
(一)观察α-MSH拮抗剂(antagonist, ANT)对家兔ET性发热的影响:实验分为4组,NS+NS组:侧脑室注射NS 20 μL,5 min后,静脉注射NS 1 mL/kg;NS+ET组:侧脑室注射NS 20 μL,5 min后再静注ET 1 mL/kg(0.4 μg/mL);ANT+ET组:侧脑室注射[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20μL(0.2μg/μL),静注ET 1 mL/kg(0.4 μg/mL);ANT+NS组: 侧脑室注射[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20 μL(0.2 μg/μL),静注NS 1 mL/kg。
(二)观察α-MSH拮抗剂对家兔TNF-α性发热的影响:实验分为4组,NS+NS组:侧脑室注射NS 20 μL,5 min后,后再注射NS 100μL;NS+TNF-α组:侧脑室注射NS 20 μL,5 min再注射TNF-α 100 μL(1 ng/μL);ANT+TNF-α组:侧脑室注射α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20 μL(0.2 μg/μL),再注射TNF-α 100 μL(1 ng/μL);ANT+NS组:侧脑室注射[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20 μL(0.2 μg/μL),再注射NS 100 μL。
, 百拇医药
六、体温反应指标及数据处理:
体温反应指标用平均体温反应曲线,3 h、6 h体温反应指数(thermal response index,TRI3、TRI6)表示。所有数据用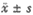 表示,组间比较用t检验。
表示,组间比较用t检验。
结果
一、α-MSH拮抗剂对家兔ET性发热的影响:
静脉注射ET(0.4 μg/kg)引起家兔体温呈双相性升高,TRI6显著高于对照组(P<0.01)。事先侧脑室注射α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide(4 μg/只),再静脉注射ET(0.4 μg/kg),则ET发热效应明显增强,双相热峰值后移,热程延长,在记录的6 h内体温持续升高,其TRI6显著高于NS+ET组(P<0.01)。而ANT+NS组体温无明显改变(P>0.05)(表1、图1)。
, 百拇医药
表1 各组6 h体温反应指数的变化
Tab 1 The changes of six-hour thermal response index(TRI6)
among various groups (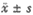 ) Group
) Group
n
TRI6
NS+NS
3
0.15±0.05
NS+ET
, 百拇医药
4
3.60±0.33*
ANT+ET
4
7.09±0.97*△
ANT+NS
3
0.25±0.24
*P<0.01,vs NS+NS group; △P<0.01,vs NS+ET group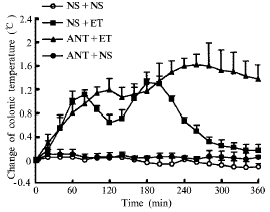
Fig 1 Mean changes of colonic temperature among ET grous and orther groups
, 百拇医药
图1 各组平均体温反应曲线变化
二、观察α-MSH拮抗剂对家兔TNF-α性发热的影响:
表2、图2所示:侧脑室注射TNF-α(100 ng/只)可致家兔体温明显升高,TRI3显著高于对照组(P<0.01)。若事先侧脑室注射α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide(4 μg/只),再注射TNF-α(100 ng/只),则体温升高更明显,其TRI3显著高于NS+TNF-α组(P<0.01)。而ANT+NS组与NS+NS组之间TRI3无显著差异(P>0.05)。
表2 各组3 h体温反应指数的变化
Tab 2 The changes of three-hour thermal response
, http://www.100md.com
index (TRI3) among various groups (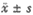 ) Group
) Group
n
TRI3
NS+NS
4
0.14±0.10
NS+ TNF-α
4
1.49±0.14*
ANT+TNF-α
, 百拇医药
4
2.54±0.43*△
ANT+NS
3
0.11±0.09
*P<0.01,vs NS+NS group; △P<0.01, vs NS+TNF-αgroup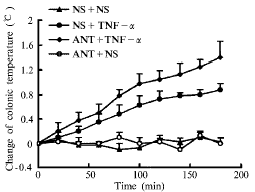
Fig 2 Mean changes of colonic temperature among TNFα groups and orther groups
图2 各组平均体温反应曲线变化
, 百拇医药
讨论
本研究发现α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide对ET及TNF-α的发热反应均有显著的增强作用,在ET性发热过程中,改变最明显的是热程延长,6 h内体温持续不降,第二峰值显著升高。已知ET是主要的细菌致热原,参与或启动多种传染性发热。TNF则是主要内生致热原之一,参与多种发热的机制。因此,本实验的结果不仅证实α-MSH是有效的内源性解热物质,而且表明α-MSH在ET性发热以及多种发热过程中发挥了限制发热的作用。
本实验中观察到α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide只增加发热反应的体温,对正常家兔体温无影响。这一结果与Samson等[5]在实验中的发现是一致的,即在IL-1性发热过程中,脑中隔α-MSH含量明显增加,而正常体温时,脑中隔α-MSH含量无显著变化。这说明中枢基础水平的α-MSH对控制正常体温不是必需的。我们先前的实验发现α-MSH可抑制中枢发热介质环-磷酸腺苷(cAMP)、促皮质激素释放激素(CRH)等的释放及促进中枢内源性解热物精氨酸加压素(AVP)的产生而控制发热反应[6~8]。在本实验中,[D-Trp7,Ala8,D-Phe10]α-SMD(6-11)-amide可能拮抗中枢内源性解热物α-MSH的这些作用,增强发热效应。从而也反过来证明α-MSH在限制发热过程中起着重要的负调节作用。
, 百拇医药
参考文献
1 Chiao H, Foster S, Yhomas R, et al. Alpha-melanocyte-stimulating hormone reduces endotoxin-induced liver inflammation. J Clin Invest, 1996, 97(9): 2038.
2 Kluger MJ. Fever: role of pyrogens and cryogens. Physiol Rev, 1991, 71(1):93.
3 Lipton JM, Catania A. α-MSH peptides modulate fever and inflammation. In: Bartfai T, Ottoson O. ed. "Neuroimmunology of fever". New York: Pergamon Press, 1992. 123 ~136.
, http://www.100md.com
4 de Lauro Castrucci AM, Sawyer TK, Al-Obeidi F, et al. Melanotropic peptide antagonists: Recent discoveries and biomedical implications. Drugs Future, 1990, 15:41.
5 Samson WK, Lipton JM, Zimmer JA, et al. The effect of fever on central α-MSH concentration in rabbit. Peptides, 1981, 2:419.
6 胡巢凤,王华东,王达安,等. α-MSH对IL-1β发热的解热机理研究. 生理学报, 1998,50(5):490.
7 胡巢凤,王彦平,王华东,等. α-MSH对EGTA发热的作用. 中国病理生理杂志,1999,15(4):299.
8 王华东,胡巢凤,王彦平,等. α-MSH对家兔ET性发热反应及脑腹中隔区AVP含量的影响.中国病理生理杂志,1998, 14(2):130.
(1998年10月5日收稿,1999年4月6日修回), 百拇医药
单位:胡巢凤 暨南大学医学院;王彦平 病理生理教研室;李楚杰 发热研究室(广州510632)
关键词:发热;内毒素类;肿瘤坏死因子;黑素细胞刺激素
中国病理生理杂志990513 摘 要 目的:观察α-黑素细胞刺激素(α-MSH)拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide对家兔内毒素(ET)及肿瘤坏死因子(TNF)性发热的影响。方法:侧脑室给药,ST-1型数字温度计测家兔的结肠温度。结果:(1)静脉注射ET,家兔体温呈典型的双相热;若事先侧脑室注射α-MSH拮抗剂, 则体温升高更明显,且热程明显延长,6h体温反应指数(TRI6)显著高于NS+ET组(P<0.01)。(2)侧脑室注射TNF-α引起体温明显升高;事先给予α-MSH拮抗剂,则显著增强TNF-α性发热效应(P<0.01)。而α-MSH拮抗剂对正常体温无影响。结论:内源性解热物质α-MSH在限制发热中发挥了重要作用。
, 百拇医药
The effect of α-MSH antagonist on fever induced by ET and TNF-α
HU Chao-Feng, WANG Yan-Ping, LI Chu-Jie
Department of Pathophysiology, Research Institute of Fever, Medical College of Jinan University, Guangzhou (510632)
Abstract AIM: To observe the effect of α-MSH antagonist [D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide on fever induced by endotoxin(ET) and tumour necrosis factor-α(TNF-α).METHODS: α-MSH antagonist was injected into a lateral cerebral ventricle of rabbits. Colonic temperature was measureed with thermistor probes. RESULTS: (1) Intravenous injection of ET caused fever with biphasic thermal response. Pretretment with [D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide significantly enhanced and prolonged the febrile response to ET. Colonic temperature remained elevated through 6h recording period. (2) Intracerebroventricular injection of TNF-α produced the rise in temperature. [D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide markedly increased TNF-α-induced fever but did not alter normal temperature. CONCLUSION: Endogenous central α-MSH contributes to physiological limitation of fever.
, 百拇医药
MeSH Fever; Endotoxins; Tumor necrosis factor; Melanocyte-stimulating hormone
α-黑素细胞刺激素(α-melanocyte-stimulating hormone, α-MSH)是一种强效的内源性解热物质,无论外周静脉还是脑室内或脑中腹隔注射α-MSH,均能抑制多种致热原引起的体温升高,但最主要的作用部位是脑腹中隔[1~3]。化学合成的六肽[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide是α-MSH拮抗剂,能拮抗内源性α-MSH的活性[4]。为进一步探讨α-MSH在正常体温及发热体温调节中的作用,本实验观察α-MSH拮抗剂对内毒素(endotoxin, ET)及肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)性发热的作用。
, 百拇医药
材料与方法
一、实验动物:
实验动物为封闭群新西兰家兔(本校动物所提供),体重2.0~2.5 kg,雌雄不拘。单笼饲养,自由饮水,实验室温度保持在(20±1)℃。实验前模拟正式实验条件,将家兔置于特制的兔架上,用模拟测温探头的导管经肛门插入10 cm并固定,适应3 d,第4 d正式实验。
二、试剂和仪器:
大肠杆菌内毒素ET(serotype,055:B5)、α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide为Sigma公司产品,实验中试剂用无热原生理盐水(normal saline, NS)稀释。TNF-α由北京邦定医学生物公司提供。ST-型数字温度计为上海医用仪表厂生产。
, 百拇医药
三、体温测定:
实验时,将测温探头由肛门插入10 cm并固定,待体温稳定后,连续测定结肠温度3次,每次间隔10 min,取均数值为基础体温。注射试剂后分别记录结肠温度6 h、3 h。
四、侧脑室插管:
家兔用3%戊巴比妥钠1 mL/kg(iv)麻醉,在APO,L4-5或R4-5处颅骨钻孔,埋植有机玻璃底座,将外径1 mm带针蕊的塑料管经底座中间小孔插入H5水平,拔出针蕊,调整塑料管位置,见脑脊液徐缓上升,封闭其上段,缝合切口。术后肌注青霉素2×104 U/kg.d-1, 连续3 d, 第4 d进行实验。实验结束后,解剖兔脑,检查插管位置是否正确。
五、实验分组及步骤:
, 百拇医药
(一)观察α-MSH拮抗剂(antagonist, ANT)对家兔ET性发热的影响:实验分为4组,NS+NS组:侧脑室注射NS 20 μL,5 min后,静脉注射NS 1 mL/kg;NS+ET组:侧脑室注射NS 20 μL,5 min后再静注ET 1 mL/kg(0.4 μg/mL);ANT+ET组:侧脑室注射[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20μL(0.2μg/μL),静注ET 1 mL/kg(0.4 μg/mL);ANT+NS组: 侧脑室注射[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20 μL(0.2 μg/μL),静注NS 1 mL/kg。
(二)观察α-MSH拮抗剂对家兔TNF-α性发热的影响:实验分为4组,NS+NS组:侧脑室注射NS 20 μL,5 min后,后再注射NS 100μL;NS+TNF-α组:侧脑室注射NS 20 μL,5 min再注射TNF-α 100 μL(1 ng/μL);ANT+TNF-α组:侧脑室注射α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20 μL(0.2 μg/μL),再注射TNF-α 100 μL(1 ng/μL);ANT+NS组:侧脑室注射[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide 20 μL(0.2 μg/μL),再注射NS 100 μL。
, 百拇医药
六、体温反应指标及数据处理:
体温反应指标用平均体温反应曲线,3 h、6 h体温反应指数(thermal response index,TRI3、TRI6)表示。所有数据用
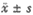 表示,组间比较用t检验。
表示,组间比较用t检验。结果
一、α-MSH拮抗剂对家兔ET性发热的影响:
静脉注射ET(0.4 μg/kg)引起家兔体温呈双相性升高,TRI6显著高于对照组(P<0.01)。事先侧脑室注射α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide(4 μg/只),再静脉注射ET(0.4 μg/kg),则ET发热效应明显增强,双相热峰值后移,热程延长,在记录的6 h内体温持续升高,其TRI6显著高于NS+ET组(P<0.01)。而ANT+NS组体温无明显改变(P>0.05)(表1、图1)。
, 百拇医药
表1 各组6 h体温反应指数的变化
Tab 1 The changes of six-hour thermal response index(TRI6)
among various groups (
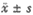 ) Group
) Groupn
TRI6
NS+NS
3
0.15±0.05
NS+ET
, 百拇医药
4
3.60±0.33*
ANT+ET
4
7.09±0.97*△
ANT+NS
3
0.25±0.24
*P<0.01,vs NS+NS group; △P<0.01,vs NS+ET group

Fig 1 Mean changes of colonic temperature among ET grous and orther groups
, 百拇医药
图1 各组平均体温反应曲线变化
二、观察α-MSH拮抗剂对家兔TNF-α性发热的影响:
表2、图2所示:侧脑室注射TNF-α(100 ng/只)可致家兔体温明显升高,TRI3显著高于对照组(P<0.01)。若事先侧脑室注射α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide(4 μg/只),再注射TNF-α(100 ng/只),则体温升高更明显,其TRI3显著高于NS+TNF-α组(P<0.01)。而ANT+NS组与NS+NS组之间TRI3无显著差异(P>0.05)。
表2 各组3 h体温反应指数的变化
Tab 2 The changes of three-hour thermal response
, http://www.100md.com
index (TRI3) among various groups (
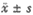 ) Group
) Groupn
TRI3
NS+NS
4
0.14±0.10
NS+ TNF-α
4
1.49±0.14*
ANT+TNF-α
, 百拇医药
4
2.54±0.43*△
ANT+NS
3
0.11±0.09
*P<0.01,vs NS+NS group; △P<0.01, vs NS+TNF-αgroup

Fig 2 Mean changes of colonic temperature among TNFα groups and orther groups
图2 各组平均体温反应曲线变化
, 百拇医药
讨论
本研究发现α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide对ET及TNF-α的发热反应均有显著的增强作用,在ET性发热过程中,改变最明显的是热程延长,6 h内体温持续不降,第二峰值显著升高。已知ET是主要的细菌致热原,参与或启动多种传染性发热。TNF则是主要内生致热原之一,参与多种发热的机制。因此,本实验的结果不仅证实α-MSH是有效的内源性解热物质,而且表明α-MSH在ET性发热以及多种发热过程中发挥了限制发热的作用。
本实验中观察到α-MSH拮抗剂[D-Trp7,Ala8,D-Phe10]α-MSH(6-11)-amide只增加发热反应的体温,对正常家兔体温无影响。这一结果与Samson等[5]在实验中的发现是一致的,即在IL-1性发热过程中,脑中隔α-MSH含量明显增加,而正常体温时,脑中隔α-MSH含量无显著变化。这说明中枢基础水平的α-MSH对控制正常体温不是必需的。我们先前的实验发现α-MSH可抑制中枢发热介质环-磷酸腺苷(cAMP)、促皮质激素释放激素(CRH)等的释放及促进中枢内源性解热物精氨酸加压素(AVP)的产生而控制发热反应[6~8]。在本实验中,[D-Trp7,Ala8,D-Phe10]α-SMD(6-11)-amide可能拮抗中枢内源性解热物α-MSH的这些作用,增强发热效应。从而也反过来证明α-MSH在限制发热过程中起着重要的负调节作用。
, 百拇医药
参考文献
1 Chiao H, Foster S, Yhomas R, et al. Alpha-melanocyte-stimulating hormone reduces endotoxin-induced liver inflammation. J Clin Invest, 1996, 97(9): 2038.
2 Kluger MJ. Fever: role of pyrogens and cryogens. Physiol Rev, 1991, 71(1):93.
3 Lipton JM, Catania A. α-MSH peptides modulate fever and inflammation. In: Bartfai T, Ottoson O. ed. "Neuroimmunology of fever". New York: Pergamon Press, 1992. 123 ~136.
, http://www.100md.com
4 de Lauro Castrucci AM, Sawyer TK, Al-Obeidi F, et al. Melanotropic peptide antagonists: Recent discoveries and biomedical implications. Drugs Future, 1990, 15:41.
5 Samson WK, Lipton JM, Zimmer JA, et al. The effect of fever on central α-MSH concentration in rabbit. Peptides, 1981, 2:419.
6 胡巢凤,王华东,王达安,等. α-MSH对IL-1β发热的解热机理研究. 生理学报, 1998,50(5):490.
7 胡巢凤,王彦平,王华东,等. α-MSH对EGTA发热的作用. 中国病理生理杂志,1999,15(4):299.
8 王华东,胡巢凤,王彦平,等. α-MSH对家兔ET性发热反应及脑腹中隔区AVP含量的影响.中国病理生理杂志,1998, 14(2):130.
(1998年10月5日收稿,1999年4月6日修回), 百拇医药