不同年龄段豚鼠螺旋蜗轴动脉的超微结构比较
作者:乔莉 王锦玲 邱建华 刘顺利
单位:第四军医大学西京医院耳鼻咽喉科 (西安710032)
关键词:豚鼠;耳蜗;螺旋蜗轴动脉
听力学及言语疾病杂志990406 【摘要】 目的 了解不同年龄段豚鼠耳蜗血管的差异。方法 采用透射电镜从亚微结构上观察不同年龄段豚鼠耳蜗微血管、血管内皮、肌层组织在解剖学上的差异。结果 幼鼠和成年鼠在形态学上差异不明显,而老龄豚鼠与成年豚鼠相比,血管腔明显扩大,血管壁形成皱折向血管腔内突起,内皮细胞增生,表面不光滑。血管壁外侧有髓神经纤维的髓鞘排列紊乱。结论 老龄豚鼠微血管结构的变化为其血管顺应性下降的研究奠定了形态学基础。
Ultrastructural Comparison of Spiral Modiolar Arteria of Guinea Pigs in Various Age Groups
, 百拇医药
Qiao Li, Wang Jinling,Qiu Jianhua,et al.
(Department of ENT, Xijing Hospital, Fourth Military Medical University, Xi'an, 710032)
【Abstract】 Objective To know the difference of cochlear vasculature from different age groups of guinea pigs.Methods To investigate the histological morphogenetic difference of cochlear microvasculature and the ultrastructures of the spiral modiolar arteria(SMA) guinea pigs from different age groups were observed under transmission electron microscope.Results There was no significant histological morphogenetic difference of SMA between the juvenile guinea pigs and the adult.Meanwhile,in the senile guinea pigs,the SMA markedly dilated;the vascular wall formed folds which processed intravascularly, with significant proliferation of the endotheliocytes appearancing with rough surface;the myelin sheatles of nerve fibers arranged disorderly in the external of vascular wall.Conclusion The characteristics of SMA might be the histological and morphogenetic base for the decreased compliance of cochlear microvasculature in the senile guinea pigs.
, 百拇医药
【Key words】 Guinea pig Cochlea Spiral modiolar arteria
螺旋蜗轴动脉(spiral modiolar arteria,SMA)是耳蜗供血的主要血管,在耳蜗血流的自主调节中起着重要的作用。Nakashima等[1]和Brown[2]分别研究了耳蜗血流与年龄之间的关系,发现幼鼠与老龄小鼠耳蜗血流的自主调节作用有着明显差异;幼鼠的蜗血流自主调节尚不成熟,而老龄鼠耳蜗血流明显下降。这些研究结果提示,耳蜗微血管的顺应性可能随动物年龄的增长而不同,但老龄动物耳蜗微血管顺应性降低的机制尚不清楚。因此实验中用豚鼠作为实验动物,结合透射电镜从亚微结构观察不同年龄段耳蜗微血管、血管内皮、肌层组织在解剖学上的差异,为进一步深入研究耳蜗血流的自主调节机制奠定基础。
1 材料与方法
选择耳廓反射灵敏、10~20天、4~5月及24月龄以上不同年龄段的雄性豚鼠各三只,巴比妥钠腹腔注射(30 mg/kg)麻醉后开胸,经左心室主动脉插管固定。先用200 ml生理盐水快速冲出血液,再用0.1 mol/L磷酸缓冲液(PB.pH7.4)配制的4%多聚甲醛、0.5%戊二醛混合固定液600 ml,快速低温灌注400 ml后,缓慢滴注40分钟。取下颞骨,打开听泡,解剖显微镜下去除骨性耳蜗,取出蜗轴,在听神经表面分离蜗轴螺旋动脉及主要分支。将此动脉置入10%饿酸,于室温下饿化30~60分钟,50%、70%酒精脱水(10 min×2),1%醋酸铀(溶于70%酒精)4℃下过夜,上升梯度逐级脱水后,置于100%酒精与环氧丙烷混合液中(1:1)及环氧丙烷各10分钟。再用环氧丙烷与环氧树脂(Epon 812)的不同比例混合液(1:1,1:3,纯树酯)室温下分别浸透1、2及3小时、超薄切片铅染后,在JEM-200EX透射电镜下观察。
, 百拇医药
2 结果
幼年豚鼠螺旋蜗轴动脉(SMA)内皮细胞排列整齐,大小基本一致,细胞腔面有数量较少的突起、表面光滑、胞浆可见数量及大小不等的泡状物、线粒体数量较少。细胞间的紧密连接稀疏,基膜及肌层较薄(图1)。成年豚鼠SMA血管内皮细胞排列较整齐,细胞腔面微突起丰富,胞浆内线粒体数量较多(图2)。在血管外侧尚可见数量较多的有髓神经纤维,环形髓鞘排列整齐(图3)。幼年及成年豚鼠SMA在亚微结构上差异不大。老年豚鼠SMA内皮细胞表面不光滑,厚薄不匀、血管内皮皱折,凹陷或突起(图4),可见内皮细胞增生,向血管腔内突起,增生的内皮细胞核染色含量丰富、线粒体数量较多(图5),血管外侧也可见有髓神经纤维的髓鞘,但髓鞘排列紊乱(图6)。


, 百拇医药
图1 幼年豚鼠SMA分支血管,内皮细胞腔面光滑,有短突起,胞浆内泡状结构较少x1360
图2 成年豚鼠SMA,内皮细胞排列较整齐,细胞腔面突起丰富,胞浆线粒体较多x2730
图3 成年豚鼠SMA,血管壁外侧可见数量较多的骨髓神经纤维,环形髓鞘排列整齐x1490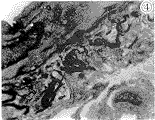


图4 老年豚鼠SMA,内皮细胞表面不光滑,厚薄不匀,向管腔皱折,凹陷或突起x19100
图5 老年豚鼠SMA,内皮细胞增生,向管腔内突起,增生的内皮细胞核染色质含量丰富,线粒体数量较多x1890
, http://www.100md.com
图6 老年豚鼠SMA,血管外膜及肌层可见有髓神经纤维,髓鞘排列吝到x4640。3 讨论
研究表明在老龄豚鼠与成年及幼龄豚鼠在SMA内皮细胞亚微结构上有明显的区别,主要有三点:①老龄豚鼠血管内皮细胞有明显的增生现象,且向腔内突起;②内皮细胞表面及SMA管腔出现明显的皱折、凹陷及突起;③SMA血管外膜及肌层内的有髓神经纤维髓鞘排列紊乱。老龄豚鼠SMA亚微结构上的变化,可能对耳蜗微循环有明显的影响。Brown[2]曾采用老龄C57BL/6小鼠作为实验动物,用激光多谱勒血流测定仪观察耳蜗血流并检测耳蜗微血管的顺应性,发现在圆窗应用血管扩张剂(sodium nitroprusside),耳蜗微血管顺应性反应无论在用药时或用药后都较对照组(青年组)明显下降。应用血管扩张剂后实验组耳蜗血流增加28%,而对照组超过40%,表明老龄小鼠耳蜗微血管对血管扩张剂的顺应性明显降低,但实验组与对照组在听生理方面无明显的差异,结合该研究的结果,提示老龄豚鼠耳蜗微血管顺应性的下降、对血管扩张剂的反应减退,有一定形态学的基础,而这种形态的变化,在一定程度上可能并不引起听功能的障碍,但受到诸如噪声、糖尿病、高血压[3]、高血脂、椎基底动脉缺血[4]等病理因素的作用后,在耳蜗血管顺应性降低的基础上,自主调节能力下降,可致耳蜗结构出现明显的缺血性损伤及听功能的障碍。
, http://www.100md.com
Hillerdal等[3](1987)采用微球法对青年大鼠(3~6月)及老年大鼠(18~24月)正常血压及自发性高血压耳蜗血流进行了测定,发现正常血压的青年大鼠耳蜗血流1.6 μL/min,自发性高血压时耳蜗血流1.51 μL/min。而老年大鼠分别是1.40 μL/min和1.29 μL/min。这些数据在年龄分组及血压分组统计学上都没有差异。但随着大鼠年龄的增加,耳蜗血流有减少的趋势,特别是在自发性高血压大鼠。年青正常血压大鼠与老年自发性高血压大鼠耳蜗血流则存在明显的差异,同时后者们有明显的耳蜗Corti器的形态学的改变。但作者并未阐明产生这一结果的原因。该研究从不同年龄豚鼠蜗轴螺旋动脉亚微结构的研究发现,老龄豚鼠较幼年及青年豚鼠SMA形态学上的变化,诸如内皮细胞向腔内增生、血管内皮呈多皱折状等都与耳蜗血流缓慢、减少等有关。这些形态学上的改变可能是产生这一现象的原因之一。
从耳蜗血管解剖学的研究来看,螺旋蜗轴动脉呈螺旋状与耳蜗圈一起上升,沿途等距离分出外上、中、内下放射状动脉,外上放射状动脉多次呈“∞”形沿前庭顶部到达螺旋韧带上缘、形成四个互不吻合、结构独立的毛细血管网;外中放射状动脉走向骨螺旋板、基底膜,形成丰富的蜗丛;内下放射状动脉分布于蜗轴壁、螺旋神经节及听神经等处,血管分布具有明显的节段性和区域性。这就决定了耳蜗血流的特点:血流缓慢而平稳,在维持耳蜗敏感度方面可能具有重要的作用;弹簧样血管结构是保持耳蜗局部血流自我调节稳定的解剖结构的基础。但从流体力学上来看,在血管分叉或弯曲处,管壁受流动的低切变应力作用,血流存在旋涡区,再加上血管较细、血流缓慢、径路较长,易发生血流淤滞和脂质物质的沉积。此外,耳蜗血管侧枝循环较少,一旦发生堵塞,不易代偿,易造成耳蜗微循环的障碍及耳蜗病理性的损害。耳蜗微血管解剖结构及血液动力学的特殊性,决定了耳蜗血流在接受精细调节的基础上,又易发生耳蜗微循环的障碍。结果中,对于老龄豚鼠来说,SMA及其分支亚微结构上内皮细胞出现明显的增生现象,血管腔出现明显的皱折、凹陷及突起则可进一步地减缓血流、发生瘀积、造成耳蜗供血的障碍。
, 百拇医药
目前对老年豚鼠内皮细胞增生的原因尚不清楚。但耳蜗微血管内皮细胞的增生至少有两个方面的作用,一方面可使管腔变小、影响耳蜗血流的血液动力学,另一方面可能是耳蜗微血管内皮细胞既参与介导血管扩张反应[6],又参与介导血管收缩反应[7],并与周围神经有营养性的相互作用。例如,兔耳动脉去交感神经和感觉神经2~8周后,对乙酰胆碱的内皮依赖性血管舒张反应显著降低[8];然而硝普钠(为非内皮依赖性)引起的最大舒张反应则不受影响。说明反应性的降低并非由于肌肉舒张能力受损。长期去交感神经也可使兔脑动脉对高碳酸血症、低氧血症及5-MT的敏感性增高[9]。结合文中的结果,提示老年豚鼠耳蜗微血管内皮细胞的增生,可能是一种保护或代偿机制,对调节耳蜗血流可能具有重要的作用,但耳蜗血管内皮细胞的增生对血液动力学的影响亦不容忽视。
耳蜗血管受交感神经及感觉神经的调节也为很多实验所证实[10]。交感神经的节后纤维及感觉神经的C类纤维多为无髓鞘纤维、其终末主要位于血管外膜及平滑肌层,感受血管运动的张力变化及调整血管收缩、舒张的状态。研究发现豚鼠螺旋蜗轴动脉的外膜及肌层有数量较多的有髓神经髓鞘结构,青年豚鼠髓鞘结构是环状,排列整齐有序,而老年豚鼠髓鞘结构排列紊乱。SMA分支动脉的外膜及肌层无神经纤维的髓鞘样结构。这一结果提示豚鼠SMA有髓神经纤维的起源尚不清楚,但有髓神经纤维可能参与了耳蜗微循环的调节,并使这种神经调节方式更加快捷,能更好地适应耳蜗微循环改变所提供的信息。
, http://www.100md.com
4 参考文献
1 Nakashima T,Miller JM,Nuttall AL.Autoregulation of cochlear blood flow in young and aged mice.Eur Arch Otorhinolaryngol,1995,252:308.
2 Brown JN, Miller JM,Nuttall AL.Age-related changes in cochlear vascular conductance in mice.Hear Res,1995,86:189.
3 Hillerdal M,Borg E,Engstrom B,et al.Cochlear blood flow in relation to age in normotersive and spontaneously hypertensive rats. Acta Otolaryngol(Stockh),1987,104:243.
, 百拇医药
4 张素珍,杨伟炎,张萍,等.椎-基底动脉供血不足性眩晕.中华耳鼻咽喉科杂志,1993,28:138.
5 Milner P,Ralevic V,Hopwood AM,et al.Ultrastructural localization of substance P and choline acetyltransferase in endothelia cells of rat coronary artery and release of substance P and acetylcholine during hypoxia. Experientia,1989,45:121.
6 Mione MC,Ralevic V,Burnstock G.Peptides and vasomotor mechanisms.Pharmacol Ther, 1990,46:429.
7 Katusic ZS,Shepherd JT,Vanhoutte PM.Potassium-induced endothelium-dependent rhythmic activity in the canine basilar artery.J Cardiovasc Pharmacol,1987,12:37.
, http://www.100md.com
8 Mangiarua EI,Bevan RD.Altered endothelium-mediated relaxation after denev ration of growing rabbit ear artery.Eur J Pharmacol,1986,122:149.
9 Aubinea P,Pearce W,Rebnier-Rebuffei AM,et al. Long-term sympathetic denervation increases sensitivity of cerebral arteries to CO2 and 5-HT in vitro.J Cereb Blood Flow Metab, 1989,9(Suppl):2506.
10 Ren TY, Laurikainen E, Quirk WS,et al.Effects of stellate ganglion stimulation of bilateral cochlear blood flow.Ann Otol Rhinol Laryngol,1993,102:378.
(1998-12-24收稿 1999-01-14修回)
, http://www.100md.com
单位:第四军医大学西京医院耳鼻咽喉科 (西安710032)
关键词:豚鼠;耳蜗;螺旋蜗轴动脉
听力学及言语疾病杂志990406 【摘要】 目的 了解不同年龄段豚鼠耳蜗血管的差异。方法 采用透射电镜从亚微结构上观察不同年龄段豚鼠耳蜗微血管、血管内皮、肌层组织在解剖学上的差异。结果 幼鼠和成年鼠在形态学上差异不明显,而老龄豚鼠与成年豚鼠相比,血管腔明显扩大,血管壁形成皱折向血管腔内突起,内皮细胞增生,表面不光滑。血管壁外侧有髓神经纤维的髓鞘排列紊乱。结论 老龄豚鼠微血管结构的变化为其血管顺应性下降的研究奠定了形态学基础。
Ultrastructural Comparison of Spiral Modiolar Arteria of Guinea Pigs in Various Age Groups
, 百拇医药
Qiao Li, Wang Jinling,Qiu Jianhua,et al.
(Department of ENT, Xijing Hospital, Fourth Military Medical University, Xi'an, 710032)
【Abstract】 Objective To know the difference of cochlear vasculature from different age groups of guinea pigs.Methods To investigate the histological morphogenetic difference of cochlear microvasculature and the ultrastructures of the spiral modiolar arteria(SMA) guinea pigs from different age groups were observed under transmission electron microscope.Results There was no significant histological morphogenetic difference of SMA between the juvenile guinea pigs and the adult.Meanwhile,in the senile guinea pigs,the SMA markedly dilated;the vascular wall formed folds which processed intravascularly, with significant proliferation of the endotheliocytes appearancing with rough surface;the myelin sheatles of nerve fibers arranged disorderly in the external of vascular wall.Conclusion The characteristics of SMA might be the histological and morphogenetic base for the decreased compliance of cochlear microvasculature in the senile guinea pigs.
, 百拇医药
【Key words】 Guinea pig Cochlea Spiral modiolar arteria
螺旋蜗轴动脉(spiral modiolar arteria,SMA)是耳蜗供血的主要血管,在耳蜗血流的自主调节中起着重要的作用。Nakashima等[1]和Brown[2]分别研究了耳蜗血流与年龄之间的关系,发现幼鼠与老龄小鼠耳蜗血流的自主调节作用有着明显差异;幼鼠的蜗血流自主调节尚不成熟,而老龄鼠耳蜗血流明显下降。这些研究结果提示,耳蜗微血管的顺应性可能随动物年龄的增长而不同,但老龄动物耳蜗微血管顺应性降低的机制尚不清楚。因此实验中用豚鼠作为实验动物,结合透射电镜从亚微结构观察不同年龄段耳蜗微血管、血管内皮、肌层组织在解剖学上的差异,为进一步深入研究耳蜗血流的自主调节机制奠定基础。
1 材料与方法
选择耳廓反射灵敏、10~20天、4~5月及24月龄以上不同年龄段的雄性豚鼠各三只,巴比妥钠腹腔注射(30 mg/kg)麻醉后开胸,经左心室主动脉插管固定。先用200 ml生理盐水快速冲出血液,再用0.1 mol/L磷酸缓冲液(PB.pH7.4)配制的4%多聚甲醛、0.5%戊二醛混合固定液600 ml,快速低温灌注400 ml后,缓慢滴注40分钟。取下颞骨,打开听泡,解剖显微镜下去除骨性耳蜗,取出蜗轴,在听神经表面分离蜗轴螺旋动脉及主要分支。将此动脉置入10%饿酸,于室温下饿化30~60分钟,50%、70%酒精脱水(10 min×2),1%醋酸铀(溶于70%酒精)4℃下过夜,上升梯度逐级脱水后,置于100%酒精与环氧丙烷混合液中(1:1)及环氧丙烷各10分钟。再用环氧丙烷与环氧树脂(Epon 812)的不同比例混合液(1:1,1:3,纯树酯)室温下分别浸透1、2及3小时、超薄切片铅染后,在JEM-200EX透射电镜下观察。
, 百拇医药
2 结果
幼年豚鼠螺旋蜗轴动脉(SMA)内皮细胞排列整齐,大小基本一致,细胞腔面有数量较少的突起、表面光滑、胞浆可见数量及大小不等的泡状物、线粒体数量较少。细胞间的紧密连接稀疏,基膜及肌层较薄(图1)。成年豚鼠SMA血管内皮细胞排列较整齐,细胞腔面微突起丰富,胞浆内线粒体数量较多(图2)。在血管外侧尚可见数量较多的有髓神经纤维,环形髓鞘排列整齐(图3)。幼年及成年豚鼠SMA在亚微结构上差异不大。老年豚鼠SMA内皮细胞表面不光滑,厚薄不匀、血管内皮皱折,凹陷或突起(图4),可见内皮细胞增生,向血管腔内突起,增生的内皮细胞核染色含量丰富、线粒体数量较多(图5),血管外侧也可见有髓神经纤维的髓鞘,但髓鞘排列紊乱(图6)。



, 百拇医药
图1 幼年豚鼠SMA分支血管,内皮细胞腔面光滑,有短突起,胞浆内泡状结构较少x1360
图2 成年豚鼠SMA,内皮细胞排列较整齐,细胞腔面突起丰富,胞浆线粒体较多x2730
图3 成年豚鼠SMA,血管壁外侧可见数量较多的骨髓神经纤维,环形髓鞘排列整齐x1490



图4 老年豚鼠SMA,内皮细胞表面不光滑,厚薄不匀,向管腔皱折,凹陷或突起x19100
图5 老年豚鼠SMA,内皮细胞增生,向管腔内突起,增生的内皮细胞核染色质含量丰富,线粒体数量较多x1890
, http://www.100md.com
图6 老年豚鼠SMA,血管外膜及肌层可见有髓神经纤维,髓鞘排列吝到x4640。3 讨论
研究表明在老龄豚鼠与成年及幼龄豚鼠在SMA内皮细胞亚微结构上有明显的区别,主要有三点:①老龄豚鼠血管内皮细胞有明显的增生现象,且向腔内突起;②内皮细胞表面及SMA管腔出现明显的皱折、凹陷及突起;③SMA血管外膜及肌层内的有髓神经纤维髓鞘排列紊乱。老龄豚鼠SMA亚微结构上的变化,可能对耳蜗微循环有明显的影响。Brown[2]曾采用老龄C57BL/6小鼠作为实验动物,用激光多谱勒血流测定仪观察耳蜗血流并检测耳蜗微血管的顺应性,发现在圆窗应用血管扩张剂(sodium nitroprusside),耳蜗微血管顺应性反应无论在用药时或用药后都较对照组(青年组)明显下降。应用血管扩张剂后实验组耳蜗血流增加28%,而对照组超过40%,表明老龄小鼠耳蜗微血管对血管扩张剂的顺应性明显降低,但实验组与对照组在听生理方面无明显的差异,结合该研究的结果,提示老龄豚鼠耳蜗微血管顺应性的下降、对血管扩张剂的反应减退,有一定形态学的基础,而这种形态的变化,在一定程度上可能并不引起听功能的障碍,但受到诸如噪声、糖尿病、高血压[3]、高血脂、椎基底动脉缺血[4]等病理因素的作用后,在耳蜗血管顺应性降低的基础上,自主调节能力下降,可致耳蜗结构出现明显的缺血性损伤及听功能的障碍。
, http://www.100md.com
Hillerdal等[3](1987)采用微球法对青年大鼠(3~6月)及老年大鼠(18~24月)正常血压及自发性高血压耳蜗血流进行了测定,发现正常血压的青年大鼠耳蜗血流1.6 μL/min,自发性高血压时耳蜗血流1.51 μL/min。而老年大鼠分别是1.40 μL/min和1.29 μL/min。这些数据在年龄分组及血压分组统计学上都没有差异。但随着大鼠年龄的增加,耳蜗血流有减少的趋势,特别是在自发性高血压大鼠。年青正常血压大鼠与老年自发性高血压大鼠耳蜗血流则存在明显的差异,同时后者们有明显的耳蜗Corti器的形态学的改变。但作者并未阐明产生这一结果的原因。该研究从不同年龄豚鼠蜗轴螺旋动脉亚微结构的研究发现,老龄豚鼠较幼年及青年豚鼠SMA形态学上的变化,诸如内皮细胞向腔内增生、血管内皮呈多皱折状等都与耳蜗血流缓慢、减少等有关。这些形态学上的改变可能是产生这一现象的原因之一。
从耳蜗血管解剖学的研究来看,螺旋蜗轴动脉呈螺旋状与耳蜗圈一起上升,沿途等距离分出外上、中、内下放射状动脉,外上放射状动脉多次呈“∞”形沿前庭顶部到达螺旋韧带上缘、形成四个互不吻合、结构独立的毛细血管网;外中放射状动脉走向骨螺旋板、基底膜,形成丰富的蜗丛;内下放射状动脉分布于蜗轴壁、螺旋神经节及听神经等处,血管分布具有明显的节段性和区域性。这就决定了耳蜗血流的特点:血流缓慢而平稳,在维持耳蜗敏感度方面可能具有重要的作用;弹簧样血管结构是保持耳蜗局部血流自我调节稳定的解剖结构的基础。但从流体力学上来看,在血管分叉或弯曲处,管壁受流动的低切变应力作用,血流存在旋涡区,再加上血管较细、血流缓慢、径路较长,易发生血流淤滞和脂质物质的沉积。此外,耳蜗血管侧枝循环较少,一旦发生堵塞,不易代偿,易造成耳蜗微循环的障碍及耳蜗病理性的损害。耳蜗微血管解剖结构及血液动力学的特殊性,决定了耳蜗血流在接受精细调节的基础上,又易发生耳蜗微循环的障碍。结果中,对于老龄豚鼠来说,SMA及其分支亚微结构上内皮细胞出现明显的增生现象,血管腔出现明显的皱折、凹陷及突起则可进一步地减缓血流、发生瘀积、造成耳蜗供血的障碍。
, 百拇医药
目前对老年豚鼠内皮细胞增生的原因尚不清楚。但耳蜗微血管内皮细胞的增生至少有两个方面的作用,一方面可使管腔变小、影响耳蜗血流的血液动力学,另一方面可能是耳蜗微血管内皮细胞既参与介导血管扩张反应[6],又参与介导血管收缩反应[7],并与周围神经有营养性的相互作用。例如,兔耳动脉去交感神经和感觉神经2~8周后,对乙酰胆碱的内皮依赖性血管舒张反应显著降低[8];然而硝普钠(为非内皮依赖性)引起的最大舒张反应则不受影响。说明反应性的降低并非由于肌肉舒张能力受损。长期去交感神经也可使兔脑动脉对高碳酸血症、低氧血症及5-MT的敏感性增高[9]。结合文中的结果,提示老年豚鼠耳蜗微血管内皮细胞的增生,可能是一种保护或代偿机制,对调节耳蜗血流可能具有重要的作用,但耳蜗血管内皮细胞的增生对血液动力学的影响亦不容忽视。
耳蜗血管受交感神经及感觉神经的调节也为很多实验所证实[10]。交感神经的节后纤维及感觉神经的C类纤维多为无髓鞘纤维、其终末主要位于血管外膜及平滑肌层,感受血管运动的张力变化及调整血管收缩、舒张的状态。研究发现豚鼠螺旋蜗轴动脉的外膜及肌层有数量较多的有髓神经髓鞘结构,青年豚鼠髓鞘结构是环状,排列整齐有序,而老年豚鼠髓鞘结构排列紊乱。SMA分支动脉的外膜及肌层无神经纤维的髓鞘样结构。这一结果提示豚鼠SMA有髓神经纤维的起源尚不清楚,但有髓神经纤维可能参与了耳蜗微循环的调节,并使这种神经调节方式更加快捷,能更好地适应耳蜗微循环改变所提供的信息。
, http://www.100md.com
4 参考文献
1 Nakashima T,Miller JM,Nuttall AL.Autoregulation of cochlear blood flow in young and aged mice.Eur Arch Otorhinolaryngol,1995,252:308.
2 Brown JN, Miller JM,Nuttall AL.Age-related changes in cochlear vascular conductance in mice.Hear Res,1995,86:189.
3 Hillerdal M,Borg E,Engstrom B,et al.Cochlear blood flow in relation to age in normotersive and spontaneously hypertensive rats. Acta Otolaryngol(Stockh),1987,104:243.
, 百拇医药
4 张素珍,杨伟炎,张萍,等.椎-基底动脉供血不足性眩晕.中华耳鼻咽喉科杂志,1993,28:138.
5 Milner P,Ralevic V,Hopwood AM,et al.Ultrastructural localization of substance P and choline acetyltransferase in endothelia cells of rat coronary artery and release of substance P and acetylcholine during hypoxia. Experientia,1989,45:121.
6 Mione MC,Ralevic V,Burnstock G.Peptides and vasomotor mechanisms.Pharmacol Ther, 1990,46:429.
7 Katusic ZS,Shepherd JT,Vanhoutte PM.Potassium-induced endothelium-dependent rhythmic activity in the canine basilar artery.J Cardiovasc Pharmacol,1987,12:37.
, http://www.100md.com
8 Mangiarua EI,Bevan RD.Altered endothelium-mediated relaxation after denev ration of growing rabbit ear artery.Eur J Pharmacol,1986,122:149.
9 Aubinea P,Pearce W,Rebnier-Rebuffei AM,et al. Long-term sympathetic denervation increases sensitivity of cerebral arteries to CO2 and 5-HT in vitro.J Cereb Blood Flow Metab, 1989,9(Suppl):2506.
10 Ren TY, Laurikainen E, Quirk WS,et al.Effects of stellate ganglion stimulation of bilateral cochlear blood flow.Ann Otol Rhinol Laryngol,1993,102:378.
(1998-12-24收稿 1999-01-14修回)
, http://www.100md.com