奥曲肽治疗肢端肥大症
作者:张壹言 顾明君
单位:中国人民解放军第二军医大学附属长征医院内分泌科,上海200003
关键词:奥曲肽;肢端巨大症;促生长素;激素类
中国新药与临床杂志990219 摘要 奥曲肽能有效抑制肢端肥大症病人生长激素的自发性过度分泌 。本文综述了治疗肢端肥大症的临床效果,对内分泌、心功能及代谢的影响,以及治疗剂 量、给药方式和不良反应等方面的研究进展。
奥曲肽(octreotide)是人工合成的长效生长抑素类似物,80年代中期开始用于治疗肢端肥大症。其特点是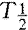 长,对多种内分泌激素有较强抑制作用。本文就奥曲肽治疗肢端肥大症的临床应用进展作简要综述。
长,对多种内分泌激素有较强抑制作用。本文就奥曲肽治疗肢端肥大症的临床应用进展作简要综述。
临床效果 肢端肥大症病人的生长激素(growth hormone,GH)长期过度分泌,导致软组织、骨骼和内脏等组织增生肥大。奥曲肽能明显改善临床症状和体征。Newman等[1]报道84例肢端肥大症病人,经奥曲肽治疗12mo后,头痛、多汗及关节痛缓解率分别为95%,87%及83%。Hanse等[2]报道10例病人,奥曲肽治疗4wk,体重平均减轻(2.5±0.4)kg,足的体积平均减少(44.5±1.8) mm3,手指环径平均缩小(1.3±0.3)mm。体重减轻的机制可能是体液容量的减少或GH诱导的合成代谢被抑制。对于需手术切除的垂体GH腺瘤病人,术前奥曲肽治疗可使多数瘤组织软化,与正常组织分界清晰,易于手术摘除。而且术后内分泌激素水平恢复正常的比例高于未接受奥曲肽治疗而直接手术者。切除的瘤体经组织学分析,无明显纤维化和坏死灶;免疫组织化学分析提示瘤内的GH与对照无明显差异[3]。对于手术不能完全清除的浸润蝶鞍旁海绵窦内的垂体GH大腺瘤,经大剂量奥曲肽(1500μg/d)治疗后,瘤体缩小、头痛消失[4]。
, http://www.100md.com
对生长激素(GH)和胰岛素样生长因子I的作用 奥曲肽能明显降低血清GH和胰岛素样生长因子I(insulin-like growth factor-I,IGF-I)的水平。经奥曲肽治疗后约94 %的病人GH呈下降趋势,50%以上病人IGF-I降低至正常[5]。Mcknight等[6] 对应用奥曲肽治疗的 8 名肢端肥大症病人进行了长达 4 a的治疗观察:治疗前,血清GH 平均 水平为(36±9) mU/L; 治疗后GH明显下降,4 a中GH平均水平为(9.4±2.1) mU/L,血浆IGF-I浓 度持续受抑制,半数病人在治疗期间一直维持在正常范围内。Newman等[1]对奥曲 肽治疗前后的情况进行比较:病人血清GH水平从治疗前的(31±6) μg/L降至(5.7±0.9)μg/L。在平均24mo(3~30mo)的治疗期间,65%的病人GH水平降至5μg/L以上,40%的病人低于2μg/L,所有病人GH水平均有明显降低(P<0.001)。血浆IGF-I浓度 从治疗前的(5200±300)U/L抑制到(2200±200)U/L。在接受12~30mo治疗的病人中,血浆IGF-I浓度在治疗过程中控制在正常范围内的占64%。Herder等[7] 报道奥曲肽能升高循环系统中IGF-I 结合蛋白I(insulin-like growth factor binding protein-I,IGFBP-I)的水平 。24 h血清IGFBP-I在奥曲肽治疗后升高37.4倍。奥曲肽的此项诱导作用不依赖于GH腺瘤上 生长抑素受体数目。推测IGFBP-I能抑制IGF-I的生物学活性。
, 百拇医药
奥曲肽不仅抑制GH释放,降低血中GH水平,而且抑制垂体腺瘤内GH生物合成。研究发现:奥 曲肽治疗后的病人GH基因表达受限,GHmRNA总量明显低于未接受治疗病人的水平[3] 。与生长抑素比较,后者不能改变GHmRNA的水平。这可能是奥曲肽明显抑制GH的机制之一 。
此外,奥曲肽与溴隐亭联合应用对GH和IGF-I的抑制作用更强[8]。单用奥曲肽GH和IGF-I分别降至初始水平的23%和32%,联合应用后,分别抑制到16%和25%。
以上研究表明,奥曲肽适用于肢端肥大症的长期治疗,能达到有效抑制GH和IGF-I浓度的要 求。对垂体GH瘤有较强的抑制其分泌作用。病人耐受性较好,仅有个别病例治疗一段时间后,对奥曲肽敏感性降低,甚至丧失,不必做长期,无效治疗[9]。需引起注意的是 :经奥曲肽治疗使GH和IGF-I水平恢复正常者,停药后会发生反复。Plockinger等[10]报道8例经奥曲肽治疗42mo的病人,GH与IGF-I平均水平分别降为(2.6±0.7)μg/L和( 0.8 ±0.1)×103IU/L。终止治疗后,分别回升到(5.6±1.1)μg/L和(2.5±1.0)×103IU /L。鉴于此种情况,病人可能需终身接受奥曲肽治疗才能控制病情。而且治疗前血清GH浓度越高 ,IGF-I恢复至正常范围的可能性越小。
, http://www.100md.com
对心脏的影响 对于左室肥大,舒张期灌流异常的肢端肥大症病人,奥曲肽可以改善心脏异常状况。Merola等[11]对11例病人给予奥曲肽治疗6mo后,左室质量指数(mass index)从(138±11)g/m2降至(116±13)g/m2,平均室壁厚度与舒张末心室内径比从(0.47±0.1)降至(0.44±0.1),右室灌注早期与晚期峰值比率从(1.000±0.010)升至(1.30±0.10)。左右室舒张期灌流的改善,对左心收缩功能无不良影响。经奥曲肽治疗,病人平静状态收缩期和舒张期心功能指数明显提高。乏氧阈和最大活动时工作负荷、耗氧量均增加[12]。Padayatty等[13]报道,奥曲肽治疗12mo后,病人平静时心率减慢。活动时间从(637±137)s提高至(787±101)s。做功从(9.0±3.3)提高至(11.9±2.7)代谢当量 。病人心功能改善,有利于降低并发心血管疾病的死亡率。
对钙和磷代谢的影响 肢端肥大症病人常表现有血清钙和磷的轻度升高,可能是由于GH或IGF-I调节小肠吸收所致。Fredstorp等[14]对10例病人经奥曲肽治 疗32mo后,血清钙、磷分别从(2.42±0.04) mmol/L 和 (1.40 ± 0.07) mmol/L 降至 (2 .32 ± 0.04)mmol/L和(1.24±0.07) mmol/L。血清甲状旁腺素水平从(21±5)μg/L上升至(40±8)μg/L 。但未观察到碱性磷酸酶、维生素D和维生素D结合蛋白浓度的改变。James等[15]认为:奥曲肽对钙、磷的调节作用不受GH对小肠吸收刺激作用的干扰。
, 百拇医药
对糖代谢的作用 其主要作用表现在2个方面:多数病例报道奥曲肽改善糖代谢。部分伴有糖尿病的病人经奥曲肽治疗,胰岛素或口服降糖药的用量可减少;部分糖耐量减低病人治疗后可恢复正常。作用机制可能是奥曲肽抑制循环中GH和胰高血糖素浓度,增强胰岛素抑制肝糖原分解作用,抑制胃肠道吸收葡萄糖[1]。也有奥曲肽致糖代谢紊乱的报道:治疗期间血清胰岛素对血糖升高的应答机制受抑制,血糖浓度升高或原有糖耐量受损进一步加重,大剂量奥曲肽治疗中,糖耐量正常者出现糖耐量减低或糖尿病[16]。个别病例甚至发生酮症酸中毒而死亡。
治疗剂量与给药方式 一般初始剂量为50~100μg/8h,以后用量可根据 血中GH和IGF-I的抑制水平增加,最大剂量可达1500μg/d。最小有效剂量为150μg/d。约 50%以上的病人经6mo治疗后,GH及IGF-I的水平可降至正常范围。剂量过高并不能给病人带来相应的疗效。
给药方式通常采用间歇皮下注射,每日3次,其优点是简便,病人易于接受。缺点是血清GH 波动明显,在下次给药前GH有上升趋势。还存在GH下降缓慢、所需药量大[17,18]。应用持续皮下输注可减少GH水平的波动。在疗效相似的前提下比间歇皮下注射方式给药量减少,不良反应也少。缺点是病人活动受限。脉冲给药方式,剂量25μg/h,该方式 不仅具有GH水平波动少,不良反应小的优点,而且对GH和IGF-I的控制更好[17 ]。
, 百拇医药
不良反应 长期应用奥曲肽的不良反应主要是引起胆结石。发生率约占接受治疗者总数的12%至60%[1]。另有部分病人发生胆汁淤积。胆结石发生的主要机制可能是奥曲肽直接抑制胆囊的收缩功能,或奥曲肽抑制胆囊收缩素的分泌而致胆囊排空受抑,餐后胆囊容积增加,胆汁潴留、浓缩,形成沉积物及析出胆固醇结晶,产生结石核心而致结石发生[19,20]。已有结石形成的病人多数无症状。停用奥曲肽后,胆囊收缩功能可恢复正常,结石自行消失。但用药时间越长,胆囊功能恢复越困难。预防胆结石发生可采用餐后给药、与熊去氧胆酸(ursodesoxycholic acid)联合使用、间断给药等措施。选用 持续皮下输注或脉冲给药方式也可降低胆结石的发生率。
其他不良反应轻微,如恶心、腹胀、腹泻,多由于奥曲肽抑制胃肠道运动和吸收功能所致。这些不良反应可在给药一段时间后自行缓解。症状明显者,短暂停药后可能好转。Nakauchi 等[21]还报道了一例女性病人,经奥曲肽治疗5mo后发生脱发,停药后恢复。
, http://www.100md.com
参考文献
1 Newman CB,Melmed S,Snyder PJ,et al.Safety and efficacy of long-term octreotide therapy of acromegaly: results of a multicente r trial in 103 patients-a clinical research center study.J Clin Endocrinol Meta b 1995; 80: 2768-75.
2 Hansen TB,Gram J,Bjerre P,Hagen C,Bollerslev J.Body composition in activ e acromegaly during treatment with octreotide: a double-blind,placebo-controlled cross-over study.Clin Endocrinol (Oxt) 1994; 41: 323-9.
, 百拇医药
3 Tsukamoto N,Nagaya T,Kuwayama A,et al.Octreotide treatment res ults in the inhibition of GH gene expression in the adenoma of the patients with acromegaly.Endocr J 1994; 41: 437-44.
4 Donckier J,Gilliard C,buysschaert M.Shrinkage of inoperable adenomas in cav ernous sinus with high-dose octreotide [letter].Lancet 1993; 342 (8866): 301.
5 Stewart PM,Kane KF,Stewart SE,Lancranjan I,Sheppard MC.Depot long-acting somatostatin analog (Sandostatin LAR) is an effective treatment for acromegaly.J Clin Endocrinol Metab 1995; 80: 3267-72.
, http://www.100md.com
6 McKnight JA,McCance DR,Sheridan B,Atkinson AB.Four years' treatment of re sistant acromegaly with octreotide.Eur J Endocrinol 1995; 132: 429-32.
7 de Herder WW,Uitterlinden P,van der Lely AJ,Hofland LJ,Lamberts SW.Octreo tide,but not bromocriptine,increases circulating insulin-like growth factor bi nding protein 1 levels in acromegaly.Eur J Endocrinol 1995; 133: 195-9.
8 Flogstad AK,Halse J,Grass P,et al.A comparison of octreotide,bromocriptine,or a combination of both drugs in acromegaly.J Clin Endocrinol M etab 1994; 79: 461-5.
, 百拇医药
9 Haraguchi K,Ohtaka M,Takazawa K,Endo T,Onaya T.Desensitization to somatos tatin analogue (Octreotide) observed in a patient with acromegaly.Endocr J 1995 ; 42: 295-300.
10 Plockinger U,Liehr RM,Quabbe HJ.Octreotide long term treatment of acromega ly: effect of drug withdrawal on serum growth hormone/insulin like growth factor -I concentrations and on serum gastrin/ 24 hour intragastric pH values.J Clin E ndocrinol Metab 1993; 77: 157-62.
, 百拇医药
11 Merola B,Cittadini A,Colao A,et al.Chronic treatment with the somatostatin analog octreotide inproves cardiac abnormalities in acromegaly.J Clin Endocrinol Metab 1993; 77: 790-3.
12 Giustina A,Boni E,Romanelli G,Grassi V,Giustina G.Cardiopulmonary perfor mance during exercise in acromegaly,and the effects of acute suppression of gro wth hormone hypersecretion with octreotide.Am J Cardiol 1995; 75: 1042-7.
13 padayatty SJ,Perrins EJ,Belchetz PE.Octreotide treatment increases exercis e capacity in patients with acromegaly.Eur J Endocrinol 1996; 134: 554-9.
, 百拇医药
14 Fredstorp L,pernow Y,Werner S.The short and long-term effects of octreotid e on calcium homeostasis in the patients with acromegaly.Clin Endocrinol (Oxf) 1993; 39: 331-6.
15 James RA,White MC,Chatterjee S,Kendall-Taylor P.The effect of octreotide treatment on serum calcium and phosphate levels in acromegaly.J Endocrinol 1993 ; 137 Suppl: 37.
16 McKnight JA,McCance DR,Crothers JG,Atkinson AB.Changes in glucose toleran ce and development of gall stones during high dose treatment with octreotide for acromegaly.Brit Med J 1989; 299: 604-5.
, http://www.100md.com
17 Giusti M,Cuttica CM,Cariola G,Vatenti S,Sessarego P,Giordano G.Treatmen t of acromegaly with octreotide: effectiveness and tolerability of its pulsatile administration by portable pump.Recenti Prog Med 1995; 86: 189-94.
18 Harris AG,Kokoris SP,Ezzat S.Continuous versus intermittent subcutaneous i n fusion of octreotide in the treatment of acromegaly.J Clin Pharmacol 1995; 35: 59-71.
19 Catnach SM,Anderson JV,Fairclough PD,et al.Effect of octreoti de on gall stone prevalence and gall bladdermotility in acromegaly.Gut 1993; 3 4: 270-3.
, 百拇医药
20 Stolk MF,van Erpecum KJ,Koppeschaar HP,et alEffect of octreo t ide on fasting gall bladder emptying,antroduodenalmotility,andmotilin releas e in acromegaly.Gut 1995; 36: 755-60.
21 Nakauchi Y,Kumon Y,Yamasaki H,Tahara K,Kurisaka M,Hashimoto K.Scalp hai r loss caused by octreotide in a patient with acromegaly: a case report.Endocr J 1995; 42: 385-9.
1997年2月28日收稿 1998年5月29日接受, 百拇医药
单位:中国人民解放军第二军医大学附属长征医院内分泌科,上海200003
关键词:奥曲肽;肢端巨大症;促生长素;激素类
中国新药与临床杂志990219 摘要 奥曲肽能有效抑制肢端肥大症病人生长激素的自发性过度分泌 。本文综述了治疗肢端肥大症的临床效果,对内分泌、心功能及代谢的影响,以及治疗剂 量、给药方式和不良反应等方面的研究进展。
奥曲肽(octreotide)是人工合成的长效生长抑素类似物,80年代中期开始用于治疗肢端肥大症。其特点是
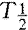 长,对多种内分泌激素有较强抑制作用。本文就奥曲肽治疗肢端肥大症的临床应用进展作简要综述。
长,对多种内分泌激素有较强抑制作用。本文就奥曲肽治疗肢端肥大症的临床应用进展作简要综述。临床效果 肢端肥大症病人的生长激素(growth hormone,GH)长期过度分泌,导致软组织、骨骼和内脏等组织增生肥大。奥曲肽能明显改善临床症状和体征。Newman等[1]报道84例肢端肥大症病人,经奥曲肽治疗12mo后,头痛、多汗及关节痛缓解率分别为95%,87%及83%。Hanse等[2]报道10例病人,奥曲肽治疗4wk,体重平均减轻(2.5±0.4)kg,足的体积平均减少(44.5±1.8) mm3,手指环径平均缩小(1.3±0.3)mm。体重减轻的机制可能是体液容量的减少或GH诱导的合成代谢被抑制。对于需手术切除的垂体GH腺瘤病人,术前奥曲肽治疗可使多数瘤组织软化,与正常组织分界清晰,易于手术摘除。而且术后内分泌激素水平恢复正常的比例高于未接受奥曲肽治疗而直接手术者。切除的瘤体经组织学分析,无明显纤维化和坏死灶;免疫组织化学分析提示瘤内的GH与对照无明显差异[3]。对于手术不能完全清除的浸润蝶鞍旁海绵窦内的垂体GH大腺瘤,经大剂量奥曲肽(1500μg/d)治疗后,瘤体缩小、头痛消失[4]。
, http://www.100md.com
对生长激素(GH)和胰岛素样生长因子I的作用 奥曲肽能明显降低血清GH和胰岛素样生长因子I(insulin-like growth factor-I,IGF-I)的水平。经奥曲肽治疗后约94 %的病人GH呈下降趋势,50%以上病人IGF-I降低至正常[5]。Mcknight等[6] 对应用奥曲肽治疗的 8 名肢端肥大症病人进行了长达 4 a的治疗观察:治疗前,血清GH 平均 水平为(36±9) mU/L; 治疗后GH明显下降,4 a中GH平均水平为(9.4±2.1) mU/L,血浆IGF-I浓 度持续受抑制,半数病人在治疗期间一直维持在正常范围内。Newman等[1]对奥曲 肽治疗前后的情况进行比较:病人血清GH水平从治疗前的(31±6) μg/L降至(5.7±0.9)μg/L。在平均24mo(3~30mo)的治疗期间,65%的病人GH水平降至5μg/L以上,40%的病人低于2μg/L,所有病人GH水平均有明显降低(P<0.001)。血浆IGF-I浓度 从治疗前的(5200±300)U/L抑制到(2200±200)U/L。在接受12~30mo治疗的病人中,血浆IGF-I浓度在治疗过程中控制在正常范围内的占64%。Herder等[7] 报道奥曲肽能升高循环系统中IGF-I 结合蛋白I(insulin-like growth factor binding protein-I,IGFBP-I)的水平 。24 h血清IGFBP-I在奥曲肽治疗后升高37.4倍。奥曲肽的此项诱导作用不依赖于GH腺瘤上 生长抑素受体数目。推测IGFBP-I能抑制IGF-I的生物学活性。
, 百拇医药
奥曲肽不仅抑制GH释放,降低血中GH水平,而且抑制垂体腺瘤内GH生物合成。研究发现:奥 曲肽治疗后的病人GH基因表达受限,GHmRNA总量明显低于未接受治疗病人的水平[3] 。与生长抑素比较,后者不能改变GHmRNA的水平。这可能是奥曲肽明显抑制GH的机制之一 。
此外,奥曲肽与溴隐亭联合应用对GH和IGF-I的抑制作用更强[8]。单用奥曲肽GH和IGF-I分别降至初始水平的23%和32%,联合应用后,分别抑制到16%和25%。
以上研究表明,奥曲肽适用于肢端肥大症的长期治疗,能达到有效抑制GH和IGF-I浓度的要 求。对垂体GH瘤有较强的抑制其分泌作用。病人耐受性较好,仅有个别病例治疗一段时间后,对奥曲肽敏感性降低,甚至丧失,不必做长期,无效治疗[9]。需引起注意的是 :经奥曲肽治疗使GH和IGF-I水平恢复正常者,停药后会发生反复。Plockinger等[10]报道8例经奥曲肽治疗42mo的病人,GH与IGF-I平均水平分别降为(2.6±0.7)μg/L和( 0.8 ±0.1)×103IU/L。终止治疗后,分别回升到(5.6±1.1)μg/L和(2.5±1.0)×103IU /L。鉴于此种情况,病人可能需终身接受奥曲肽治疗才能控制病情。而且治疗前血清GH浓度越高 ,IGF-I恢复至正常范围的可能性越小。
, http://www.100md.com
对心脏的影响 对于左室肥大,舒张期灌流异常的肢端肥大症病人,奥曲肽可以改善心脏异常状况。Merola等[11]对11例病人给予奥曲肽治疗6mo后,左室质量指数(mass index)从(138±11)g/m2降至(116±13)g/m2,平均室壁厚度与舒张末心室内径比从(0.47±0.1)降至(0.44±0.1),右室灌注早期与晚期峰值比率从(1.000±0.010)升至(1.30±0.10)。左右室舒张期灌流的改善,对左心收缩功能无不良影响。经奥曲肽治疗,病人平静状态收缩期和舒张期心功能指数明显提高。乏氧阈和最大活动时工作负荷、耗氧量均增加[12]。Padayatty等[13]报道,奥曲肽治疗12mo后,病人平静时心率减慢。活动时间从(637±137)s提高至(787±101)s。做功从(9.0±3.3)提高至(11.9±2.7)代谢当量 。病人心功能改善,有利于降低并发心血管疾病的死亡率。
对钙和磷代谢的影响 肢端肥大症病人常表现有血清钙和磷的轻度升高,可能是由于GH或IGF-I调节小肠吸收所致。Fredstorp等[14]对10例病人经奥曲肽治 疗32mo后,血清钙、磷分别从(2.42±0.04) mmol/L 和 (1.40 ± 0.07) mmol/L 降至 (2 .32 ± 0.04)mmol/L和(1.24±0.07) mmol/L。血清甲状旁腺素水平从(21±5)μg/L上升至(40±8)μg/L 。但未观察到碱性磷酸酶、维生素D和维生素D结合蛋白浓度的改变。James等[15]认为:奥曲肽对钙、磷的调节作用不受GH对小肠吸收刺激作用的干扰。
, 百拇医药
对糖代谢的作用 其主要作用表现在2个方面:多数病例报道奥曲肽改善糖代谢。部分伴有糖尿病的病人经奥曲肽治疗,胰岛素或口服降糖药的用量可减少;部分糖耐量减低病人治疗后可恢复正常。作用机制可能是奥曲肽抑制循环中GH和胰高血糖素浓度,增强胰岛素抑制肝糖原分解作用,抑制胃肠道吸收葡萄糖[1]。也有奥曲肽致糖代谢紊乱的报道:治疗期间血清胰岛素对血糖升高的应答机制受抑制,血糖浓度升高或原有糖耐量受损进一步加重,大剂量奥曲肽治疗中,糖耐量正常者出现糖耐量减低或糖尿病[16]。个别病例甚至发生酮症酸中毒而死亡。
治疗剂量与给药方式 一般初始剂量为50~100μg/8h,以后用量可根据 血中GH和IGF-I的抑制水平增加,最大剂量可达1500μg/d。最小有效剂量为150μg/d。约 50%以上的病人经6mo治疗后,GH及IGF-I的水平可降至正常范围。剂量过高并不能给病人带来相应的疗效。
给药方式通常采用间歇皮下注射,每日3次,其优点是简便,病人易于接受。缺点是血清GH 波动明显,在下次给药前GH有上升趋势。还存在GH下降缓慢、所需药量大[17,18]。应用持续皮下输注可减少GH水平的波动。在疗效相似的前提下比间歇皮下注射方式给药量减少,不良反应也少。缺点是病人活动受限。脉冲给药方式,剂量25μg/h,该方式 不仅具有GH水平波动少,不良反应小的优点,而且对GH和IGF-I的控制更好[17 ]。
, 百拇医药
不良反应 长期应用奥曲肽的不良反应主要是引起胆结石。发生率约占接受治疗者总数的12%至60%[1]。另有部分病人发生胆汁淤积。胆结石发生的主要机制可能是奥曲肽直接抑制胆囊的收缩功能,或奥曲肽抑制胆囊收缩素的分泌而致胆囊排空受抑,餐后胆囊容积增加,胆汁潴留、浓缩,形成沉积物及析出胆固醇结晶,产生结石核心而致结石发生[19,20]。已有结石形成的病人多数无症状。停用奥曲肽后,胆囊收缩功能可恢复正常,结石自行消失。但用药时间越长,胆囊功能恢复越困难。预防胆结石发生可采用餐后给药、与熊去氧胆酸(ursodesoxycholic acid)联合使用、间断给药等措施。选用 持续皮下输注或脉冲给药方式也可降低胆结石的发生率。
其他不良反应轻微,如恶心、腹胀、腹泻,多由于奥曲肽抑制胃肠道运动和吸收功能所致。这些不良反应可在给药一段时间后自行缓解。症状明显者,短暂停药后可能好转。Nakauchi 等[21]还报道了一例女性病人,经奥曲肽治疗5mo后发生脱发,停药后恢复。
, http://www.100md.com
参考文献
1 Newman CB,Melmed S,Snyder PJ,et al.Safety and efficacy of long-term octreotide therapy of acromegaly: results of a multicente r trial in 103 patients-a clinical research center study.J Clin Endocrinol Meta b 1995; 80: 2768-75.
2 Hansen TB,Gram J,Bjerre P,Hagen C,Bollerslev J.Body composition in activ e acromegaly during treatment with octreotide: a double-blind,placebo-controlled cross-over study.Clin Endocrinol (Oxt) 1994; 41: 323-9.
, 百拇医药
3 Tsukamoto N,Nagaya T,Kuwayama A,et al.Octreotide treatment res ults in the inhibition of GH gene expression in the adenoma of the patients with acromegaly.Endocr J 1994; 41: 437-44.
4 Donckier J,Gilliard C,buysschaert M.Shrinkage of inoperable adenomas in cav ernous sinus with high-dose octreotide [letter].Lancet 1993; 342 (8866): 301.
5 Stewart PM,Kane KF,Stewart SE,Lancranjan I,Sheppard MC.Depot long-acting somatostatin analog (Sandostatin LAR) is an effective treatment for acromegaly.J Clin Endocrinol Metab 1995; 80: 3267-72.
, http://www.100md.com
6 McKnight JA,McCance DR,Sheridan B,Atkinson AB.Four years' treatment of re sistant acromegaly with octreotide.Eur J Endocrinol 1995; 132: 429-32.
7 de Herder WW,Uitterlinden P,van der Lely AJ,Hofland LJ,Lamberts SW.Octreo tide,but not bromocriptine,increases circulating insulin-like growth factor bi nding protein 1 levels in acromegaly.Eur J Endocrinol 1995; 133: 195-9.
8 Flogstad AK,Halse J,Grass P,et al.A comparison of octreotide,bromocriptine,or a combination of both drugs in acromegaly.J Clin Endocrinol M etab 1994; 79: 461-5.
, 百拇医药
9 Haraguchi K,Ohtaka M,Takazawa K,Endo T,Onaya T.Desensitization to somatos tatin analogue (Octreotide) observed in a patient with acromegaly.Endocr J 1995 ; 42: 295-300.
10 Plockinger U,Liehr RM,Quabbe HJ.Octreotide long term treatment of acromega ly: effect of drug withdrawal on serum growth hormone/insulin like growth factor -I concentrations and on serum gastrin/ 24 hour intragastric pH values.J Clin E ndocrinol Metab 1993; 77: 157-62.
, 百拇医药
11 Merola B,Cittadini A,Colao A,et al.Chronic treatment with the somatostatin analog octreotide inproves cardiac abnormalities in acromegaly.J Clin Endocrinol Metab 1993; 77: 790-3.
12 Giustina A,Boni E,Romanelli G,Grassi V,Giustina G.Cardiopulmonary perfor mance during exercise in acromegaly,and the effects of acute suppression of gro wth hormone hypersecretion with octreotide.Am J Cardiol 1995; 75: 1042-7.
13 padayatty SJ,Perrins EJ,Belchetz PE.Octreotide treatment increases exercis e capacity in patients with acromegaly.Eur J Endocrinol 1996; 134: 554-9.
, 百拇医药
14 Fredstorp L,pernow Y,Werner S.The short and long-term effects of octreotid e on calcium homeostasis in the patients with acromegaly.Clin Endocrinol (Oxf) 1993; 39: 331-6.
15 James RA,White MC,Chatterjee S,Kendall-Taylor P.The effect of octreotide treatment on serum calcium and phosphate levels in acromegaly.J Endocrinol 1993 ; 137 Suppl: 37.
16 McKnight JA,McCance DR,Crothers JG,Atkinson AB.Changes in glucose toleran ce and development of gall stones during high dose treatment with octreotide for acromegaly.Brit Med J 1989; 299: 604-5.
, http://www.100md.com
17 Giusti M,Cuttica CM,Cariola G,Vatenti S,Sessarego P,Giordano G.Treatmen t of acromegaly with octreotide: effectiveness and tolerability of its pulsatile administration by portable pump.Recenti Prog Med 1995; 86: 189-94.
18 Harris AG,Kokoris SP,Ezzat S.Continuous versus intermittent subcutaneous i n fusion of octreotide in the treatment of acromegaly.J Clin Pharmacol 1995; 35: 59-71.
19 Catnach SM,Anderson JV,Fairclough PD,et al.Effect of octreoti de on gall stone prevalence and gall bladdermotility in acromegaly.Gut 1993; 3 4: 270-3.
, 百拇医药
20 Stolk MF,van Erpecum KJ,Koppeschaar HP,et alEffect of octreo t ide on fasting gall bladder emptying,antroduodenalmotility,andmotilin releas e in acromegaly.Gut 1995; 36: 755-60.
21 Nakauchi Y,Kumon Y,Yamasaki H,Tahara K,Kurisaka M,Hashimoto K.Scalp hai r loss caused by octreotide in a patient with acromegaly: a case report.Endocr J 1995; 42: 385-9.
1997年2月28日收稿 1998年5月29日接受, 百拇医药